-
结直肠癌(CRC)是全球第三大常见的恶性肿瘤,也是导致死亡最常见恶性肿瘤之一[1]。酪氨酸激酶抑制剂(TKI)的临床应用,有效地改善了结直肠癌患者的预后[2]。呋喹替尼是我国自主研发的一种高选择性肿瘤血管生成抑制剂。已有研究证实[3-5],其在转移性结直肠癌(mCRC)三线及后线治疗中有总生存期获益。但由于个体对药物敏感性的差异,以及对相同药物的整体吸收、代谢、排泄反应速率的不同,导致相同的给药方案对不同人群产生的治疗效果不同[6]。此外,在进行联合用药时,也可能因为药物的相互作用,影响临床治疗效果,并增加发生毒副反应的机会。为保障患者使用呋喹替尼的安全性和有效性,预防和减少不良反应发生率,有必要对呋喹替尼进行血药浓度监测。本文建立了检测呋喹替尼血药浓度的高效液相色谱法(HPLC),该方法简便、快速、准确、专属性强,与液质联用方法相比,可操作性强、检测成本低,易于推广应用,可用于临床肠癌患者呋喹替尼血药浓度的常规监测,为临床实施个体化给药提供支持。
-
Agilent1260高效液相色谱系统(型号:1260 Infinity II,美国安捷伦科技有限公司);电子分析天平(型号:CPA2250,德国赛多利斯科学仪器有限公司);冷冻离心机(型号:Centrifuge 5804R,德国艾本德有限公司);超声仪(型号:SK7200H,上海科导超声仪器有限公司);浓缩仪(型号:Auto Vap S60,美国ART);Hitech-Kflow水纯化系统(型号:18.2MΩ,Hitech-Kflow,上海和泰仪器有限公司)。
呋喹替尼对照品(批号:420065-201901,纯度>99.9%)、阿帕替尼对照品(批号:101253-201101,纯度>96.2%)(中国食品药品检定研究院);色谱纯乙腈(批号:JA110130,默克股份两合公司);磷酸二氢钾(批号:20210309,分析纯)、磷酸(批号:20160217,分析纯)(上海凌峰化学试剂有限公司);乙酸乙酯(分析纯,美国天地有限公司)等。
-
色谱柱采用Welch Ultimate XB-C18(4.6 mm×150 mm,5 μm),检测波长为240 nm,柱温为35℃,流速设定为1.0 ml/min;流动相为乙腈:10 mmol/L磷酸二氢钾(磷酸调pH 3.15)=40∶60(V/V),进样量为20 μl。
-
呋喹替尼储备液1的配制:精密称取呋喹替尼对照品10.00 mg,置于10.00 ml容量瓶中,用40%乙腈溶解定容成浓度为1.00 mg/ml的呋喹替尼溶液,密封保存于−20℃冰箱备用。
呋喹替尼储备液2的配制:精密称取呋喹替尼对照品20.00 mg,置于10.00 ml容量瓶中,用40%乙腈溶解定容成浓度为2.00 mg/ml的呋喹替尼溶液,密封保存于−20℃冰箱,作为呋喹替尼质控样品备用。
内标阿帕替尼储备液的配制:精密称取阿帕替尼对照品10.00 mg,置于10.00 ml容量瓶中,加入40%乙腈溶解并定容,制成浓度为1.00 mg/ml的阿帕替尼溶液,密封保存于−20℃冰箱,使用时用乙腈稀释成浓度为1 000 ng/ml的工作溶液。
-
精密吸取200 μl血浆生物样品,加入1 000 ng/ml内标阿帕替尼溶液20 μl,涡旋30 s使血浆溶液充分混匀。混匀后,加入乙酸乙酯1 000 μl,涡旋3 min,于冷冻离心机内离心10 min,转速为:13 000 r/min;精密吸取上清液850 μl,氮气吹干后,加入200 μl流动相使复溶,涡旋1 min,13 000 r/min离心5 min后,精密吸取上层清液进样20 μl。
-
呋喹替尼标准曲线制备:将呋喹替尼储备液(1.00 mg/ml)用乙腈逐级稀释后,加入空白血浆制成含呋喹替尼15.63、31.25、62.50、125.00、250.00、500.00 ng/ml的血浆溶液,作为标准曲线;依上述前处理方法处理后,计算标准曲线。
质控血浆样品的制备:将呋喹替尼储备液(2.00 mg/ml)用乙腈逐级稀释后,加入空白血浆制成含呋喹替尼31.25、125.00、400.00 ng/ml的质控血浆样品,并依上述预处理方法进行处理后进样。
-
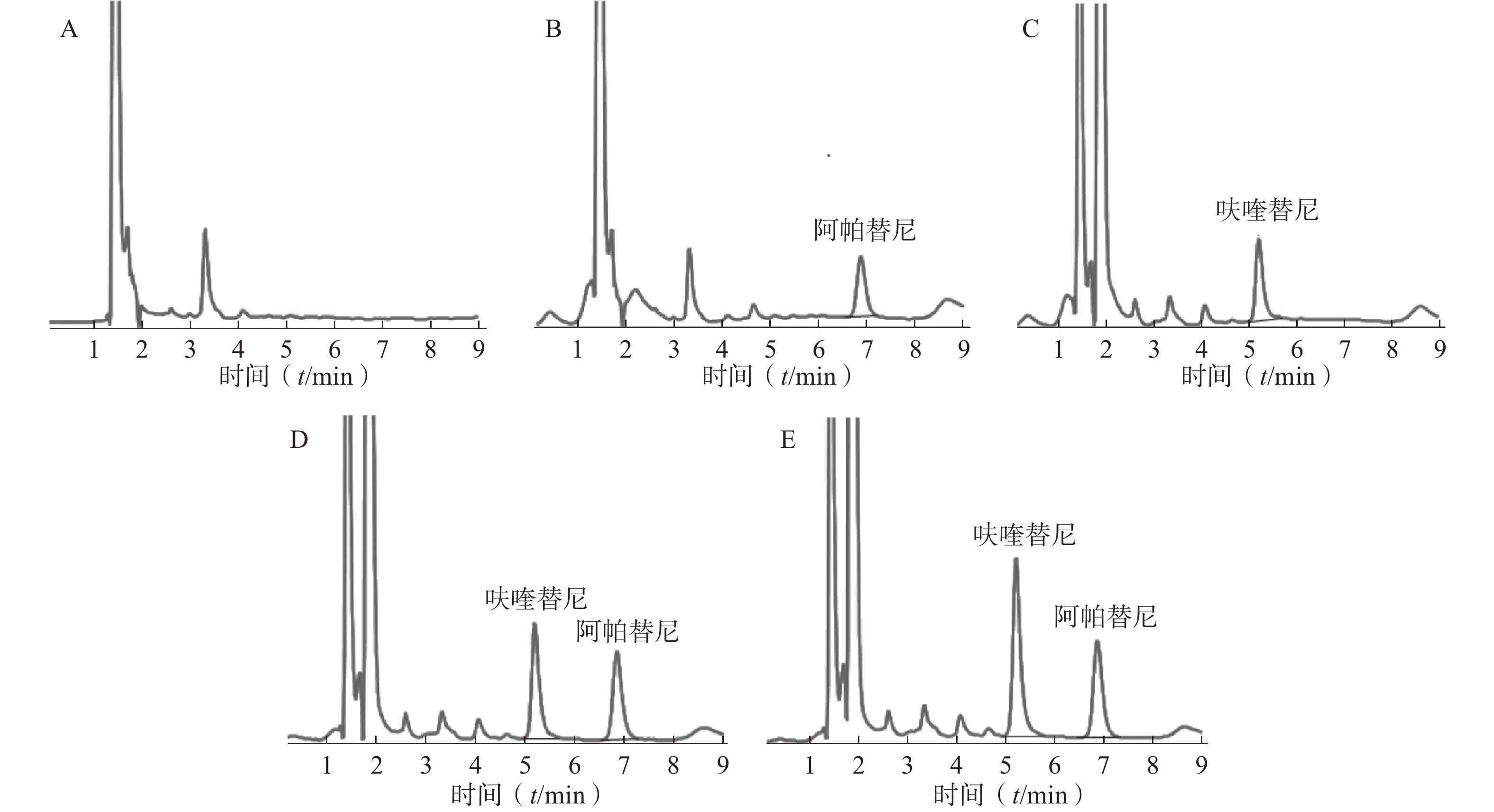
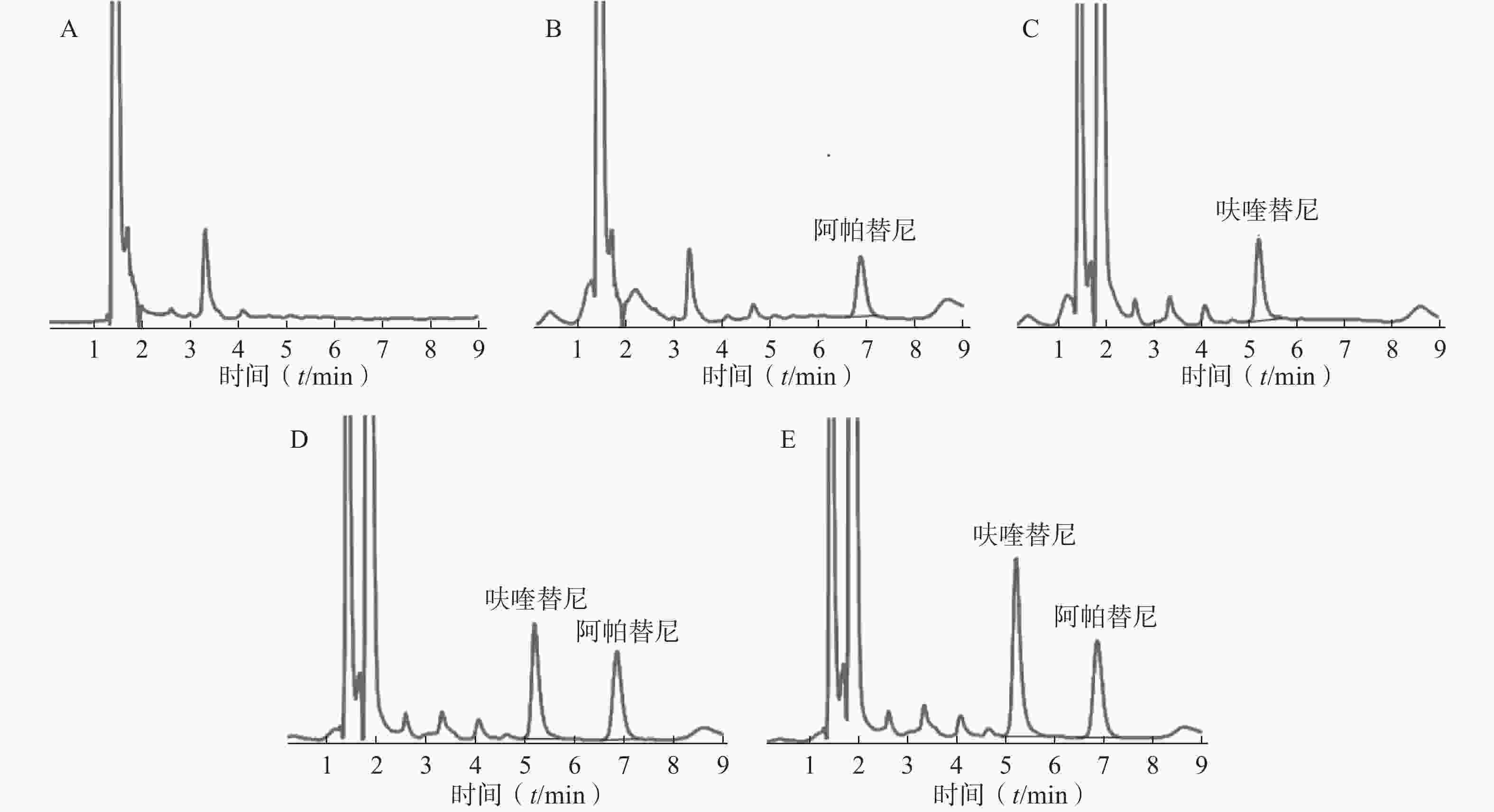
按照前述色谱条件及预处理方法,选取空白血浆、空白血浆+阿帕替尼(内标,浓度为1 000 ng/ml)空白血浆+呋喹替尼(40.00 ng/ml)、空白血浆+呋喹替尼(80.00 ng/ml)及阿帕替尼(内标,浓度为1 000 ng/ml)、患者血浆(49.37 ng/ml)+阿帕替尼(内标,浓度为1 000 ng/ml)进行专属性的考察,见图1。在此实验条件下,呋喹替尼和内标物阿帕替尼的出峰时间分别为5.13 min和6.83 min,受血浆内源性物质及其他杂质的影响较小。
-
选取新配置的呋喹替尼标准曲线用工作液,稀释后直接配置含呋喹替尼浓度为15.63、31.25、62.50、125.00、250.00、500.00 ng/ml的血浆浓度溶液,按“1.4血浆样品预处理”项所述方法进行前处理及测定;横坐标(X)为呋喹替尼对照品标准浓度(ng/ml)、纵坐标(Y)为本品对照品峰面积与内标物峰面积的比值,拟合标准曲线方程为 Y=0.015 4X+0.032 2(r=0.999 9)。结果显示,呋喹替尼在15.63~500.00 ng/ml的浓度范围内线性变化关系良好,定量下限为15.63 ng/ml。
取工作溶液配制成含有15.63 ng/ml呋喹替尼对照品的血浆溶液,平行配制5份并分别加入内标阿帕替尼溶液,按照前述方法进行预处理并测定。计算测定值与理论值的偏差。结果显示呋喹替尼定量下限的RE值(n=5)为111.1%,RSD值(n=5)为2.63%;符合定量分析下限的要求。
-
取相应工作液配置成3种含有呋喹替尼浓度(31.25、125.00、400.00 ng/ml)的血浆样品,平行制备低、中、高浓度水平各5份,分别加入内标阿帕替尼溶液,进行血浆样品前处理及测定,连续测定3 d,考察日间精密度和准确度。结果见表1。
表 1 人血浆中呋喹替尼的精密度与准确度
浓度
(ng/ml)日内 日间 RSD(%) 回收(%) RSD(%) 回收率(%) 31.25 1.83 101.20 6.30 105.1 125.00 2.29 96.12 3.48 106.2 400.00 4.79 95.23 4.75 107.9 -
配制含有呋喹替尼低、中、高3种浓度的质控样品各5份,分别加入内标阿帕替尼溶液,进行血浆样品前处理并测定。另取呋喹替尼标准工作液,加入乙腈稀释制成相应的低、中、高3个浓度水平的呋喹替尼溶液,分别加入内标阿帕替尼溶液后进行测定分析。将上述两种低、中、高3种不同浓度溶液所得峰面积进行比较,计算提取回收率。结果见表2。
表 2 人血浆中呋喹替尼提取回收率
浓度(ng/ml) 提取回收率(%) RSD(%) 31.25 97.29 1.70 125.00 102.10 3.53 400.00 99.95 0.68 -
制备低、中、高3种不同浓度的呋喹替尼质控样品各5份,在−40℃条件下反复冻融3次后,按“1.4”项下方法处理并测定。用未经冻融处理配制的血浆样品制作标准曲线并计算呋喹替尼的血药浓度、RE值及RSD值。结果显示呋喹替尼低浓度、中浓度、高浓度的RSD值分别为7.19%、6.87%、3.06%,低浓度、中浓度、高浓度的实测值与未经冻融的低浓度、中浓度、高浓度的实测值的偏差分别为107.4%、106.2%、109.3%。
-
制备低、中、高3种相应浓度的呋喹替尼质控样品各5份,在室温(25℃)下放置6 h,按“1.4”项下方法处理并测定。用新制备的血浆样品配制标曲并计算样品浓度、RE值和RSD值。结果呋喹替尼低浓度、中浓度、高浓度样品室温放置6 h后RSD值分别为1.80%、3.11%、3.37%,与未经室温放置的低浓度、中浓度、高浓度的实测值的偏差分别为111.3%、112.1%、111.7%。
-
制备低、中、高3种相应浓度的呋喹替尼质控样品各5份,分别加入内标阿帕替尼溶液,按“1.4”项下方法进行前处理后在进样器中放置24 h后进行分析。随后利用新建立的血浆样品制作的质量标准浓度曲线进行计算血浆浓度、RE值和RSD值的计算。结果为呋喹替尼低浓度、中浓度、高浓度RSD值分别为4.57%、6.33%、3.14%,低浓度、中浓度、高浓度的测定值与未经进样器放置前的低浓度、中浓度、高浓度的实测值的偏差分别为97.88%、95.73%和99.40%。
-
在临床中收集使用呋喹替尼进行药物治疗的患者病例及血样。患者按每天一次,每次4 mg剂量,服用3周,停药1周的用药方案。服药一段时间后,采集患者用药前0.5 h血样(血样采集使用EDTA抗凝管)。采血后管内全血经离心机6 000 r/min离心5 min分离血浆。吸取200 μl血浆,加入内标阿帕替尼溶液(1 000 ng/ml)20 μl后,涡旋30 s。按“1.4血浆样品预处理”项下方法进行前处理。根据当天标准曲线定量计算,3例患者血药浓度结果见表3。
表 3 患者血药浓度(谷浓度)检测结果(n=2)
患者 呋喹替尼(ng/ml) 患者1 41.77 患者2 39.39 患者3 30.96 -
近年来,有研究[7-8]利用质谱方法检测呋喹替尼血药浓度。质谱法的高特异性、高分离和高效分析的优势,使其在科学研究中备受青睐。但在实际工作中,质谱维护成本及使用成本较高,不易于推广。
本实验首次建立了HPLC测定人血浆中呋喹替尼药物浓度的方法。实验利用乙酸乙酯液液萃取法对血浆样本中呋喹替尼进行萃取,后利用氮吹复溶的方法,提高待测样品纯度的同时对样品进行浓缩,从而提高检测限。在内标选择的过程中,考虑到与目标物理化性质相似、不与目标物发生反应、稳定等因素。首先选取了与呋喹替尼理化结构相近的TKI类药物,如:瑞戈非尼、阿帕替尼、舒尼替尼等进行内标物的筛选测定。后经预实验发现,在呋喹替尼相应液相条件下,备选内标中的阿帕替尼响应最好、峰型最佳、保留时间最短,且与呋喹替尼及血浆内源性物质无相互干扰,故选择阿帕替尼作为本实验的内标。最终,呋喹替尼的线性范围为15.63~500.00 ng/ml,线性关系良好。呋喹替尼日内、日间的RSD值均小于6.79%;呋喹替尼的提取回收率为97.29%~102.1%;冻融稳定性、室温稳定性、进样器稳定性考察均符合要求。该方法简便、快速、准确、专属性强、检测成本低,易于推广,可用于临床肠癌患者呋喹替尼血药浓度的常规监测,为临床实施个体化给药提供支持。
Therapeutic drug monitoring and clinical application of fruquintinib
-
摘要:
目的 基于高效液相色谱法(HPLC)建立呋喹替尼治疗药物监测的色谱分析方法。 方法 采用Welch Ultimate XB-C18(4.6 mm×150 mm,5 μm)色谱柱,检测波长240 nm,柱温35℃,流动相为乙腈:10 mmol/L磷酸二氢钾(pH 3.15)=40∶60(V/V),流速为1.0 ml/min,内标为阿帕替尼,血浆样品经乙酸乙酯液液萃取后进样测定。 结果 方法学考察结果显示呋喹替尼在浓度15.63~500.00 ng/ml范围内线性良好(r=0.999 9),方法的回收率为95%~110%,RSD均小于10%,方法的提取回收率均高于97%,所有稳定性考察均符合要求。 结论 建立的HPLC法具有专属性高、检测简便和推广性强等优点,可广泛用于临床上肿瘤患者的呋喹替尼血药浓度的监测。 Abstract:Objective To establishing a chromatographic analysis method for therapeutic drug monitoring of fruquintinib by high-performance liquid chromatography (HPLC). Methods The analysis was conducted using a Welch Ultimate XB-C18 (4.6 mm×150 mm, 5 μm) column with the column temperature at 35℃. The flow rate was 1.0 ml/min and the detection wavelength was at 240 nm. The mobile phase consisted of acetonitrile and 10 mmol/L potassium dihydrogen phosphate (pH 3.15)= 40∶60(V∶V). The internal standard substance was Apatinib.All plasma samples were extracted with ethyl acetate solution. Results The linearity of Fruquintinib in plasma was good within the range of 15.63-500.00 ng/ml (r=0.999 9). The recoveries of the method were between 95%-110% with the RSD less than 10%. The extraction rates of the method were all higher than 97%. The stability tests met the relative requirements. Conclusion A HPLC method for the determination of Fruquintinib in human plasma was established. The method had good specialty, and could be used to detect the blood concentrations of Fruquintinib in clinical practice to improve the individualized medication. -
Key words:
- fruquintinib /
- therapeutic drug monitoring /
- HPLC /
- individualized medication
-
表 1 人血浆中呋喹替尼的精密度与准确度
浓度
(ng/ml)日内 日间 RSD(%) 回收(%) RSD(%) 回收率(%) 31.25 1.83 101.20 6.30 105.1 125.00 2.29 96.12 3.48 106.2 400.00 4.79 95.23 4.75 107.9 表 2 人血浆中呋喹替尼提取回收率
浓度(ng/ml) 提取回收率(%) RSD(%) 31.25 97.29 1.70 125.00 102.10 3.53 400.00 99.95 0.68 表 3 患者血药浓度(谷浓度)检测结果(n=2)
患者 呋喹替尼(ng/ml) 患者1 41.77 患者2 39.39 患者3 30.96 -
[1] SIEGEL R L, WAGLE N S, CERCEK A, et al. Colorectal cancer statistics, 2023[J]. CA A Cancer J Clinicians, 2023, 73(3): 233-254. doi: 10.3322/caac.21772 [2] 张宜利, 李巍. 结直肠癌肝转移转化治疗进展[J]. 腹部外科, 2021, 34(4): 322-326. doi: 10.3969/j.issn.1003-5591.2021.04.016 [3] LI J, QIN S K, XU R H, et al. Effect of fruquintinib vs placebo on overall survival in patients with previously treated metastatic colorectal cancer: the FRESCO randomized clinical trial[J]. JAMA, 2018, 319(24): 2486-2496. doi: 10.1001/jama.2018.7855 [4] 郭芬, 时建明, 张璐瑶, 等. 呋喹替尼治疗转移性结直肠癌的真实世界观察[J]. 实用肿瘤杂志, 2024, 39(1): 40-45. [5] 胡浪, 林小玲, 唐文军. 呋喹替尼单药及联合PD-1抑制剂用于晚期转移性结肠癌后线治疗的疗效及安全性[J]. 实用医学杂志, 2023, 39(15): 1966-1973. doi: 10.3969/j.issn.1006-5725.2023.15.019 [6] XU R H, LI J, BAI Y X, et al. Safety and efficacy of fruquintinib in patients with previously treated metastatic colorectal cancer: a phase Ib study and a randomized double-blind phase Ⅱ study[J]. J Hematol Oncol, 2017, 10(1): 22. doi: 10.1186/s13045-016-0384-9 [7] ZHAO J, YAN D M, LI Y, et al. Simultaneous determination of 11 oral targeted antineoplastic drugs and 2 active metabolites by LC-MS/MS in human plasma and its application to therapeutic drug monitoring in cancer patients[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2024, 1237: 124100. doi: 10.1016/j.jchromb.2024.124100 [8] 温州医科大学附属第一医院. 一种快速检测大鼠血浆中呋喹替尼的UPLC-MS/MS方法[P]. 中国, 201910539488.8. 2019-08-27. -




 下载:
下载: