-
白念珠菌(candida albicans)是一种机会致病菌,通常存在于人体的消化道及泌尿生殖道。当人体免疫力下降时,白念珠菌可能侵入人体,造成侵袭性真菌感染。近年来,随着器官移植者、艾滋病人等免疫功能低下人群数量的增多,白念珠菌的侵袭性感染愈发常见[1-2]。目前,临床用于预防和治疗侵袭性真菌感染的药物主要包括棘白菌素类、多烯类和三唑类等,其中,两性霉素B(amphotericin B, AmB)为多烯类抗真菌药物的代表,主要通过破坏真菌的细胞膜,引起细胞内液外溢,致使真菌死亡[3]。AmB具有抗菌谱广、疗效好等优点,但长期用药存在肝肾毒性、低钾血症和静脉炎等不良反应,并产生严重的耐药性[4-5]。
通常,不同种类药物联合使用可有协同或拮抗作用,其中,协同作用的药物联合使用具有扩大抗菌谱、减轻毒副作用和减少耐药等优点,因此在临床上越来越受到关注[6]。针对抗真菌药物的联合用药,目前在进行多维度的试验和可行性探索。临床上常将AmB与氮唑类药物联合应用以减少副作用的发生。此外,中药活性成分丁香酚与AmB联用可促进活性氧的产生,从而发挥协同抗真菌作用[7]。
烟酰胺(nicotinamide, NAM)是维生素B3的衍生物,在抗真菌药物和护肤品中均有广泛应用[7]。课题组前期研究表明,NAM是一种有效的抗真菌药物增效剂,与多种抗真菌药物联合应用均能发挥协同作用,其作用机制包括增加细胞内活性氧的产生,增强对细胞被膜的抑制作用等[8-9]。本研究将NAM与AmB联用,从代谢组学角度探究NAM协同AmB抑制白念珠菌的潜在作用机制,为临床抗真菌药物的联用提供参考。
-
Thermo Trace GC Ultra and DSQII气相色谱-质谱联用仪(Thermo fisher,USA);METTLER AE 240型电子天平(瑞士梅特勒公司);SW-CT-IF 型超净化工作台(苏州安泰空气技术有限公司);HZ-9610KB 恒温培养箱(江苏太仓实验设备厂);电子分析天平 AUW 220D(日本SHIMADZU 公司);Infinite M200 多功能酶标仪(Austria TECAN 公司)。
-
甲氧基胺盐酸盐(Sigma Aldrich 公司);吡啶(Sigma Aldrich 公司); N-甲基-N-(三甲基硅烷)三氟乙酰胺(MSTFA,Sigma Aldrich 公司);三甲基氯硅烷(TMCS,Sigma Aldrich 公司);二甲基亚砜(DMSO,Sigma Aldrich 公司);烟酰胺(Sigma Aldrich 公司);两性霉素B(中国食品药品检定研究院);正己烷(分析纯,购自国药试剂公司)。
-
白念珠菌SC5314(由瑞士Vaudois州立大学医学中心Dominique Sanglard教授惠赠);酵母浸出粉胨葡萄糖(YPD)培养液:酵母浸膏10 g,蛋白胨20 g,葡萄糖20 g,溶解于
1000 ml三蒸水,高压灭菌,4 ℃保存;RPMI 1640培养基:RPMI 1640培养基粉末10 g,吗啡啉丙磺酸34.5 g,碳酸氢钠2.0 g,加入三蒸水900 ml溶解,用氢氧化钠室温下调节pH至7.0,三蒸水定容至1 000 ml,0.22 µm微孔滤膜过滤除菌后于4 ℃保存。 -
取单克隆白念珠菌,接种至1 ml YPD培养液于30 ℃、200 r/min,培养16 h至对数生长期后,用RPMI 1640培养基稀释菌液至浓度为5×103 cells/ml。为确定白念珠菌对药物的敏感性,采用肉汤微量稀释法并进行适当调整,两种药物分别在96孔板按两倍递减稀释,NAM的浓度为0.313~80 mmol/L,AmB的浓度为0.005~2 μg/ml。与无药物组相比,将药物干预组的生长抑制率为80%时的药物浓度确定为MIC80。
在此基础上,将培养至对数生长后期的菌液于多功能酶标仪中测定600 nm处的光密度值(A600)。使用RPMI
1640 培养液调整菌液浓度至A600值为0.1,继续培养至A600值为0.2时,分别加入AmB和NAM进行干预,使AmB终浓度分别为0.005、0.01、0.02、0.04、0.08 µg/ml,NAM终浓度分别为0.125、0.25、0.5、1、2 mmol/L,继续培养4 h。对照组中加入相同体积的DMSO,其浓度应小于0.05%,以确保不影响白念珠菌的生长。将联用组A600值降低至对照组A600值的1/2,对应的浓度确定为后续代谢组学研究中的给药浓度。 -
挑取单克隆白念珠菌,接种至1 ml YPD培养液于30 ℃,200 r/min,培养16 h至对数生长期,用YPD培养液调整菌液浓度至1×106 cells/ml,取20 ml置于锥形瓶中培养,至A600值为0.2时进行药物干预。对于NAM组,加入适当浓度的NAM对照品溶液,使其浓度为1 mmol/L;对于AmB组,加入适当浓度的AmB对照品溶液,使其浓度为0.04 µg/ml;对于联用组,加入适当浓度的NAM和AmB对照品溶液,使其浓度分别为1 mmol/L和0.04 µg/ml;对于对照组,加入相同体积的DMSO。继续培养4 h,收集样品,每组重复6个独立样本。
-
样品收集后,用灭菌的PBS清洗两次,
3000 r/min离心3 min,弃上清液。重悬于1 ml水,静置15 min。放入−80 ℃冰箱15 min后取出,60 ℃金属浴15 min,重复冻融操作3次,13 200 r/min离心,取上清液,冷冻干燥。 -
向上述冷冻干燥的样品中加入75 µl甲氧胺盐酸盐的吡啶溶液(20 mg/ml),涡旋5 min,70 ℃温孵1 h,再加入75 µl MSTFA溶液(含1%TMCS),50 ℃温孵30 min,
13200 r/min离心5 min,取上清液1 µl,注入气相色谱-质谱联用仪分析。 -
将样品沉淀物在室温下风干至恒重,称量样品干重,用于各样本质量校正。
-
色谱条件:采用Agilent DB-5MS石英毛细管柱(30 m×0.25 mm,0.25 µm)进行代谢物分离;进样口温度:260 ℃;升温程序:起始温度为70 ℃,保持3 min,4 ℃/min升至220 ℃,再8 ℃/min升至310 ℃,保持10 min;载气:高纯氦气;流速:1.0 ml/min。进样量为1µl。质谱条件:电子轰击源(EI源),温度:200 ℃,扫描范围m/z50~800。
-
将原始数据转化成CDF格式,利用R软件XCMS包对数据进行峰校正、对齐和积分,样品各峰面积分别以各自的细胞干重和内标进行校正。利用SIMCA 14.1.0(Umetrics,Sweden)软件进行偏最小二乘法判别分析(PLS-DA),以VIP>1.5或<0.5,P<0.05为阈值筛选差异代谢物,然后运用NIST库检索,进行差异代谢物的鉴定。
-
采用微量液基稀释法考察NAM与AmB对白念珠菌SC5314的作用。单独使用NAM和AmB时MIC80分别为20 mmol/L、0.64 μg/ml,联用后的MIC80分别为2 mmol/L、0.08 μg/ml。NAM或AmB单独使用时均表现出抗菌作用,而NAM和AmB的联用显著降低了MIC80值。以部分抑制浓度指数(FICI)评价NAM与AmB的作用方式,结果显示NAM和AmB联用的FICI值为0.38(通常FICI<0.5为协同作用),表明两者联用具有协同抗真菌的作用。当联用组NAM和AmB浓度分别为1 mmol/L和0.04 μg/ml时,其A600值约为对照组的1/2,而单独给予该剂量下的NAM组与对照组相比A600几乎没有变化,AmB组A600约为对照组的75%,表现出轻微的抑制作用。为真实反映联用后代谢物的变化情况,本研究选择NAM和AmB药物的干预浓度分别为1 mmol/L和0.04 μg/ml。
-
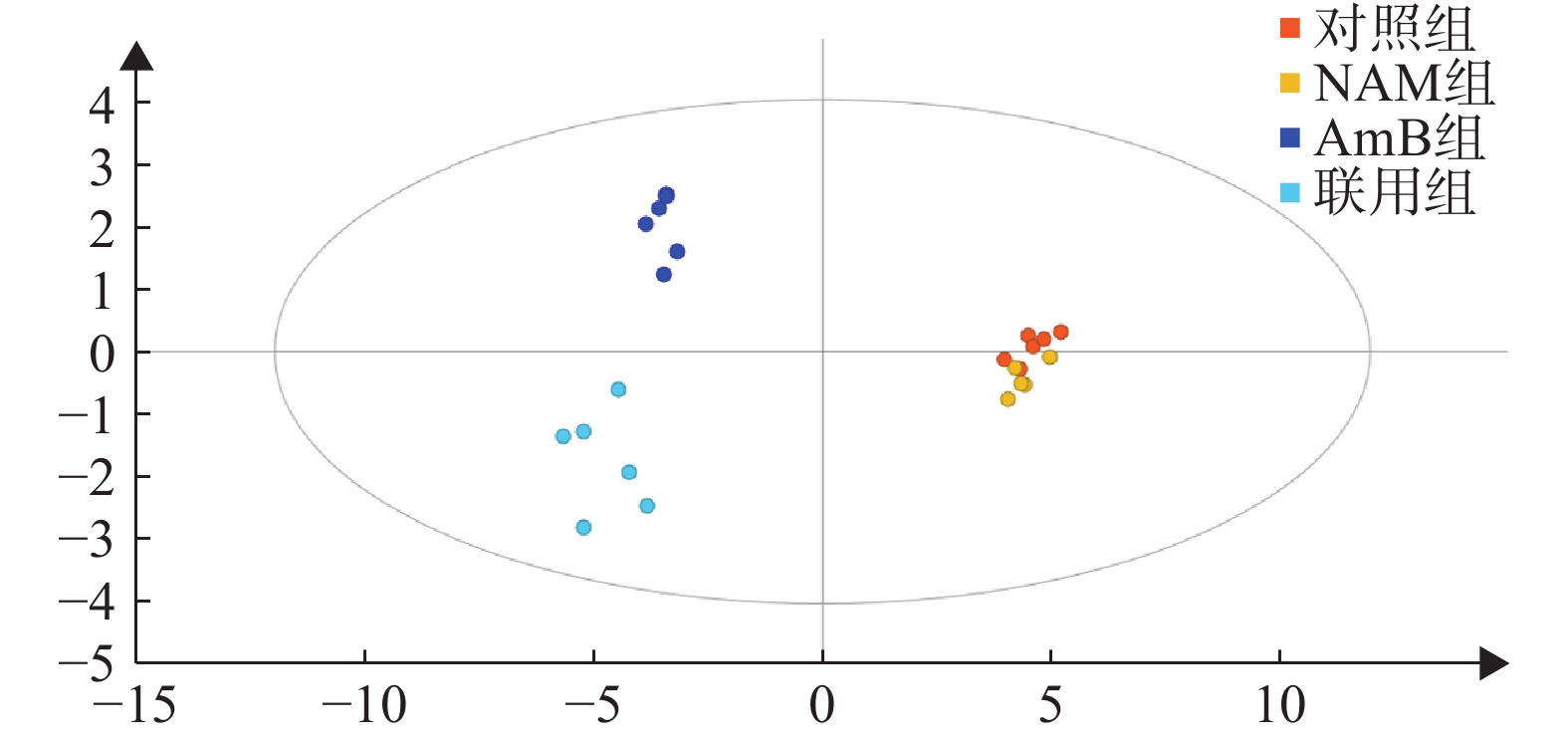
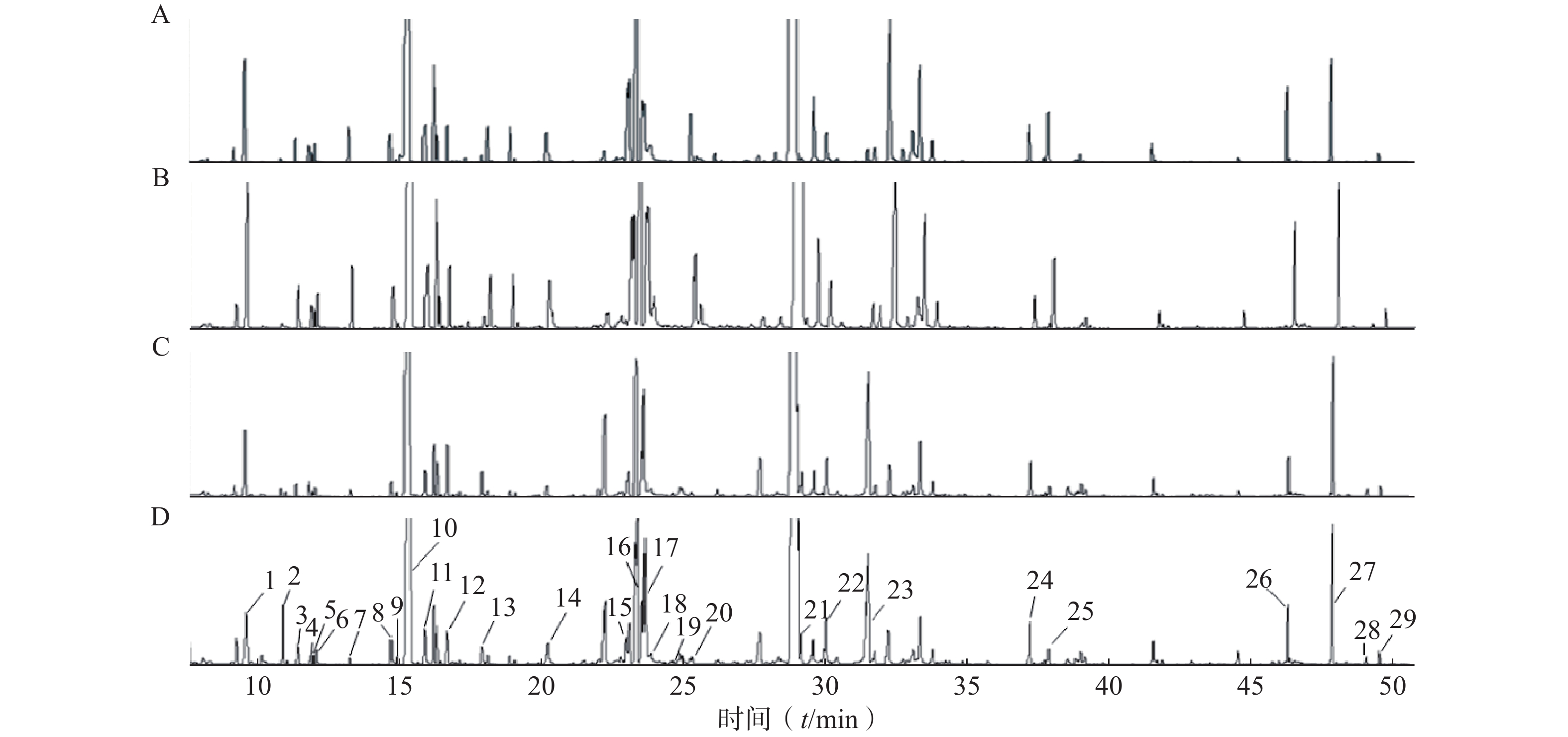
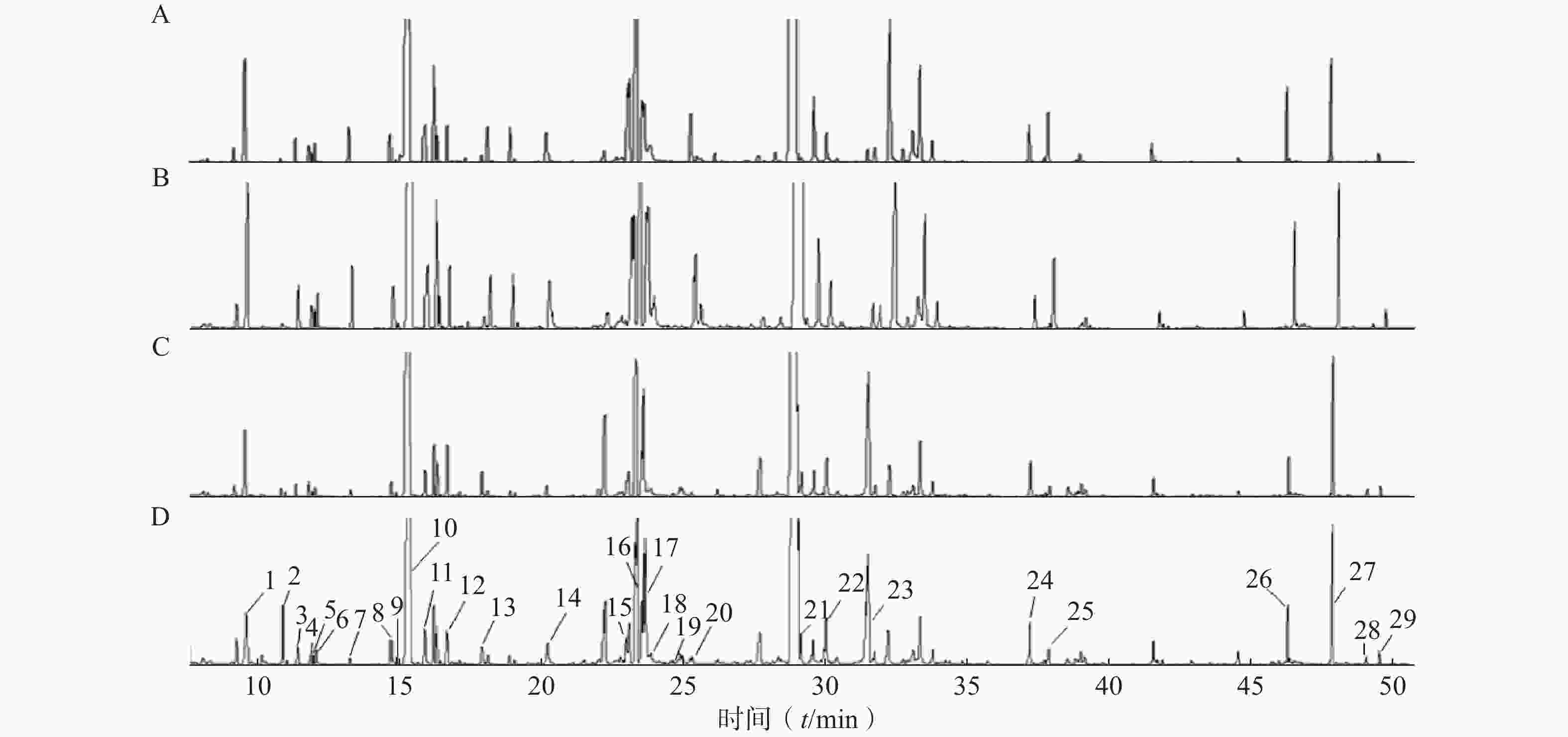
按“2.4气相色谱-质谱条件”进代谢物的分离分析,最终得到典型的总离子流图(图1)。从代谢物峰的相对强度可以看出,对照组与NAM组代谢轮廓比较相似,而AmB组和联用组与对照组相比存在明显差异。将原始数据按“2.5”项下方法进行处理并使用PLS-DA分析,结果如图2所示。对照组和NAM组未有明显分离,表明该剂量下的烟酰胺的干预未导致白念珠菌的代谢轮廓发生显著变化。AmB组及联用组与对照组分离趋势明显,表明该剂量下的药物干预引起了白念珠菌代谢轮廓的显著变化。AmB组与联用组相比,代谢轮廓也存在明显差异,表明两组间的代谢物差异较大。
-
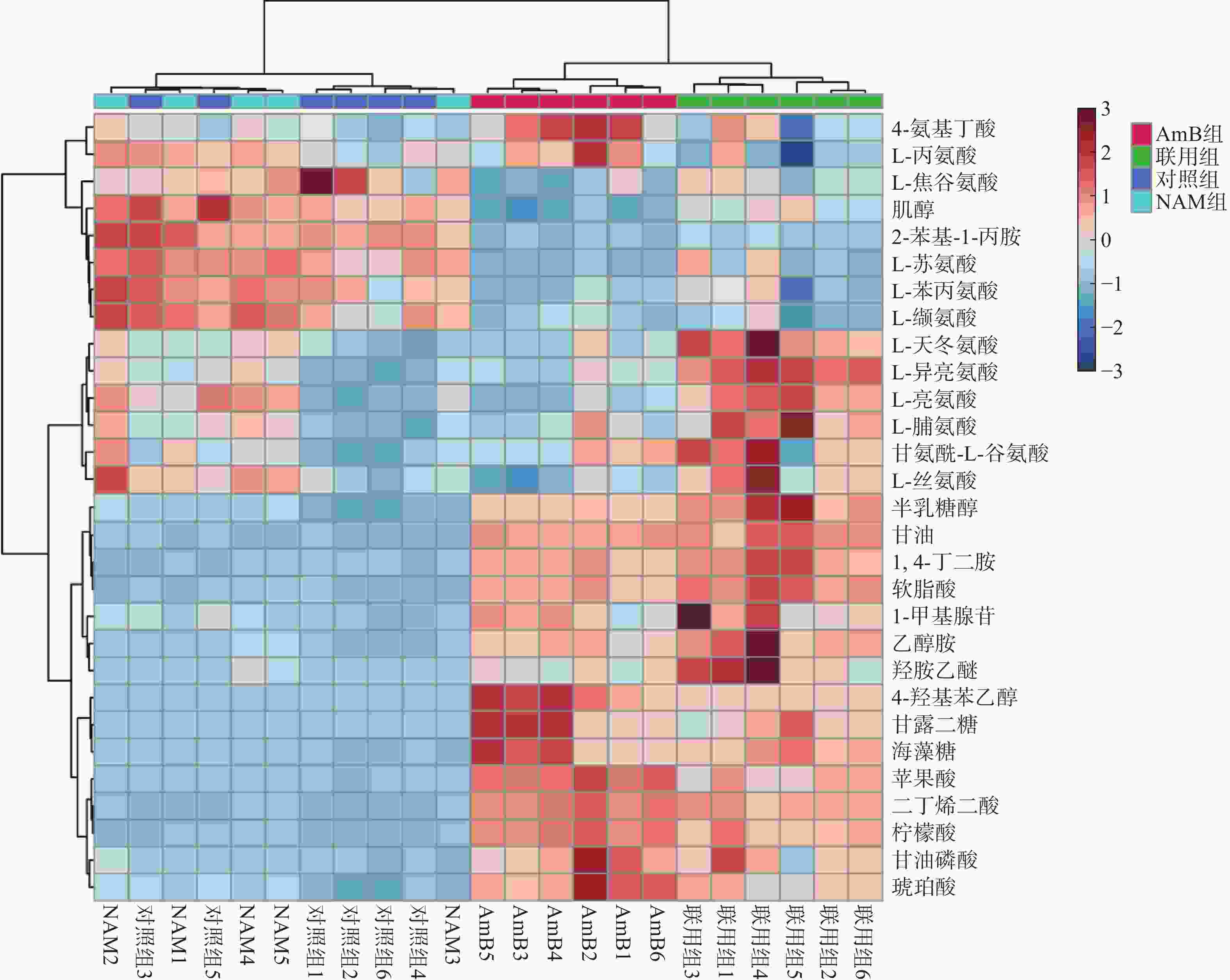
将对照组、NAM组、AmB组和联用组的胞内代谢物的变化情况进行统计分析和可视化呈现,结果如表1和图3所示。
表 1 对照组、AmB组、联用组差异代谢物鉴别结果
序号 保留时间
(t/min)代谢物 AmB组 vs 对照组 联用组 vs 对照组 联用组 vs AmB组 变化趋势 FC1值 变化趋势 FC2值 变化趋势 FC3值 1 9.66 L-丙氨酸 − − ↓ 0.64* − − 2 10.93 羟胺乙醚 ↑ 16.31*** ↑ 20.30*** ↑ 1.24 3 11.46 L-亮氨酸 − − ↑ 1.56 ↑ 1.69## 4 11.92 4-氨基丁酸 ↑ 1.69** − − ↓ 0.62# 5 12.03 L-脯氨酸 − − ↑ 1.60 ↑ 1.37## 6 12.13 L-异亮氨酸 − − ↑ 2.05** ↑ 1.78### 7 13.34 L-缬氨酸 ↓ 0.46*** ↓ 0.42*** − − 8 14.77 L-丝氨酸 − − ↑ 1.29 ↑ 1.49# 9 14.97 乙醇胺 ↑ 3.01*** ↑ 4.12*** ↑ 1.37 10 15.42 甘油 ↑ 2.86*** ↑ 3.17*** ↑ 1.10 11 15.94 L-苏氨酸 ↓ 0.22*** ↓ 0.46** − − 12 16.76 琥珀酸 ↑ 2.48*** ↑ 1.89*** ↓ 0.76# 13 17.99 2-丁烯二酸 ↑ 10.00 ↑ 8.47*** ↓ 0.85# 14 20.3 L-天冬氨酸 − − ↑ 1.67** ↑ 1.58### 15 22.35 苹果酸 ↑ 15.19*** ↑ 9.58*** ↓ 0.63### 16 23.19 L-焦谷氨酸 ↓ 0.42** ↓ 0.67* − − 17 23.76 甘氨酰-L-谷氨酸 ↑ 1.99* ↑ 2.61 − − 18 23.97 L-苯丙氨酸 ↓ 0.49*** ↓ 0.58** − − 19 24.73 4-羟基苯乙醇 ↑ 6.93*** ↑ 4.06*** ↓ 0.59## 20 25.41 2-苯基-1-丙胺 ↓ 0.15*** ↓ 0.23*** − − 21 29.3 1,4-丁二胺 ↑ 4.90*** ↑ 6.07*** ↑ 1.24 22 30.18 甘油磷酸 ↑ 2.36*** ↑ 1.98* − − 23 31.64 柠檬酸 ↑ 33.56*** ↑ 26.16*** − − 24 37.36 十六烷酸 ↑ 2.98*** ↑ 3.64*** ↑ 1.22## 25 38.03 纤维醇 ↓ 0.39*** ↓ 0.70** ↑ 1.81### 26 46.46 1-甲基腺苷 ↑ 1.61** ↑ 1.95* ↑ 1.21 27 48.03 海藻糖 ↑ 4.75*** ↑ 4.07*** − − 28 49.25 甘露糖 ↑ 12.88*** ↑ 8.68** ↓ 0.68 29 49.71 半乳糖醇 ↑ 2.32*** ↑ 3.12*** ↑ 1.34# 注:FC1值=AmB组平均值/对照组平均值;FC2值=联用组平均值/对照组平均值;FC3值=联用组平均值/AmB组平均值;↑:相对含量升高;↓:相对含量降低;−:两组含量无显著差异。
*P<0.05,**P<0.01,***P<0.001,与对照组比较;#P<0.05,##P<0.01,###P<0.001,与AmB组比较。与对照组相比,联用组有28个代谢物发生变化;而AmB组与联用组比较,差异代谢物减少至19个。NAM组和对照组之间的聚类分组不明显,说明该剂量下的NAM未影响白念珠菌的生长和代谢。AmB单独干预时对白念珠菌具有一定的抑制作用,与对照组相比有23个代谢物发生显著变化。
利用 MetaboAnalyst 5.0对差异代谢物进行通路分析,发现主要涉及甘油酯代谢、氨基酸代谢、三羧酸循环等通路的变化。联用组与对照组相比有28个代谢物发生变化,其中5个代谢物在AmB单独给药时未发生变化。此外,联用组与AmB族相比有19个代谢物发生显著变化,其中4个代谢物(L-亮氨酸,L-异亮氨酸,L-天冬氨酸,纤维醇)含量变化趋势明显(FC值>1.5或<0.5),表明联合用药在一定程度上改变了AmB抑制白念珠菌的作用模式。
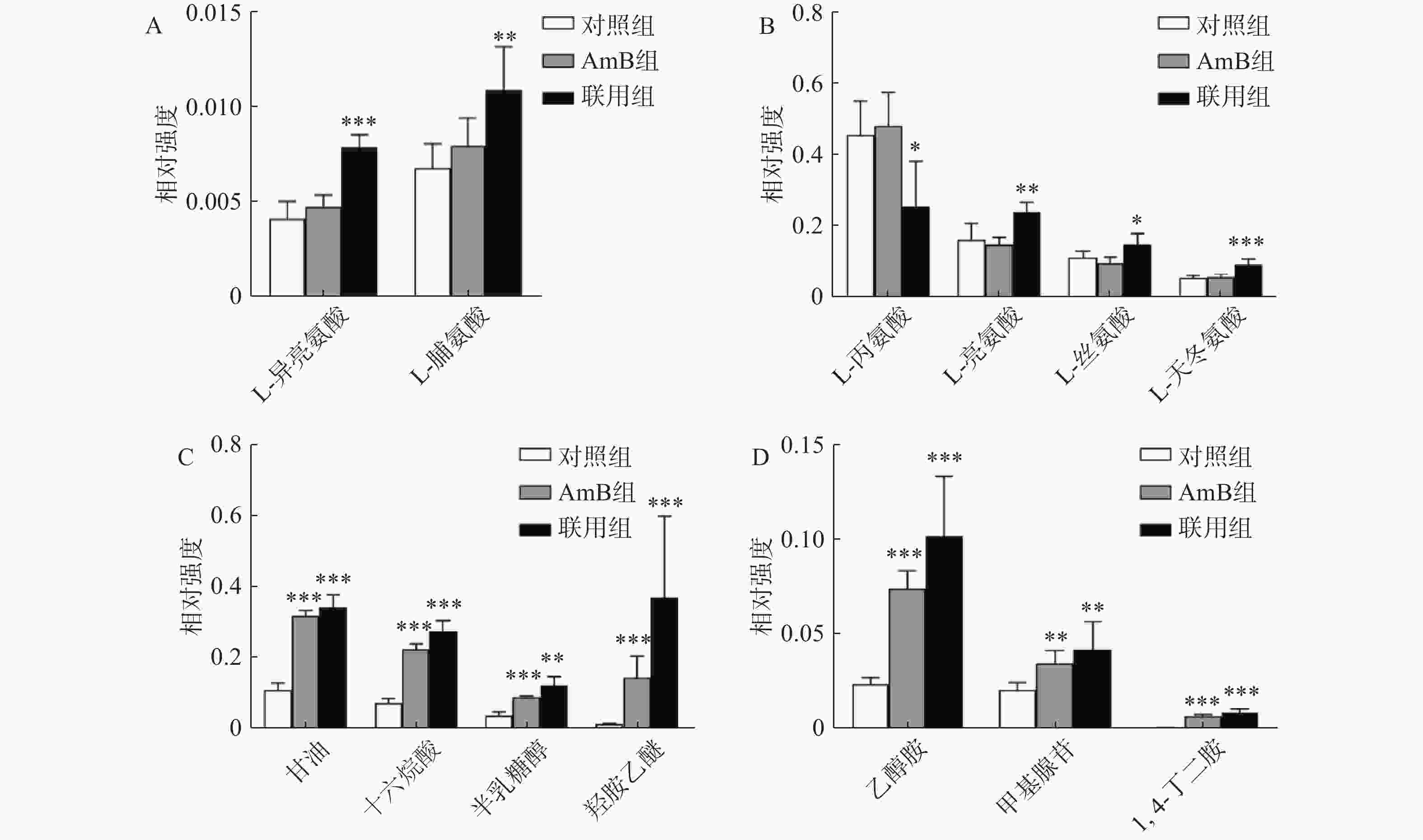
氨基酸是真核生物正常生命活动中不可或缺的物质,氨基酸的代谢失衡会导致白念珠菌的生长和繁殖缺乏能量供应,同时影响氮平衡、糖类代谢等相关通路[10]。氨基酸代谢异常是联合给药干预后白念珠菌的主要特征之一。与对照组相比,联用组中的L-亮氨酸、L-脯氨酸、L-异亮氨酸、L-丝氨酸、L-天冬氨酸的FC值>1.5,含量发生显著变化,而这些代谢物在AmB单独干预时的变化没有统计学差异(图4A和4B),表明在此剂量下AmB单独干预对于白念珠菌的轻微抑制作用并没有对其氨基酸的合成和代谢造成很大影响。然而,加入NAM后氨基酸含量的变化清晰地呈现了氨基酸代谢通路的变化。支链氨基酸含量的变化与机体的能量代谢密切相关,L-亮氨酸和L-异亮氨酸含量升高,推测可能由于NAM和AmB联用后激活了作用于支链氨基酸合成和代谢通路中的相关酶,并对外界刺激做出了应激反应。
此外,三羧酸循环是生物体内营养物质氧化的主要过程,与白念珠菌的CO2感应及菌丝发育的调控密切相关,该过程活性下降会导致白念珠菌利用碳源的能力降低,导致细胞的生长速度明显放缓[11]。与对照组相比,AmB组和联用组中柠檬酸、琥珀酸、苹果酸等三羧酸循环相关代谢物FC值均>1.5,表明给药后三羧酸循环相关代谢物均出现蓄积,但联用组蓄积情况反而低于AmB组。与对照组相比,AmB组和联用组中的羟胺乙醚、乙醇胺、甘油、1,4-丁二胺、软脂酸、甲基腺苷、半乳糖醇的FC值>1.5,含量明显升高,并且联用组中的含量显著高于AmB组(图4C、图4D)。
在白念珠菌中,鸟氨酸经过鸟氨酸脱羧酶能代谢为腐胺,而腐胺又能进一步转化为精胺、亚精胺等其他多胺。已有研究表明,干扰多胺合成通路能增强AmB抑制白念珠菌生物被膜合成的作用[12],推测NAM可能干扰了白念珠菌的多胺合成通路,从而增强AmB对白念珠菌的抑制作用。总之,以上结果表明,NAM与AmB联用并不仅仅增强了AmB原有的作用途径,还在一定程度上改变了其单独干预时的作用模式。
-
本研究利用气相色谱-质谱联用技术分析NAM与AmB作用下白念珠菌的代谢轮廓,筛选出的差异代谢物包括氨基酸、有机酸、多胺、糖类等成分,且涉及白念珠菌的氨基酸合成、三羧酸循环、甘油酯代谢等通路。NAM与AmB联用后,与对照组相比,部分代谢物变化趋势与单独使用AmB时一致,且变化幅度更大;同时也有部分代谢物在AmB单独作用时未发生变化,而联用后则发生显著变化,说明NAM增强了AmB在原代谢通路中的作用,同时在一定程度上改变了其作用途径。因此,推测NAM与AmB联用后可能通过影响白念珠菌的三羧酸循环,干扰其氨基酸代谢,影响其多胺合成等途径,发挥对AmB的增效作用。
The mechanism of nicotinamide combined with amphotericin B against Candida albicans based on metabolomics technology
-
摘要:
目的 基于代谢组学的方法研究烟酰胺(NAM)协同两性霉素B(AmB)抑制白念珠菌的潜在作用机制。 方法 分别使用适当浓度的NAM、AmB单独处理和二者联用处理浮游型白念珠菌,再基于气相色谱-质谱联用技术分析其胞内代谢物,通过多元统计分析筛选差异代谢物,并用NIST数据库进行检索鉴定。 结果 与对照组相比,NAM单独干预组与之分离趋势不明显,而AmB组、联用组与之具有明显的分离趋势。AmB干预后有23个代谢物发生显著性变化,NAM+AmB联合干预后有28个代谢物发生显著性变化,包括氨基酸、有机酸、多胺、糖类等成分。 结论 NAM是白念珠菌的内源性代谢物,其与AmB联用后可增强AmB在原代谢通路中的作用,同时一定程度上改变了其作用途径,推测NAM与AmB联用后可能通过调整白念珠菌的三羧酸循环、干扰其氨基酸代谢、影响多胺的合成等途径来发挥其对AmB的增效作用。 Abstract:Objective To investigate the potential mechanism of nicotinamide combined with amphotericin B against Candida albicans based on metabolomics. Methods The intracellular metabolites of C. albicans intervened by different drugs including NAM, AmB, and their combination with a proper concentration were analyzed by gas chromatography-mass spectrometry. The differential metabolites were screened by multivariate statistical analysis and identified by searching the NIST database. Results Compared with the control group, the NAM intervention group was hardly separated from it, while the AmB group and NAM+AmB group showed a clear trend of separation. Under the intervention of AmB, 23 metabolites significantly changed compared with the control group, and 28 metabolites remarkably changed after NAM+AmB intervention, including amino acids, organic acids, sugars and other components. Conclusion NAM, as an endogenous metabolite of C. albicans, combined with AmB could enhance the effects of AmB in the original metabolic pathway and changed it to a certain extent. It was speculated that AmB combined with NAM may pose more antifungal effect on Candida albicans by regulating the tricarboxylic acid cycle, interfering with amino acid metabolism and influencing polyamine synthesis. -
Key words:
- gas chromatography-mass spectrometry /
- amphotericin B /
- nicotinamide /
- candida albicans /
- metabolomics
-
表 1 对照组、AmB组、联用组差异代谢物鉴别结果
序号 保留时间
(t/min)代谢物 AmB组 vs 对照组 联用组 vs 对照组 联用组 vs AmB组 变化趋势 FC1值 变化趋势 FC2值 变化趋势 FC3值 1 9.66 L-丙氨酸 − − ↓ 0.64* − − 2 10.93 羟胺乙醚 ↑ 16.31*** ↑ 20.30*** ↑ 1.24 3 11.46 L-亮氨酸 − − ↑ 1.56 ↑ 1.69## 4 11.92 4-氨基丁酸 ↑ 1.69** − − ↓ 0.62# 5 12.03 L-脯氨酸 − − ↑ 1.60 ↑ 1.37## 6 12.13 L-异亮氨酸 − − ↑ 2.05** ↑ 1.78### 7 13.34 L-缬氨酸 ↓ 0.46*** ↓ 0.42*** − − 8 14.77 L-丝氨酸 − − ↑ 1.29 ↑ 1.49# 9 14.97 乙醇胺 ↑ 3.01*** ↑ 4.12*** ↑ 1.37 10 15.42 甘油 ↑ 2.86*** ↑ 3.17*** ↑ 1.10 11 15.94 L-苏氨酸 ↓ 0.22*** ↓ 0.46** − − 12 16.76 琥珀酸 ↑ 2.48*** ↑ 1.89*** ↓ 0.76# 13 17.99 2-丁烯二酸 ↑ 10.00 ↑ 8.47*** ↓ 0.85# 14 20.3 L-天冬氨酸 − − ↑ 1.67** ↑ 1.58### 15 22.35 苹果酸 ↑ 15.19*** ↑ 9.58*** ↓ 0.63### 16 23.19 L-焦谷氨酸 ↓ 0.42** ↓ 0.67* − − 17 23.76 甘氨酰-L-谷氨酸 ↑ 1.99* ↑ 2.61 − − 18 23.97 L-苯丙氨酸 ↓ 0.49*** ↓ 0.58** − − 19 24.73 4-羟基苯乙醇 ↑ 6.93*** ↑ 4.06*** ↓ 0.59## 20 25.41 2-苯基-1-丙胺 ↓ 0.15*** ↓ 0.23*** − − 21 29.3 1,4-丁二胺 ↑ 4.90*** ↑ 6.07*** ↑ 1.24 22 30.18 甘油磷酸 ↑ 2.36*** ↑ 1.98* − − 23 31.64 柠檬酸 ↑ 33.56*** ↑ 26.16*** − − 24 37.36 十六烷酸 ↑ 2.98*** ↑ 3.64*** ↑ 1.22## 25 38.03 纤维醇 ↓ 0.39*** ↓ 0.70** ↑ 1.81### 26 46.46 1-甲基腺苷 ↑ 1.61** ↑ 1.95* ↑ 1.21 27 48.03 海藻糖 ↑ 4.75*** ↑ 4.07*** − − 28 49.25 甘露糖 ↑ 12.88*** ↑ 8.68** ↓ 0.68 29 49.71 半乳糖醇 ↑ 2.32*** ↑ 3.12*** ↑ 1.34# 注:FC1值=AmB组平均值/对照组平均值;FC2值=联用组平均值/对照组平均值;FC3值=联用组平均值/AmB组平均值;↑:相对含量升高;↓:相对含量降低;−:两组含量无显著差异。
*P<0.05,**P<0.01,***P<0.001,与对照组比较;#P<0.05,##P<0.01,###P<0.001,与AmB组比较。 -
[1] 张欠欠, 罗传玉, 陈嘉琪, 等. 白念珠菌感染现状及抗真菌药物研究进展[J]. 中国真菌学杂志, 2021, 16(5): 356-360. doi: 10.3969/j.issn.1673-3827.2021.05.013 [2] WANG Y. Looking into Candida albicans infection, host response, and antifungal strategies[J]. Virulence, 2015, 6(4): 307-308. doi: 10.1080/21505594.2014.1000752 [3] JACOBS S E, ZAGALIOTIS P, WALSH T J. Novel antifungal agents in clinical trials[J]. F1000Research, 2021, 10: 507. doi: 10.12688/f1000research.28327.1 [4] BAGHIROVA A A, KASUMOV K M. Antifungal macrocycle antibiotic amphotericin B-its present and future. multidisciplinary perspective for the use in the medical practice[J]. Biochem Mosc Suppl B Biomed Chem, 2022, 16(1): 1-12. [5] 赵柳娅, 曹颖瑛, 姜远英. 两性霉素B联合用药的研究进展[J]. 药学实践杂志, 2014, 32(1): 1-4,8. [6] MORAES D C. Recent developments on the anti-Candida effect of amphotericin B combined with a second drug - a mini-review[J]. An Acad Bras Cienc, 2023, 95(1): e20220033. doi: 10.1590/0001-3765202320220033 [7] KHAN S N, KHAN S, MISBA L, et al. Synergistic fungicidal activity with low doses of eugenol and amphotericin B against Candida albicans[J]. Biochem Biophys Res Commun, 2019, 518(3): 459-464. doi: 10.1016/j.bbrc.2019.08.053 [8] XING X R, LIAO Z B, TAN F, et al. Effect of nicotinamide against Candida albicans[J]. Front Microbiol, 2019, 10: 595. doi: 10.3389/fmicb.2019.00595 [9] YAN Y, LIAO Z B, SHEN J, et al. Nicotinamide potentiates amphotericin B activity against Candida albicans[J]. Virulence, 2022, 13(1): 1533-1542. doi: 10.1080/21505594.2022.2119656 [10] BÖTTCHER B, DRIESCH D, KRÜGER T, et al. Impaired amino acid uptake leads to global metabolic imbalance of Candida albicans biofilms[J]. NPJ Biofilms Microbiomes, 2022, 8(1): 78. doi: 10.1038/s41522-022-00341-9 [11] TAO L, ZHANG Y L, FAN S R, et al. Integration of the tricarboxylic acid (TCA) cycle with cAMP signaling and Sfl2 pathways in the regulation of CO2 sensing and hyphal development in Candida albicans[J]. PLoS Genet, 2017, 13(8): e1006949. doi: 10.1371/journal.pgen.1006949 [12] LIAO Z B, ZHANGGUAN X Z, ZHU Z Y, et al. Enhancement of the antibiofilm activity of amphotericin B by polyamine biosynthesis inhibitors[J]. Int J Antimicrob Agents, 2015, 46(1): 45-52. doi: 10.1016/j.ijantimicag.2015.02.021 -




 下载:
下载: