-
创伤性脑损伤(TBI)是脑部受外力打击后引起的神经系统疾病,可导致大脑暂时性或永久性的功能或结构损伤[1],是急诊外科最为常见的损伤,同时也是现代战争的标志性创伤之一。TBI可分为原发性损伤和继发性损伤,继发性损伤包括氧化应激、炎症反应、线粒体功能障碍等,是TBI患者神经修复预后不良的主要原因[2],也与多种神经退行性疾病的病理机制密切相关。
基于干细胞的组织再生修复治疗已经在基础研究和临床试验中得到广泛开展[3]。间充质干细胞(MSCs)移植是促进中枢神经损伤后修复极具潜力的方向[4]。MSCs是一种多能干细胞,可以从骨髓、脐带等组织中获取[5-6]。研究表明,炎症环境中,MSCs可以迁移到脑损伤部位,通过旁分泌机制分泌生长因子、抗炎因子等,具有减少神经炎症、增强神经发生以及改善运动和认知功能的作用[4, 7-8]。TBI后,将骨髓间充质干细胞(BMSCs)直接注射到脑损伤部位,或通过静脉或动脉注射,被证明可以显著改善运动和认知障碍[9-11]。白藜芦醇(RSV)是非黄酮类多酚有机化合物,具有抗炎、抗氧化等作用[12]。RSV已被证明可抑制神经元自噬和炎症,减轻TBI引起的脑水肿,提高学习记忆能力,并促进运动感觉功能恢复[13]。
组织工程支架是再生医学中非常有应用潜力的工具,使用无毒、低免疫原性、可注射和降解的生物材料作为支架负载生物活性单元,如干细胞/胞外囊泡进行移植治疗,具有局部定位、修补缺损组织、可在较长时间内发挥治疗活性的优势[14],有效解决干细胞移植滞留和存活率低的难题。温度敏感水凝胶因其对温度变化的敏感性而得到了广泛应用,该特性赋予了水凝胶局部可注射及驻留的特性[15]。N-异丙基丙烯酰胺(NIPAM)是热敏感性聚合物之一,低临界相转变温度为32℃,接近于人体温度,化学性质稳定,已被广泛用作具有智能温度响应性的药物和基因传递系统,是制备温度响应性水凝胶的理想材料[16]。透明质酸(HA)是细胞外基质的主要成分之一,存在于全身组织,并且具有低硬度和生物相容性,是一种有潜力用于脑组织的生物医学应用材料[17]。丝素蛋白(SF)是从蚕丝中提取的天然高分子纤维蛋白,具有低免疫原性及可生物降解特性[18]。
本研究以SF和HA为聚合物骨架,结合温敏分子NIPAM制备了温敏水凝胶NIPAM-HA-SF,负载BMSCs和RSV-LIP,考察水凝胶对TBI的治疗作用。
-
Thermo UltiMate 3000液相色谱仪(美国Thermo公司);冷冻干燥机V55C(美国Virtis有限公司)。FBS(美国Gibco公司);MSCs培养基套装(上海唯恩生物有限公司);MEM培养基(上海源培生物科技股份有限公司);RSV(99%,上海阿拉丁生化科技股份有限公司);氢化卵磷脂[艾伟拓(上海)医药科技有限公司];胆固醇(99%生物技术级,上海麦克林生化科技股份有限公司);NIPAM(上海泰坦科技股份有限公司);透明质酸[生工生物工程(上海)股份有限公司];丝素蛋白[150 KD,复向丝素医疗科技(苏州)有限公司];活性氧检测试剂盒、Calcein/PI细胞活性与细胞毒性检测试剂盒(上海碧云天生物技术有限公司);TNF-α ELISA试剂盒(武汉菲恩生物科技有限公司);激光粒度分析仪(英国Malvern公司);多功能荧光测定仪(美国Agilent公司)。
SD大鼠、C57小鼠均购于上海斯莱克实验动物有限责任公司;动物实验均经海军军医大学医学伦理委员会批准,并按照海军军医大学动物护理和使用指南进行饲养。
-
取SD大鼠(雄性,2~3周),麻醉后脱颈处死,分离股骨和胫骨,PBS冲洗骨髓腔并收集冲洗液,过70 μm筛网后以300×g离心5 min,以PBS重悬,300×g离心5 min,以红细胞裂解液重悬,静置10 min。450×g离心后以PBS重悬,300×g离心5 min得到细胞沉淀。加入MSCs完全培养基,接种于细胞培养皿,置于37℃,5% CO2细胞培养箱培养。
-
称取0.153 g NIPAM,溶解于双蒸水中,在冰浴条件下氮气除氧1 h。过硫酸钾(KPS,0.058 g)和2-巯基乙胺(AET,0.122 g)分别溶解于双蒸水中,在冰浴条件下氮气保护搅拌。4 h后,加入HA溶液(0.256 g溶解于双蒸水中),加入EDC/NHS(0.200 g/0.100 g),N2保护低温反应24 h,得到NIPAM-HA。
将NIPAM-HA和SF混合(SF∶HA=1∶1),加入EDC/NHS(0.400 g/0.200 g),N2保护低温反应24 h。透析3 d,收集产物,−80℃过夜,使用真空冷冻干燥机冻干3 d,得NIPAM-HA-SF。
-
以薄膜分散-挤出法制备RSV-LIP。称取RSV、卵磷脂、氢化卵磷脂、胆固醇适量,溶解于10 ml混合溶剂中(甲醇∶氯仿=1∶1,V/V),浓度分别为0.200、0.660、1.540、0.734 mg/ml。45℃,20 r/min避光旋蒸1 h,加入5 ml PBS(1×,pH 7.4),45℃水化1 h。而后将混悬液依次通过挤出器过400、100 nm膜各挤出30次,得到RSV-LIP。
-
取RSV-LIP混悬液,马尔文激光粒度仪测定粒径、Zeta电位。
-
色谱条件:色谱柱:Diamonsil C18(200 mm×4.6 mm,5 μm);流动相:乙腈-PBS(0.01 mol/L,pH 7.4)(65∶35);流速:0.8 ml/min;检测波长:306 nm;柱温:35℃;进样量:10 μl。
取 200 μl RSV-LIP溶液,加入4倍体积甲醇涡旋15 min,4℃,15 000 r/min离心30 min,取上清液,HPLC法测定脂质体中药物浓度。同时取200 μl RSV-LIP,4℃,15 000 r/min离心30 min,吸弃上清液,加入甲醇混匀,4℃,15 000 r/min离心 30 min,取上清液,HPLC分析,按照以下公式测定载药量和包封率:
$$ \begin{split}\text{包封率} & =\frac{\text{脂质体中包封的药量}}{\text{脂质体中总药量}}\times 100\text{%;} \\ \text{载药量} & =\frac{\text{脂质体中包封的药量}}{\text{脂质体总质量}}\times 100\text{%。}\end{split} $$ -
取适量NIPAM-HA-SF溶解于双蒸水,加入适量RSV-LIP,搅拌均匀,置于37℃孵育10 min即得载RSV-LIP水凝胶。
-
线性:色谱条件同“1.4.3”。精密量取一定体积的对照品母液于5 ml容量瓶中,分别用甲醇稀释浓度为1、4、10、20、50、100、200 μg/ml的对照品溶液。按上述色谱条件进行测定,以RSV质量浓度(X)为横坐标,峰面积(Y)为纵坐标,进行线性回归。
专属性:精密称定RSV对照品10 mg加甲醇溶解,置于100 ml棕色容量瓶并定容至刻度线,摇匀,即为对照品溶液。取100 μl载RSV-LIP的水凝胶,甲醇溶解后置于5 ml容量瓶中并定容,超声5 min,10 000 r/min离心10 min,取上清液过0.22 μm滤膜即得供试品溶液。取100 μl空白脂质体凝胶,按供试品溶液的制备方法制备,即得阴性样品溶液。
精密度:取4、20、200 μg/ml的对照品溶液,按上述色谱条件1 d内重复进样3次考察日内精密度,同时连续3 d测定以考察日间精密度。
回收率:取100 μl载空白脂质体的水凝胶置于5 ml容量瓶中,分别加入不同体积的RSV对照品溶液,以甲醇定容至刻度线,使RSV浓度分别为4、20、200 μg/ml,同浓度制备3份。摇匀,超声5 min,10 000 r/min离心10 min,取上清液,过0.22 μm滤膜后进样测定。
体外释药:取适量载RSV-LIP的水凝胶装封于透析袋(3.5×106 Da)中,置于20 ml的双蒸水中,37℃,100 r/min条件下持续震荡。分别于0.5、1、2、4、6、8、10、12、24、48、72 h吸取1 ml袋外溶液,并补充相同温度体积的空白释放介质。取出溶液加入适量甲醇,10 000 r/min离心15 min,取上清液,过0.22 μm滤膜后进样。测定不同时间点释放介质内RSV的浓度,绘制体外释放曲线,计算RSV的累计释放度。
-
将BMSCs与RSV-LIP和水凝胶一起共孵育,使用Calcein/PI细胞活性与细胞毒性检测试剂盒检测BMSCs生存情况。取生长状态良好的BMSCs,将1
$ \times $ 105个细胞接种到共聚焦皿中,并加入灭好菌的水凝胶及RSV-LIP,置于37℃,5% CO2细胞培养箱中培养。培养1、4 d后,用 Calcein AM/PI检测工作液检测。激光共聚焦显微镜观察染色效果,活细胞呈绿色荧光,死细胞呈红色荧光。 -
以TBHP制备神经元细胞氧化应激损伤模型。分组为对照组、TBHP组、BMSCs组、RSV组、RSV-LIP组和BMSCs+RSV-LIP组。取对数生长期的HT22细胞接种至24孔板,37℃孵育24 h后,每孔加入1 ml培基稀释的TBHP(10 μg/ml),37℃孵育24 h后吸弃上清液,按分组加入各组样品,其中RSV为10 μg/ml,BMSCs为1×105个/孔,37℃孵育48 h。使用活性氧检测试剂盒检测各组ROS水平,荧光酶标仪检测荧光强度(Ex/Em=488/525 nm)。
-
以LPS制备小胶质细胞炎症损伤模型。分组为对照组、LPS组、BMSCs组、RSV组、RSV-LIP组和BMSCs+RSV-LIP组。取对数生长期的BV2细胞接种至24孔板,37℃孵育24 h后,每孔加入0.10 μg/ml的 LPS,37℃孵育24 h后吸弃上清液。按分组加入各组样品,其中RSV为10 μg/ml,BMSCs为1×105个/孔,37℃孵育24 h。取细胞上清液,收集于离心管内,使用ELISA 试剂盒检测TNF-α水平,酶标仪 450 nm检测吸光度值。
-
构建划痕损伤模型。分组为对照组、BMSCs组、RSV组、RSV-LIP组和BMSCs+RSV-LIP组。取对数生长期的NE-4C接种至24孔板,细胞密度达80%~90%后用1 ml枪头在细胞层上进行划痕。划痕结束后,使用PBS洗细胞1次,按分组加入各组样品,其中RSV为10 μg/ml,BMSCs为1×105个/孔,置37℃,5% CO2培养箱培养。0、12、24 h观察各组细胞的迁移情况并拍照。
-
C57小鼠(雄性,8周龄)随机分组:Sham组(假手术组)、对照组(造模后不给药)、载BMSCs水凝胶组、载RSV-LIP水凝胶组、载BMSCs+RSV-LIP水凝胶组,每组6只。
建立控制皮质冲击(CCI)损伤模型。腹腔注射1%(w/v)戊巴比妥钠溶液麻醉小鼠(50 mg/kg),固定于脑立体定位仪,沿头顶正中线做约1 cm左右的纵向切口,暴露出头骨。在前囟后约1 mm,冠状缝右侧约2 mm位置,钻出一个直径为4 mm 圆形孔。设置仪器工作参数:冲击速度为5 m/s,冲击深度为1.0 mm,冲击持续时间为100 ms,对小鼠脑部进行撞击。撞击结束后按分组进行处理,脑损伤原位注射20 μl含药凝胶(BMSCs:1×106个/只,RSV:0.9 mg/kg),消毒伤口并进行缝合。
-
改良神经功能损害(mNSS)评分实验。根据mNSS评分标准,对各组TBI小鼠的运动、感觉、平衡能力以及反射反应等情况予以评估。mNSS评分为0~18分,分数越高表明TBI小鼠的神经功能损伤越严重。本实验于TBI术后1、2、3、4、5、6、7、9、11、14 d进行评估。
踏空实验。TBI术后1、2、3、4、5、6、7、9、11、14 d将各组TBI小鼠放置在铁丝网格随机的位置上,观察并记录其行走的总步,以及在移动过程中踩空的次数。计算踩空次数和总步数的比值,比值越大说明TBI小鼠的神经损伤越严重。
悬挂实验。水平悬空固定一根钢针,TBI术后1、2、3、4、5、6、7、9、11、14 d依次将各组TBI小鼠挂在钢针的中间,观察并记录其在钢针上悬挂的时间及状态。评分标准为: ①脱落(0分);②仅悬挂在钢针上(达30 s),但无法移动(1分);③前爪挂在钢针上,同时后爪试图挂钢针上(2分);④2只前爪和1只或2只后爪挂在钢针上(3分);⑤4只爪子都挂于钢针,且尾巴卷在钢针上(4分);⑥爬到了一侧固定的架子上(5分)。分值越低说明TBI小鼠的神经损伤越严重。
-
采用GraphPad Prism 9(GraphPad Software, San Diego, CA)计算。两组间数据的比较采用Unpaired Student’s T-test,多组间的数据比较采用One-way ANOVA。以P<0.05表示差异有统计学意义,P<0.01表示差异显著,P<0.001表示差异非常显著。
-
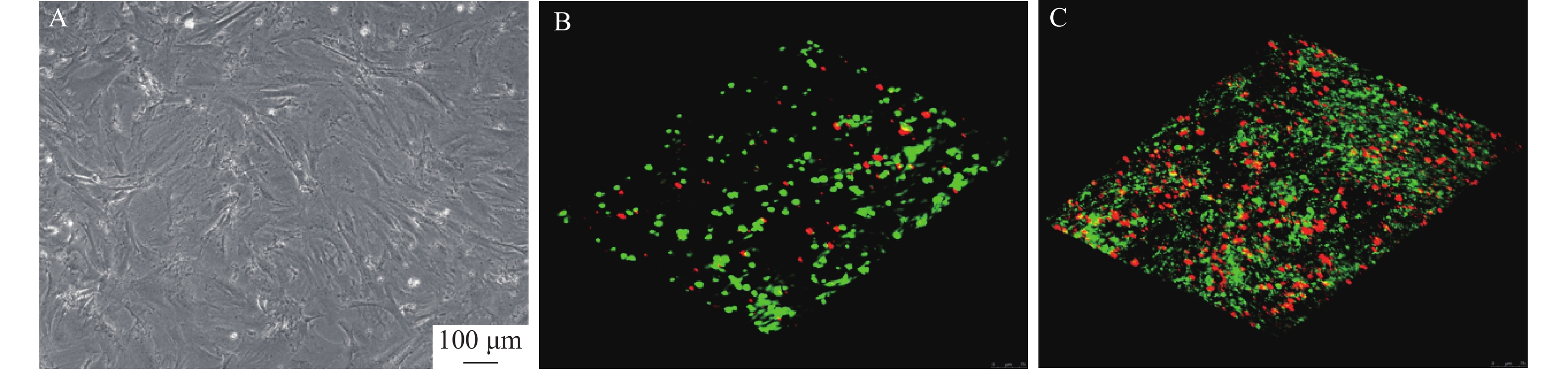
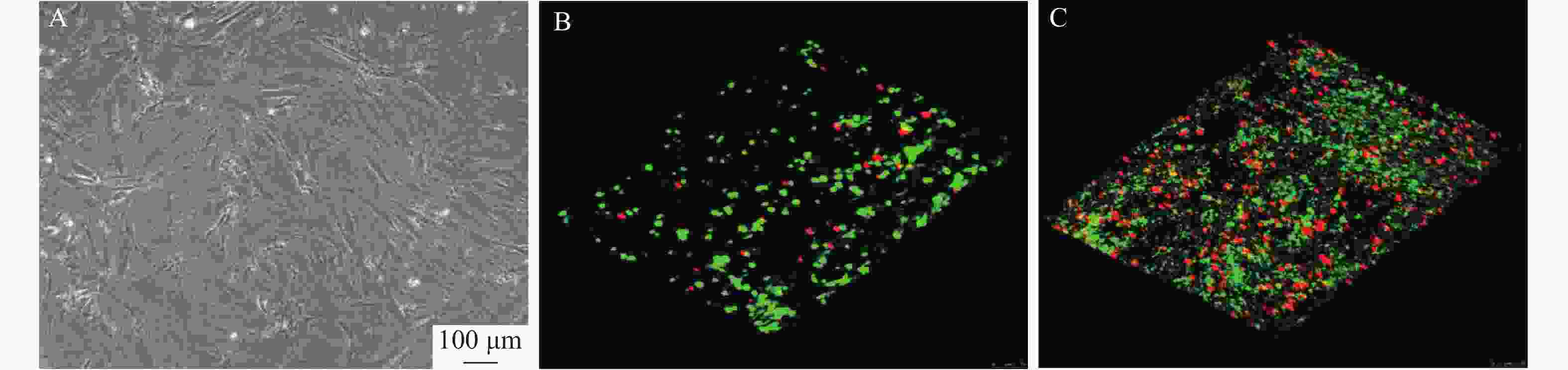
如图1所示,BMSCs与RSV-LIP和水凝胶共培养1、4 d,激光共聚焦显微镜观察显示绿色荧光细胞较多,BMSCs生长状况良好,随着时间的延长,死细胞的比例增加,活细胞也有所增加,说明装载RSV-LIP的水凝胶支架对细胞活性无影响,具有较好的生物相容性。
-
RSV-LIP的粒径、Zeta电位分别为(127.80±0.41) nm,(−4.90±0.51) mV。
-
RSV-LIP中RSV的包封率为(78.50%±1.48%),载药量为(2.37%±0.06%)。
-
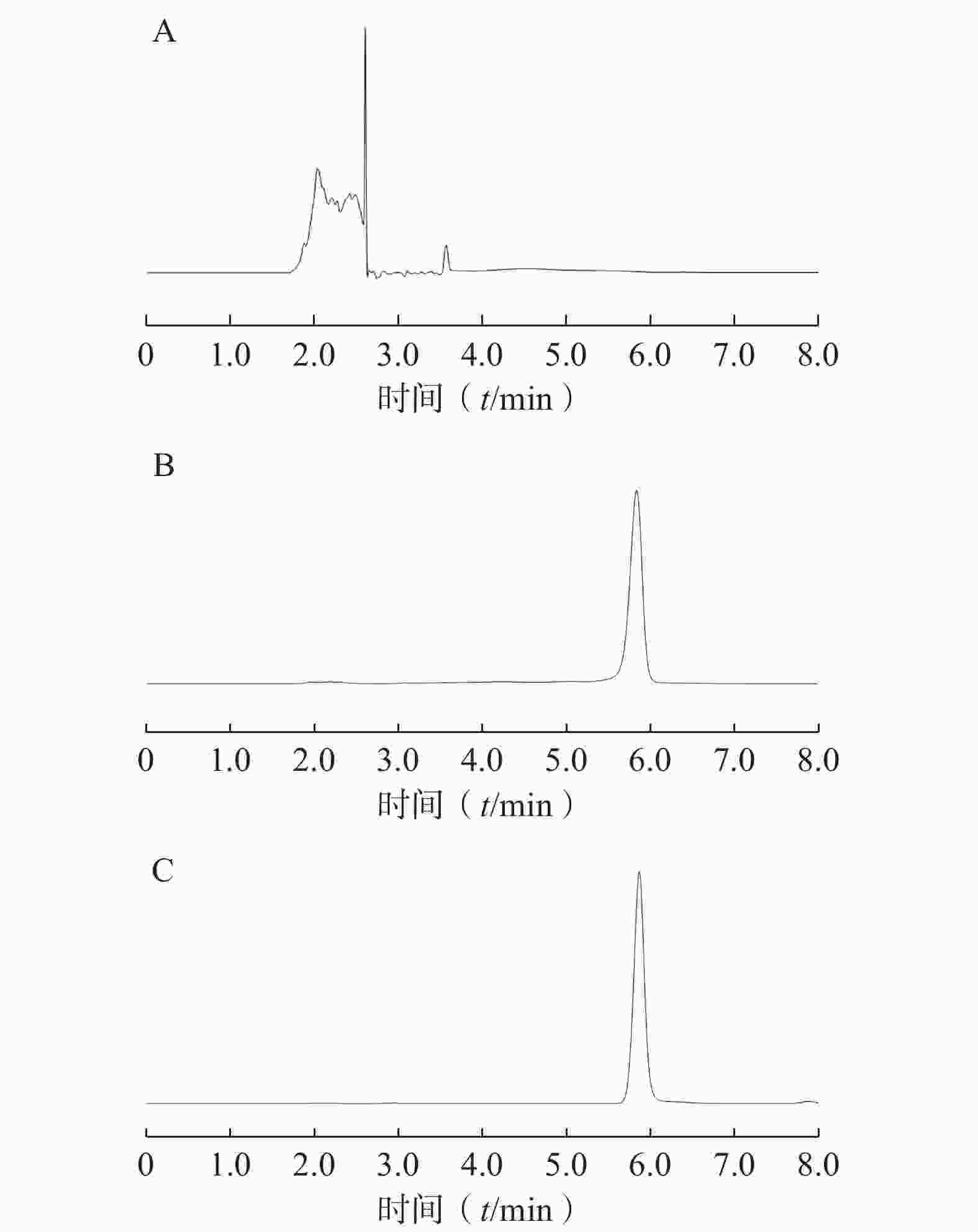
如图2所示,方法专属性良好,RSV保留时间为5.90 min,空白载体对RSV测定无干扰。1~200 µg/ml浓度范围内,RSV浓度(C, μg/ml)与峰面积(A)呈良好线性关系,线性回归方程为 A=1.953 8 C+3.012 3,R2=
0.9998 。 -
由表1可知,低、中、高浓度RSV在日内和日间均具有良好的精密度,日内精密度和日间精密度RSD均小于5%,表明所建立方法的精密度满足要求,可用于样品中RSV的含量测定。
表 1 RSV的HPLC色谱分析法精密度(
$\bar x $ ±s, n=3)浓度
(μg/ml)日内 日间 $ \bar x $±s RSD(%) $ \bar x $±s RSD(%) 100 104.40±0.22 0.21 103.40±0.25 0.24 20 24.03±0.13 0.54 2.48±0.23 1.02 4 3.80±0.02 0.53 3.78±0.03 0.79 由表2可知,低、中、高浓度RSV的回收率均在95%~115%范围内,且RSD值均小于等于5%,表明该方法稳定可靠,可用于样品中RSV含量的测定。
表 2 RSV的HPLC色谱分析法回收率(
$\bar x $ ±s, n=3)加样浓度(μg/ml) 回收浓度(μg/ml) 回收率(%) RSD(%) 100 107.70±0.03 107.10 0.03 20 20.99±0.02 104.60 0.10 4 4.02±0.02 100.20 0.50 -
载RSV-LIP的水凝胶前2 h累计释放RSV约15%,在24、48和72 h的累计释药量分别是(39.57%±0.36%)、(42.23%±0.13%)和(43.31%±0.34%),具有明显的缓释作用。
-
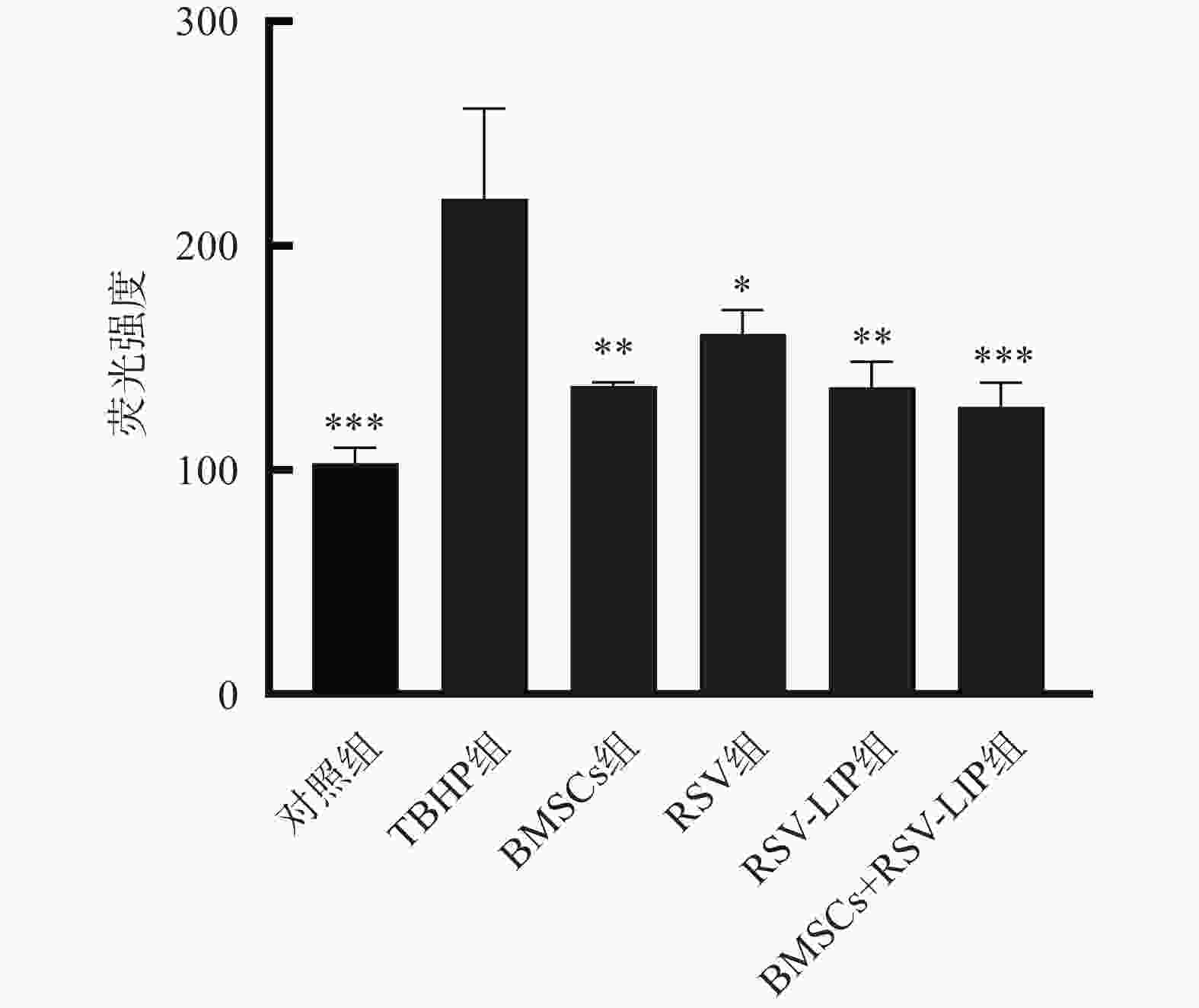
如图3所示,BMSCs组、RSV组、RSV-LIP组和BMSCs+RSV-LIP组ROS水平均低于TBHP组,其中,BMSCs+RSV-LIP组差异显著(P<0.001),说明BMSCs和RSV均具有抗氧化应激损伤的作用,合用具有协同增效的作用。
-
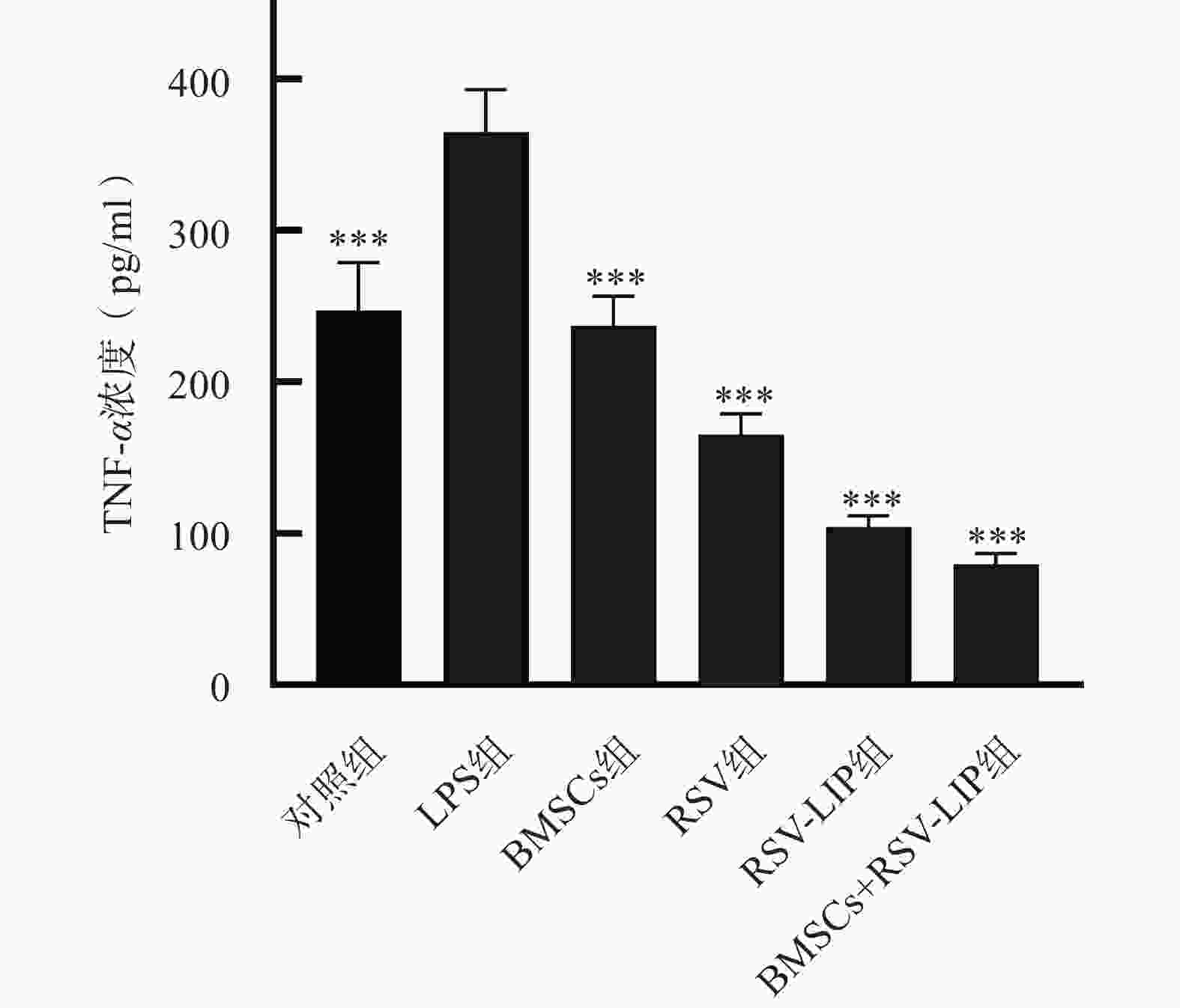
如图4所示 BMSCs组、RSV组、RSV-LIP组、BMSCs+RSV-LIP组的TNF-α水平均低于LPS组(P<0.001),说明BMSCs和RSV均具有抗炎作用。其中,BMSCs+RSV-LIP组、RSV-LIP组的抗炎作用显著高于RSV组(P<0.01)、BMSCs组(P<0.001),说明RSV以脂质体形式给药具有显著抗炎作用。
-
如图5所示,比较0、12和24 h划痕宽度,BMSCs组和BMSCs+RSV-LIP组NE-4C细胞迁移速度明显较快,表明BMSCs可以促进神经干细胞迁移,有助于损伤神经系统的再生修复。
-
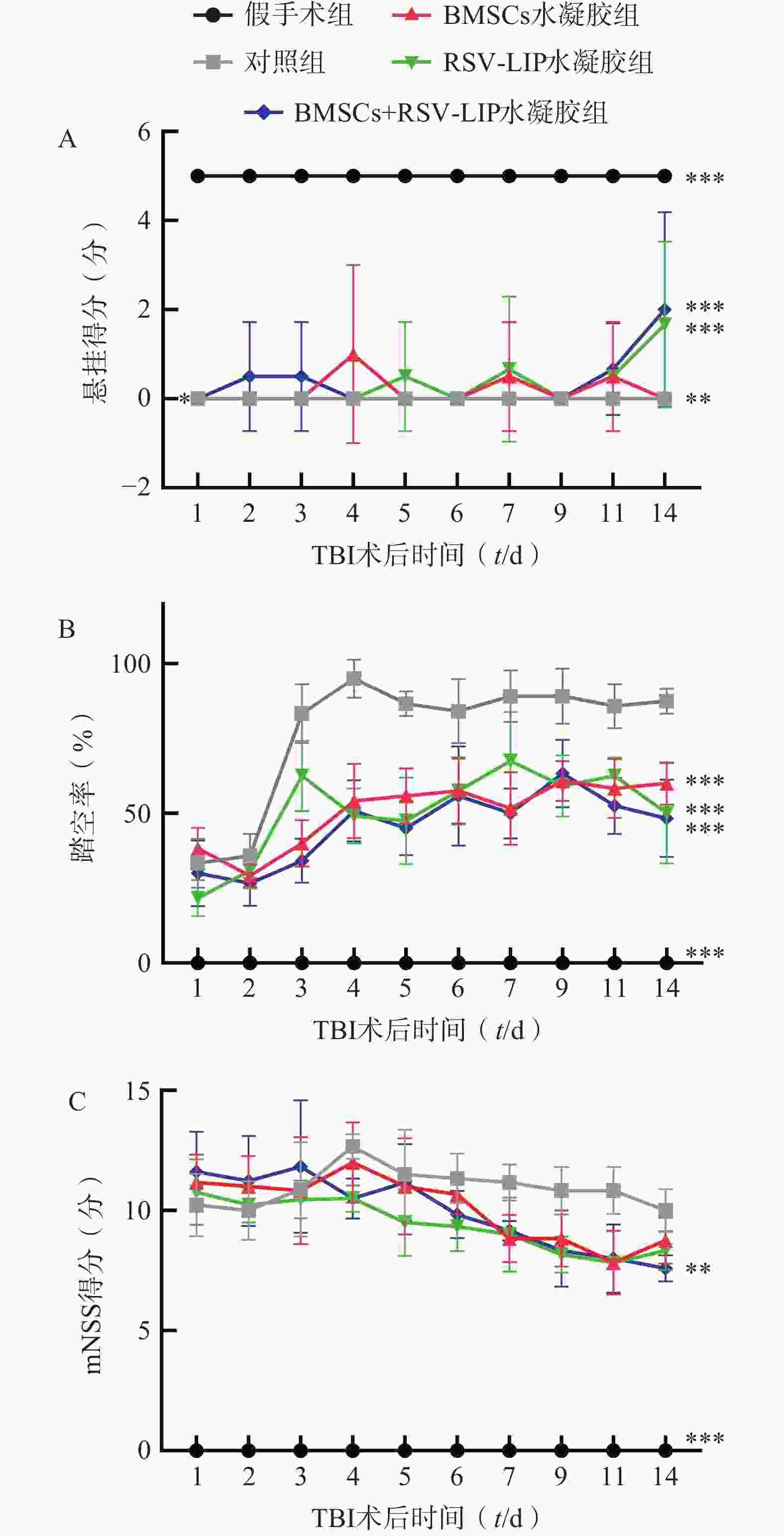
如图6A所示,BMSCs+RSV-LIP水凝胶组悬挂得分显著高于对照组(P<0.001),RSV-LIP水凝胶组得分显著高于对照组(P<0.001)。如图6B所示,BMSCs水凝胶组、RSV-LIP水凝胶组、BMSCs+RSV-LIP水凝胶组踏空概率均显著低于对照组(P<0.001)。如图6C所示,BMSCs+RSV-LIP水凝胶组mNSS评分低于对照组(P<0.01),综合说明载BMSCs+RSV-LIP水凝胶可以改善TBI小鼠肢体协调能力和平衡功能,促进TBI小鼠感觉运动功能的恢复。
-
MSCs用于再生医学的多种机制及作用得到广泛研究,MSCs在中枢神经的修复中,不仅可以促进内源性神经干细胞的增殖、迁徙和分化[19],同时具有抗炎作用[20]以及促进受损BBB恢复[21]等功能。但是干细胞移植治疗还存在一些问题,受损和病变组织内的恶劣环境不利于干细胞的有效保留、存活和增殖[22]。创造有利于干细胞局部驻留发挥活性的的微环境,成为提高干细胞移植疗效的重要举措。白藜芦醇可以抑制神经炎症和细胞凋亡,减少梗死体积和神经元损伤,改善神经功能[23-24]。白藜芦醇通过对NF-κB活化途径的抑制,抑制巨噬细胞分泌细胞因子,减轻炎症反应,还可以抑制脂质过氧化。研究发现,白藜芦醇可以剂量依赖性抑制IL-1α、IL-6和TNF-α的产生,并在体外下调IL-17的mRNA表达和蛋白质分泌[25]。Guo等[26]亦证实白藜芦醇可以明显抑制巨噬细胞内TNF-α、IL-1β和IL-6的表达,下调了toll样受体4(TLR4)/NF-κB/缺氧诱导因子-1α(HIF-1α)的蛋白表达,具有显著的抗炎、抗氧化机制[27]。但是白藜芦醇在碱性条件下稳定性降低,对光敏感易降解,水溶性差[28],研究人员对多种递送系统如脂质体、微乳、纳米囊泡等进行了研究,用以控制白藜芦醇的稳定性和释放[29]。本研究中将白藜芦醇制备为脂质体,形成水分散系统从而有利于在水凝胶中分散,同时药物从脂质体中缓慢释放,从而持续发挥治疗作用。干细胞在水凝胶中的生物活性对其发挥作用很重要,本研究发现在载有白藜芦醇脂质体的水凝胶中,细胞的生存状态良好,说明BMSCs可以在水凝胶中维持较好的活性。
水凝胶具有三维交联的聚合物网络,能够提高细胞移植滞留和存活率,控制药物释放速度,常被用作治疗载体实现局部或全身药物输送。本文构建了的温敏水凝胶支架,包载BMSCs和RSV-LIP发挥协同作用。研究表明,内源性的神经干细胞的再生和分化在TBI损伤的情况下受到抑制,BMSCs具有促进神经干细胞增值的作用,同时白藜芦醇具有显著的抗炎和抗ROS活性,二者联合将改善TBI损伤后微环境,促进内源性神经干细胞的迁徙。同时水凝胶可以模拟细胞外微环境,为BMSCs驻留和活性保持提供适宜环境。水凝胶的基质材料为透明质酸和丝素蛋白,均为天然的高分子材料,透明质酸是构成细胞ECM的重要组成部分,丝素蛋白具有天然的降解特性,被FDA批准用于医药辅料,因此制备的水凝胶具有良好的生物相容性,可赋予细胞生长驻留的空间,提供支架环境以利于细胞增殖和活性保持,载体同时具有生物降解特性,安全性好适宜用于中枢给药。
Hydrogel scaffolds loaded with bone marrow mesenchymal stem cells/resveratrol liposomes for traumatic brain injury treatment
-
摘要:
目的 制备温敏水凝胶支架负载骨髓间充质干细胞(BMSCs)及白藜芦醇脂质体(RSV-LIP)形成治疗单元,考察其对创伤性脑损伤的治疗效率。 方法 提取大鼠BMSCs,制备RSV-LIP并进行表征,构建细胞模型考察BMSCs联合RSV-LIP的体外药效。将BMSCs和RSV-LIP装载于水凝胶,构建TBI小鼠模型并评价水凝胶对模型的治疗作用。 结果 RSV-LIP粒径127.8 nm,电位−4.9 mV,包封率78.50%,载药量2.37%。细胞Live/Dead染色结果表明水凝胶具有良好的生物相容性。BMSCs联合RSV-LIP对TNF-α具有明显抑制作用,可以显著降低ROS水平,划痕实验中具有显著的促细胞迁徙作用。水凝胶与对照组相比,mNSS评分显著降低(P<0.01)、悬挂得分显著升高(P<0.001)、踏空率显著降低(P<0.001)。 结论 BMSCs和RSV-LIP联合应用具有抗氧化应激、抗炎和促进神经干细胞迁徙的作用,将其负载于水凝胶支架后局部植入,可以改善TBI小鼠的运动感觉功能。 Abstract:Objective To prepare a thermosensitive hydrogel scaffold loaded with bone marrow mesenchymal stem cells(BMSCs) and resveratrol liposomes (RSV-LIP) to form a therapeutic unit and evaluate its treatment efficacy for traumatic brain injury (TBI). Methods BMSCs were extracted from rats, and RSV-LIP was prepared and characterized. Cell models were constructed to investigate the pharmacological effects of BMSCs combined with RSV-LIP. BMSCs and RSV-LIP were then loaded into the hydrogel, and a TBI mouse model was established to evaluate the therapeutic effects of the hydrogel. Results The RSV-LIP had a particle size of 127.8 nm, a Zeta potential of −4.9 mV, an encapsulation efficiency of 78.50%, and a drug loading content of 2.37%. Live-dead staining indicated good biocompatibility of the hydrogel. The combination of BMSCs and RSV-LIP significantly inhibited TNF-α and reduced ROS levels, promoting cell migration in scratch assays. Compared to the control group, the hydrogel group showed significantly lower mNSS scores (P<0.01), higher hanging scores (P<0.001), and reduced stepping errors (P<0.001). Conclusion The combination of BMSCs and RSV-LIP exhibited antioxidative stress, anti-inflammatory, and neurogenic cell migration-promoting effects. When loaded into a hydrogel scaffold and locally implanted, it could improve the motor and sensory functions in TBI mice. -
表 1 RSV的HPLC色谱分析法精密度(
$\bar x $ ±s, n=3)浓度
(μg/ml)日内 日间 $ \bar x $ ±sRSD(%) $ \bar x $ ±sRSD(%) 100 104.40±0.22 0.21 103.40±0.25 0.24 20 24.03±0.13 0.54 2.48±0.23 1.02 4 3.80±0.02 0.53 3.78±0.03 0.79 表 2 RSV的HPLC色谱分析法回收率(
$\bar x $ ±s, n=3)加样浓度(μg/ml) 回收浓度(μg/ml) 回收率(%) RSD(%) 100 107.70±0.03 107.10 0.03 20 20.99±0.02 104.60 0.10 4 4.02±0.02 100.20 0.50 -
[1] CRUPI R, CORDARO M, CUZZOCREA S, et al. Management of traumatic brain injury: from present to future[J]. Antioxidants (Basel), 2020, 9(4):297. [2] ORTEGA-PÉREZ S, AMAYA-REY M C. Secondary brain injury: a concept analysis[J]. J Neurosci Nurs, 2018, 50(4):220-224. doi: 10.1097/JNN.0000000000000384 [3] SONG C G, ZHANG Y Z, WU H N, et al. Stem cells: a promising candidate to treat neurological disorders[J]. Neural Regen Res, 2018, 13(7):1294-1304. doi: 10.4103/1673-5374.235085 [4] DAS M, MAYILSAMY K, MOHAPATRA S S, et al. Mesenchymal stem cell therapy for the treatment of traumatic brain injury: progress and prospects[J]. Rev Neurosci, 2019, 30(8):839-855. doi: 10.1515/revneuro-2019-0002 [5] DA SILVA MEIRELLES L, CHAGASTELLES P C, NARDI N B. Mesenchymal stem cells reside in virtually all post-natal organs and tissues[J]. J Cell Sci, 2006, 119(Pt 11): 2204-2213. [6] LYE K L, NORDIN N, VIDYADARAN S, et al. Mesenchymal stem cells: from stem cells to sarcomas[J]. Cell Biol Int, 2016, 40(6):610-618. doi: 10.1002/cbin.10603 [7] DEHGHANIAN F, SOLTANI Z, KHAKSARI M. Can mesenchymal stem cells act multipotential in traumatic brain injury[J]? J Mol Neurosci, 2020, 70(5):677-688. doi: 10.1007/s12031-019-01475-w [8] HASAN A, DEEB G, RAHAL R, et al. Mesenchymal stem cells in the treatment of traumatic brain injury[J]. Front Neurol, 2017, 8:28. [9] ADUGNA D G, ARAGIE H, KIBRET A A, et al. Therapeutic application of stem cells in the repair of traumatic brain injury[J]. Stem Cells Cloning, 2022, 15:53-61. [10] LU D, MAHMOOD A, WANG L, et al. Adult bone marrow stromal cells administered intravenously to rats after traumatic brain injury migrate into brain and improve neurological outcome[J]. Neuroreport, 2001, 12(3):559-563. doi: 10.1097/00001756-200103050-00025 [11] MAHMOOD A, LU D, YI L, et al. Intracranial bone marrow transplantation after traumatic brain injury improving functional outcome in adult rats[J]. J Neurosurg, 2001, 94(4):589-595. doi: 10.3171/jns.2001.94.4.0589 [12] MENG T T, XIAO D F, MUHAMMED A, et al. Anti-inflammatory action and mechanisms of resveratrol[J]. Molecules, 2021, 26(1):229. doi: 10.3390/molecules26010229 [13] FENG Y, JU Y R, YAN Z J, et al. Resveratrol attenuates autophagy and inflammation after traumatic brain injury by activation of PI3K/Akt/mTOR pathway in rats[J]. Fn, 2022, 60(2):153-164. doi: 10.5114/fn.2022.118184 [14] WANG C M, GONG Y H, ZHONG Y, et al. The control of anchorage-dependent cell behavior within a hydrogel/microcarrier system in an osteogenic model[J]. Biomaterials, 2009, 30(12):2259-2269. doi: 10.1016/j.biomaterials.2008.12.072 [15] HUANG H Q, QI X L, CHEN Y H, et al. Thermo-sensitive hydrogels for delivering biotherapeutic molecules: a review[J]. Saudi Pharm J, 2019, 27(7):990-999. doi: 10.1016/j.jsps.2019.08.001 [16] HU Y L, SHIN Y, PARK S, et al. Multifunctional oxidized Succinoglycan/Poly (N-isopropylacrylamide-co-acrylamide) hydrogels for drug delivery[J]. Polymers, 2022, 15(1):122. doi: 10.3390/polym15010122 [17] TORRES-ORTEGA P V, DEL CAMPO-MONTOYA R, PLANO D, et al. Encapsulation of MSCs and GDNF in an injectable nanoreinforced supramolecular hydrogel for brain tissue engineering[J]. Biomacromolecules, 2022, 23(11):4629-4644. doi: 10.1021/acs.biomac.2c00853 [18] JEONG Y W, KIM H S, THANGAVELU M, et al. Progress in silk fibroin based composite scaffold/hydrogel: silk fibroin/PEG hydrogel for the RPE regeneration a promising biomaterial for clinical application[J]. Front Mater, 2020, 7:305. [19] MUNOZ J R, STOUTENGER B R, ROBINSON A P, et al. Human stem/progenitor cells from bone marrow promote neurogenesis of endogenous neural stem cells in the hippocampus of mice[J]. Proc Natl Acad Sci U S A, 2005, 102(50):18171-18176. doi: 10.1073/pnas.0508945102 [20] ZHANG R, LIU Y, YAN K, et al. Anti-inflammatory and immunomodulatory mechanisms of mesenchymal stem cell transplantation in experimental traumatic brain injury[J]. J Neuroinflammation, 2013, 10:106. [21] MENGE T, ZHAO Y H, ZHAO J, et al. Mesenchymal stem cells regulate blood-brain barrier integrity through TIMP3 release after traumatic brain injury[J]. Sci Transl Med, 2012, 4(161):161ra150. [22] BURDICK J A, MAUCK R L, GERECHT S. To serve and protect: hydrogels to improve stem cell-based therapies[J]. Cell Stem Cell, 2016, 18(1):13-15. doi: 10.1016/j.stem.2015.12.004 [23] YU P P, WANG L, TANG F R, et al. Resveratrol pretreatment decreases ischemic injury and improves neurological function via sonic hedgehog signaling after stroke in rats[J]. Mol Neurobiol, 2017, 54(1):212-226. doi: 10.1007/s12035-015-9639-7 [24] HOU Y Y, WANG K, WAN W J, et al. Resveratrol provides neuroprotection by regulating the JAK2/STAT3/PI3K/AKT/mTOR pathway after stroke in rats[J]. Genes Dis, 2018, 5(3):245-255. doi: 10.1016/j.gendis.2018.06.001 [25] FUGGETTA M P, BORDIGNON V, COTTARELLI A, et al. Downregulation of proinflammatory cytokines in HTLV-1-infected T cells by Resveratrol[J]. J Exp Clin Cancer Res, 2016, 35(1):118. doi: 10.1186/s13046-016-0398-8 [26] GUO L, ZHANG X, LV N, et al. Therapeutic role and potential mechanism of resveratrol in atherosclerosis: TLR4/NF-κB/HIF-1α[J]. Mediators of Inflammation, 2023, 2023(1):1097706. [27] GU T Y, WANG N M, WU T, et al. Antioxidative stress mechanisms behind resveratrol: a multidimensional analysis[J]. J Food Qual, 2021, 2021:5571733. [28] BROTONS-CANTO A, GONZALEZ-NAVARRO C J, GURREA J, et al. Zein nanoparticles improve the oral bioavailability of resveratrol in humans[J]. J Drug Deliv Sci Technol, 2020, 57:101704. doi: 10.1016/j.jddst.2020.101704 [29] MACHADO N D, GUTIÉRREZ G, MATOS M, et al. Preservation of the antioxidant capacity of resveratrol via encapsulation in niosomes[J]. Foods, 2021, 10(5):988. doi: 10.3390/foods10050988 -




 下载:
下载: