-
睡莲科植物莲Nelumbo nucifera Gaertn.的干燥成熟种子与幼叶及胚根均可入药,《中国药典》分别收载为莲子和莲子心,莲子甘、涩、平,可治脾虚泄泻,心悸失眠。莲子心苦、寒,多用于热入心包,血热吐血。二者同源但药效相异,是“同源异效”的典型代表。中药药效的不同主要与其化学成分差异有关[1]。研究表明莲子和莲子心中均含生物碱类成分,具有良好抗癌活性[2-6]。推测生物碱类成分含量的差异,可能是导致莲子与莲子心药效差异的关键物质基础。
同步热分析法检测简单快速,可快速判断药材成分之间是否存在差异[7]。回流法提取生物碱的产率高,抗氧化活性强[8-9]。与其他评价法相比,细胞学评价法具有高效、简便、准确的优点,且诱导癌细胞凋亡是控制癌症的有效方式[10-14]。本实验采用同步热分析法判别莲子和莲子心成分是否存在差异,以甲基莲心碱为参考指标,优化生物碱提取工艺,UV法和HPLC法分别测定生物碱含量,通过细胞实验评价莲子和莲子心的抗癌活性差异,为莲子和莲子心的合理应用提供依据。
-
市售湖南湘潭带芯白莲子(批号:DB43/T 439),经海军军医大学黄宝康教授鉴定为睡莲科植物莲Nelumbo nucifera Gaertn.的干燥成熟种子,经手工剥离,干燥分别得莲子和莲子心药材样品。
-
Cary100型紫外分光光度计(美国Agilent公司);1260型高效液相色谱仪(美国Agilent公司);TGA/DSC3+(美国METTLER公司);12 L cascade型冷冻干燥机(美国Labconco公司);ReadMax 1500型光吸收全波长酶标仪 (上海闪谱生物技术有限公司);BHS-2型电热恒温水浴锅(群安实验仪器有限公司);TDZ5型离心机(赫西仪器设备有限公司);XS205DU十万分之一天平(美国METTLER公司)。
甲基莲心碱对照品(乐美天医药,纯度≥98%,批号:DSTDJ003302);异莲心碱对照品(乐美天医药,纯度≥98%,批号:DST230719-066);莲心碱对照品(乐美天医药,纯度≥98%,批号:DST230316-066);人肝癌细胞HepG2(中国科学院上海细胞库);CCK-8(上海碧云天生物技术有限公司);乙腈、三乙胺(色谱纯,赛默飞世尔科技公司);其余试剂(AR,上海泰坦科技股份有限公司)。
-
莲子和莲子心药材分别研磨,过120目筛,各精密称取粉末12.0 mg,设置温度范围为30~1 100 ℃,升温速率10 ℃/min,测试气氛Ar,流速50 ml/min,测试坩埚:70 μl铂金套陶瓷坩埚。
-
莲子、莲子心药材分别磨成细粉,各称30.0 g,置于500 ml圆底烧瓶,加75%乙醇(固液比1∶10),80 ℃恒温水浴回流3次,每次1 h,合并提取液,旋转蒸发,分别得80 ml浓缩液。
0.5 mol/L HCl调节莲子、莲子心浓缩液至pH值为3.0。浓缩液减压抽滤得到滤液,等量石油醚重复萃取3次,弃石油醚层,3 000 r/min离心10 min,保留溶液。2 mol/L NaOH调节二者pH值至8.0,离心后取下层沉淀,冷冻干燥,分别得总生物碱。另取莲子、莲子心浓缩液旋蒸得浸膏状固体,冷冻干燥得各自总提物。
-
称量甲基莲子心碱对照品5.0 mg,加无水乙醇配制200 μg/ml对照品溶液。
-
称量莲子总生物碱、莲子心总生物碱、莲子心总提物适量,无水乙醇溶解,分别配制成160、80、400 μg/ml的供试品溶液。
-
精密量取“2.3.1”项中对照品溶液1.0、1.5、2.0、2.5、3.0 ml于10 ml量瓶,无水乙醇定容,配制浓度20、30、40、50、60 μg/ml的梯度对照品溶液。无水乙醇为空白对照,282 nm波长处测定上述溶液的吸光度。甲基莲心碱对照品浓度为横坐标、吸光度值为纵坐标,计算线性回归方程,将“2.3.2”项的供试品溶液按上述实验步骤测定吸光度,代入方程求总生物碱含量。
-
色谱柱:Agilent ZORBAX Eclipse Plus-C18柱(2.1 mm×100 mm, 1.8 μm);流速:0.3 ml/min;检测波长:282 nm;柱温:30 ℃;进样量:5 μl;流动相:乙腈(A)-0.07%三乙胺(B);等度洗脱0~12 min,45%A[15]。
-
对照品溶液制备:精密称定莲子中主要生物碱成分异莲心碱、甲基莲心碱、莲心碱对照品适量,0.45 μm微孔滤膜过滤,分别制成1.03、1.63、0.99 mg/ml的对照品溶液。
供试品溶液制备:精密称定各提取物,甲醇定容,0.45 μm微孔滤膜过滤,即为供试品溶液。
-
称取甲基莲子心碱对照品、莲子总生物碱、莲子心总生物碱各10 mg分别溶于200 μl DMSO,配制50 mg/ml母液,DMEM培养基稀释成2 mg/ml工作液。实验前稀释为1、2、5、10、20、50、100、200 μg/ml待测液[16]。
莲子总提物、莲子心总提物母液配制同上,DMEM培养基稀释为8 mg/ml工作液,实验前稀释成5、10、20、50、100、200、400、800 μg/ml的待测液[17-19],设置空白对照组。
-
人肝癌细胞HepG2接种含10%胎牛血清DMEM培养基,37 ℃、5% CO2培养3 d,弃去培养基,PBS荡洗。0.05%胰蛋白酶-乙二胺四乙酸(Trypsin-EDTA)消化细胞,配制密度5×104个/ml细胞悬液,每孔100 μl接种96孔板中,细胞贴壁培养12 h后弃培养基,每孔加入100 μl不同浓度药物的培养基培养24 h,弃培养基,加入新鲜培养基后,每孔加入CCK-8试剂10 μl,细胞培养箱中孵育2 h。酶标仪450 nm波长处测定各孔吸光度(A)值,按公式(1)计算抑制率。
$$ \text{抑制率}=\frac{(A_{\text{对照}}-A_{\text{实验}})}{(A_{\text{对照}}-A_{\text{背景}})}\times100\text{%} $$ (1) 实验数据都以均值±标准差(Mean±SD)表示,利用SPSS 26.0对数据进行统计学分析,组间比较采用One-way ANOVA检验。
-
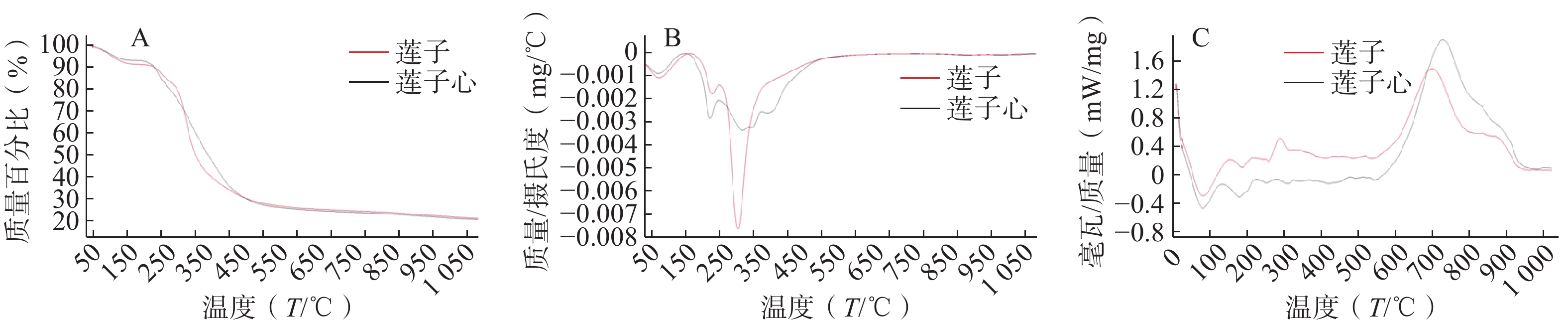
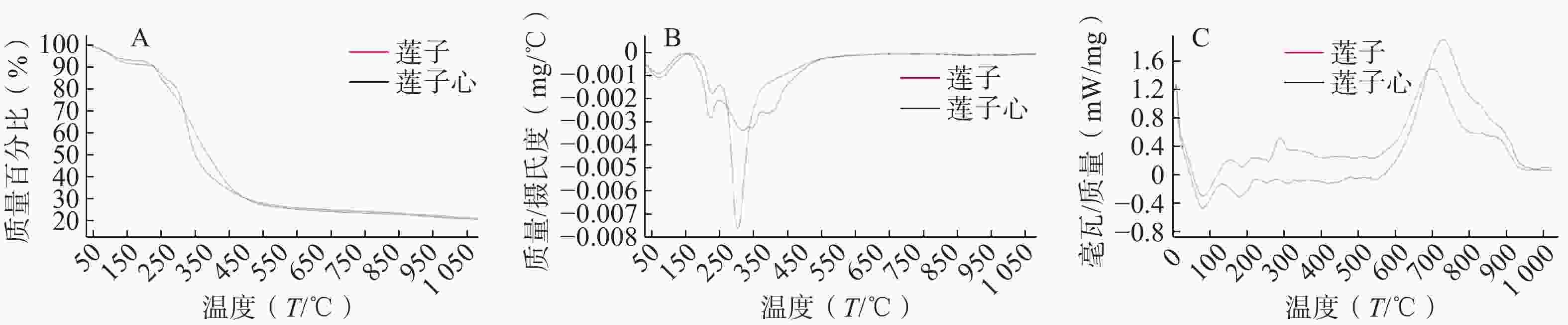
通过DTG曲线可将莲子热重图谱失重分为3个阶段(△W1=7.61%,△W2=7.65%,△W3=55.73%),第一阶段室温至171℃,第二阶段169~256℃,主要失去游离水和结晶水以及低沸点小分子化合物,第三阶段为255~512 ℃,是主要成分发生氧化反应及分解反应的重要阶段。
而莲子心热重曲线可分为5个阶段(△W1=6.04%,△W2=10.88%,△W3=23.77%,△W4=8.50%,△W5=24.41%)。第一阶段调节室温至160 ℃,第二阶段158~245 ℃,莲子心粉末脱水,挥发油等低沸点挥发成分释放,第三、四阶段243~360 ℃,失去易分解生物碱类及黄酮类化合物,第五阶段360~620 ℃,难挥发成分及固定碳进行燃烧[20]。
失重台阶数量和失重速率的不同侧面反映了物质成分组成的差别。莲子主要成分的失去集中在255~512 ℃,为1个失重台阶,失去质量的55.73%。莲子心主要成分的失去集中在243~620 ℃,呈现3个失重台阶,失去质量的56.67%。莲子心的热解过程比莲子复杂得多,可能与莲子心含有独特成分或含量更丰富的化合物有关。
DSC图谱在TG曲线失重阶段具有相应的吸收峰,57~172 ℃莲子和莲子心DSC曲线均有一个较强的吸热宽峰,此温度范围内二者成分差异较小。莲子在175~278 ℃范围内,先吸热后放热,莲子心在154~244 ℃处为吸热峰,其成分有一定重叠,此处莲子化合物热稳定性弱于莲子心。莲子和莲子心的主要有机成分在246~560 ℃范围内开始分解反应,246~385 ℃莲子心吸热峰与两个连续极弱吸热部分对应TG图谱中单独失重台阶△W3和△W4,387~563 ℃表现为先吸热后放热,对应TG曲线中的△W5,DSC中每个峰皆与热重曲线对应,莲子此部分在TG表现为一个失重台阶△W3。 莲子和莲子心中的生物碱类成分多为阿朴菲类,其熔点多集中于102~245 ℃,在相应升温阶段,莲子和莲子心热分析曲线的峰型、位置、大小皆有差异,推测与二者成分的差异有密切关系(图1)。
-
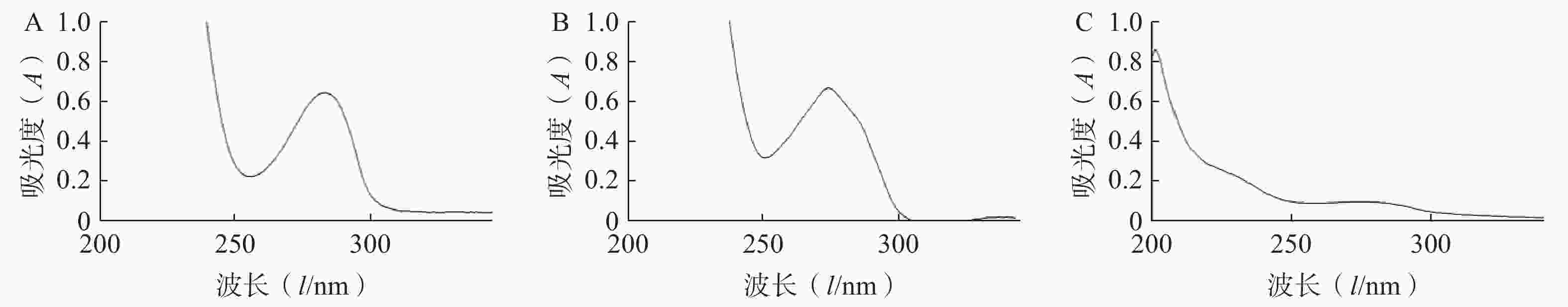
通过总生物碱在282 nm的特征吸收峰,得线性回归方程:Y=0.013 3X−0.001 4(r=0.999),供试品溶液吸光度代入计算,莲子心总生物碱中生物碱含量为60.56%,莲子心总提物中生物碱含量占10.16%,莲子总生物碱曲线未见明显吸收峰(图2),说明莲子中生物碱含量极低。推测生物碱类成分含量的差异可能是引起两者生物活性不同的主要原因。
-
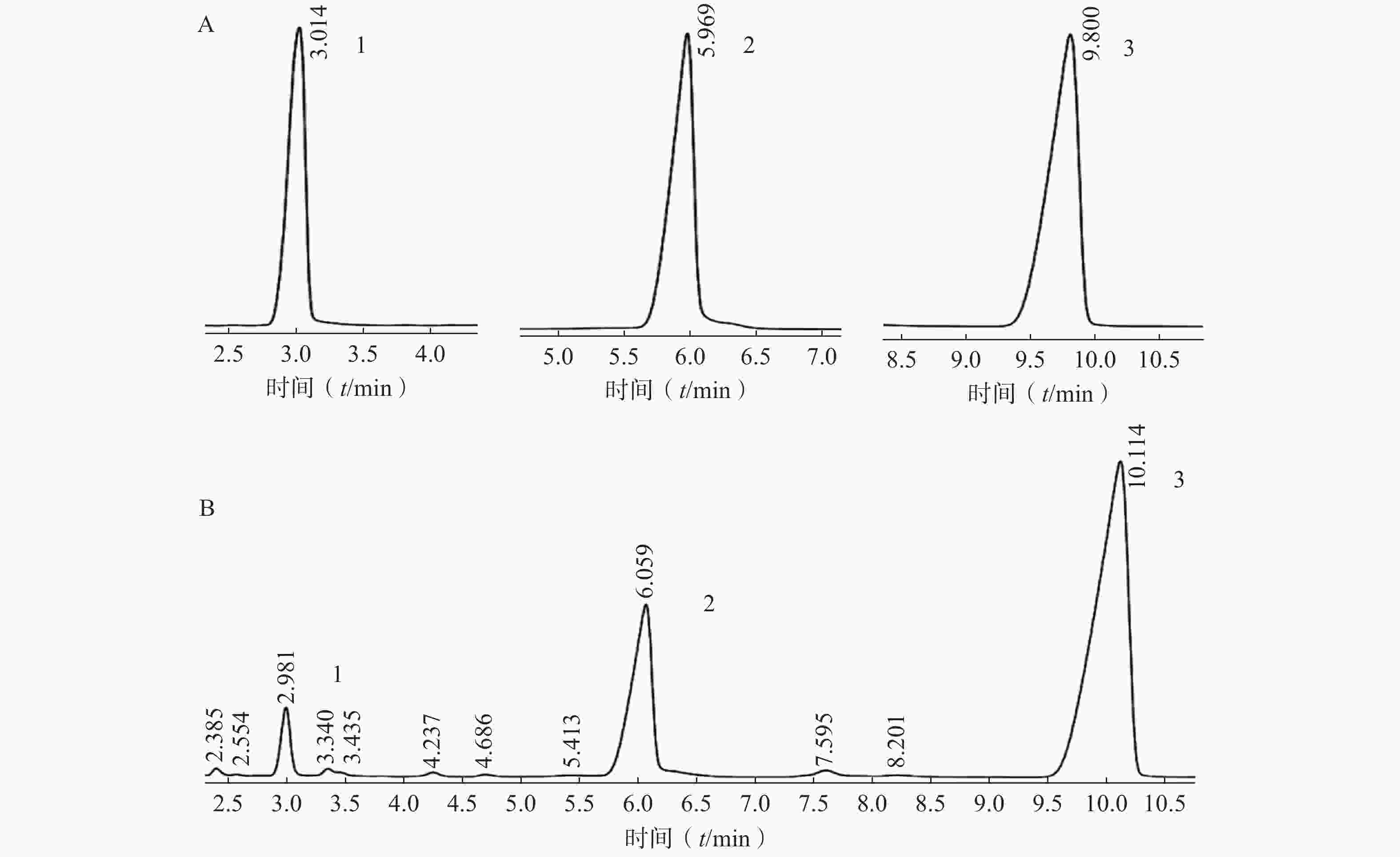
对照品及莲子心总生物碱HPLC图谱见图3,莲子和莲子心其他提取物中异莲心碱、甲基莲心碱及莲心碱的含量测定结果见表1。
表 1 各提取物中3种生物碱类成分含量测定(n=3)
序号 对照品 莲子总生物碱 莲子总提物 莲子心总生物碱 莲子心总提物 含量(%) RSD(%) 含量(%) RSD(%) 含量(%) RSD(%) 含量(%) RSD(%) 1 异莲心碱 — — — — 16.15 0.37 0.39 0.02 2 甲基莲心碱 0.02 0.01 — — 33.30 0.60 0.94 0.02 3 莲心碱 — — — — 3.32 0.07 — — 4 总含量 0.02 — — — 52.77 — 1.33 — 注:“—”表示未测得。 -
由表2的数据可以看出,甲基莲心碱和莲子心总生物碱可显著抑制人肝癌细胞HepG2的增殖,而莲子总生物碱对人肝癌细胞HepG2的增殖无抑制作用。表3中莲子心总提物对人肝癌细胞HepG2的增殖抑制效果优于莲子总提物,说明生物碱类成分含量的差异可能是导致两者药效差异的关键。浓度为200 μg/ml的莲子总提物展现出对肝癌细胞的抑制作用,并具有明显的浓度依赖性,推测莲子中含有除生物碱外的抗癌成分。
表 2 甲基莲心碱、莲子总生物碱、莲子心总生物碱对HepG2的增殖抑制率(n=3)
浓度
(μg/ml)甲基莲心碱 莲子总生物碱 莲子心总生物碱 A450 抑制率(%) A450 抑制率(%) A450 抑制率(%) 0 0.65±0.04 0.00±5.89 0.92±0.09 0.00±10.15 1.26±0.23 0.00±17.98 1 0.54±0.05** 18.16±7.83** 1.03±0.05 −10.97±5.51 0.97±0.08 23.07±6.07 2 0.51±0.02*** 21.51±2.73*** 0.95±0.03 −2.41±3.10 0.81±0.11* 35.78±8.84* 5 0.45±0.04*** 31.89±6.22*** 0.88±0.11 4.77±12.36 0.75±0.17* 40.59±13.33* 10 0.36±0.03*** 45.59±5.20*** 1.00±0.07 −8.00±7.72 0.59±0.08** 53.39±6.09** 20 0.13±0.02*** 80.63±3.74*** 0.97±0.12 −4.85±13.09 0.38±0.01** 69.70±1.19** 50 0.06±0.01*** 91.32±0.79*** 0.99±0.14 −7.48±15.28 0.09±0.19** 92.57±15.40** 100 0.07±0.01*** 89.62±0.78*** 0.94±0.15 −1.50±16.02 0.08±0.08** 93.98±6.34** 200 0.08±0.02*** 88.25±2.76*** 0.94±0.03 −1.21±3.66 0.08±0.01*** 93.35±0.70*** *P<0.05,**P<0.01,***P<0.001,与0 μg/ml组比较。 表 3 莲子总提物、莲子心总提物对HepG2的增殖抑制率(n=3)
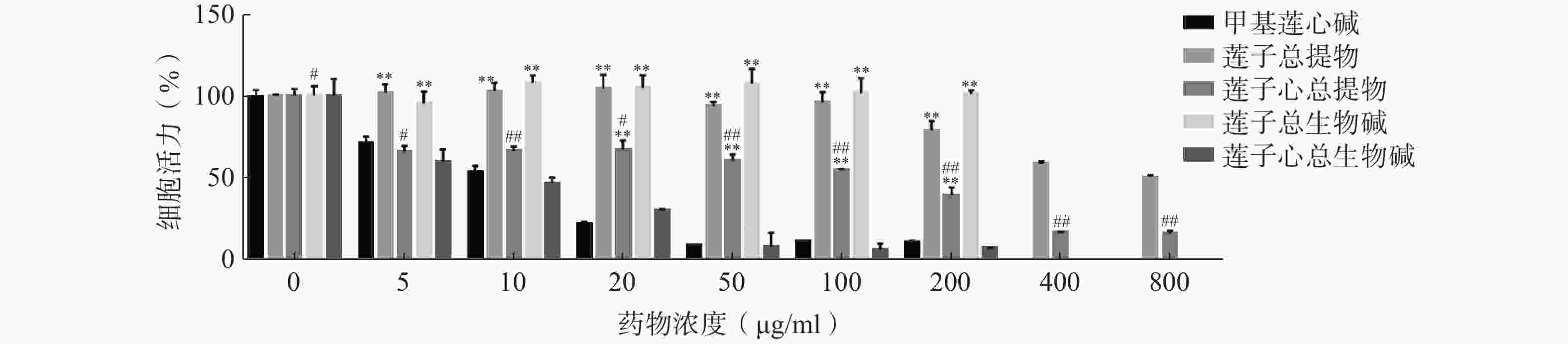
浓度(μg/ml) 莲子总提物 莲子心总提物 A50 抑制率(%) A 450 抑制率(%) 0 0.61±0.01 0.00±0.97 0.68±0.05 0.00±7.11 5 0.62±0.06 −1.85±9.06 0.45±0.04** 34.35±5.86** 10 0.63±0.05 −2.76±8.68 0.45±0.03** 34.01±4.51** 20 0.64±0.09 −4.53±14.26 0.45±0.07** 33.17±9.70** 50 0.57±0.03 6.45±4.45 0.41±0.04** 39.98±6.48** 100 0.59±0.07 4.15±11.07 0.37±0.01*** 45.37±1.08*** 200 0.48±0.06* 21.36±9.78* 0.27±0.06*** 60.81±8.60*** 400 0.36±0.01*** 41.76±2.25*** 0.11±0.01*** 83.57±0.78*** 800 0.31±0.01*** 49.49±1.74*** 0.11±0.02*** 84.11±2.91*** *P <0.05,**P<0.01,***P<0.001,与0 μg/ml组比较。 由图4可见,相同质量浓度(50 μg/ml)的各提取物对人肝癌细胞HepG2增殖抑制作用为:甲基莲心碱对照品组=莲子心总生物碱>莲子心总提物>莲子总提物>莲子总生物碱。对HepG2细胞增殖的抑制作用与总生物碱含量呈现明显的浓度依赖性。上述结果验证了莲子心抑制人肝癌细胞HepG2增殖率的关键因素是生物碱含量与组成,即生物碱为莲子心和莲子药效差异的物质基础。
-
莲子、莲子心化学组成复杂,通过同步热分析仪可比对二者成分的差异,建立一种快速检测两者之间物质基础差异的方法。莲子和莲子心加热过程中涉及多种物理及化学变化,热分析图谱中二者差异主要集中在240~620 ℃范围内,与莲子中部分生物碱物理相变温度相似[21],由此可推测影响二者曲线主要差异的关键成分之一可能为生物碱类化合物。
UV法和HPLC法测得提取物中总生物碱含量排序一致:莲子心总生物碱>莲子心总提物>莲子总生物碱。由于UV法能够检测所有化合物在282 nm处的吸收,而HPLC法对样品进行了成分分离,仅检测莲心碱、异莲心碱、甲基莲心碱的特征吸收,因此,两者测定各提取物生物碱含量差异显著[22]。UV法在莲子总生物碱中未检测到生物碱,HPLC法测得其甲基莲心碱含量0.02%,故而HPLC法测定莲子生物碱含量较UV法更精准。
已有研究证实甲基莲子心碱对人肝癌HepG2细胞有显著抑制作用,且存在浓度依赖性[23]。细胞实验中,莲子心总生物碱和莲子心总提物对HepG2细胞的体外抑制效果显著且存在浓度依赖性,莲子总生物碱对HepG2细胞无抑制效果,证明生物碱含量的高低影响二者的抗癌活性。
莲子总提物组在浓度较高时对人肝癌细胞HepG2的增殖产生明显抑制,且抑制作用随浓度的提高而增强,除了生物碱类成分外,莲子与莲子心中均含有黄酮类成分[24],推测黄酮类成分在一定浓度下也会抑制人肝癌细胞HepG2增殖。
本实验对比分析莲子和莲子心总生物碱类成分、含量的差异,以及两者对人肝癌细胞HepG2增殖的影响。其相关性分析初步揭示生物碱类成分是导致两者抗癌活性不同的关键物质基础,为阐释莲子和莲子心的性味功效提供科学依据,也为其进一步的临床应用提供参考。
Comparative analysis of alkaloid components and anticancer activity between Nelumbinis Semen and Nelumbinis Plumula
-
摘要:
目的 比较莲子和莲子心生物碱类成分差异及对人肝癌细胞HepG2的抑制效果,探究莲子和莲子心抗癌活性差异的物质基础。 方法 同步热分析法初步比较莲子和莲子心成分差异,回流提取法提取莲子、莲子心生物碱,UV法和HPLC法测定生物碱含量,CCK-8法检测其对HepG2细胞的体外增殖抑制作用,验证两者药效差异。 结果 同步热分析法结果显示,在相应升温阶段莲子和莲子心热分析曲线的峰型、位置、大小皆有差异。莲子与莲子心生物碱的含量:莲子心总生物碱>莲子心总提物>莲子总生物碱,莲子心总生物碱可有效抑制HepG2细胞增殖,莲子总生物碱则对其无影响。 结论 生物碱类成分组成和含量的差异可能是导致莲子和莲子心生物活性差异的关键,本研究为探索莲子和莲子心性味功效差异的物质基础及临床合理应用提供依据。 Abstract:Objective To compare the differences in alkaloids between Nelumbinis Semen and Nelumbinis Plumula and their inhibitory effects on the proliferation of HepG2 cells, and investigate the material basis for their anti-cancer activity differences. Methods Simultaneous Thermal Analysis was used to preliminarily compare the component differences between Nelumbinis Semen and Nelumbinis Plumula. Alkaloids were extracted from them by both using reflux extraction, and their contents were measured by UV and HPLC methods. The CCK-8 method was used to assess the in vitro inhibitory effects of the alkaloids on the HepG2 cells, and to verify pharmacological differences. Results Simultaneous thermal analysis revealed distinct peak shapes, positions, and sizes in the thermal analysis curves of Nelumbinis Semen and Nelumbinis Plumula at respective temperature stages. The contents of total alkaloids showed as follows: the total alkaloids in Nelumbinis Plumula > total extract of Nelumbinis Plumula > the total alkaloids in Nelumbinis Semen. The total alkaloids in Nelumbinis Plumula effectively inhibited HepG2 cell proliferation, while the total alkaloids in Nelumbinis Semen showed no impact. Conclusion Differences in the composition and content of alkaloids may be key factors underlying the biological activities differences between Nelumbinis Semen and Nelumbinis Plumula. This study provided a basis for exploring the material foundation of the differential efficacy and properties of Nelumbinis Semen and Nelumbinis Plumula, which could support their rational clinical application. -
Key words:
- Nelumbinis Semen /
- Nelumbinis Plumula /
- bioactivity /
- anti-cancer activity /
- alkaloids
-
表 1 各提取物中3种生物碱类成分含量测定(n=3)
序号 对照品 莲子总生物碱 莲子总提物 莲子心总生物碱 莲子心总提物 含量(%) RSD(%) 含量(%) RSD(%) 含量(%) RSD(%) 含量(%) RSD(%) 1 异莲心碱 — — — — 16.15 0.37 0.39 0.02 2 甲基莲心碱 0.02 0.01 — — 33.30 0.60 0.94 0.02 3 莲心碱 — — — — 3.32 0.07 — — 4 总含量 0.02 — — — 52.77 — 1.33 — 注:“—”表示未测得。 表 2 甲基莲心碱、莲子总生物碱、莲子心总生物碱对HepG2的增殖抑制率(n=3)
浓度
(μg/ml)甲基莲心碱 莲子总生物碱 莲子心总生物碱 A450 抑制率(%) A450 抑制率(%) A450 抑制率(%) 0 0.65±0.04 0.00±5.89 0.92±0.09 0.00±10.15 1.26±0.23 0.00±17.98 1 0.54±0.05** 18.16±7.83** 1.03±0.05 −10.97±5.51 0.97±0.08 23.07±6.07 2 0.51±0.02*** 21.51±2.73*** 0.95±0.03 −2.41±3.10 0.81±0.11* 35.78±8.84* 5 0.45±0.04*** 31.89±6.22*** 0.88±0.11 4.77±12.36 0.75±0.17* 40.59±13.33* 10 0.36±0.03*** 45.59±5.20*** 1.00±0.07 −8.00±7.72 0.59±0.08** 53.39±6.09** 20 0.13±0.02*** 80.63±3.74*** 0.97±0.12 −4.85±13.09 0.38±0.01** 69.70±1.19** 50 0.06±0.01*** 91.32±0.79*** 0.99±0.14 −7.48±15.28 0.09±0.19** 92.57±15.40** 100 0.07±0.01*** 89.62±0.78*** 0.94±0.15 −1.50±16.02 0.08±0.08** 93.98±6.34** 200 0.08±0.02*** 88.25±2.76*** 0.94±0.03 −1.21±3.66 0.08±0.01*** 93.35±0.70*** *P<0.05,**P<0.01,***P<0.001,与0 μg/ml组比较。 表 3 莲子总提物、莲子心总提物对HepG2的增殖抑制率(n=3)
浓度(μg/ml) 莲子总提物 莲子心总提物 A50 抑制率(%) A 450 抑制率(%) 0 0.61±0.01 0.00±0.97 0.68±0.05 0.00±7.11 5 0.62±0.06 −1.85±9.06 0.45±0.04** 34.35±5.86** 10 0.63±0.05 −2.76±8.68 0.45±0.03** 34.01±4.51** 20 0.64±0.09 −4.53±14.26 0.45±0.07** 33.17±9.70** 50 0.57±0.03 6.45±4.45 0.41±0.04** 39.98±6.48** 100 0.59±0.07 4.15±11.07 0.37±0.01*** 45.37±1.08*** 200 0.48±0.06* 21.36±9.78* 0.27±0.06*** 60.81±8.60*** 400 0.36±0.01*** 41.76±2.25*** 0.11±0.01*** 83.57±0.78*** 800 0.31±0.01*** 49.49±1.74*** 0.11±0.02*** 84.11±2.91*** *P <0.05,**P<0.01,***P<0.001,与0 μg/ml组比较。 -
[1] 刘静, 陈莎, 刘安. 荷叶和莲子心“同源异效” 的物质基础分析[J]. 中国实验方剂学杂志, 2020, 26(22): 131-139. [2] KIM N Y, YANG I J, KIM S, et al. Lotus (Nelumbo nucifera)seedpod extract inhibits cell proliferation and induces apoptosis in non-small cell lung cancer cells via downregulation of Axl[J]. J Food Biochem, 2021, 45(2): e13601. [3] POORNIMA P, WENG C F, PADMA V V. Neferine, an alkaloid from Lotus seed embryo, inhibits human lung cancer cell growth by MAPK activation and cell cycle arrest[J]. Biofactors, 2014, 40(1): 121-131. [4] 孙婵. 莲子心化学成分及甲基莲心碱纯化工艺研究[D]. 沈阳: 辽宁大学, 2016. [5] 吕晶, 韩栋年, 金磊, 等. 莲子心化学成分研究[J]. 世界最新医学信息文摘, 2018, 18(73): 100-101. [6] 赵秀玲, 党亚丽. 莲子心化学成分及其提取、药理作用的研究进展[J]. 食品科学, 2018, 39(23): 329-336. doi: 10.7506/spkx1002-6630-201823047 [7] 岳改月, 孙昭倩, 王百龙, 等. 海洋药材石首鱼的TG-DSC热分析研究[J]. 中国海洋药物, 2021, 40(1): 37-40. [8] 林文津, 徐榕青, 张亚敏, 等. 正交试验法优选莲子心提取物制备工艺[J]. 世界中西医结合杂志, 2009, 4(6): 401-403. doi: 10.3969/j.issn.1673-6613.2009.06.009 [9] 杨小青, 宋金春, 谢顺岚, 等. 不同提取方法莲子心总生物碱抗氧化活性比较[J]. 中国医药导报, 2015, 12(18): 100-104. [10] 王征, 张宁, 王翠玲, 等. 热者寒之细胞中药学初探[J]. 吉林中医药, 2015, 35(12): 1255-1259. [11] 赵文杰, 范铭沁, 姚方圆, 等. 南葶苈子与白芥子寒热药性的细胞学方法评价[J]. 中华中医药杂志, 2021, 36(5): 2949-2952. [12] 隋峰, 戴丽, 李倩, 等. TRPV1通道介导的热生成是辛热(温)中药药性表征的重要模式[J]. 药学学报, 2015, 50(7): 836-841. [13] 程薇薇, 刘建利, 张宁, 等. 评价中药寒热药性的实验方法研究[J]. 中草药, 2010, 41(7): 1122-1126. [14] 冯霞, 易若琨, 孙鹏, 等. 巴莲莲子生物碱提取物对人肝癌细胞HepG2的体外抗癌效果[J]. 食品科学, 2017, 38(19): 206-211. [15] 王晓颖, 连赟芳, 褚克丹, 等. HPLC测定建莲莲子心生物碱的含量[J]. 中国实验方剂学杂志, 2012, 18(22): 117-120. [16] 林伟明, 王子晨, 吴文敬, 等. 细胞学方法评价南美草药阿萨伊的寒热药性[J]. 世界中医药, 2018, 13(11): 2889-2895. [17] 王征, 刘建利, 王翠玲, 等. 用两种细胞评价中药白薇寒热药性[J]. 中华中医药杂志, 2016, 31(4): 1383-1385. [18] 张宁, 成程, 李红民, 等. 基于细胞学方法评价5种中药复方的寒热药性[J]. 中华中医药杂志, 2016, 31(3): 1081-1084. [19] 王亚男, 窦德强. 细胞学方法评价6种中药的寒热药性[J]. 辽宁中医杂志, 2017, 44(3): 558-560. [20] 马俊楠. 基于热分析技术的荷叶、蒲黄、藕节炒炭共性规律研究[D]. 太原: 山西中医学院, 2015. [21] 马俊楠, 孟祥龙, 薛非非, 等. 热分析技术和HPLC法研究荷叶炒炭工艺[J]. 中成药, 2016, 38(3): 613-620. [22] 陈肖家, 张庆文, 季晖, 等. 紫外分光光度法和高效液相色谱法测定淫羊藿总黄酮含量的比较研究[J]. 药物分析杂志, 2007, 27(5): 625-630. [23] 杨超, 田文月, 陈国威, 等. 莲子心生物碱提取分离、活性评价及制剂的研究进展[J]. 中华中医药学刊, 2021, 39(9): 142-144. [24] 辛佳, 孙恒, 刘娟, 等. 莲黄酮类化合物鉴定、功能与应用的研究进展[J]. 植物科学学报, 2023, 41(3): 400-410. -




 下载:
下载: