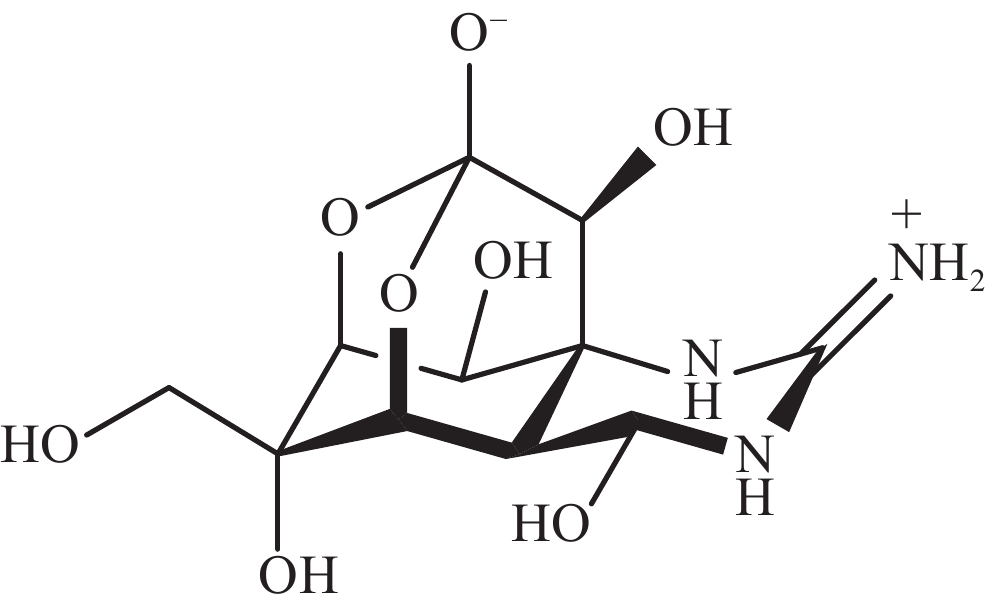
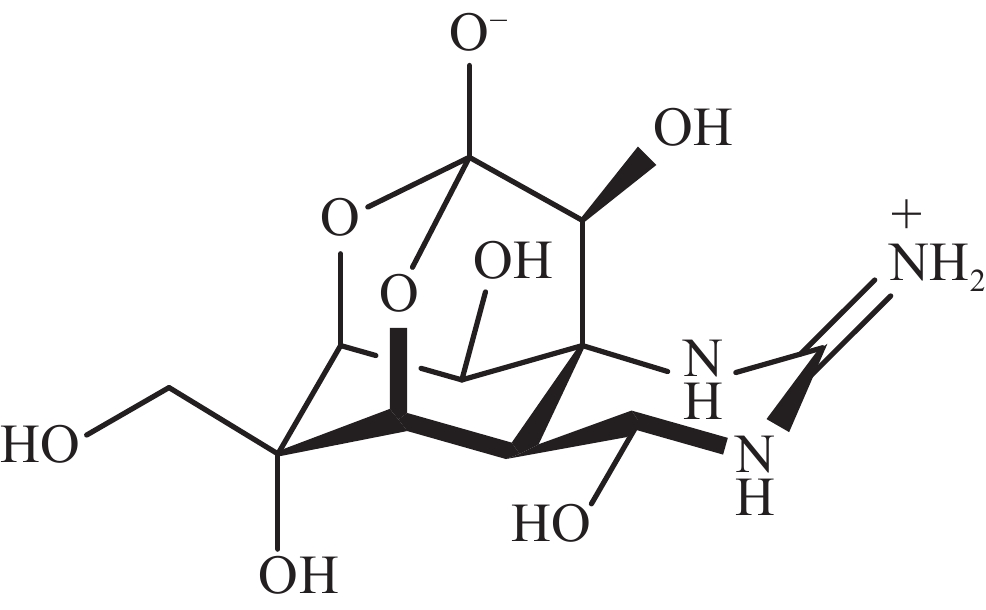
-
河豚毒素(TTX)是一种在自然环境中产生的致命神经毒素。其化学结构包含一个单独的胍基团,连接到一个高度氧化的碳主链上,TTX的碳主链由2,4-二噁金刚烷结构组成,并有5个羟基修饰,TTX是氨基全氢喹唑啉型化合物(图1)。TTX通过抑制神经和肌肉细胞的动作电位发挥作用,已成为研究可兴奋细胞的有用工具。一项使用乌贼巨大轴突的研究表明,TTX只阻断了钠通道而对静息膜电位没有影响[1],钠通道的结构被认为是一个钟形分子,含有多个腔,相对分子质量约为3×105[2]。自此以后,TTX成为神经生理学研究中的一种热门化学物质[3]。此外,TTX有望成为治疗偏头痛、海洛因成瘾者戒断和麻醉药物,TTX在疼痛医学领域得到了较高的重视[4-5]。本文通过综述TTX的来源以及TTX的生物合成研究进展,重点关注TTX可能的微生物来源,为TTX的生产与生物合成研究提供科学参考。
-
外源性学说认为TTX是通过环境中的生物摄取而产生的、并在生物体内形成,这个过程通常耗时较长,导致摄入生物的突变和进化,使它们对TTX产生抵抗力。Matsui等用人工饲养的幼鱼进行饲养实验以验证TTX外源的可能性,研究人员将河豚鱼随机分配到试验组和对照组,确保两组之间在外观或其他特征上没有显著差异,试验组和对照组的河豚鱼都主动摄取了绝大部分饲料,并没有出现产毒迹象[6-7],然后将毒性卵巢投喂给试验组的河豚鱼,在第5天试验组河豚鱼的所有组织已具有毒性,尽管不同组织的毒性程度不同,但是研究人员认为产生TTX的生物体是可以从外界获得TTX[8]。根据另外一个研究,TTX的外源来源被证明是一种贝类(Charonia sauliae),它在摄入有毒的海藻后在体内累积了TTX[9]。
TTX通过食物链在河豚体内积累的机制于2006年提出,研究者给河豚投喂不含TTX的饲料时,海底网箱养殖的26个河豚的肌肉、皮肤、性腺和其他脏器以及陆地养殖的14个河豚标本的卵巢完全没有毒性。如果阻止产生TTX的微生物入侵,在海底网箱或陆地养殖一年的5 000多个河豚标本也变得无毒,但当无毒的河豚被喂食含有TTX的饲料时,河豚变得有毒[10]。
-
内源性学说认为TTX可能是一种偶然产生的代谢产物,存在于产生TTX的生物体内时可能具有某些生理功能,而非仅仅是一种毒素。1963年,研究者从蝾螈Taricha颗粒中分离出一种新的神经毒素,此神经毒素最初被归类为芋螺毒素[11]。1964年,研究者对芋螺毒素和TTX的结构进行对比,认为这两种毒素的结构是相同的[12]。自此以后,人们用TTX来命名这种毒素。后来,Hanifin等的研究发现,当蝾螈被长时间圈养后,它们体内的TTX水平会增加[13]。当对蝾螈的背部进行电刺激时,身体上特有的Taricha颗粒会释放出TTX,并且经过9个月的人工饲养,Taricha颗粒似乎能够自主产生TTX。蝾螈体内TTX的来源可能是背侧皮肤和卵巢组织,因为除了这两个组织外,其他组织中只有低水平的TTX。此外,有研究发现蝾螈的TTX自主产生与性别无关,并且刺激背侧皮肤后,TTX的增加不是由于卵巢组织中TTX的补充,这表明蝾螈背部的Taricha颗粒可自主产生TTX。
-
共生微生物学说认为TTX可能是由产生它的动物和体内的微生物之间共生合成的。既往学者对河豚体内产生TTX的微生物进行了广泛的研究,普遍认为微生物是产生TTX的生物体内的真正来源[9]。有研究表明,当把产生TTX的微生物从河豚体内分离出来后,这些河豚在人工饲养时就失去了产生TTX的能力,这支持了TTX通过共生微生物产生的假说[10]。对产生TTX的微生物诸多研究发现,来自不同地区的微生物所产生的TTX浓度不同,采用不同的分析检测方法所检测到的TTX浓度也有所不同,详见表1。
表 1 不同来源微生物中的河豚毒素含量和检测方法
产生TTX的微生物 国家/地区 TTX检测方法 TTX浓度(µg/ml) Vibrio alginolyticus 日本 HPLC-MS;UV-Vis;GC-MS 0.08[14] Vibrio alginolyticus 日本 HPLC-FLD:GC–MS 0.001 2[15] Bacillus sp. 菲律宾 HPLC–FLD;GC–MS 0.001 5[16] Pseudomonas sp 菲律宾 HPLC–FLD;GC–MS 0.002 5[17] Shewanella putrefaciens 日本 HPLC–FLD;GC–MS 0.012[18] Vibrio alginolyticus 日本 HPLC–FLD 0.28~0.79[19] Microbacterium 中国香港 TLC;LC–ESI–MS 0.042[20] Arabinogalactanolyticum 中国香港 TLC;LC–ESI–MS 0.04[21] Serratia marcescens 中国香港 TLC;LC–ESI–MS 0.03[22] Vibrio alginolyticus 中国 TLC 0.32[22] Bacillus sp 中国 HPLC–FLD;LC–ESI–MS 0.32[23] Actinomyces sp 中国 HPLC–FLD 0.1[24] Nocardiopsis dassonvillei 夏威夷 TLC;LC–ESI–MS;UV–Vis 0.1[24] Vibrio harveyi 中国 HPLC–MS 0.5~15.7[24] Lysinibacillus fusiformis 中国 LC–ESI–MS 0.024[24] Aeromonas sp 中国香港 ELISA;HPLC–MS 0.002[17] Raoultella terrigena 泰国 ELISA;LC–MALDI–TOF 0.008[17] Shewanella putrefaciens 越南 MS;HPLC–MS–MS 0.195~0.366[25] Providencia rettgeri 越南 HPLC–FLD;TLC 0.015~0.021[25] Enterococcus faecium 中国 HPLC–FLD;TLC 0.015~0.030[26] Enterobacter cloaca 中国 HPLC–FLD;TLC 0.96[26] Rahnella aquatilis 英国 ELISA;HPLC–MS–MS 0.6[27] Vibrio cholerae 英国 ELISA;HPLC–MS–MS (4.2~71.8)×10−5[28] 注:HPLC-MS:高效液相色谱-质谱联用;HPLC-FLD:高效液相色谱-荧光法;UV-Vis:紫外可见分光光度法;GC-MS:气相色谱-质谱联用;TLC:薄层色谱法;ELISA:酶联免疫吸附试验;LC–ESI–MS:液相色谱-电喷雾质谱;HPLC–MS–MS:二级质谱;MS:质谱。 -
TTX是一种选择性阻断电压门控钠通道的化合物,由于其特异性作用,TTX成为神经科学研究中的重要化学工具。除神经科学研究领域外,TTX在麻醉和镇痛领域也获得了广泛关注。由此可见,诸多领域对TTX的需求不断增加。目前,获取TTX的主要方法是从河豚的肝脏和卵巢中提取,但这种方法对河豚种群有不利影响且效率较低,因此,亟需探索其他途径来获取TTX。
理论上可以通过化学合成的方式获取TTX,但该方法所用原料昂贵,化学反应步骤多、耗时长、产量低且过程复杂[29]。因此,需要寻找一种可靠、成本效益高且可持续的TTX获取方法。目前,现代分子遗传学方法已取得重大突破,其能够有效解释类似TTX的天然产物的组装过程。通过在遗传水平层面全面了解这些产物的生物合成方式,有望对微生物开展精确的基因工程,从而大规模生产TTX,这将极大地推动TTX的应用和开发。在此背景下,利用TTX的生物合成基因来产生稳定且可持续的TTX成为了相对可靠的方法。
-
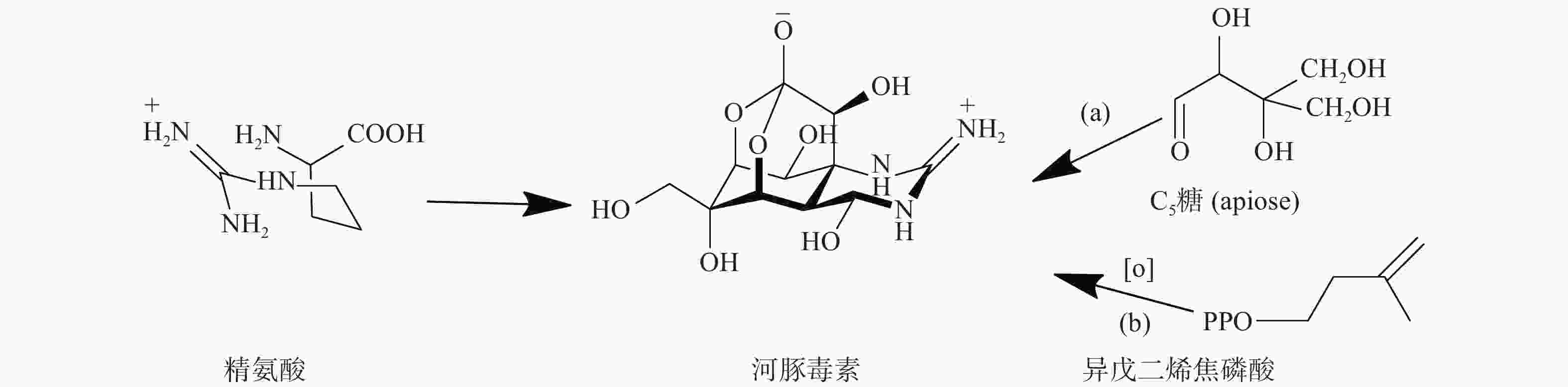
TTX的骨架结构来源可以分为两部分:胍基部分来源于精氨酸前体,而糖环部分来源于C5糖(apiose)或者异戊二烯焦磷酸(图2)。Shimizu等的研究采用了两种基于TTX碳主链的生物合成方法来研究蝾螈的摄食机制,研究结果表明,当毒性蝾螈被喂食含有放射性的(2-14C)-醋酸盐、(胍-14C)-精氨酸、(尿素-14C)-瓜氨酸或(U-14C)-葡萄糖的饲料时,在初级代谢物(如胆固醇和某些酰胺)中检测到放射性,但蝾螈产生的TTX却没有放射性[30]。后续实验通过注射或完全浸泡蝾螈,对(2-14C)-醋酸盐、(胍-14C)-精氨酸、(尿素-14C)-瓜氨酸或(U-14C)-葡萄糖的检测也得到了阴性结果。尽管喂养实验无法证实标记底物通过预测的生物合成途径进入TTX,但也不能完全排除TTX由这些生物合成前体组装而成的可能性。如果蝾螈体内的TTX来自微生物,蝾螈可能无法通过喂食途径来准确地将标记的底物输送到微生物生物合成TTX的位点。此外,在标记的底物到达微生物的生物合成位点之前,可能被蝾螈代谢利用,因此,在胆固醇和氨基酸等初级代谢物中可以检测到标记物。
蝾螈合成TTX的前体可能并非从头开始,而是通过食物摄入获取,就像河豚一样,这也可以解释研究结果呈阴性的原因。当喂食不含TTX的饲料时,蝾螈的毒性会随着时间的推移而增加,而河豚的毒性会随着时间的推移而降低[10]。该结果表明蝾螈体内TTX的生物起源可能与其他生物不同,是内源性而非外源性饮食来源。
-
目前对于TTX的生物合成路径知之甚少,Shimizu仅提出了2种可能的途径(图2),并且没有强有力的数据来支持这些假设。由于TTX的结构较为独特,目前缺乏类似的生物合成研究,这阻碍了可揭示其生物合成途径的分子工具的发展。TTX的生物合成及其组装的遗传学基础是基于:编码生物合成酶的基因聚集在产生生物体的基因组上。因此,对于被提议的编码基因或区域的确认可以帮助确定完整的基因簇。
基于TTX的独特结构,它包含一个单独的胍基团,连接到一个高度氧化的碳主链上,它的碳主链由2,4-二噁金刚烷结构组成,并有5个羟基修饰,存在多种可能的途径,并且也有许多潜在的酶参与生物合成。
-
胍基部分在TTX的毒性方面具有重要作用,当与电压门控钠通道结合时,胍基部分与钠通道上的羟基之间形成盐桥[31],促进TTX与钠通道受体的正确结合[32]。胍基部分是研究TTX生物合成的良好起点,TTX中胍基结合有两种途径:一是通过氨基转移酶从氨基供体转移,二是通过非核糖体肽合成酶(NRPS)结合精氨酸[33]。
(1)氨基转移酶参与河豚毒素生物合成
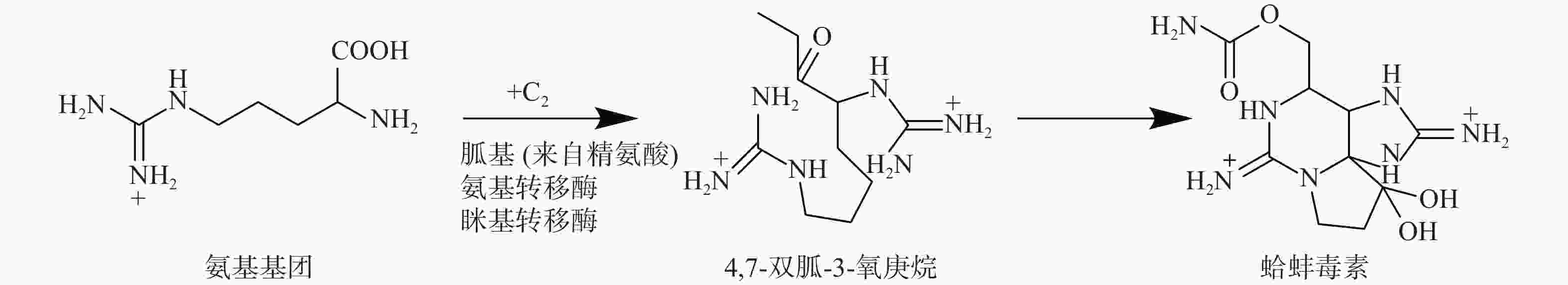
氨基转移酶是负责将胍基从供体转移到受体的酶,TTX中胍基部分的起源被认为是通过氨基转移酶从氨基供体(如精氨酸)到TTX生物合成的前体底物,这些酶也参与河豚毒素类似物的生物合成。例如,蛤蚌毒素(saxitoxin)的生物合成研究中,首先,氨基转移酶将氨基从精氨酸转移到蛤蚌毒素的前体4,7-双胍-3-氧庚烷,然后将前体4,7-双胍-3-氧庚烷引入到后续的生物合成中(图3)[34]。在该生物合成途径中,编码氨基转移酶的基因与包括NRPS和聚酮合成酶(PKS)的其他生物合成酶聚集在一起。蛤蚌毒素与TTX有许多相似之处,均是分子量相对较小的毒素[蛤蚌毒素(C10H17N7O4)分子量是299 g/mol,TTX(C11H17N3O8)分子量是319 g/mol]、化学结构有胍基、两者都是钠通道阻滞剂、与钠通道的电压门控结合在同一位点。更重要的是,两者都已经被证明可以由微生物进行生物合成。因此,蛤蚌毒素和TTX的生物合成可能涉及类似的机制。在TTX生物合成中,氨基转移酶可以促进氨基与丙氨酸结合形成胍基丙酸酯,该底物可以被用作后续生物合成的前体,由后续PKS基因编码蛋白继续完成TTX的合成(图4)[35]。
(2)非核糖体肽合成酶(NRPS)参与河豚毒素生物合成
TTX的胍基部分最初被认为是由精氨酸与一个支链的阿松糖或异戊二烯单元形成的(图5)。精氨酸以这种方式结合可能需要使用多肽的生物合成机制[36]。然而,这种多肽途径在TTX的生物合成中很难被发现,很有可能出现在NRPS-PKS组装中(NRPS和I型PKS是多功能酶复合物)。
NPRS模块主要包括3个结构域:①依赖ATP的腺苷化酶结构域,用于激活特定的氨基酸;②肽键载体用于固定底物;③结构域C,用于催化肽键载体与底物之间的肽键形成。与核糖体肽键合成酶不同的是,NPRS可以加工处理非蛋白质前体(修饰氨基酸或非蛋白质氨基酸)。PKS模块也包括3个结构域:①对乙酰CoA硫酯化底物具有高亲和力的酰基转移酶;②酰基载体蛋白;③催化2个酰基载体蛋白底物结合的酮缩合酶。这些模块通常包含许多额外的催化域,这些催化域的作用是调整组装分子,从而产生进一步的结构多样性。最后,组装的分子从酶复合物中释放出来,通常是通过硫酯酶,该结构域也可以直接作用于最终产物的环化。
-
TTX含有一种独特的、高度含氧的2,4-二噁金刚烷碳链,研究者对TTX碳链的来源提出假说,包括聚酮来源[37]、C5支糖来源[36] 和C5异戊二烯来源[38]。在TTX中引入C5单元需要通过精氨酸引导,而非依赖酰胺基转移酶促进胍基转移,这可以解释TTX结构中所有碳原子的来源。
(1)聚酮链衍生碳骨架
Woodward等提出胍基可能是从氨基转移到一个三碳单元受体上得到的,然后由丙二酰辅酶A衍生的乙酸延伸,以合成主链中的所有碳骨架[39]。
(2)糖环衍生碳骨架
Shimizu等人提出TTX的高度氧化的结构可能是通过精氨酸与含氧的、支链C5糖(如apiose)的缩合得到的[35]。在天然产物中掺杂apiose的现象很少见,只在少数植物天然产物中出现,如由熊胆草产生的锥藻皂苷含有apiose[40]。在对TTX的研究发现,在TTX中加入apiose会产生高度氧化的碳链,然而在脱氧的TTX前体中可能不存在apiose[35]。
(3)萜衍生碳骨架
萜烯类的天然产物来源于C5异戊二烯单元,如二甲基烯丙基焦磷酸(DMAPP)和异戊烯基二磷酸(IPP)。Yasumoto等人提出通过异戊二烯和单一精氨酸的混合合成TTX是可行的(图5)[38],即在NRPS的调控下生成1-羟基-5,11-双脱氧河豚毒素,随后通过逐步的氧化反应,生成TTX中的高度氧化的碳链。无论TTX生物合成是否包含聚酮、糖或萜类底物,所采用的途径都是独特的,不同于迄今为止所研究的任何其他途径。同时,环境因素在TTX的生物合成中也起着重要作用,这也可能是陆地和海洋生物的生物合成存在差异的一个重要原因。
-
人们对TTX的研究已开展了较长时间,从毒性和药理学角度对其已有深入了解,但关于TTX的来源以及生物合成途径的争论仍在继续。有关TTX的来源仍存在多种学说,主要包括外源性学说、内源性学说和共生微生物学说。外源性学说认为TTX可能源自环境中的生物,这些生物摄取了TTX并通过食物链的传递积累在生物体内。内源性学说认为这些生物自身具有生物合成TTX的能力,可能通过特定的生理过程或代谢途径合成这种毒素。共生微生物学说认为TTX是通过生物体内的共生微生物合成的,这些微生物可能是细菌或真菌,它们与宿主形成共生关系,通过代谢过程产生TTX并与宿主动物共存。虽然这些学说各有支持者,但关于TTX真正的来源仍有待科学进一步研究和阐明。
分子技术的进步使我们在遗传水平上更深入地认识小分子的生物合成途径。目前,基于遗传学的方法揭示了非常规结构的分子的部分或完全组装的生物合成基因簇。通过对生物合成基因簇的研究,不仅可以鉴定催化底物的酶,还可以鉴定特定酶的首选底物和辅助因子。此外,结构上与TTX相似的其他天然产物可能存在与之共同的生物合成途径或前体。
虽然对TTX的生物合成进行研究比较困难,但本文试图根据现有的知识强调TTX可能存在的生物合成途径。由于TTX结构的新颖性,目前的研究仍面临诸多困难,并且很多研究尚未得出具体结果。针对这一问题建议采用传统方法和现代方法相结合的研究策略,以进一步阐明TTX的生物合成机制。通过结合传统的实验方法和现代的分子技术,可以更全面地揭示TTX组装的机制,并有望发现新的生物合成酶,这些酶也可能具有一定的商业潜力。
Research progress on the source and biosynthesis of tetrodotoxin
-
摘要: 河豚毒素(TTX)是一种强效神经毒素,因具有特异性的钠通道阻断作用而被广泛用于生物医学领域研究。虽然既往研究者已从不同的海洋生物中鉴定出TTX,但TTX的真正来源尚不明确,具体的生物合成途径也不清楚。本文综述了已报道的TTX来源以及TTX的生物合成研究进展,重点关注TTX可能的微生物来源,为TTX的生产与生物合成研究提供科学参考。Abstract: Tetrodotoxin(TTX)is a potent neurotoxin known for its specific sodium channel blocking effects, widely used in biomedical research. While TTX has been identified in various marine organisms, its true origin remains unclear, and the specific biosynthetic pathways are yet to be elucidated. The reported sources of TTX and the progress in research on TTX biosynthesis were summarized, with a focus on potential microbial sources of TTX, which could provide scientific reference for the production and biosynthesis studies of TTX.
-
Key words:
- tetrodotoxin /
- source /
- biosynthesis
-
表 1 不同来源微生物中的河豚毒素含量和检测方法
产生TTX的微生物 国家/地区 TTX检测方法 TTX浓度(µg/ml) Vibrio alginolyticus 日本 HPLC-MS;UV-Vis;GC-MS 0.08[14] Vibrio alginolyticus 日本 HPLC-FLD:GC–MS 0.001 2[15] Bacillus sp. 菲律宾 HPLC–FLD;GC–MS 0.001 5[16] Pseudomonas sp 菲律宾 HPLC–FLD;GC–MS 0.002 5[17] Shewanella putrefaciens 日本 HPLC–FLD;GC–MS 0.012[18] Vibrio alginolyticus 日本 HPLC–FLD 0.28~0.79[19] Microbacterium 中国香港 TLC;LC–ESI–MS 0.042[20] Arabinogalactanolyticum 中国香港 TLC;LC–ESI–MS 0.04[21] Serratia marcescens 中国香港 TLC;LC–ESI–MS 0.03[22] Vibrio alginolyticus 中国 TLC 0.32[22] Bacillus sp 中国 HPLC–FLD;LC–ESI–MS 0.32[23] Actinomyces sp 中国 HPLC–FLD 0.1[24] Nocardiopsis dassonvillei 夏威夷 TLC;LC–ESI–MS;UV–Vis 0.1[24] Vibrio harveyi 中国 HPLC–MS 0.5~15.7[24] Lysinibacillus fusiformis 中国 LC–ESI–MS 0.024[24] Aeromonas sp 中国香港 ELISA;HPLC–MS 0.002[17] Raoultella terrigena 泰国 ELISA;LC–MALDI–TOF 0.008[17] Shewanella putrefaciens 越南 MS;HPLC–MS–MS 0.195~0.366[25] Providencia rettgeri 越南 HPLC–FLD;TLC 0.015~0.021[25] Enterococcus faecium 中国 HPLC–FLD;TLC 0.015~0.030[26] Enterobacter cloaca 中国 HPLC–FLD;TLC 0.96[26] Rahnella aquatilis 英国 ELISA;HPLC–MS–MS 0.6[27] Vibrio cholerae 英国 ELISA;HPLC–MS–MS (4.2~71.8)×10−5[28] 注:HPLC-MS:高效液相色谱-质谱联用;HPLC-FLD:高效液相色谱-荧光法;UV-Vis:紫外可见分光光度法;GC-MS:气相色谱-质谱联用;TLC:薄层色谱法;ELISA:酶联免疫吸附试验;LC–ESI–MS:液相色谱-电喷雾质谱;HPLC–MS–MS:二级质谱;MS:质谱。 -
[1] NARAHASHI T, DEGUCHI T, URAKAWA N, et al. Stabilization and rectification of muscle fiber membrane by tetrodotoxin[J]. Am J Physiol, 1960, 198: 934-938. doi: 10.1152/ajplegacy.1960.198.5.934 [2] SATO C, UENO Y, ASAI K, et al. The voltage-sensitive sodium channel is a bell-shaped molecule with several cavities[J]. Nature, 2001, 409(6823): 1047-1051. doi: 10.1038/35059098 [3] NARAHASHI T. Pharmacology of tetrodotoxin[J]. J Toxicol Toxin Rev, 2001, 20(1): 67-84. doi: 10.1081/TXR-100102537 [4] GONZÁLEZ-CANO R, RUIZ-CANTERO M C, SANTOS-CABALLERO M, et al. Tetrodotoxin, a potential drug for neuropathic and cancer pain relief?[J]. Toxins, 2021, 13(7): 483. doi: 10.3390/toxins13070483 [5] 赖晓慧, 肖义军. 河豚毒素的研究进展[J]. 福建畜牧兽医, 2019, 41(4): 23-24,29. doi: 10.3969/j.issn.1003-4331.2019.04.010 [6] MATSUI T, HAMADA S, KONOSU S. Difference in accumulation of puffer fish toxin and crystalline tetrodotoxin in the puffer fish, Fugu rubripes rubripes[J]. NIPPON SUISAN GAKKAISHI, 1981, 47(4): 535-537. doi: 10.2331/suisan.47.535 [7] MATSUI T, OHTSUKA Y, SAKAI K. Recent advances in tetrodotoxin research[J]. Yakugaku Zasshi, 2000, 120(10): 825-837. doi: 10.1248/yakushi1947.120.10_825 [8] YAMADA R, TSUNASHIMA T, TAKEI M, et al. Seasonal changes in the tetrodotoxin content of the flatworm Planocera multitentaculata[J]. Mar Drugs, 2017, 15(3): 56. doi: 10.3390/md15030056 [9] KONO M, MATSUI T, FURUKAWA K, et al. Accumulation of tetrodotoxin and 4, 9-anhydrotetrodotoxin in cultured juvenile kusafugu Fugu niphobles by dietary administration of natural toxic komonfugu Fugu poecilonotus liver[J]. Toxicon, 2008, 51(7): 1269-1273. doi: 10.1016/j.toxicon.2008.02.017 [10] NOGUCHI T, ARAKAWA O, TAKATANI T. Toxicity of pufferfish Takifugu rubripes cultured in netcages at sea or aquaria on land[J]. Comp Biochem Physiol Part D Genomics Proteomics, 2006, 1(1): 153-157. doi: 10.1016/j.cbd.2005.11.003 [11] BROWN M S, MOSHER H S. Tarichatoxin: isolation and purification[J]. Science, 1963, 140(3564): 295-296. doi: 10.1126/science.140.3564.295 [12] MOSHER H S, FUHRMAN F A, BUCHWALD H D, et al. Tarichatoxin: tetrodotoxin: a potent neurotoxin[J]. Science, 1964, 144(3622): 1100-1110. doi: 10.1126/science.144.3622.1100 [13] HANIFIN C T, BRODIE E D 3rd, BRODIE E D Jr. Tetrodotoxin levels of the rough-skin newt, Taricha granulosa, increase in long-term captivity[J]. Toxicon, 2002, 40(8): 1149-1153. doi: 10.1016/S0041-0101(02)00115-0 [14] STRAND M, HEDSTRÖM M, SETH H, et al. The bacterial(Vibrio alginolyticus)production of tetrodotoxin in the ribbon worm Lineus longissimus-Just a false positive?[J]. Mar Drugs, 2016, 14(4): 63. doi: 10.3390/md14040063 [15] NOGUCHI T, HWANG D F, ARAKAWA O, et al. Vibrio alginolyticus, a tetrodotoxin-producing bacterium, in the intestines of the fish Fugu vermicularis vermicularis[J]. Mar Biol, 1987, 94(4): 625-630. doi: 10.1007/BF00431409 [16] HWANG D F, ARAKAWA O, SAITO T, et al. Tetrodotoxin-producing bacteria from the blue-ringed Octopus octopus maculosus[J]. Mar Biol, 1989, 100(3): 327-332. doi: 10.1007/BF00391147 [17] YU V C, YU P H, HO K C, et al. Isolation and identification of a new tetrodotoxin-producing bacterial species, Raoultella terrigena, from Hong Kong marine puffer fish Takifugu niphobles[J]. Mar Drugs, 2011, 9(11): 2384-2396. doi: 10.3390/md9112384 [18] THUESEN E V, KOGURE K. Bacterial production of tetrodotoxin in four species of Chaetognatha[J]. Biol Bull, 1989, 176(2): 191-194. doi: 10.2307/1541587 [19] WU Z L, YANG Y, XIE L P, et al. Toxicity and distribution of tetrodotoxin-producing bacteria in puffer fish Fugu rubripes collected from the Bohai Sea of China[J]. Toxicon, 2005, 46(4): 471-476. doi: 10.1016/j.toxicon.2005.06.002 [20] WU Z L, XIE L P, XIA G L, et al. A new tetrodotoxin-producing actinomycete, Nocardiopsis dassonvillei, isolated from the ovaries of puffer fish Fugu rubripes[J]. Toxicon, 2005, 45(7): 851-859. doi: 10.1016/j.toxicon.2005.02.005 [21] WANG X J, YU R C, LUO X, et al. Toxin-screening and identification of bacteria isolated from highly toxic marine gastropod Nassarius semiplicatus[J]. Toxicon, 2008, 52(1): 55-61. doi: 10.1016/j.toxicon.2008.04.170 [22] CAMPBELL S, HARADA R M, DEFELICE S V, et al. Bacterial production of tetrodotoxin in the pufferfish Arothron hispidus[J]. Nat Prod Res, 2009, 23(17): 1630-1640. doi: 10.1080/14786410903003780 [23] WANG J, FAN Y H, YAO Z G. Isolation of a Lysinibacillus fusiformis strain with tetrodotoxin-producing ability from puffer fish Fugu obscurus and the characterization of this strain[J]. Toxicon, 2010, 56(4): 640-643. doi: 10.1016/j.toxicon.2010.05.011 [24] YANG G M, XU J L, LIANG S H, et al. A novel TTX-producing Aeromonas isolated from the ovary of Takifugu obscurus[J]. Toxicon, 2010, 56(3): 324-329. doi: 10.1016/j.toxicon.2010.03.019 [25] AUAWITHOOTHIJ W, NOOMHORM A. Shewanella putrefaciens, a major microbial species related to tetrodotoxin(TTX)-accumulation of puffer fish Lagocephalus lunaris[J]. J Appl Microbiol, 2012, 113(2): 459-465. doi: 10.1111/j.1365-2672.2012.05339.x [26] NGUYEN T H K, NGUYEN H N, NGHE D V, et al. Biological activities of tetrodotoxin-producing Enterococcus faecium AD1 isolated from puffer fishes[J]. Biomed Res Int, 2015, 2015: 973235. [27] WEI F, MA T L, GONG X L, et al. Identification of tetrodotoxin-producing bacteria from goby Yongeichthys criniger[J]. Toxicon, 2015, 104: 46-51. doi: 10.1016/j.toxicon.2015.07.335 [28] TURNER A D, POWELL A, SCHOFIELD A, et al. Detection of the pufferfish toxin tetrodotoxin in European bivalves, England, 2013 to 2014[J]. Euro Surveill, 2015, 20(2): 21009. [29] KISHI Y, FUKUYAMA T, ARATANI M, et al. Synthetic studies on tetrodotoxin and related compounds. IV. Stereospecific total syntheses of DL-tetrodotoxin[J]. J Am Chem Soc, 1972, 94(26): 9219-9221. doi: 10.1021/ja00781a039 [30] SHIMIZU Y, KOBAYASHI M. Apparent lack of tetrodotoxin biosynthesis in captured Taricha torosa and Taricha granulosa[J]. Chem Pharm Bull, 1983, 31(10): 3625-3631. doi: 10.1248/cpb.31.3625 [31] LEE C H, RUBEN P C. Interaction between voltage-gated sodium channels and the neurotoxin, tetrodotoxin[J]. Channels(Austin), 2008, 2(6): 407-412. [32] FOZZARD H A, LEE P J, LIPKIND G M. Mechanism of local anesthetic drug action on voltage-gated sodium channels[J]. Curr Pharm Des, 2005, 11(21): 2671-2686. doi: 10.2174/1381612054546833 [33] HERNÁNDEZ-GUZMÁN G, ALVAREZ-MORALES A. Isolation and characterization of the gene coding for the amidinotransferase involved in the biosynthesis of phaseolotoxin in Pseudomonas syringae pv. phaseolicola[J]. Mol Plant Microbe Interact, 2001, 14(4): 545-554. doi: 10.1094/MPMI.2001.14.4.545 [34] KELLMANN R, MIHALI T K, JEON Y J, et al. Biosynthetic intermediate analysis and functional homology reveal a saxitoxin gene cluster in cyanobacteria[J]. Appl Environ Microbiol, 2008, 74(13): 4044-4053. doi: 10.1128/AEM.00353-08 [35] ADAMS S, CHE D S, QIN G X, et al. Novel biosynthesis, metabolism and physiological functions of L-homoarginine[J]. Curr Protein Pept Sci, 2019, 20(2): 184-193. [36] KOTAKI Y, SHIMIZU Y. 1-Hydroxy-5, 11-dideoxytetrodotoxin, the first N-hydroxy and ring-deoxy derivative of tetrodotoxin found in the newt Taricha granulosa[J]. J Am Chem Soc, 1993, 115(3): 827-830. doi: 10.1021/ja00056a001 [37] BANE V, LEHANE M, DIKSHIT M, et al. Tetrodotoxin: chemistry, toxicity, source, distribution and detection[J]. Toxins, 2014, 6(2): 693-755. doi: 10.3390/toxins6020693 [38] KUDO Y, YASUMOTO T, KONOKI K, et al. Isolation and structural determination of the first 8-epi-type tetrodotoxin analogs from the newt, Cynops ensicauda popei, and comparison of tetrodotoxin analogs profiles of this newt and the puffer fish, Fugu poecilonotus[J]. Mar Drugs, 2012, 10(3): 655-667. doi: 10.3390/md10030655 [39] BAIDILOV D, RYCEK L, TRANT J F, et al. Chemoenzymatic synthesis of advanced intermediates for formal total syntheses of tetrodotoxin[J]. Angew Chem Int Ed, 2018, 57(34): 10994-10998. doi: 10.1002/anie.201804602 [40] SU Y F, KOIKE K, GUO D A, et al. New apiose-containing triterpenoid saponins from Conyza blinii[J]. Tetrahedron, 2001, 57(31): 6721-6726. doi: 10.1016/S0040-4020(01)00632-9 -




 下载:
下载: