-
乌头(aconite)是传统中药[1],具有温阳散寒功效,临床用于治疗心功能不全等虚寒证候。现代研究证实其含多种活性成分,展现抗肿瘤、免疫调节等药理作用[2-3],其中,高乌甲素[4]等已被开发为临床药物。尽管其抗肿瘤效应[5]已被证实,但具体作用机制仍需深入探索。
巨噬细胞作为免疫系统的重要组成部分,在固有免疫和适应性免疫中发挥关键作用[6]。根据功能差异,巨噬细胞可分为M1和M2两种极化类型[7]。其中,细菌和其产物脂多糖 (LPS)可诱导M1型极化,促进促炎因子分泌,增强抗病原体能力;而白介素4(IL-4)诱导的M2型则分泌抗炎因子,参与组织修复[8-9]。在肿瘤微环境中,肿瘤相关巨噬细胞(tumor associated macrophage,TAMs)多呈现M2型表型,通过免疫逃逸机制促进肿瘤进展。M1型特征性表达一氧化氮合成酶(iNOS)、IL-6等标志物,M2型则高表达精氨酸酶1(Arg1)、类几丁质酶3样分子3(Ym1)等分子[10]。通过调控巨噬细胞极化状态,可有效增强抗肿瘤免疫应答,为肿瘤治疗提供新思路。
课题组前期研究表明[11],乌头煎剂(AD)可抑制肝癌小鼠肿瘤生长并影响巨噬细胞浸润,提示其抗肿瘤作用可能与巨噬细胞调控相关。为验证这一假设,本研究首次评估了AD对巨噬细胞活性和极化的影响。通过LPS/IL-4刺激模型,结合流式细胞术和qPCR分析,检测了细胞活性、极化标志物(iNOS、IL-6、Arg-1、Ym1)及细胞因子(TNF-α、IL-10)表达,为阐明AD调控巨噬细胞极化的机制提供实验依据。
-
RAW264.7小鼠巨噬细胞株,由海军军医大学转化医学中心临床肿瘤研究所提供。
-
中药材为制川乌(产地:陕西,批号:18031206)购自海军军医大学第一附属医院中药房,制备成乌头冻干粉以备后续实验。
-
胎牛血清(BI 公司);DMEM(上海源培生物公司);脂多糖(Sigma 公司);IL-4(Novoprotein公司);Arg-1、iNOS、IL-6、YM1及内参基因 GAPDH 引物均由上海冠泰生物科技有限公司合成;TNF-α、IL-10 ELISA kit由上海威奥生物科技有限公司提供;流式抗体FITC Anti-Mouse F4/80、APC Anti-Mouse CD206、PE Anti-Mouse CD86 Antibody(Elabscience公司);高速冷冻离心机(Eppendorf 5810R,德国);多功能酶标仪(BioTek Synergy HT,美国);紫外-分光光度计(Beckman Du730,美国);流式细胞仪(Thermo Fisher,美国)。
-
细胞在37 ℃、5% CO2及饱和湿度条件下,培养于含10%胎牛血清,含1%青-链霉素溶液的 DMEM完全培养液中。
-
取500 g乌头粉末加4 000 ml去离子水回流提取4 h,收取药液后重复提取一次。合并两次的提取液,经减压过滤、旋转蒸发浓缩后冻干,得冻干粉4 ℃保存。临用前取0.8 g冻干粉溶于40 ml PBS,离心过滤(22 μm)制得20 mg/ml母液(−20 ℃保存)。实验时37 ℃复温后,DMEM稀释至所需浓度使用。
-
将RAW264.7细胞接种于96孔板,设未处理对照组及不同浓度乌头煎剂组(1、2、2.5、4、5、8、10 mg/ml),每组3复孔。细胞培养24 h后加入CCK-8孵育1 h,450 nm测A值。根据IC50结果筛选,排除具有生物毒性的影响浓度后,选择低、中、高3个无毒浓度用于后续实验。随后分别用LPS、IL-4对细胞进行诱导,设未处理对照组、LPS/IL-4模型组及AD不同浓度组(AD-L/M/H),相同条件培养24 h后检测细胞增殖率。
-
将RAW264.7细胞接种于6孔板,设9组(n=3):对照组、LPS/IL-4组及AD低(0.5 mg/ml)、中(1 mg/ml)、高(2 mg/ml)浓度组。给药组预处理2 h后,模型组和给药组分别加入LPS(1 μg/ml)或IL-4(40 ng/ml)诱导,对照组不做处理,24 h后收集样本检测。
-
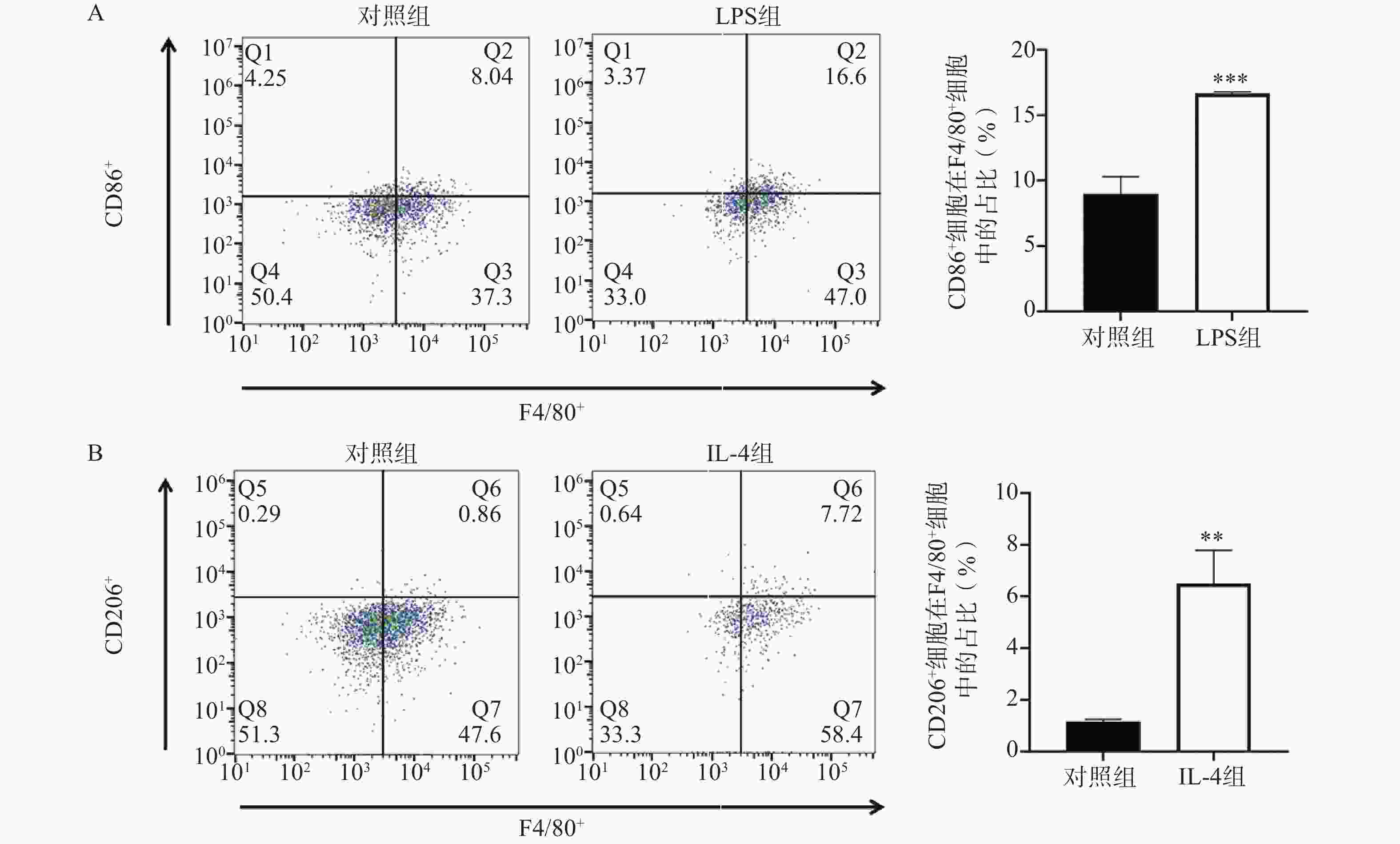
按照上述分组并药物处理24 h后,取细胞制备单细胞悬液(1×106个/ml),分别用荧光标记的流式抗体进行表面标记染色:FITC标记的抗F4/80抗体用于鉴定巨噬细胞,PE标记的抗CD86抗体用于标记M1型巨噬细胞,APC标记的抗CD206抗体用于标记M2型巨噬细胞,4 ℃避光染色30 min。PBS重悬后上机检测,以F4/80+细胞为门控,通过Flow Jo分析CD86+(M1型)和CD206+(M2型)细胞比例。从而评估不同处理组中巨噬细胞亚群的变化情况。
-
用荧光定量PCR检测对照组、LPS模型组及AD不同浓度组(LPS+AD-L/M/H)内IL-6、iNOS mRNA 的表达,并检测对照组、IL-4模型组及AD不同浓度组(IL-4+AD-L/M/H)内YM1及Arg-1 mRNA 的表达。
(1)细胞总RNA 的提取及逆转录:取冻存细胞裂解液,加入0.1 ml氯仿替代物,经振荡混匀后离心分层,收集上清液沉淀,经洗涤后晾干。用40 μl DEPC水溶解RNA沉淀,测定其浓度及纯度(A260/280=1.8~2.0)。随后按照试剂盒说明将RNA逆转录为cDNA。
(2)荧光定量PCR:采用SYBR Green qPCR Master Mix 试剂盒进行荧光定量PCR反应,反应条件为95 ℃预变性 30 s,随后进行40 个循环扩增(95 ℃变性 5 s,60 ℃ 退火30 s)。每次扩增设置GAPDH为内参对照。选用 2−ΔΔCt 法分析样本中IL-6、iNOS、Arg-1、YM1mRNA的相对表达量。荧光定量 PCR引物序列见表1。
表 1 荧光定量 PCR引物序列
引物 序列 长度(bp) GAPDH F:GCTTGGGCTTCCTTTAGGGTA 79 R:GATTTCATAACGGCGGTTCATT IL-6 F:GCTACCAAACTGGATATAATCAGG 129 R:GGACTCTGGCTTTGTCTTTCTT iNOS F:TTG ACG CTC GGA ACT GTA 74 R:GTT GGT GGC ATA AAG TAT GTG Arg-1 F:GCC AGG GAC TGA CTA CCT TAA 90 R:AGT TCT GTC TGC TTT GCT GTG Ym1 F:TGA GGA AGA ATC TGT GGA GAA 108 R:TGA GAC AGT TCA GGG ATC TTG -
收集各组细胞上清液,参照TNF-α、IL-10 Elisa检测试剂盒说明书进行操作。根据标准品浓度梯度绘制标准曲线,计算样本中TNF-α和IL-10的浓度,结果以pg/ml表示。所有操作均在生物安全柜内进行,确保实验过程无菌。
-
实验数据用GraphPad Prism 8.0统计软件处理分析,统计方法使用 One-Way ANOVA 及 LSD 检验,两独立样本使用t检验比较两组间差异。数据用(
$\bar x $ ±s)表示。 -
CCK-8实验表明,与RAW264. 7空白组比较,乌头煎剂在0.5~4 mg/ml范围内显著促进RAW264.7细胞增殖(P<0.05,表2),当浓度升高到5 mg/ml时抑制生长(P<0.05,表2)。基于IC50测定,后续实验选用0.5、1、2 mg/ml(低、中、高浓度)以确保无细胞毒性影响。
表 2 乌头煎剂对RAW264.7细胞活性的影响(
$\bar x $ ±s)组别 浓度(mg/ml) n 细胞活性(%) 对照组 0 3 100±3.63 AD1组 0.5 3 122.12±4.70# AD2组 1 3 154.77±5.39# AD3组 2 3 157.47±5.07# AD4组 2.5 3 121.32±4.28# AD5组 4 3 112.84±0.92# AD6组 5 3 88.57±0.63* AD7组 8 3 66.18±3.89* AD8组 10 3 53.79±1.75* *P<0.05,抑制增殖,#P<0.05,促进增殖,与对照组比较。 -
表3数据显示,LPS(1 μg/ml)刺激24 h可显著提升RAW264.7细胞增殖(P<0.05),而乌头煎剂预处理后协同作用进一步增强,呈现剂量依赖性(P<0.05)。根据表4数据,IL-4(40 ng/ml)对细胞活力影响不显著(P>0.05),但联合乌头煎剂后增殖率呈浓度依赖性下降(P<0.05)。
表 3 乌头煎剂对LPS诱导的RAW264.7细胞增殖率的影响(
$\bar x $ ±s)组别 n 增殖率(%) 对照组 3 100±.2.63* LPS组 3 106.87±0.20 LPS+AD-L组 3 113.80±1.00* LPS+AD-M组 3 119.21±2.36* LPS+AD-H组 3 128.13±2.46* *P<0.05,与LPS组比较。 表 4 乌头煎剂对IL-4诱导的RAW264.7细胞增殖率的影响(
$\bar x $ ±s)组别 n 增殖率(%) 对照组 3 100±2.40 IL-4组 3 98.52±0.43 IL-4+AD-L组 3 90.65±0.28* IL-4+AD-M组 3 86.47±0.82* IL-4+AD-H组 3 82.14±0.61* *P<0.05,与IL-4组比较。 -
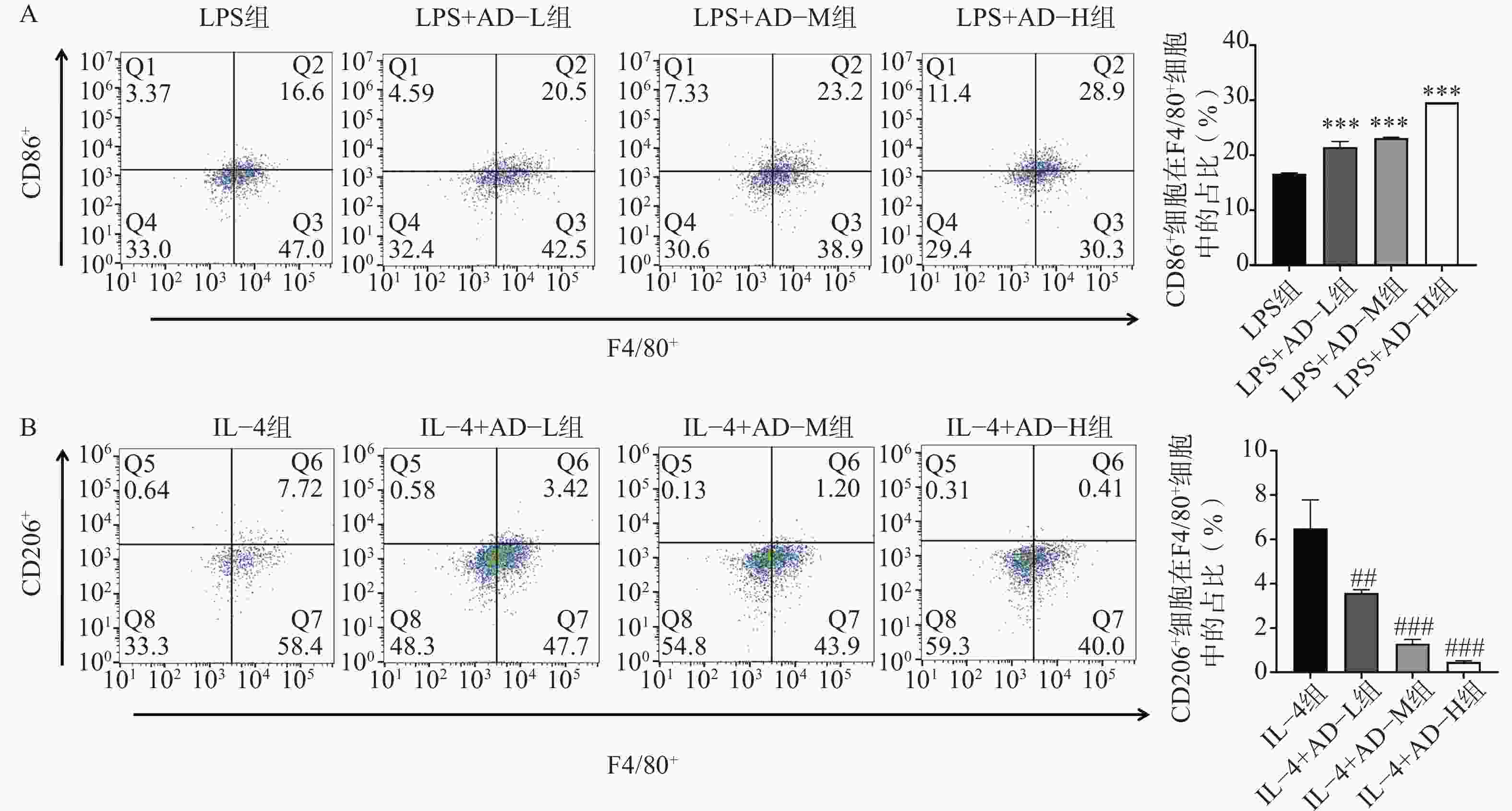
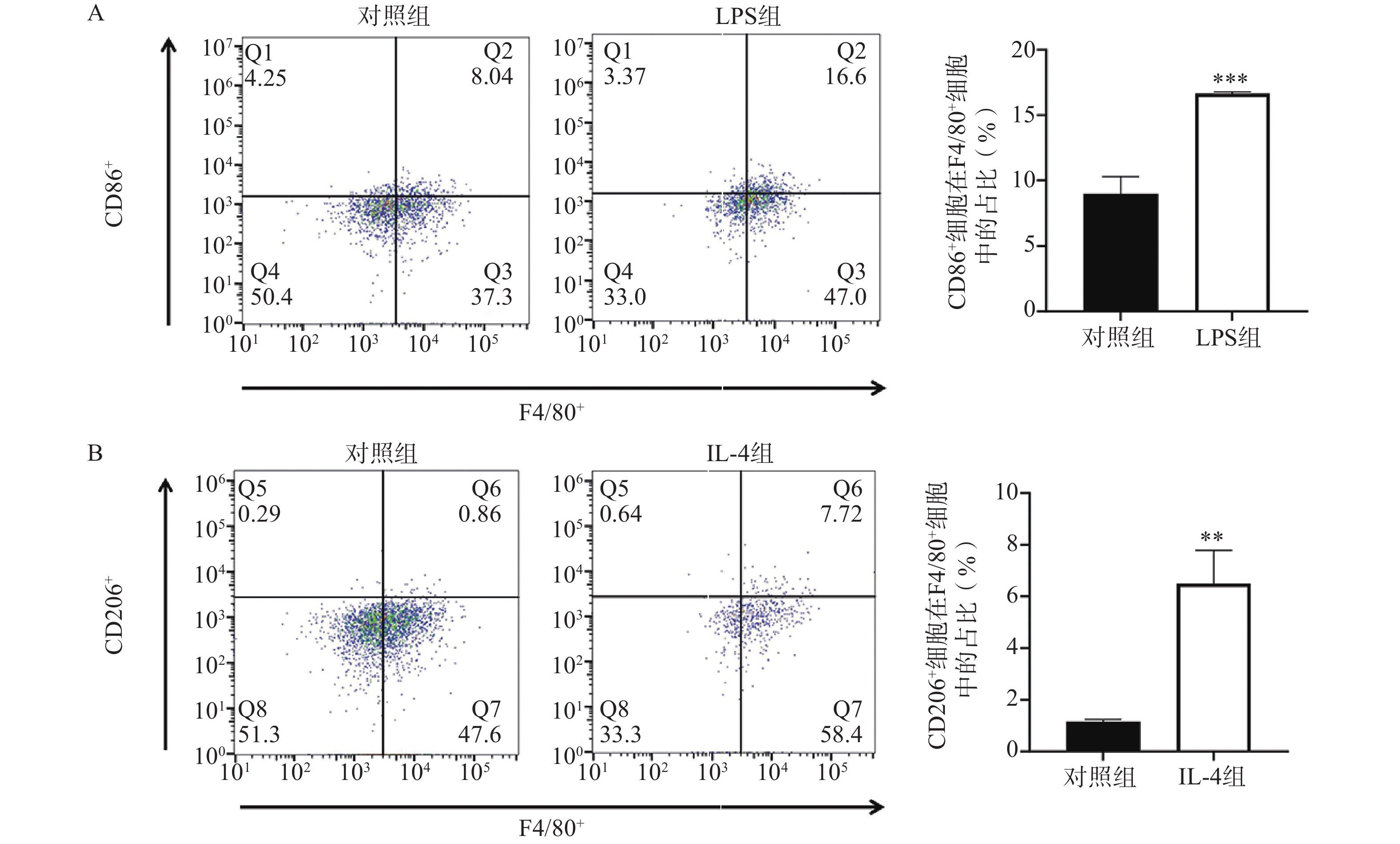
流式细胞术分析显示,LPS刺激显著提高CD86+M1型巨噬细胞比例(P<0.05)(图1A);而IL-4处理则明显增加CD206+M2型细胞比例(P<0.05,图1B)。乌头煎剂预处理后,LPS组的M1型极化进一步增强(图2A),而IL-4组的M2型极化被显著抑制(图2B),均呈现剂量依赖性(P<0.05)。这些结果提示,乌头煎剂可能通过双向调节巨噬细胞极化状态,一方面增强其抗肿瘤免疫活性,另一方面抑制其促肿瘤生长功能。
-
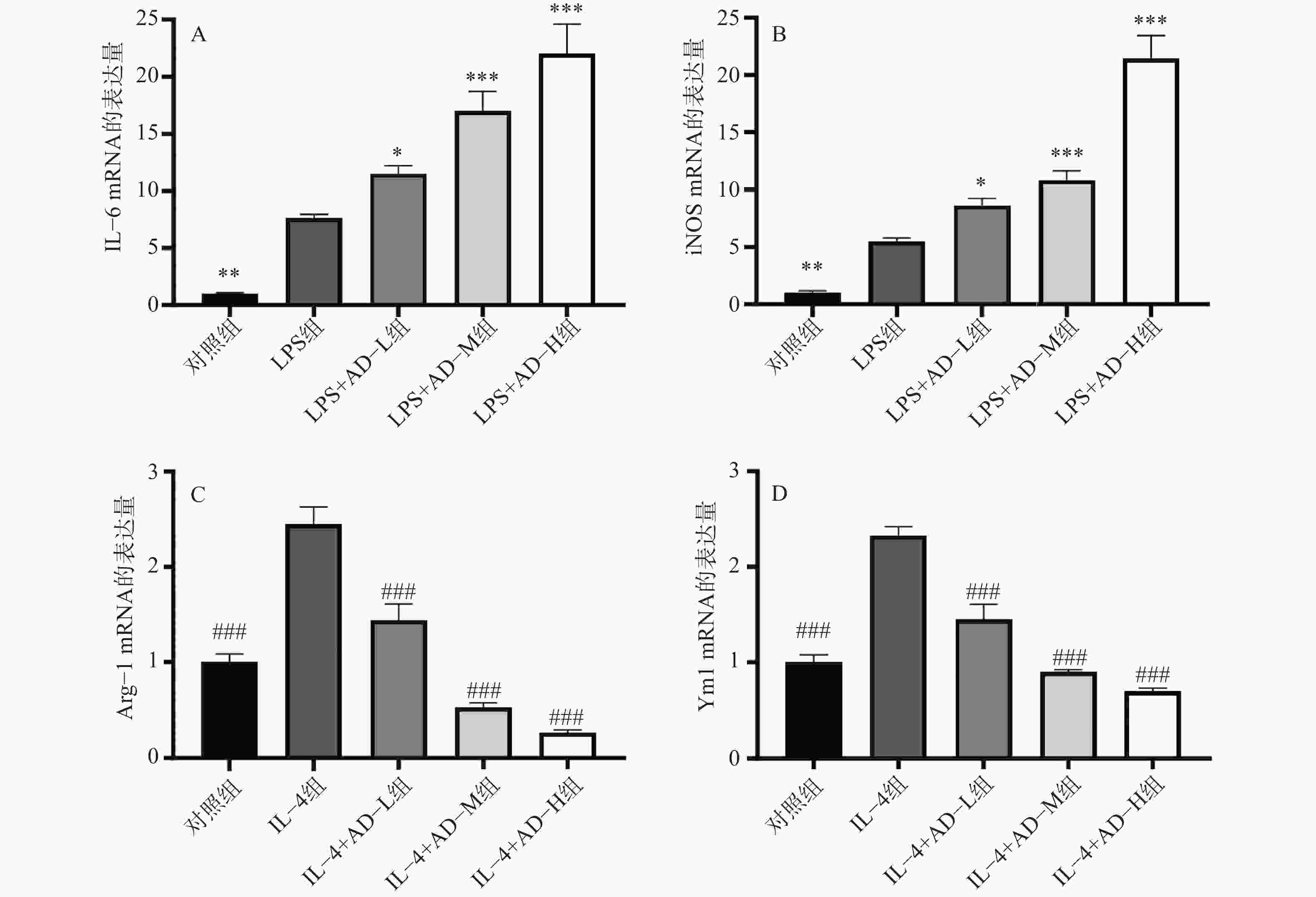
荧光定量PCR结果显示(图3A、图3B),LPS刺激显著上调IL-6和iNOS表达水平(P<0.05);乌头煎剂预处理后进一步增强该效应,且呈剂量依赖性(P<0.05)。(图3C、图3D)。IL-4刺激后显著提高Arg-1和YM1水平(P<0.05),而乌头煎剂可剂量依赖性抑制其表达(P<0.05)。这些数据表明,乌头煎剂具有双向调控巨噬细胞极化的独特作用:一方面通过增强IL-6/iNOS表达水平促进M1型巨噬细胞的抗肿瘤免疫活性,另一方面通过抑制Arg-1/YM1表达水平阻断M2型巨噬细胞的免疫抑制功能。
-
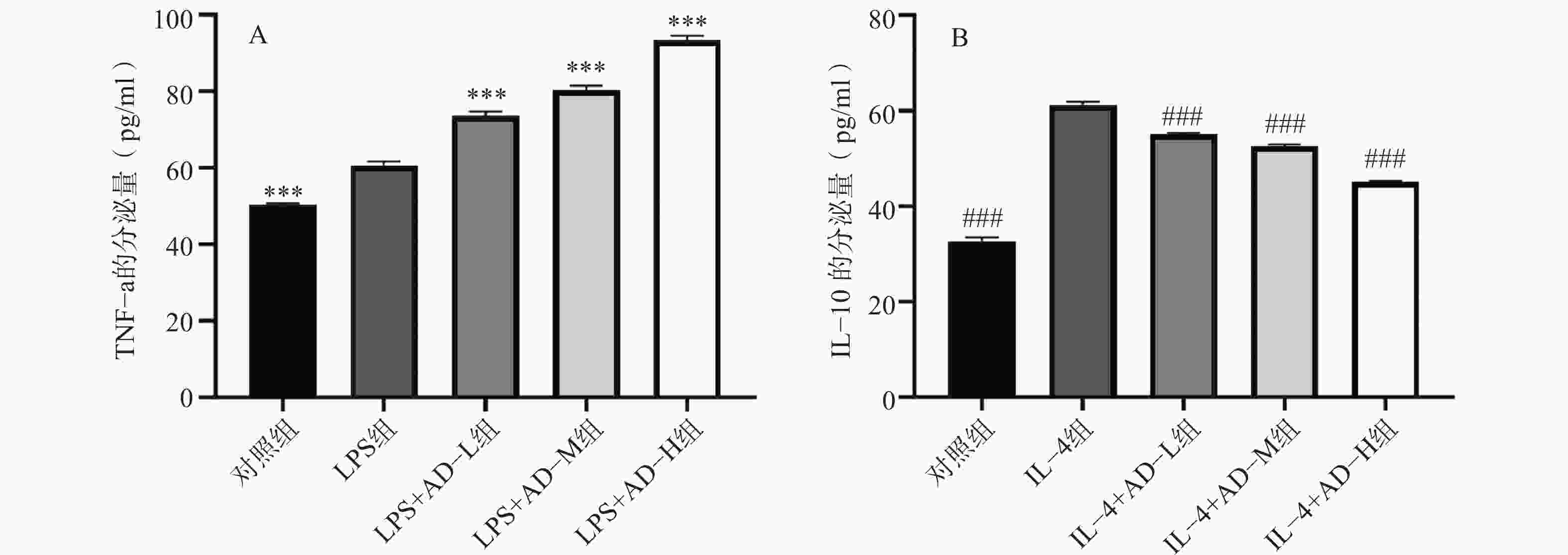
Elisa检测结果显示(图4A),LPS单独刺激显著促进TNF-α分泌(P<0.05),乌头煎剂预处理后该效应进一步增强且呈剂量依赖性。表明其对M1型巨噬细胞促炎功能具有协同激活作用。IL-4显著增加IL-10分泌水平(P<0.05),而乌头煎剂可剂量依赖性抑制其分泌(图4B),提示其可阻断M2型巨噬细胞的免疫抑制功能。
-
巨噬细胞具有高度可塑性,可在微环境调控下分化为促炎的M1型或抗炎的M2型,二者在肿瘤微环境中发挥截然不同的作用[12]。TAMs通常呈现M2样表型,促进肿瘤进展。研究表明[13-14],巨噬细胞已成为肿瘤治疗的关键靶点,其功能调控在肿瘤免疫治疗中具有核心研究价值。乌头及其活性化合物具有广泛的生物活性,包括抗肿瘤、免疫调节等多种药理作用[15]。近年来,其在慢性心力衰竭、慢性低血压、休克等疾病治疗中的应用也有报道[16]。本研究在前期体内实验的基础上[17],探讨了乌头煎剂对巨噬细胞极化的调控作用。
实验结果表明,一定浓度范围的乌头煎剂能促进RAW264.7细胞增殖,呈浓度依赖性。在免疫功能调控方面,乌头煎剂展现出显著的巨噬细胞极化调节作用:在LPS诱导的M1极化模型中,乌头煎剂显著提升CD86+细胞比例,上调IL-6、iNOS和TNF-α表达,增强巨噬细胞的促炎活性和抗肿瘤免疫应答;而在IL-4诱导的M2极化模型中,乌头煎剂则抑制CD206+细胞比例及下调免疫抑制相关分子Arg-1、Ym1和IL-10的水平。这些发现表明,乌头煎剂可通过双向调控巨噬细胞极化状态。为开发基于巨噬细胞极化的肿瘤免疫治疗策略提供了潜在候选药物。本研究通过体外实验证实了乌头煎剂能够显著激活巨噬细胞并调控其极化状态,为开发新型肿瘤免疫治疗策略提供了重要理论基础。然而需要指出的是,本研究仍存在若干局限性:首先,实验仅停留在细胞水平,缺乏动物模型验证,无法全面反映乌头煎剂在复杂机体环境中的作用效果;其次,对乌头煎剂调控巨噬细胞极化的分子机制探讨不够深入,虽然检测了部分标志物的表达变化,但尚未阐明具体的信号转导通路和关键靶点;再者,乌头煎剂作为复杂的中药制剂,其活性成分与巨噬细胞的相互作用机制有待进一步解析。基于这些局限,未来研究应当着重按照以下方向开展:建立荷瘤动物模型,在体内验证乌头煎剂对肿瘤相关巨噬细胞的调控作用;采用蛋白质组学和转录组学等技术深入挖掘关键信号通路;开展乌头煎剂活性成分的分离鉴定,明确其药效物质基础;探索乌头煎剂与现有肿瘤治疗方案的协同作用机制。这些深入研究将为乌头煎剂的临床应用提供更坚实的科学依据,推动中药在肿瘤免疫治疗领域的创新发展,为开发基于巨噬细胞重编程的肿瘤免疫治疗提供新路径。
Effect of aconite decoction on the activity and polarization of mouse RAW264.7 macrophages
-
摘要:
目的 探讨乌头煎剂(aconite decoction, AD)对脂多糖(lipopolysaccharide,LPS)或白介素 4(IL-4)诱导的小鼠RAW264. 7 巨噬细胞活性及其向M1、M2型极化的影响。 方法 采用CCK-8法检测乌头煎剂的细胞毒性;分别以 LPS诱导RAW264. 7细胞向M1型极化、IL-4诱导RAW264. 7细胞向M2型极化,并加入不同浓度乌头煎剂干预。通过流式细胞术检测RAW264. 7巨噬细胞的极化类型;采用荧光定量 PCR检测与巨噬细胞极化相关的IL-6、一氧化氮合成酶(iNOS)、精氨酸酶1(Arg1)、类几丁质酶3样分子3(chitinase 3-like,Chi3l3或称Ym1)的mRNA 表达水平;利用Elisa法检测细胞上清液中与巨噬细胞极化相关细胞因子肿瘤坏死因子(TNF-α)、IL-10的含量。 结果 乌头煎剂在无毒浓度范围内显著升高LPS 诱导下细胞内IL-6和iNOS的mRNA表达水平,降低IL-4 诱导下细胞内 Arg-1、Ym1的mRNA表达水平;同时,乌头煎剂显著增加LPS 诱导下细胞分泌TNF-α的水平,降低IL-4诱导下细胞分泌IL-10的水平。 结论 乌头煎剂能够促进巨噬细胞的增殖,增加其活性;对LPS诱导的巨噬细胞向M1型极化具有显著促进作用;对IL-4诱导的巨噬细胞向M2型极化具有抑制作用。这一发现为乌头煎剂在肿瘤免疫治疗中的应用提供了实验依据。 Abstract:Objective To investigate the effects of Aconite decoction (AD) on the viability and polarization of murine RAW264.7 macrophages induced by lipopolysaccharide (LPS) or interleukin-4 (IL-4). Methods Cytotoxicity of AD was assessed by the CCK-8 assay. RAW264.7 cells were polarized toward M1 phenotype by LPS or M2 phenotype by IL-4, followed by treatment with varying concentrations of AD. Macrophage polarization was analyzed by flow cytometry. Quantitative PCR was performed to measure mRNA expression of polarization-associated markers (IL-6, iNOS, Arg1, and Ym1). ELISA was used to quantify secreted cytokines (TNF-α and IL-10)in the supernatant. Results At non-toxic concentrations, IL-6 and iNOS mRNA levels in LPS-stimulated cells were significantly upregulated while Arg1 and Ym1 expression in IL-4-treated groups were downregulated by AD. Concurrently, TNF-α secretion in LPS-induced M1 polarization was enhanced but IL-10 production in IL-4-induced M2 polarization was suppressed by AD. Conclusion AD could promote macrophage proliferation and viability, augments LPS-driven M1 polarization, and inhibit IL-4-mediated M2 polarization, which provided experimental evidence for the potential application of AD in tumor immunotherapy. -
Key words:
- aconite decoction /
- macrophage polarization /
- M1/M2 phenotype /
- immunotherapy
-
表 1 荧光定量 PCR引物序列
引物 序列 长度(bp) GAPDH F:GCTTGGGCTTCCTTTAGGGTA 79 R:GATTTCATAACGGCGGTTCATT IL-6 F:GCTACCAAACTGGATATAATCAGG 129 R:GGACTCTGGCTTTGTCTTTCTT iNOS F:TTG ACG CTC GGA ACT GTA 74 R:GTT GGT GGC ATA AAG TAT GTG Arg-1 F:GCC AGG GAC TGA CTA CCT TAA 90 R:AGT TCT GTC TGC TTT GCT GTG Ym1 F:TGA GGA AGA ATC TGT GGA GAA 108 R:TGA GAC AGT TCA GGG ATC TTG 表 2 乌头煎剂对RAW264.7细胞活性的影响(
$\bar x $ ±s)组别 浓度(mg/ml) n 细胞活性(%) 对照组 0 3 100±3.63 AD1组 0.5 3 122.12±4.70# AD2组 1 3 154.77±5.39# AD3组 2 3 157.47±5.07# AD4组 2.5 3 121.32±4.28# AD5组 4 3 112.84±0.92# AD6组 5 3 88.57±0.63* AD7组 8 3 66.18±3.89* AD8组 10 3 53.79±1.75* *P<0.05,抑制增殖,#P<0.05,促进增殖,与对照组比较。 表 3 乌头煎剂对LPS诱导的RAW264.7细胞增殖率的影响(
$\bar x $ ±s)组别 n 增殖率(%) 对照组 3 100±.2.63* LPS组 3 106.87±0.20 LPS+AD-L组 3 113.80±1.00* LPS+AD-M组 3 119.21±2.36* LPS+AD-H组 3 128.13±2.46* *P<0.05,与LPS组比较。 表 4 乌头煎剂对IL-4诱导的RAW264.7细胞增殖率的影响(
$\bar x $ ±s)组别 n 增殖率(%) 对照组 3 100±2.40 IL-4组 3 98.52±0.43 IL-4+AD-L组 3 90.65±0.28* IL-4+AD-M组 3 86.47±0.82* IL-4+AD-H组 3 82.14±0.61* *P<0.05,与IL-4组比较。 -
[1] 荣宝山, 黄凯丽, 袁琳嫣, 等. 乌头类药材化学成分和药理作用研究进展[J]. 中国药事, 2021, 35(8):932-947. [2] 周长凯, 高静, 付蕾, 等. 川乌抗肿瘤作用研究进展及可行性分析[J]. 中华中医药学刊, 2020, 38(12):179-182. [3] 艾嫦, 朱妍妍, 赵长琦. 乌头属植物化学成分、药理作用及其内生菌的研究进展[J]. 天然产物研究与开发, 2012, 24(2):248-259. doi: 10.3969/j.issn.1001-6880.2012.02.027 [4] GAO Y, FAN H, NIE A, et al. Aconitine: a review of its pharmacokinetics, pharmacology, toxicology and detoxification[J]. J Ethnopharmacol, 2022, 293:115270. doi: 10.1016/j.jep.2022.115270 [5] 陈晓峥, 程菊, 石小艺, 等. 乌头属二萜生物碱的抗肿瘤活性研究进展[J]. 中国中药杂志, 2023, 48(14):3765-3773. [6] TIAN Z Q, HOU X J, LIU W T, et al. Macrophages and hepatocellular carcinoma[J]. Cell Biosci, 2019, 9:79. doi: 10.1186/s13578-019-0342-7 [7] 戈文珂, 吴卫兵. 肿瘤微环境中肿瘤相关巨噬细胞极化的影响因素及其意义[J]. 中国肺癌杂志, 2023, 26(3):228-237. [8] 王成志, 刘一帆, 张晓青, 等. 天然产物调控肿瘤相关巨噬细胞在抗肿瘤免疫中的研究进展[J]. 现代肿瘤医学, 2024, 32(22):4378-4385. doi: 10.3969/j.issn.1672-4992.2024.22.028 [9] 张硌, 王义武, 张令强, 等. 巨噬细胞极性及调控机制[J]. 科学通报, 2012, 57(S2):2661-2665. [10] YUNNA C, MENGRU H, LEI W, et al. Macrophage M1/M2 polarization[J]. Eur J Pharmacol, 2020, 877:173090. doi: 10.1016/j.ejphar.2020.173090 [11] 杨康迪. 乌头煎剂调节NK细胞免疫功能抗肝癌的实验研究[D]. 上海: 海军军医大学, 2023. [12] ORECCHIONI M, GHOSHEH Y, PRAMOD AB, et al. Corrigendum: Macrophage Polarization: Different Gene Signatures in M1(LPS+)vs. Classically and M2(LPS-)vs. Alternatively Activated Macrophages[J]. Fro Immunol, 2020, 11:234. doi: 10.3389/fimmu.2020.00234 [13] 黄鑫昱, 苏盛元, 王开琛等. 巨噬细胞在肝癌发生、发展中的作用机制及其靶向治疗研究进展[J]. 肝脏, 2022, 27(6):708-711. [14] 应航洁, 史丽云. 巨噬细胞极性转化及其分子调控机制[J]. 医学综述, 2014, 20(17):3095-3097. [15] 张佳艺, 闫梓乔, 杜璐瑶, 等. 乌头抗肿瘤的应用及研究[J]. 中医药导报, 2019, 25(10):45-49. [16] 王欢, 王丽娜, 顾伟. 乌头属药物对机体免疫功能调节作用的研究进展[J]. 山东医药, 2020, 60(6):105-108. [17] QI X, LIN W, WANG H, et al. Aconitine inhibits the prolife ration of hepatocellular carcinoma by inducing apoptosis[J]. Int J Clin Exper Pathol, 2018, 11(11):5278-5289. -




 下载:
下载: