-
压力性损伤(PI)是由于长期受压、剪切力或摩擦导致的局部组织损伤[1]。临床中,PI是一个重大的医疗挑战,其发病率较高,住院时间长且造成巨大的社会经济负担[2]。因此,开发有效的预防和管理策略对于减轻这种负担并改善患者预后至关重要[3]。近年来,研究发现外泌体(Exo)在PI的治疗中具有重要潜力。Exo是由细胞通过胞吐作用释放的细胞外囊泡,富含生物活性分子,参与免疫调节、组织修复及血管生成等过程[4]。Exo具有生物相容性好、免疫原性低、易于储存运输、便于长期保存等优势。Exo可通过促进血管生成、刺激成纤维细胞增殖及调节巨噬细胞极化,有效减轻炎症并促进组织再生[5]。这些研究表明,基于Exo的治疗方法是一种治疗PI的创新策略,为新型Exo制剂的开发奠定了基础。
PI的发生与巨噬细胞极化失衡密切相关,尤其是M1型巨噬细胞在损伤部位的持续存在[6]。M1型巨噬细胞虽在炎症早期通过清除病原体和坏死组织发挥作用,但其持续激活会加重组织损伤。相比之下,M2型巨噬细胞在抑制炎症和促进组织修复中起关键作用。因此,M1与M2型巨噬细胞之间的平衡对PI的修复至关重要[7]。近年来,巨噬细胞来源的Exo因其强大的免疫调节与组织再生能力备受关注[8]。尤其是来源于M2型巨噬细胞的Exo(ExoMϕ-M2),携带抗炎因子和miRNAs,能有效抑制促炎反应并促进组织再生。ExoMϕ-M2在调节巨噬细胞极化中发挥关键作用,能将巨噬细胞从M1表型转化为M2表型,从而营造有利于创面愈合的微环境[9]。
本研究结合了ExoMϕ-M2的治疗潜力,开发了一种新型Exo喷剂用于治疗PI。研究中使用IL-4和Ta颗粒诱导巨噬细胞为M2型后提取Exo-IL-4/Exo-Ta,并将其悬浮于生理盐水中,制备成可喷雾的制剂应用于创伤部位。本研究可能为PI的治疗提供一种高效且具有应用前景的潜在方案。
-
本研究经陆军军医大学动物研究委员会批准,编号为AMUWEC20242019。获取大鼠股骨和胫骨,用DMEM/F12(Gibco)冲洗骨髓腔获取骨髓细胞悬液,500×g离心5 min,加入红细胞裂解液(Beyotime),用含10%胎牛血清(Gibco)、1%青霉素-链霉素(Gibco)及20 ng/ml巨噬细胞集落刺激因子(Sigma)的RPMI 1640培养基(Thermo Fisher)进行培养。大鼠成纤维细胞购自OriCell®(大鼠皮肤成纤维细胞,RASSK-02031),细胞使用OriCell®大鼠皮肤成纤维细胞完全培养基(RASSK-90011)进行培养。
-
购买的Ta(Macklin)通过扫描电子显微镜(SEM)进行表征。根据参考文献,巨噬细胞分别与20 ng/ml的IL-4(Beyotime)[10]或30 μg/ml的Ta[11]共培养72 h,通过免疫荧光染色与Western blots评估巨噬细胞的极化情况。
-
为了提取Exo-IL-4/Exo-Ta,巨噬细胞分别与IL-4或Ta共培养72 h,收集培养基上清液,培养过程选用Exo去除的胎牛血清(VivaCell)。Exo的提取使用Total Exosome Isolation Reagent(Thermo Fisher),参考说明书进行操作。通过透射电子显微镜(TEM)观察Exo的形态,Western blots检测外泌体的表面标志物(ALIX、CD81、TSG101及Calnexin)。
-
DiO(Beyotime)对巨噬细胞进行标记,按照实验步骤提取Exo-IL-4/Exo-Ta。将带有荧光的Exo-IL-4/Exo-Ta与M1型巨噬细胞共培养72 h,通过激光扫描共聚焦显微镜观察Exo-IL-4/Exo-Ta在M1型巨噬细胞内的分布。
-
为了明确Exo-Ta的生物学功能,收集未经任何处理的巨噬细胞分泌的外泌体与Exo-Ta,在数据非依赖采集模式(DIA)下,使用VanquishTM Neo UHPLC系统与Thermo Orbitrap Astral质谱仪联用进行液相色谱-质谱分析。收获数据后进行相关生物信息学分析。
-
动物实验在开展之前已获得伦理委员会批准。大鼠麻醉后剃除臀部区域的毛发,在臀部与腹部交界处切开,用钝性分离的方式暴露臀大肌,在其内部植入无菌镀锌铁片。将肌肉和皮肤依次缝合,并对手术部位进行消毒。24 h后,在与金属植入物位置对应的皮肤表面放置磁铁,以向臀大肌及其覆盖的皮肤施加压力,持续3 d[12]。受压处皮肤出现溃疡和渗出,中心部位皮肤变黑。造模完成后,使用喷雾器将1 ml外泌体溶液(Exo-IL-4/Exo-Ta,1×109微粒/ml,每3 d喷1次,共5次)均匀喷洒于创面[13]。
-
免疫荧光染色与Western blots的步骤与常规操作无明显差异,详见课题组前期研究[14]。
-
数据以均值±标准差(
$ \bar x \pm s $ )表示,并使用GraphPad Prism 9.0软件进行分析。所有体外实验均重复进行3次。两组间的比较采用独立样本t检验,多组间的比较采用单因素方差分析(One-way ANOVA),随后进行Tukey事后检验。对于多组有序数据,使用Kruskal-Wallis检验,并结合Nemenyi检验确定统计学意义。P<0.05被认为具有统计学显著性。 -
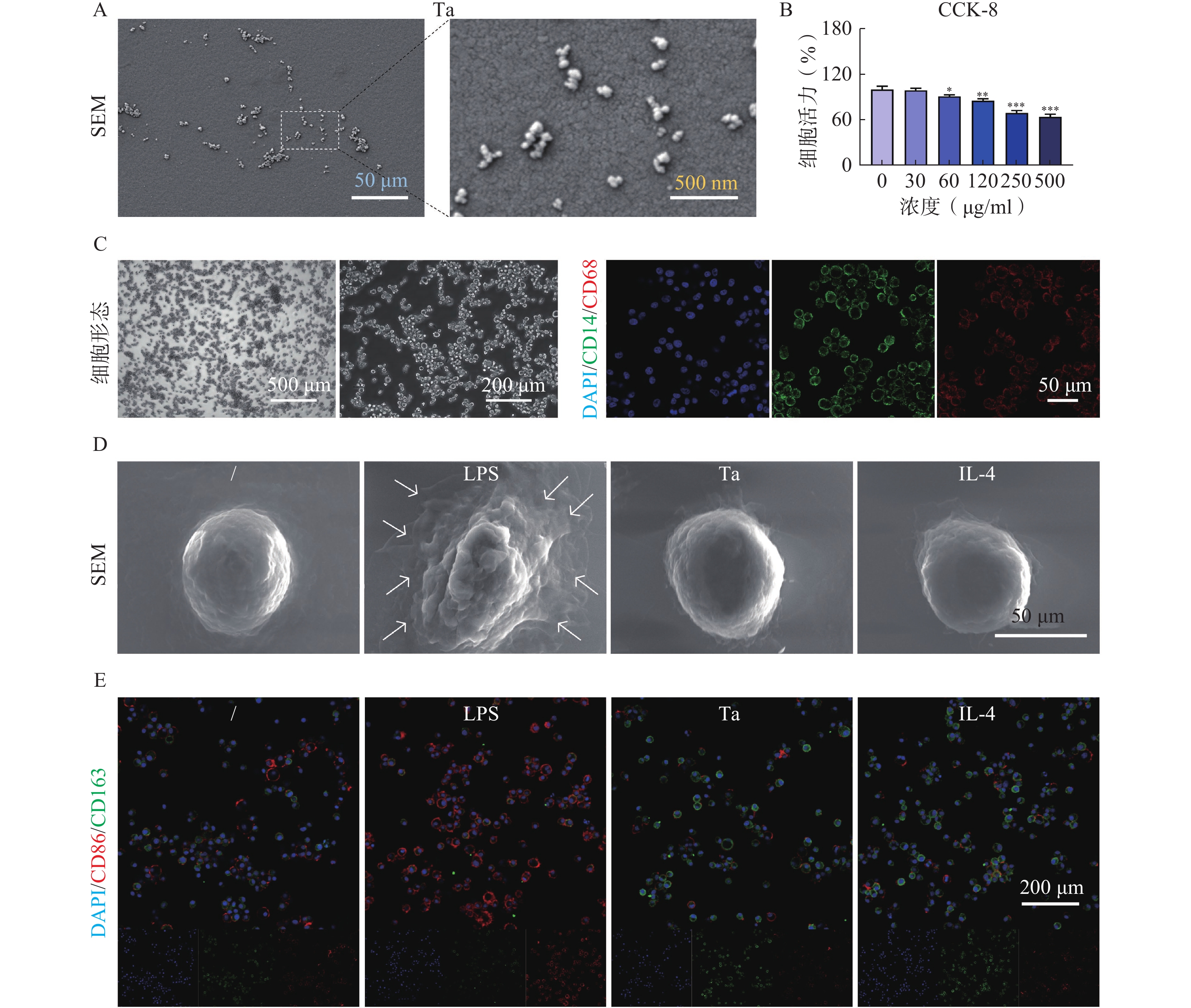
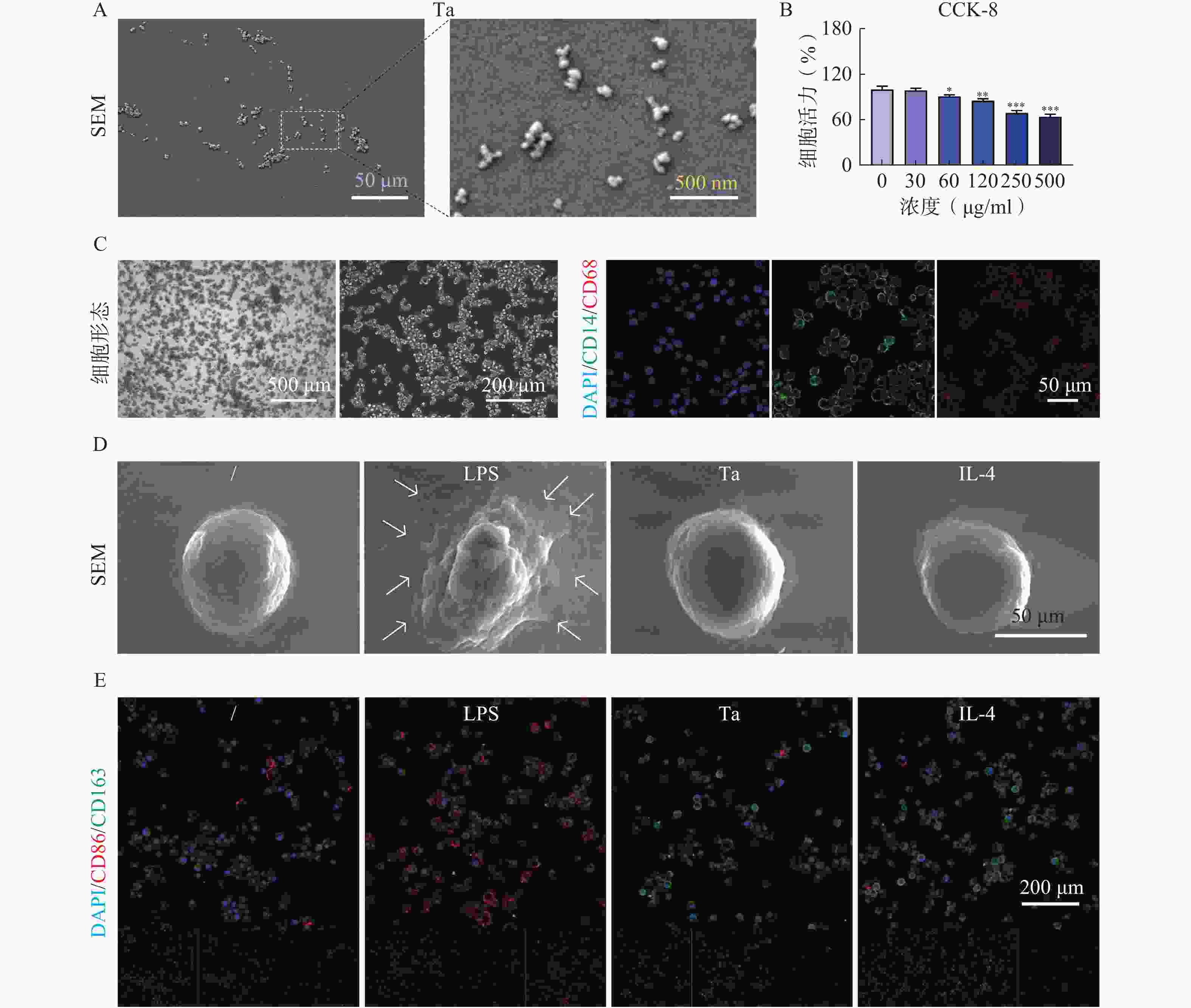
SEM实验结果显示Ta在溶液中均匀分布,呈现圆球形态(图1A)。CCK-8实验结果显示,72 h内Ta在30 μg/ml浓度下对巨噬细胞无显著毒性作用(图1B)。体外培养中巨噬细胞呈现贴壁生长的特性,形态不规则,细胞体延伸出细长的伪足。细胞形态表现为圆形与长形的异质性混合,并在表面高度表达CD14和CD68(图1C)。SEM实验结果显示,LPS组的巨噬细胞表现出更为细长的形态,具有明显的伪足,且细胞表面粗糙。相比之下,IL-4/Ta组的巨噬细胞呈现更为圆形的形态,伪足数量较少且较短,细胞表面较脂多糖(LPS)组细胞更为光滑(图1D)。免疫荧光染色与Western blots实验结果显示,IL-4/Ta处理后的巨噬细胞主要表达M2型标志物CD163,而LPS处理后的巨噬细胞主要表达M1型标志物CD86(图1E)。
-
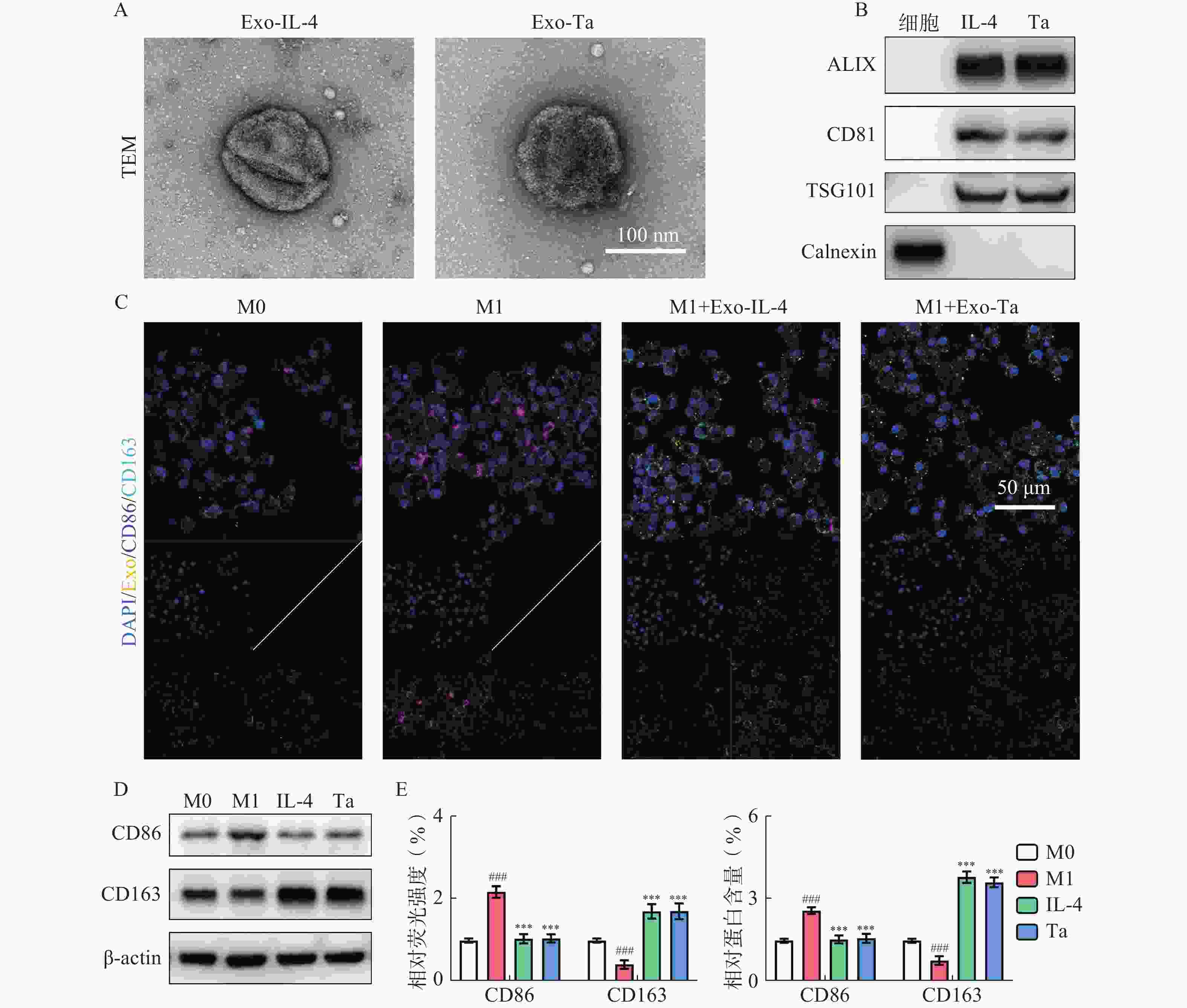
TEM实验结果显示Exo-IL-4/Exo-Ta均呈现圆球性状并具有典型的双层膜结构(图2A)。此外,Western blots实验结果显示Exo-IL-4/Exo-Ta高表达外泌体特异性蛋白(ALIX、CD81及TSG101),未检测到阴性标志物Calnexin(图2B),巨噬细胞作为阴性对照。免疫荧光染色与Western blots实验结果显示,M1型巨噬细胞与Exo-IL-4/Exo-Ta共培养后,Exo在巨噬细胞内分布均匀,巨噬细胞中CD86的表达量下降,CD163的分泌水平上升(图2C,2D和2E)。
-
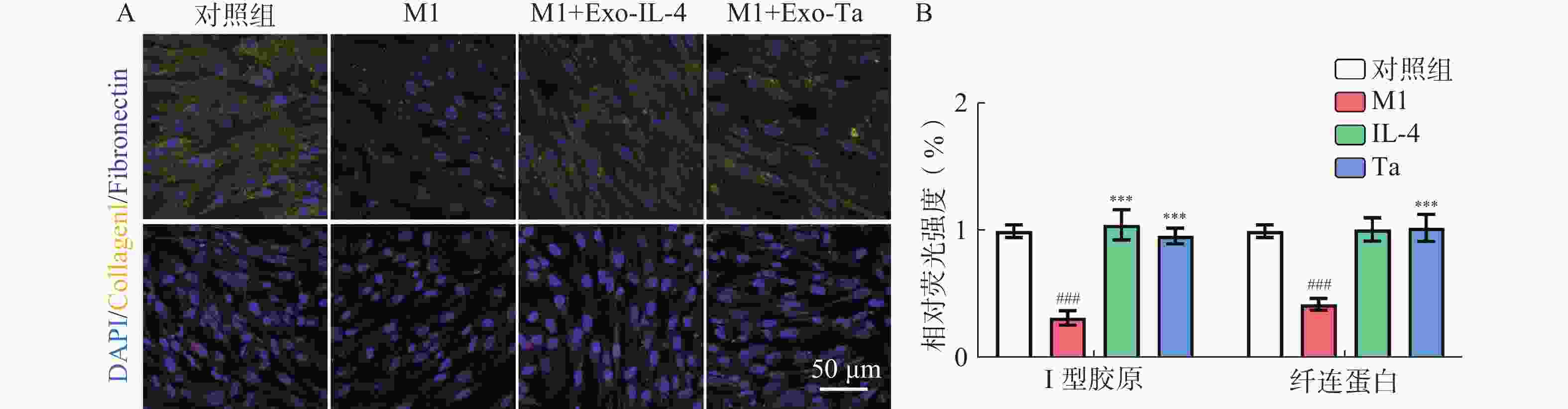
成纤维细胞与M1型巨噬细胞共培养后,I型胶原(Collagen I)与纤连蛋白(Fibronectin)表达水平下降。在加入Exo-IL-4/Exo-Ta后,M1型巨噬细胞这一效应得到了逆转,Collagen I与Fibronectin的含量得到提升(图3A和3B)。单独成纤维细胞组作为对照组。
-
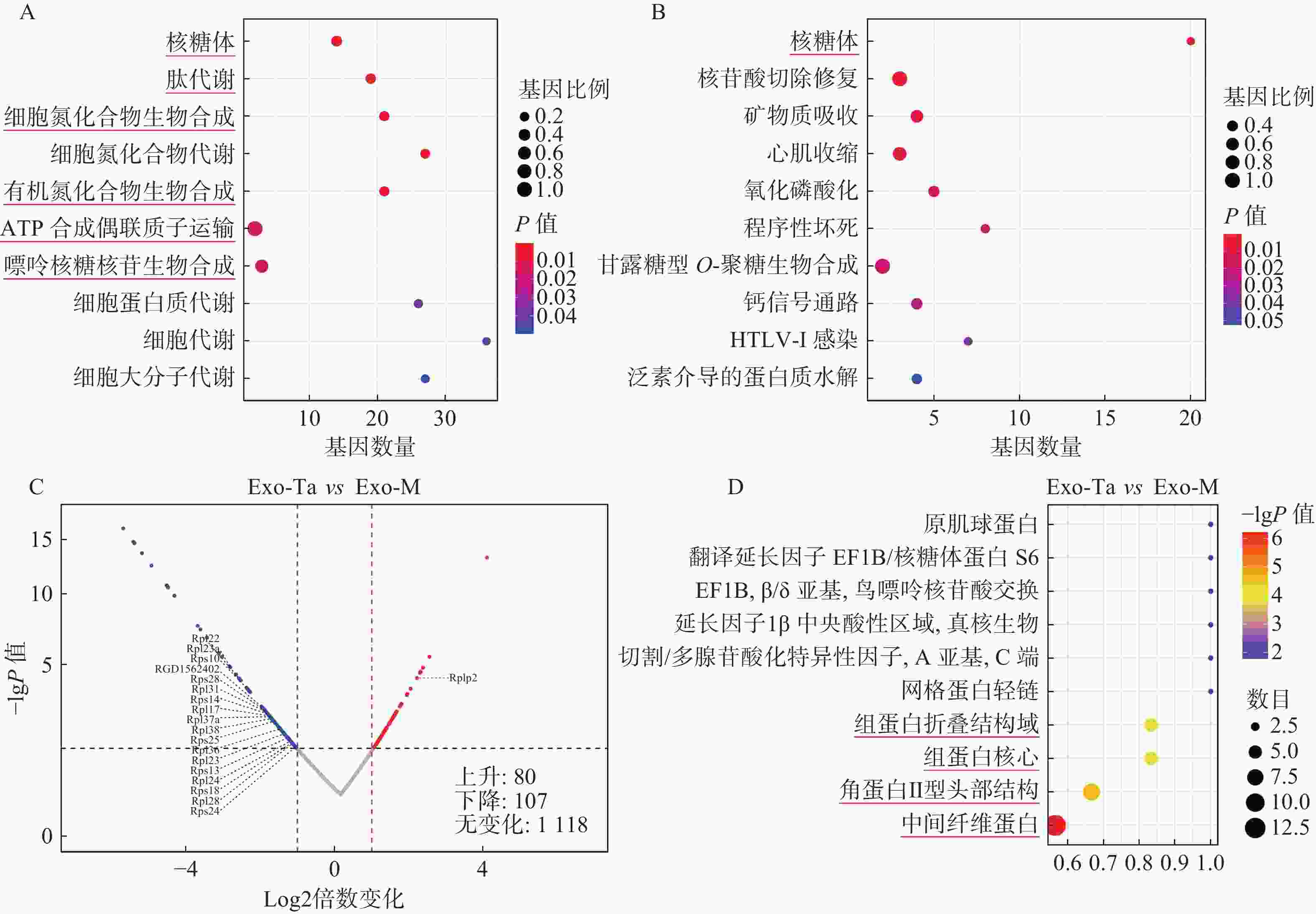
在蛋白组学检测中共鉴定并定量分析了
1439 种蛋白质,基于倍数变化(上调:>2.0,下调:<0.50)及P值<0.05的筛选标准,总共187种蛋白质在表达水平上发生了显著变化。相比未经任何处理的巨噬细胞分泌的外泌体(Exo-M),Exo-Ta中有80种蛋白质含量上调,107种蛋白质含量下调。KEGG通路富集分析结果表明有20种表达水平发生变化的蛋白质与核糖体的功能密切相关并富集于该通路。GO生物过程分析进一步揭示这些蛋白质与核糖体、肽代谢、细胞氮化合物的生物合成与代谢、有机氮化合物的生物合成、ATP合成偶联质子转运及嘌呤核苷的生物合成过程密切相关。InterPro结构域富集分析结果显示,中间纤维蛋白、Ⅱ型角蛋白头部、组蛋白核心及组蛋白折叠等结构域显著富集(图4)。 -
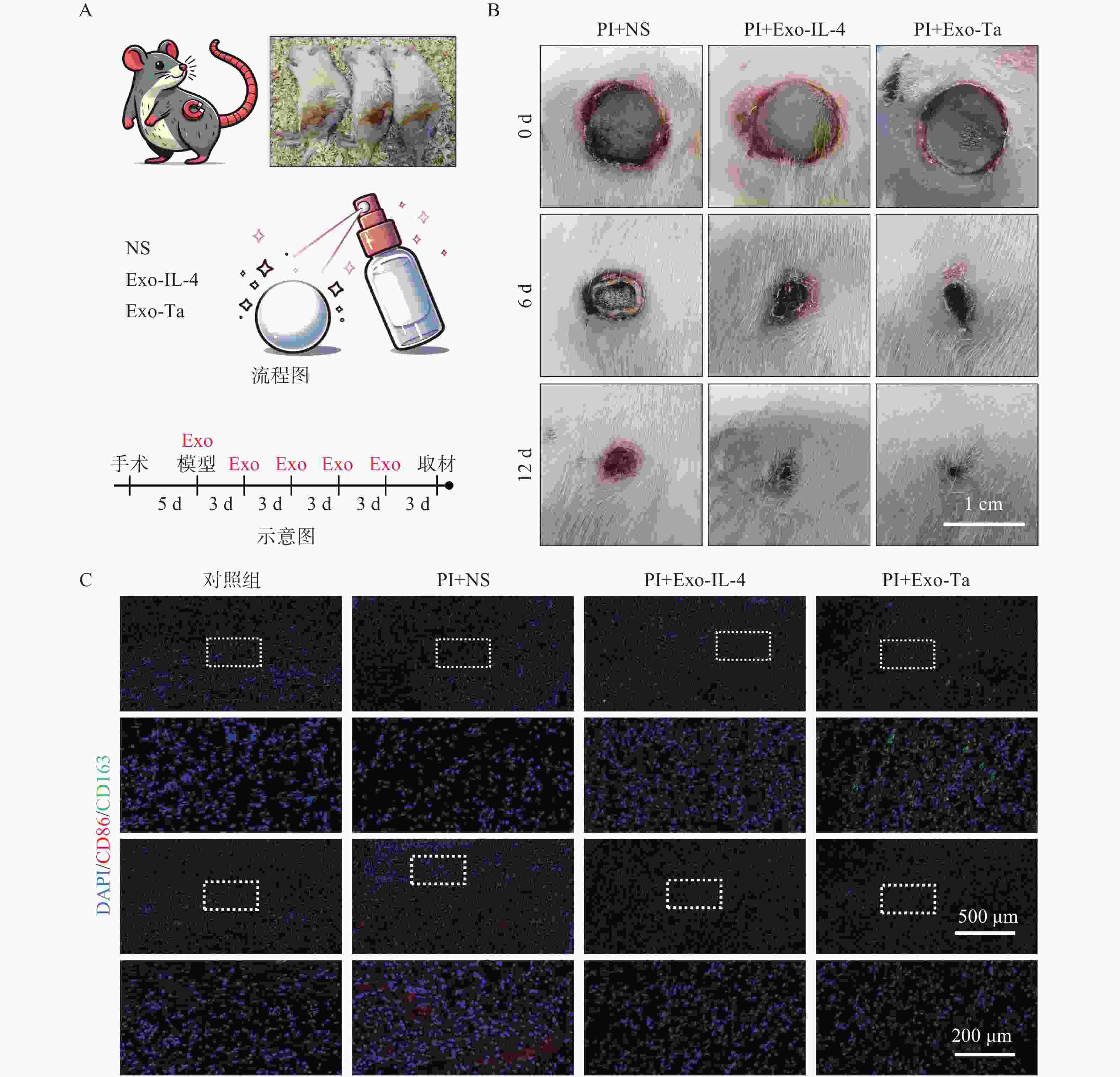
大鼠PI模型的构建及Exo-IL-4/Exo-Ta的应用时间线详见流程图(图5A)。将DIO标记的Exo-IL-4/Exo-Ta喷洒于创面表面。在治疗后第6天和第12天示用相机拍摄了大鼠创面的照片。与生理盐水处理组相比,Exo-IL-4/Exo-Ta处理组的大鼠表现出更显著的愈合效果,创面面积减少且局部炎症反应减轻(图5B)。组织的免疫荧光染色结果显示,与生理盐水组相比,外泌体处理组(Exo-IL-4/Exo-Ta)的CD86表达减少,而CD163表达增加。生理盐水组的CD86表达高于正常组,CD163表达则低于正常组(图5C)。
-
压力性损伤的特征是严重的组织炎症、持续的免疫反应和受损的愈合能力,尤其是M1型巨噬细胞的活化会加剧炎症,延缓组织修复。有研究表明,M2型巨噬细胞的外泌体在调节巨噬细胞极化和促进组织再生方面具有显著的治疗潜力。M2型巨噬细胞的外泌体(ExoMϕ-M2)已被证明可以通过IL-10/IL-10R通路促进成骨作用并抑制破骨细胞生成[15]。此外,M2型巨噬细胞的褪黑素修饰外泌体已被报道能够缓解慢性炎症、调控内质网应激并促进牙周组织再生[16]。
巨噬细胞的M2型极化常通过加入IL-4进行诱导,但该方法耗时长且成本较高。课题组前期实验与本研究均发现,Ta能够有效诱导巨噬细胞向M2型表型极化,为巨噬细胞的治疗应用提供了一种成本低且便捷的方法[11]。Ta颗粒具有优异的生物相容性、可重复使用性及优良的经济性,可以降低治疗成本。此外,细胞实验结果显示Exo-Ta能降低M1型巨噬细胞的炎症活性并增强成纤维细胞的基质分泌,效果与Exo-IL-4相当。因此,Ta颗粒在炎症调控和伤口修复中展现出独特作用,凸显了其作为一种安全、经济且广泛适用的治疗策略的潜力。
蛋白质组学分析揭示了Exo-Ta外泌体中的蛋白在介导其生物功能中的关键作用。Exo-Ta与Exo-M之间的显著差异蛋白表达表明,Exo-Ta可能携带的特定分子特征,从而赋予其独特的修复性能。20种差异蛋白在核糖体通路中的富集,突显了翻译调控在Exo-Ta功能活性中的重要性。已有研究表明,RPL38通过抑制METTL3-m6A介导的SOCS2表达促进骨关节炎进展,而其敲低则能缓解软骨细胞功能障碍[17];RPL17作为血管平滑肌细胞的生长抑制因子,其表达降低促进细胞增殖并加剧颈动脉内膜中层增厚[18];RPL36的减少可能降低miR-
4432 在细胞外囊泡中的负载,从而减轻其对脐带干细胞的抑制作用,进而改善静脉畸形中异常的血管周围细胞覆盖[19];RPL22在银屑病病灶中的过表达会驱动角质形成细胞的增殖加速和凋亡延迟,同时通过CXCL10的上调促进CD4+ T细胞募集,加剧炎症反应[20]。此外,GO分析揭示的肽代谢、含氮化合物生物合成及ATP合成等关键通路表明,细胞的代谢及生物合成活动发生了重新编程。这些通路与能量生产和大分子合成密切相关,是组织修复和再生的基础,可能为Exo-Ta增强组织修复效果提供了机制性解释。动物实验结果表明Exo-IL-4/Exo-Ta喷剂治疗通过减轻炎症反应与增强组织重塑促进压力性损伤的愈合。相较于生理盐水组,Exo-IL-4/Exo-Ta治疗组大鼠的创面面积显著缩小、炎性细胞浸润减少,CD86表达的降低及CD163含量的增多,进一步验证了Exo-IL-4/Exo-Ta在体内能够促进巨噬细胞向M2型极化,有利于炎症消退并加速组织修复进程。Exo-IL-4/Exo-Ta喷剂展现出优良的抗炎和组织修复能力,为巨噬细胞极化在伤口愈合中的应用提供了新的思路。
综上所述,本研究结果强调了基于Exo的治疗策略在PI修复中的潜在应用价值。Exo-M2通过调控炎症并促进组织再生,为伤口愈合提供了一种新思路。然而,本研究仍存在一定的局限性,Exo的具体作用机制尚未完全阐明,其蛋白及其他活性分子的功能特性需要进一步解析。未来研究重点是优化Exo的递送方式,探索不同递送体系在PI治疗中的适用性,并进一步解析Exo的分子组成,揭示驱动修复效应的特定功能蛋白或其他关键分子。
Therapeutic effects and mechanisms of M2 macrophage exosome spray on pressure injuries
-
摘要:
目的 探索由白介素-4(IL-4)与钽颗粒(Ta)诱导的M2型巨噬细胞外泌体制备的喷剂,在压力性损伤愈合中的作用及其潜在机制。 方法 骨髓来源的巨噬细胞经IL-4或Ta诱导为M2型巨噬细胞后提取外泌体(Exo-IL-4/Exo-Ta)。体外探索Exo-IL-4/Exo-Ta对M1型巨噬细胞表型与成纤维细胞基质分泌的调控作用。采用蛋白组学分析Exo-Ta作用的生物过程与调控网络。利用大鼠压力性损伤模型评价Exo-IL-4/Exo-Ta对创面愈合速率、炎症细胞浸润及胶原沉积的影响。 结果 体外实验中,Exo-IL-4/Exo-Ta能诱导M1型巨噬细胞向M2型转化,降低巨噬细胞促炎因子的分泌并促进抗炎物质的表达,提升成纤维细胞胶原蛋白和纤连蛋白的含量。蛋白组学结果表明,Exo-Ta主要参与能量代谢与大分子生物合成等生物学进程。体内实验中,Exo-IL-4/Exo-Ta喷剂能促进创面修复、减轻炎症浸润及改善组织重塑等。 结论 M2型巨噬细胞外泌体喷剂通过调控炎症反应和促进组织再生加速压力性损伤的愈合,具有优良的临床应用潜力。 Abstract:Objective To investigate the effects and underlying mechanisms of a spray prepared from exosomes derived from M2 macrophages induced by interleukin-4 (IL-4) and tantalum particles (Ta) on the healing of pressure ulcers. Methods Bone marrow-derived macrophages were polarized into M2 macrophages using IL-4 or Ta, and exosomes (Exo-IL-4/Exo-Ta) were extracted. The regulatory effects of Exo-IL-4/Exo-Ta on M1 macrophage phenotypes and fibroblast matrix secretion were evaluated in vitro. Proteomic analysis was conducted to explore the biological processes and regulatory networks associated with Exo-Ta. A rat pressure ulcer model was used to assess the effects of Exo-IL-4/Exo-Ta spray on wound healing rate, inflammatory cell infiltration, and collagen deposition. Results In vitro, Exo-IL-4/Exo-Ta induced the polarization of M1 macrophages to M2 macrophages, reduced the secretion of pro-inflammatory factors, and promoted the expression of anti-inflammatory substances. Additionally, Exo-IL-4/Exo-Ta enhanced the production of collagen and fibronectin in fibroblasts. Proteomic analysis revealed that Exo-Ta primarily participated in biological processes such as energy metabolism and macromolecule biosynthesis. In vivo, Exo-IL-4/Exo-Ta spray accelerated wound healing, reduced inflammatory infiltration, and improved tissue remodeling in the rat pressure ulcer model. Conclusion Exosome sprays derived from M2 macrophages could accelerate pressure ulcer healing by modulating inflammation and promoting tissue regeneration, which demonstrated excellent clinical application potential. -
Key words:
- exosome spray /
- pressure ulcers /
- M2 macrophages /
- tantalum
-
-
[1] WANG I, WALKER R M, GILLESPIE B M, et al. Risk factors predicting hospital-acquired pressure injury in adult patients: an overview of reviews[J]. Int J Nurs Stud, 2024, 150: 104642. doi: 10.1016/j.ijnurstu.2023.104642 [2] UDESHIKA PRIYADARSHANI SUGATHAPALA R D, LATIMER S, BALASURIYA A, et al. Prevalence and incidence of pressure injuries among older people living in nursing homes: a systematic review and meta-analysis[J]. Int J Nurs Stud, 2023, 148: 104605. doi: 10.1016/j.ijnurstu.2023.104605 [3] CHABOYER W, LATIMER S, PRIYADARSHANI U, et al. The effect of pressure injury prevention care bundles on pressure injuries in hospital patients: a complex intervention systematic review and meta-analysis[J]. Int J Nurs Stud, 2024, 155: 104768. doi: 10.1016/j.ijnurstu.2024.104768 [4] LI Y C, ZHU Z Y, LI S C, et al. Exosomes: compositions, biogenesis, and mechanisms in diabetic wound healing[J]. J Nanobiotechnology, 2024, 22(1): 398. doi: 10.1186/s12951-024-02684-1 [5] AL-MADHAGI H. The landscape of exosomes biogenesis to clinical applications[J]. Int J Nanomedicine, 2024, 19: 3657-3675. doi: 10.2147/IJN.S463296 [6] HE Y Z, YUE J Q, TENG Y W, et al. Tryptanthrin promotes pressure ulcers healing in mice by inhibiting macrophage-mediated inflammation via cGAS/STING pathways[J]. Int Immunopharmacol, 2024, 130: 111687. doi: 10.1016/j.intimp.2024.111687 [7] LUO M, ZHAO F K, CHENG H, et al. Macrophage polarization: an important role in inflammatory diseases[J]. Front Immunol, 2024, 15: 1352946. doi: 10.3389/fimmu.2024.1352946 [8] HUANG X, DENG Y F, XIAO J H, et al. Genetically engineered M2-like macrophage-derived exosomes for P. gingivalis-suppressed cementum regeneration: From mechanism to therapy[J]. Bioact Mater, 2023, 32: 473-487. [9] QIAN Y F, CHU G L, ZHANG L, et al. M2 macrophage-derived exosomal miR-26b-5p regulates macrophage polarization and chondrocyte hypertrophy by targeting TLR3 and COL10A1 to alleviate osteoarthritis[J]. J Nanobiotechnol, 2024, 22(1): 72. doi: 10.1186/s12951-024-02336-4 [10] CHEN Y L, WANG T, LIANG F X, et al. Nicotinamide phosphoribosyltransferase prompts bleomycin-induced pulmonary fibrosis by driving macrophage M2 polarization in mice[J]. Theranostics, 2024, 14(7): 2794-2815. doi: 10.7150/thno.94482 [11] YANG J J, GONG X Y, LI T, et al. Tantalum particles promote M2 macrophage polarization and regulate local bone metabolism via macrophage-derived exosomes influencing the fates of BMSCs[J]. Adv Healthc Mater, 2024, 13(17): e2303814. doi: 10.1002/adhm.202303814 [12] YUAN Y, TAKASHI E, HOU P, et al. Topical skin application of small-molecule antiplatelet agent against pressure injury in rat models[J]. Int J Mol Sci, 2024, 25(3): 1639. doi: 10.3390/ijms25031639 [13] GHANBARI M, SALKOVSKIY Y, CARLSON M A. The rat as an animal model in chronic wound research: an update[J]. Life Sci, 2024, 351: 122783. doi: 10.1016/j.lfs.2024.122783 [14] YANG J J, WANG X, FAN Y H, et al. Tropoelastin improves adhesion and migration of intra-articular injected infrapatellar fat pad MSCs and reduces osteoarthritis progression[J]. Bioact Mater, 2021, 10: 443-459. [15] CHEN X T, WAN Z, YANG L, et al. Exosomes derived from reparative M2-like macrophages prevent bone loss in murine periodontitis models via IL-10 mRNA[J]. J Nanobiotechnology, 2022, 20(1): 110. doi: 10.1186/s12951-022-01314-y [16] CUI Y, HONG S B, XIA Y H, et al. Melatonin engineering M2 macrophage-derived exosomes mediate endoplasmic reticulum stress and immune reprogramming for periodontitis therapy[J]. Adv Sci, 2023, 10(27): e2302029. doi: 10.1002/advs.202302029 [17] SHI L, HU H B, SUN P X, et al. RPL38 knockdown inhibits the inflammation and apoptosis in chondrocytes through regulating METTL3-mediated SOCS2 m6A modification in osteoarth-ritis[J]. Inflamm Res, 2022, 71(7-8): 977-989. doi: 10.1007/s00011-022-01579-x [18] SMOLOCK E M, KORSHUNOV V A, GLAZKO G, et al. Ribosomal protein L17, RpL17, is an inhibitor of vascular smooth muscle growth and carotid intima formation[J]. Circulation, 2012, 126(20): 2418-2427. doi: 10.1161/CIRCULATIONAHA.112.125971 [19] CHEN G H, REN J G, XIA H F, et al. Ribosomal protein L36-mediated selective loading of microRNA-4432 into extracellular vesicles contributes to perivascular cell dysfunction in venous malformations[J]. Br J Dermatol, 2025, 192(4): 717-727. doi: 10.1093/bjd/ljae492 [20] ZENG J R, ZHANG Y, ZHANG H Y, et al. RPL22 overexpression promotes psoriasis-like lesion by inducing keratinocytes abnormal biological behavior[J]. Front Immunol, 2021, 12: 699900. doi: 10.3389/fimmu.2021.699900 -




 下载:
下载: