-
卒中是世界范围内第二位致死、第三位致残的原因[1]。随着社会人口老龄化,卒中的发病率逐年增加,已成为严重威胁人类健康的公共卫生问题。缺血性卒中(ischemic stroke, IS)是我国最常见的卒中亚型,约占所有卒中的80%[2]。卒中后抑郁(post-stroke depression, PSD)是IS常见且严重的后遗症之一,发生率为11%~41%[3]。PSD的临床表现包括情绪低落或烦躁、精力下降、思维迟缓、言语动作减少以及睡眠障碍等,不仅严重影响患者功能康复、认知功能和生活质量,还增加自杀率[4-5]。目前,PSD的治疗包括药物和非药物治疗。对于抑郁症状持续存在或加重的患者,选择性5-羟色胺再摄取抑制剂(如氟西汀、帕罗西汀、舍曲林等)是首选抗抑郁药[6]。舍曲林作为临床常用的抗抑郁药物,临床疗效确切,但起效慢,改善认知功能作用有限。近年来,认知行为疗法、远程医疗、重复经颅磁刺激、护理干预等创新方法促进了PSD的治疗进步,药物治疗联合非药物治疗的综合方法往往可以获得更好的临床效果,减少不良反应[7]。
有氧运动作为IS患者常见的非药物治疗措施,可以显著增强神经可塑性,改善认知功能[8-9]。此外,最近的Meta分析[10]表明,有氧运动可以显著改善卒中患者的抑郁症状。其机制可能与有氧运动抑制卒中后神经炎症反应有关[11-12]。目前,关于有氧运动联合舍曲林在老年PSD患者中的应用报道较少。因此,本研究通过比较舍曲林与有氧运动联合舍曲林治疗老年PSD患者的临床疗效及对认知功能和炎性细胞因子的影响,为老年PSD患者的临床治疗决策提供参考。
-
选取 2022年6月至2024年12月徐州医科大学附属徐州市立医院收治的70例老年PSD患者。采用随机数字表法将患者分为对照组(舍曲林治疗)和试验组(有氧运动联合舍曲林治疗),各35例,疗程为8周。对照组年龄60~85岁,平均年龄(70.46±7.41)岁,女性15例,男性20例,BMI 17.00~35.00(23.60±4.31)kg/m2,卒中病程12~20(16.11±3.03)周;试验组年龄61~85岁,平均年龄(71.26±5.85)岁,女性11例,男性24例,BMI 19.72~34.60(25.27±3.86)kg/m2,卒中病程12~20(15.91±2.58)周。本研究获得徐州医科大学附属徐州市立医院伦理委员会批准(伦理批准号:xyyll[2023]003),每位患者及家属均签署知情同意书。
-
①年龄≥60岁;②符合IS的诊断标准[13];③符合PSD诊断标准,且汉密尔顿抑郁量表(HAMD)评分≥17分[14];④卒中发作后首次确诊抑郁;⑤临床资料完整。
-
①急性期卒中者;②合并严重心肺疾病、肝肾功能不全、自身免疫性疾病、全身炎症性疾病、恶性肿瘤等;③对舍曲林药物过敏者;④智力障碍或无法完成抑郁评估者;⑤既往有抑郁、癫痫病史者;⑥无法配合完成有氧运动。
-
两组患者均接受宣教、常规治疗脑卒中:①脑卒中的相关知识;②早期筛查、早期预防PSD的重要性;③常见的抗抑郁药物的用法及作用机制。所有患者给予瑞舒伐他汀钙片(批准文号:国药准字 H20080669,南京正大天晴制药有限公司),口服10 mg/次,1次/天;拜阿司匹林肠溶片(批准文号:国药准字 HJ20160685,拜耳有限公司),口服100 mg/次,1次/天。
-
对照组采用盐酸舍曲林片(批准文号:国药准字 H20204012,晖致制药有限公司)治疗,口服50 mg/次,1次/天,根据疗效调整用药剂量,最大剂量为200 mg/天,维持最低有效剂量持续治疗8周。
-
试验组在对照组的基础上联合有氧运动。由两名经培训后的护士对患者进行有氧运动训练,具体方法[15]如下:每节课开始时先进行10 min的热身,包括步行和躯干、四肢关节的静态伸展运动;然后进行多次中等强度的踏步运动(踩脚踏车或健身操),每次至少10 min,每次运动之间最多休息5 min;随后,进行类似于日常活动的各种简单的上肢运动(如洗脸、刷牙等),协助促进整体身体运动;训练结束时,进行10 min的冷却训练(≤与热身训练相同的步行和静态伸展运动)。有氧运动负荷的控制:心率=最大心率×(60%~75%)。最大心率=220-年龄(心率大约控制范围 120~140次/min)。训练时间为60 min/次,3次/周,共治疗8周。根据自我效能理论,采用动机策略(包括设定目标、口头鼓励及情绪激励),以确保患者的依从性。受试者入组后,不允许自行应用其他治疗脑梗死的药物。监测记录出勤率,提供练习日志,以便患者进行自我监测。
-
主要评价指标为抑郁症状改善情况、临床疗效、认知功能、血清炎性细胞因子水平以及治疗期间不良反应发生情况。
-
采用HAMD评估两组患者治疗前以及治疗后4周、8周的抑郁症状。HAMD包含17项内容,总分54分,≥17分为抑郁,分数越高提示抑郁症状越严重。
-
记录两组患者的临床疗效,以末次HAMD评分的减分率为依据,HAMD评分≤7分或减分率≥75%为痊愈,50%~74%为显效,25%~49%为有效,<25%为无效。总有效率=痊愈率+显效率+有效率。
-
采用简易智力状态检查量表(Mini-Mental State Examination Scale, MMES)评估两组患者治疗前以及治疗后4周、8周的认知功能。该量表共19个条目,总分30分,<27分提示存在认知功能障碍。
-
实验室检查血样于入院第二天早晨(6:00-7:00)采集,患者禁食过夜,取患者空腹肘静脉血3 ml,离心(5min,3000r/min)取血清,采用多功能酶标仪(美国伯腾公司)检测血清IL-1β, IL-6、TNF-α水平,检测方法为酶联免疫吸附法(试剂盒由武汉三鹰生物技术有限公司供应)。
-
采用SPSS 22.0统计学软件处理数据。服从正态分布的计量资料以
$ \overline{x} $ ± s表示,组间比较采用独立样本t检验,组内治疗前、后比较采用配对t检验;计数资料以例(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。 -
共纳入70例患者,两组患者基线资料比较,差异均无统计学意义(P>0.05),见表1。
表 1 两组老年卒中后抑郁患者基线资料比较
项目 对照组 试验组 t/χ2 P值 年龄(岁, $ \bar{x} $±s) 70.46±7.41 71.26±5.85 −0.502 0.618 性别(例,%) 0.979 0.322 男性 20(57.14) 24(68.57) 女性 15(42.86) 11(41.43) BMI(kg/m2, $ \bar{x} $±s) 23.60±4.31 25.27±3.86 −1.752 0.084 卒中病程(周, $ \bar{x} $±s) 16.11±3.03 15.91±2.58 0.297 0.767 -
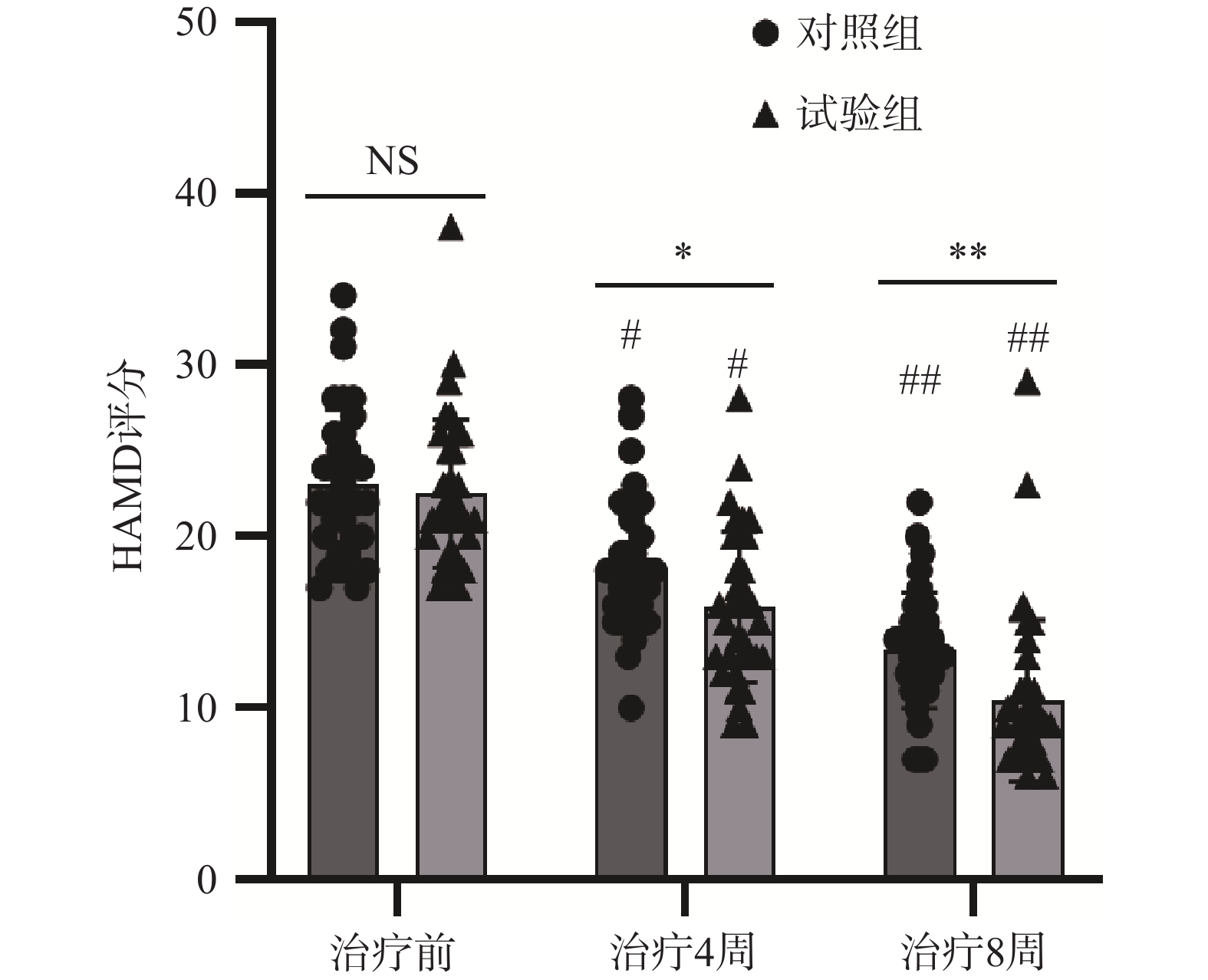
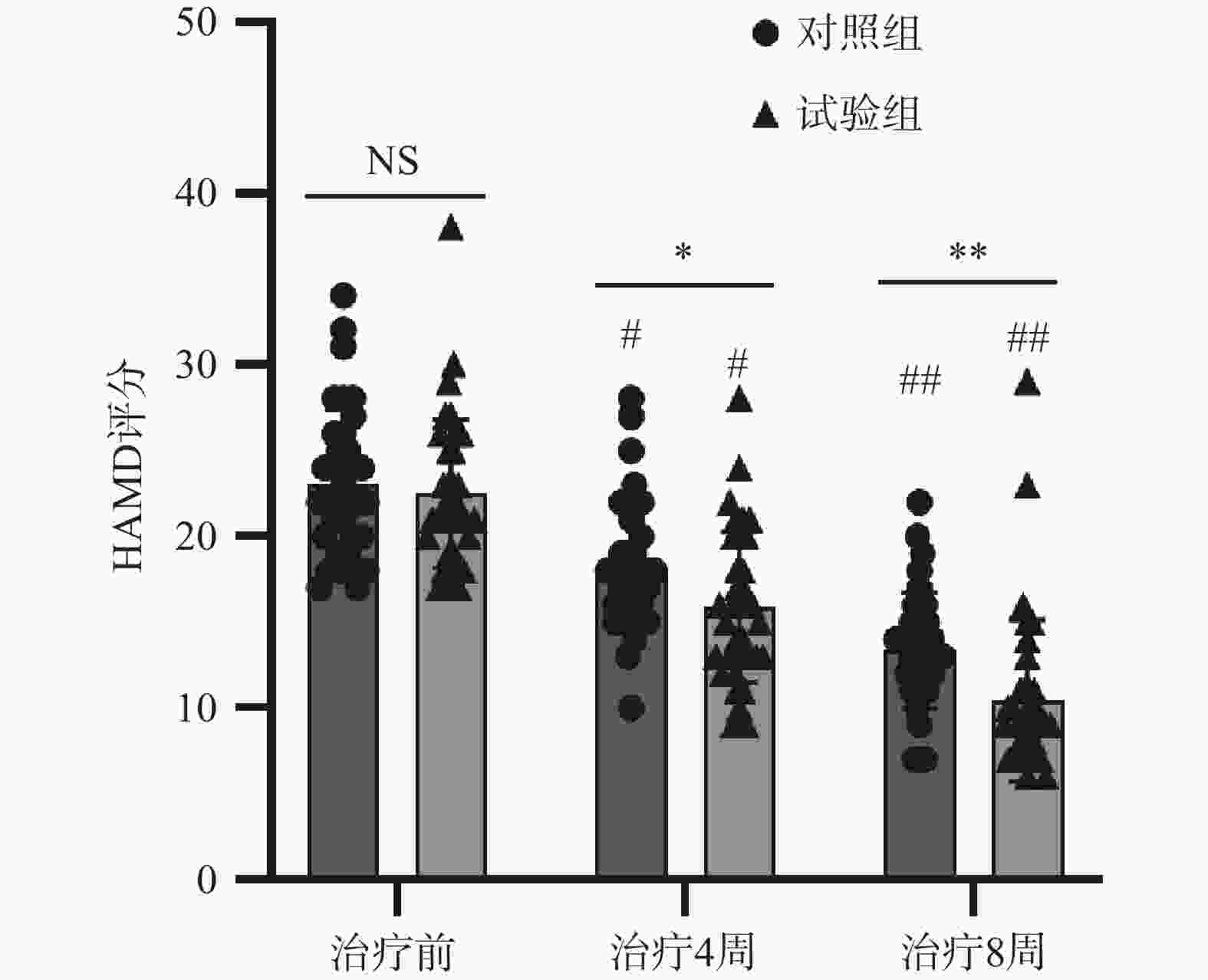
两组患者治疗前HAMD评分比较,差异无统计学意义(P>0.05)。两组患者治疗4、8周的HAMD评分均较治疗前明显下降,差异均有统计学意义(P<0.05);组间相比,试验组治疗4、8周的HAMD评分均低于实验对照组,差异均有统计学意义(P<0.05),见表2、图1。
表 2 两组老年卒中后抑郁患者HAMD评分比较(
$ \bar{x} $ ±s, 分)组别 例数 HAMD评分 t值 P值 治疗前 治疗4周 治疗8周 对照组 35 23.06±4.31 18.20±3.80# 13.37±3.40## 13.578/16.351 <0.001/<0.001 试验组 35 22.51±4.33 15.91±4.40#* 10.43±4.72##** 22.283/24.451 <0.001/<0.001 t值 0.526 2.327 2.995 P值 0.601 0.023 0.004 *P<0.05,**P<0.01,试验组与对照组比较;#P<0.05,##P<0.01与同组治疗前比较 -
试验组临床总有效率为94.29%,高于对照组的77.14%,差异有统计学意义(P<0.05),见表3。
表 3 两组老年卒中后抑郁患者临床总有效率比较[例(%)]
组别 例数 痊愈 显效 有效 无效 总有效 对照组 35 4(11.43) 15(42.86) 8(22.86) 8(22.86) 27(77.14) 试验组 35 10(28.57) 20(57.14) 3(8.57) 2(5.71) 33(94.29) χ2值 9.158 4.200 P值 0.027 0.040 -
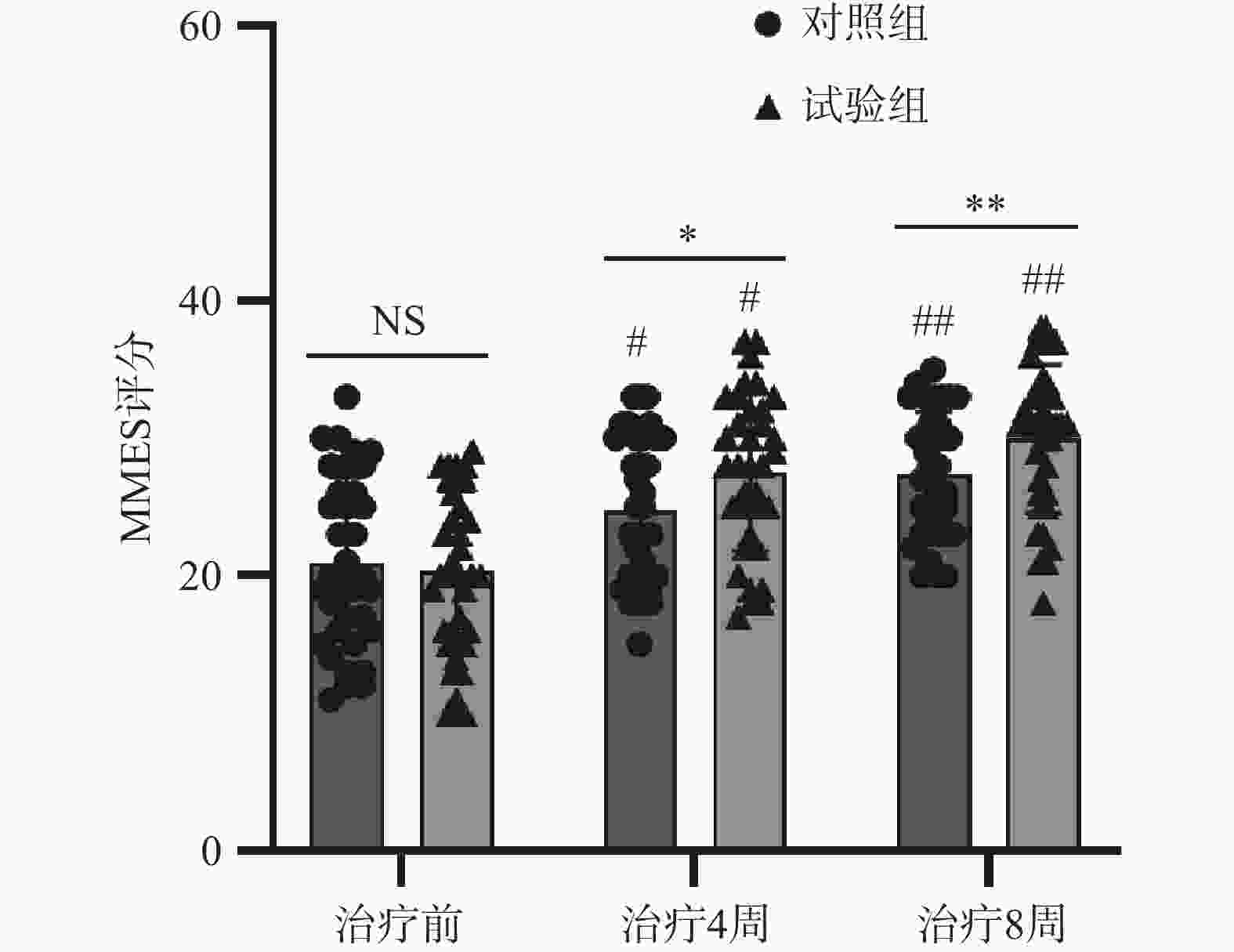
两组患者治疗前MMSE评分比较,差异无统计学意义(P>0.05)。两组患者治疗4、8周后的MMSE评分均较治疗前明显升高,差异均有统计学意义(P<0.05);组间相比,试验组治疗后MMSE评分高于对照组,差异均有统计学意义(P<0.05),见表4。
表 4 两组老年卒中后抑郁患者MMES评分比较(
$ \bar{x} $ ±s, 分)组别 例数 MMES评分 t值 P值 治疗前 治疗4周 治疗8周 对照组 35 19.86±5.23 23.20±4.14# 25.37±3.15## −9.296/−10.688 <0.001/<0.001 试验组 35 20.40±5.74 25.74±4.00#* 27.71±3.37##** −9.148/−10.153 <0.001/<0.001 t值 0.414 −2.614 −3.001 P值 0.680 0.011 0.004 *P<0.05,**P<0.01,试验组与对照组比较;#P<0.05,##P<0.01,与同组治疗前比较 -
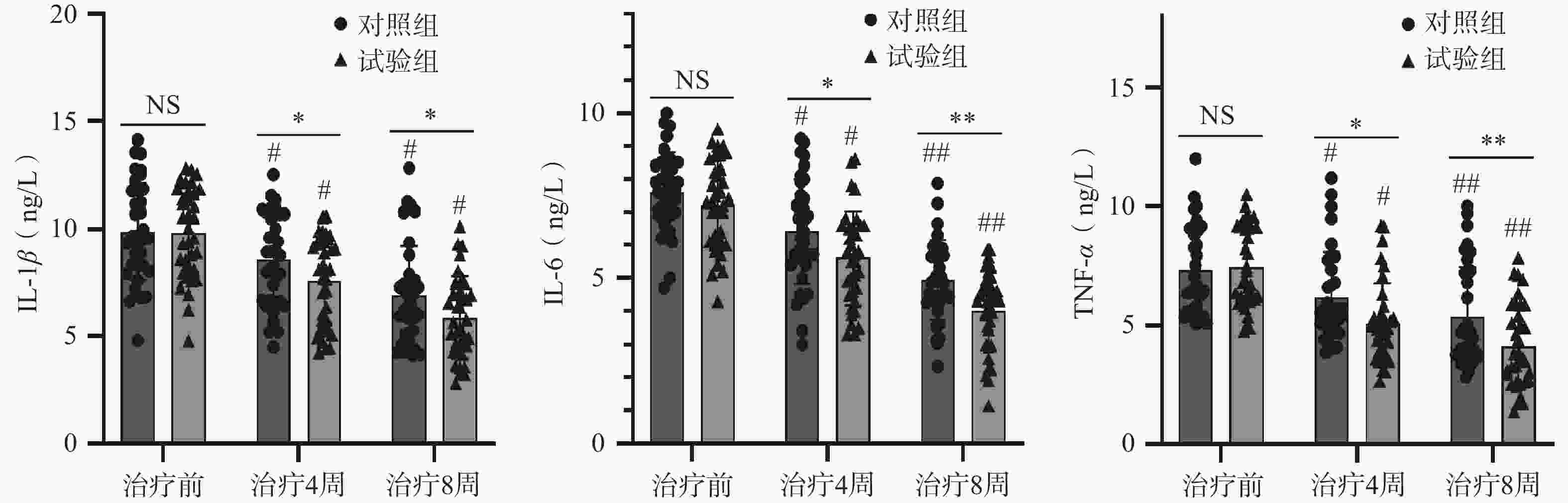
两组患者治疗后4周、8周的血清IL-1β、IL-6、TNF-α水平均较治疗前明显降低,差异均有统计学意义(P<0.05);组间相比,试验组治疗后4周、8周的血清IL-1β、IL-6、TNF-α水平均低于对照组,差异均有统计学意义(P<0.05),见表5。
表 5 两组老年卒中后抑郁患者血清炎性细胞因子水平比较(
$ \bar{x} $ ±s,ng/L)组别 例数 IL-1β t值 P值 治疗前 治疗4周 治疗8周 对照组 35 9.87±2.28 8.54±2.13# 6.91±2.28## 6.964/12.597 <0.001/<0.001 试验组 35 9.83±2.09 7.53±2.02#* 5.87±1.91##** 6.004/9.691 <0.001/<0.001 t值 0.084 2.109 2.072 P值 0.933 0.047 0.042 组别 例数 IL-6 t值 P值 治疗前 治疗4周 治疗8周 试验组 35 7.59±1.21 6.40±1.59# 4.95±1.21## 4.645/13.233 <0.001/<0.001 试验组 35 7.22±1.33 5.61±1.42#* 4.01±1.19##** 5.473/24.588 <0.001/<0.001 t值 1.222 2.213 3.277 P值 0.226 0.030 0.002 组别 例数 TNF-α t值 P值 治疗前 治疗4周 治疗8周 对照组 35 7.32±1.84 6.16±1.91# 5.35±2.10## 5.943/10.933 <0.001/<0.001 试验组 35 7.44±1.69 5.06±1.71#* 4.12±1.76##** 10.044/15.762 <0.001/<0.001 t值 -0.285 2.555 2.650 P值 0.777 0.013 0.010 *P<0.05,**P<0.01,试验组与对照组比较; #P<0.05,##P<0.01,与同组治疗前比较。 -
对照组有1例恶心,1例嗜睡,1例便秘;试验组有1例恶心,1例嗜睡,上述不良反应均在初期出现,程度均可耐受,不影响后续研究观察。两组不良反应发生率分别为8.57%、5.71%,差异无统计学意义(χ2=0.215,P=0.643)。
-
PSD是卒中患者常见并发症之一,卒中患者抑郁症的发生风险是正常人群的9倍[16]。PSD多发生于卒中后1年内,其中,约71%的PSD发生于卒中后3个月内[17]。由于对于PSD的重视不足,早期往往难以识别此类患者并进行治疗,给家庭和社会带来沉重的负担。因此,早期筛查、早期干预、早期治疗对于减少PSD的发生,改善患者生活质量的十分重要。PSD和卒中后认知功能障碍(PSCI)常重叠出现,相互影响,增加了早期筛查及治疗的复杂性。前瞻性研究[18]表明,PSD是PSCI的独立危险因素,32.2%的PSD患者合并PSCI。Williams等[19]的研究同样证实,卒中后6个月内的抑郁症状与认知障碍密切相关。舍曲林作为选择性5-羟色胺再摄取抑制剂,广泛应用于治疗PSD,可有效改善抑郁情绪,但改善认知功能的作用效果有限。药物治疗联合非药物治疗的综合方法可能为PSD的治疗提供新的方法[7]。有氧运动不仅可以显著改善卒中患者的认知功能[8-9],还可以改善患者抑郁症状[10]。本研究采用有氧运动联合舍曲林治疗PSD,探究该方案的疗效及对认知功能和炎性细胞因子的影响。
老年卒中患者日常活动较少、四肢关节灵活性差、骨骼强度下降,不适于高强度的功能锻炼。有氧运动作为一种廉价且容易操作的干预措施非常适合老年卒中患者的康复治疗,通过有目的、有规律的运动可以提高患者的氧摄取能力,有利于患者的康复。本研究结果表明,与对照组比较,采用有氧运动联合舍曲林治疗后的患者HAMD评分更低,MMSE评分更高,临床总有效率更高,提示有氧运动联合舍曲林有助于减轻抑郁症状,改善认知功能,提高临床疗效。与既往研究结果一致。VanDerwerker等[20]研究表明,有氧运动联合重复经颅磁刺激可以改善PSD患者的抑郁症状,步行能力提高50%以上。另一项前瞻性研究[21]表明,中等强度的有氧运动可以显著改善PSCI患者的认知功能及记忆力。
炎症反应已成为PSD、PSCI病理生理机制的研究热点之一。脑梗死后,由于脑微血管内皮细胞的激活及血脑屏障的破坏,IL-1β、IL-6和TNF-α等促炎性细胞因子释放;同时,在梗死灶及周边组织开始出现激活的胶质细胞并伴有多种外周免疫细胞的浸润,逐渐形成全脑炎症环境,从而加速血脑屏障破坏、脑水肿和微循环障碍,造成继发性脑损伤。抑制卒中后的神经炎症反应是预防PSD、PSCI的潜在机制之一。Tang等[11]研究发现,有氧运动通过激活SIRT1/BDNF/MTORC1信号通路,抑制L-1β、IL-6和TNF-α的表达,提高突触可塑性并增强星形胶质细胞活性,从而减少卒中后抑郁样行为。另一项动物实验[12]表明,有氧运动可以增加PSD模型大鼠海马区BDNF/probDNF比值,促进神经发生,从而改善抑郁样行为。本研究结果表明,联合治疗能更有效地降低患者血清IL-1β、IL-6和TNF-α水平。尽管本研究未检测治疗前后炎症因子的正常参考范围,且这些指标水平的绝对下降幅度看似有限,但在病理状态下,即使是正常范围内的波动也可能具有生物学意义。本研究中观察到的具有统计学意义的炎症因子水平下降,很可能反映了有氧运动协同舍曲林有效缓解了卒中后的全身性及神经炎症状态,这或许是其改善抑郁和认知功能的重要机制之一。未来研究可进一步明确这些炎症因子变化与临床改善程度之间的量效关系。本研究中两组不良反应发生率差异无统计学意义,表明有氧运动联合舍曲林未增加不良反应,安全性较好。
综上所述,有氧运动联合舍曲林治疗老年PSD有助于减轻抑郁症状,提高临床疗效,改善认知功能,减轻炎性细胞因子表达水平,安全可靠。本研究存在以下不足:作为回顾性研究,难免存在研究对象的选择偏倚;其次,随访时间较短、缺乏更加详尽的临床资料及数据挖掘、样本量较少,可能造成假阳性或假阴性。需开展大样本、多中心、前瞻性的临床研究,进一步验证有氧运动联合舍曲林治疗老年PSD的临床疗效。
The efficacy of aerobic exercise combined with sertraline in the treatment of elderly patients with post-stroke depression, and its effect on cognitive function and inflammatory cytokine
-
摘要:
目的 探讨有氧运动联合舍曲林治疗老年卒中后抑郁(PSD)的疗效,评估其对认知功能和炎性细胞因子的影响。 方法 选取 2022年6月至2024年12月徐州医科大学附属徐州市立医院收治的70例老年PSD患者。采用随机数字表法将患者分为对照组(舍曲林治疗)和试验组(有氧运动联合舍曲林治疗),各35例,疗程为8周。比较2组治疗前和治疗4、8周的汉密尔顿抑郁量表(HAMD)评分,评估临床疗效;比较治疗前后的认知功能[简易智力状态检查量表(MMSE)]和炎性细胞因子[白介素-1β(IL-1β)、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)]水平。 结果 治疗前 2组患者基线资料差异均无统计学意义,治疗后4周、8周的HAMD评分均较治疗前明显降低,差异均有统计学意义(P<0.05);组间相比,试验组治疗后4周、8周的HAMD评分均小于对照组,差异均有统计学意义(P值均<0.05)。试验组临床总有效率为94.29%,高于对照组的77.14%,差异有统计学意义(P<0.05)。2组患者治疗后4周、8周的MMSE评分均较治疗前明显升高,差异均有统计学意义(P值均<0.05);组间相比,试验组治疗后4周、8周的MMSE评分均小于对照组,差异均有统计学意义(P值均<0.05)。2组患者治疗后4周、8周的血清IL-1β、IL-6、TNF-α均较治疗前明显降低,差异均有统计学意义(P值均<0.05);组间相比,试验组治疗后4周、8周的血清IL-1β、IL-6、TNF-α均低于对照组,差异均有统计学意义(P值均<0.05)。2组不良反应发生率分别为8.57%、5.71%,差异无统计学意义(P>0.05)。 结论 有氧运动联合舍曲林治疗老年PSD有助于减轻抑郁症状,提高临床疗效,改善认知功能,减轻炎性细胞因子表达水平,安全可靠。 Abstract:Objective To investigate the efficacy of aerobic exercise combined with sertraline in the treatment of post-stroke depression (PSD) in elderly patients and its effects on cognitive function and inflammatory cytokines. Methods 70 elderly PSD patients admitted to the Xuzhou Municipal Hospital affiliated with Xuzhou Medical University from June 2022 to December 2024 were selected as study objects. Patients were randomly divided into control group treated with sertraline and study group treated with aerobic exercise combined with sertraline. The treatment duration was 8 weeks. The Hamilton Depression Rating Scale (HAMD) scores, the clinical efficacy, cognitive function [Mini Mental State Examination (MMSE)], and the levels of inflammatory cytokines (IL-1β, IL-6, TNF-α) were compared before and after treatment. Results No significant differences in baseline data were observed between the two groups before treatment. After 4 and 8 weeks of treatment, HAMD scores were significantly decreased compared to baseline in both groups (all P<0.05). The study group showed significantly lower HAMD scores than the control group at both 4 and 8 weeks (all P<0.05). The overall clinical effective rate was significantly higher in the study group (94.29%) than in the control group (77.14%)(P<0.05). MMSE scores were significantly increased compared to baseline in both groups at 4 and 8 weeks(all P<0.05), and the study group demonstrated significantly higher MMSE scores than the control group at both time points (all P<0.05). Similarly, serum levels of IL-1β, IL-6, and TNF-α were significantly reduced from baseline in both groups at 4 and 8 weeks (all P<0.05). The reductions in these inflammatory cytokine levels were significantly greater in the study group compared to the control group (all P<0.05). The incidence of adverse reactions was 8.57% in the control group and 5.71% in the study group, with no statistically significant difference (P>0.05). Conclusion The combination of aerobic exercise and sertraline is a safe and reliable therapeutic strategy for elderly PSD patients, alleviating depressive symptoms, improving cognitive function, and reducing systemic inflammation. -
Key words:
- aerobic exercise /
- sertraline /
- post-stroke depression /
- cognitive function /
- inflammatory cytokine
-
表 1 两组老年卒中后抑郁患者基线资料比较
项目 对照组 试验组 t/χ2 P值 年龄(岁, $ \bar{x} $ ±s)70.46±7.41 71.26±5.85 −0.502 0.618 性别(例,%) 0.979 0.322 男性 20(57.14) 24(68.57) 女性 15(42.86) 11(41.43) BMI(kg/m2, $ \bar{x} $ ±s)23.60±4.31 25.27±3.86 −1.752 0.084 卒中病程(周, $ \bar{x} $ ±s)16.11±3.03 15.91±2.58 0.297 0.767 表 2 两组老年卒中后抑郁患者HAMD评分比较(
$ \bar{x} $ ±s, 分)组别 例数 HAMD评分 t值 P值 治疗前 治疗4周 治疗8周 对照组 35 23.06±4.31 18.20±3.80# 13.37±3.40## 13.578/16.351 <0.001/<0.001 试验组 35 22.51±4.33 15.91±4.40#* 10.43±4.72##** 22.283/24.451 <0.001/<0.001 t值 0.526 2.327 2.995 P值 0.601 0.023 0.004 *P<0.05,**P<0.01,试验组与对照组比较;#P<0.05,##P<0.01与同组治疗前比较 表 3 两组老年卒中后抑郁患者临床总有效率比较[例(%)]
组别 例数 痊愈 显效 有效 无效 总有效 对照组 35 4(11.43) 15(42.86) 8(22.86) 8(22.86) 27(77.14) 试验组 35 10(28.57) 20(57.14) 3(8.57) 2(5.71) 33(94.29) χ2值 9.158 4.200 P值 0.027 0.040 表 4 两组老年卒中后抑郁患者MMES评分比较(
$ \bar{x} $ ±s, 分)组别 例数 MMES评分 t值 P值 治疗前 治疗4周 治疗8周 对照组 35 19.86±5.23 23.20±4.14# 25.37±3.15## −9.296/−10.688 <0.001/<0.001 试验组 35 20.40±5.74 25.74±4.00#* 27.71±3.37##** −9.148/−10.153 <0.001/<0.001 t值 0.414 −2.614 −3.001 P值 0.680 0.011 0.004 *P<0.05,**P<0.01,试验组与对照组比较;#P<0.05,##P<0.01,与同组治疗前比较 表 5 两组老年卒中后抑郁患者血清炎性细胞因子水平比较(
$ \bar{x} $ ±s,ng/L)组别 例数 IL-1β t值 P值 治疗前 治疗4周 治疗8周 对照组 35 9.87±2.28 8.54±2.13# 6.91±2.28## 6.964/12.597 <0.001/<0.001 试验组 35 9.83±2.09 7.53±2.02#* 5.87±1.91##** 6.004/9.691 <0.001/<0.001 t值 0.084 2.109 2.072 P值 0.933 0.047 0.042 组别 例数 IL-6 t值 P值 治疗前 治疗4周 治疗8周 试验组 35 7.59±1.21 6.40±1.59# 4.95±1.21## 4.645/13.233 <0.001/<0.001 试验组 35 7.22±1.33 5.61±1.42#* 4.01±1.19##** 5.473/24.588 <0.001/<0.001 t值 1.222 2.213 3.277 P值 0.226 0.030 0.002 组别 例数 TNF-α t值 P值 治疗前 治疗4周 治疗8周 对照组 35 7.32±1.84 6.16±1.91# 5.35±2.10## 5.943/10.933 <0.001/<0.001 试验组 35 7.44±1.69 5.06±1.71#* 4.12±1.76##** 10.044/15.762 <0.001/<0.001 t值 -0.285 2.555 2.650 P值 0.777 0.013 0.010 *P<0.05,**P<0.01,试验组与对照组比较; #P<0.05,##P<0.01,与同组治疗前比较。 -
[1] GBD 2019 STROKE COLLABORATORS. Global, regional, and national burden of stroke and its risk factors, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet Neurol, 2021, 20(10): 795-820. doi: 10.1016/S1474-4422(21)00252-0 [2] 宗宁宁, 张思源, 谭逸, 等. 近10年中国缺血性卒中治疗和预防进展[J]. 国际脑血管病杂志, 2022, 30(12): 881-889. [3] GUO J L, WANG J J, SUN W, et al. The advances of post-stroke depression: 2021 update[J]. J Neurol, 2022, 269(3): 1236-1249. doi: 10.1007/s00415-021-10597-4 [4] CAI W, MUELLER C, LI Y J, et al. Post stroke depression and risk of stroke recurrence and mortality: a systematic review and meta-analysis[J]. Ageing Res Rev, 2019, 50: 102-109. doi: 10.1016/j.arr.2019.01.013 [5] ZHANG S M, WANG A R, ZHU W F, et al. Meta-analysis of risk factors associated with suicidal ideation after stroke[J]. Ann Gen Psychiatry, 2022, 21(1): 1. doi: 10.1186/s12991-021-00378-8 [6] 王梅杰, 邓雨芳, 周翔, 等. 加拿大《最佳实践建议: 卒中后抑郁、认知、疲劳》解读[J]. 中国全科医学, 2021, 24(17): 2214-2217. [7] RAGGI A, SERRETTI A, FERRI R. A comprehensive overview of post-stroke depression treatment options[J]. Int Clin Psychopharmacol, 2024, 39(3): 127-138. doi: 10.1097/YIC.0000000000000532 [8] PENNA L G, PINHEIRO J P, RAMALHO S H R, et al. Effects of aerobic physical exercise on neuroplasticity after stroke: systematic review[J]. Arq Neuro-Psiquiatr, 2021, 79(9): 832-843. doi: 10.1590/0004-282x-anp-2020-0551 [9] LI X G, GENG D, WANG S Y, et al. Aerobic exercises and cognitive function in post-stroke patients: a systematic review with meta-analysis[J]. Medicine, 2022, 101(41): e31121. doi: 10.1097/MD.0000000000031121 [10] YANG Z X, QIN S K, LI J X, et al. The effect of exercise interventions on reducing the risk of depressive and cognitive disorders in post-stroke: a systematic review and meta-analysis[J]. Front Neurol, 2025, 16: 1564347. doi: 10.3389/fneur.2025.1564347 [11] TANG J Z, LU L N, YUAN J B, et al. Exercise-induced activation of SIRT1/BDNF/mTORC1 signaling pathway: a novel mechanism to reduce neuroinflammation and improve post-stroke depression[J]. Actas Esp Psiquiatr, 2025, 53(2): 366-378. doi: 10.62641/aep.v53i2.1838 [12] LUO L, LI C Q, DU X X, et al. Effect of aerobic exercise on BDNF/proBDNF expression in the ischemic hippocampus and depression recovery of rats after stroke[J]. Behav Brain Res, 2019, 362: 323-331. doi: 10.1016/j.bbr.2018.11.037 [13] 倪小佳, 林浩, 罗旭飞, 等. 脑卒中中西医结合防治指南(2023版)[J]. 中国全科医学, 2025, 28(5): 521-533. [14] 魏艳艳, 尹璐, 徐海婷, 等. 中文版双相抑郁评估量表信效度及最佳界值[J]. 中国神经精神疾病杂志, 2021, 47(12): 710-715. doi: 10.3969/j.issn.1002-0152.2021.12.002 [15] SONG D, YU D S F. Effects of a moderate-intensity aerobic exercise programme on the cognitive function and quality of life of community-dwelling elderly people with mild cognitive impairment: a randomised controlled trial[J]. Int J Nurs Stud, 2019, 93: 97-105. doi: 10.1016/j.ijnurstu.2019.02.019 [16] JØRGENSEN T S H, WIUM-ANDERSEN I K, WIUM-ANDERSEN M K, et al. Incidence of depression after stroke, and associated risk factors and mortality outcomes, in a large cohort of Danish patients[J]. JAMA Psychiatry, 2016, 73(10): 1032-1040. doi: 10.1001/jamapsychiatry.2016.1932 [17] LIU L, XU M, MARSHALL I J, et al. Prevalence and natural history of depression after stroke: a systematic review and meta-analysis of observational studies[J]. PLoS Med, 2023, 20(3): e1004200. doi: 10.1371/journal.pmed.1004200 [18] LI Y, TANG A J, GE L L, et al. The relationship between social and psychological factors with cognitive impairment after stroke: a prospective study[J]. Front Psychiatry, 2024, 15: 1403027. doi: 10.3389/fpsyt.2024.1403027 [19] WILLIAMS O A, DEMEYERE N. Association of depression and anxiety with cognitive impairment 6 months after stroke[J]. Neurology, 2021, 96(15): e1966-e1974. doi: 10.1212/wnl.0000000000011748 [20] VANDERWERKER C J, ROSS R E, STIMPSON K H, et al. Combining therapeutic approaches: rTMS and aerobic exercise in post-stroke depression: a case series[J]. Top Stroke Rehabil, 2018, 25(1): 61-67. doi: 10.1080/10749357.2017.1374685 [21] Huang YL, Ou HN, Zhao WJ, et al. The effects of moderate-intensity aerobic exercise on cognitive function in individuals with stroke-induced mild cognitive impairment: a randomized controlled pilot study[J]. J Rehabil Med, 2024, 56: jrm33001. -




 下载:
下载: