-
西罗莫司(SRL)是第三代大环内酯类免疫抑制剂,临床上广泛应用于器官移植术后的抗排斥反应,以及自身免疫性疾病的治疗[1-2],需长期服用。但是由于其治疗窗窄(5~15 ng/ml)[3],在水中的溶解度仅为1.73 μg/ml[4],属于典型的难溶性药物,且个体差异大,不良反应发生率高。因此,提高药物溶解度并将其制成缓释片有望改善药物的利用与吸收,减轻毒副作用,提高移植术后患者的生活质量。课题组前期利用自微乳给药系统(SMEDDS)成功制备SRL-SMEDDS,该难溶性药物的溶出度得到了极大的提高[5],但自微乳需用软胶囊装填,贮存要求高,如果放置时间过长则胶囊壳易变硬,影响其崩解和自乳化[6-7]。所以本课题组进一步采用具有良好的生物相容性、较大的孔径、极大的比表面积等特点的药物载体-介孔硅(MS)将其吸附固化[4, 8],并成功制得具有良好缓释特性的西罗莫司自微乳-介孔硅缓释片[9]。
体外溶出是考察制剂处方中药物的主成分的溶出或释放情况,作为评价药物制剂质量的重要指标,并以此为依据进行药物制剂的研发[10]。综上所述,本研究旨在考察、评估西罗莫司自微乳-介孔硅缓释片的制剂质量及其体外释药影响因素,以期为相关制剂的深入研究、生产等提供科学依据。
-
TP-5型单冲压片机生产于上海天凡药机制造厂;Agilent 1200型高效液相色谱系统(美国Agilent公司);RCZ-6BZ型智能溶出仪、YPD-200C型片剂硬度仪、CJY-300B型片剂脆碎度测试仪(上海黄海药检仪器有限公司)。
-
SRL原料药(含量99.5%)、SRL对照品(含量99.9%),购买于福建科瑞药业有限公司。SRL-SMEDDS、SBA-15、缓释片的制备相关材料具体信息参考本课题组前期发表文章[9]。
-
色谱柱:Eclipse XDB-C18(4.6 mm× 250 mm,5 μm),美国Agilent公司,具体检测条件参考本课题组前期的设定[9]。配置SRL对照品溶液,浓度分别为2.5、5、10、15、20、25 μg/ml,考察其线性关系。制备不同浓度的SRL样品溶液,分别为5.00、10.00、15.00 μg/ml,每个浓度连续进样6次,计算相对标准偏差(RSD)值,以评估方法的精密度。精密称取含2.00 mg药物的样品溶液,分别加入1.60、2.00、2.40 mg SRL各3份,进行回收率的考察。
-
基于本课题组前期所优化的处方制备SRL-SMEDDS[5, 11],参考Zhao[12]等的方法制备SBA-15,采用物理搅拌法制备西罗莫司自微乳-介孔硅[1∶1(w/w)]。辅料过80目筛备用。精密称取处方量的各辅料,混合搅拌均匀,采用粉末直接压片法制备缓释片[9]。本课题组前期通过单因素考察及星点设计实验优化得到的缓释片最佳处方为:SRL-SMEDDS-SBA-15的用量为162 mg;HPMC-K4M的用量为80 mg;CMS-Na的用量为80 mg;MCC的用量为168 mg[9]。
-
参考2020年版《中国药典》四部通则0101相关规定,对自制缓释片进行硬度、脆碎度及含量均匀度考察。硬度的检查:取自制缓释片6片,使用硬度测量仪进行硬度的测量。脆碎度的检查:取缓释片14片,使用吹风机清除表面的松散粉末,然后精确称重x1,并将它们置入片剂脆碎度仪的转筒内,转动100次。完成后取出片剂,重复上述粉末清除和称重过程得x2,通过计算两次称重的差值得出减失重量百分比(%),以此来评估缓释片的脆碎度。含量均匀度的检查:取10片缓释片,对每片进行含量测定(每片标示量为100%的标准)得xi,计算其均值x和标准差s,以及标示量与均值之差的绝对值A(A=|100−x|),代入相应公式,进行含量均匀度的测算。
-
分别考察不同直径大小(10、11、12 mm)、不同硬度(50、70、90 N)、不同转速(50、75、100 r/min)、不同溶出方法(篮法、桨法)、不同pH值的释放介质[分别为1.2、4.5、6.8的蒸馏水溶液、0.4%十二烷基硫酸钠(SDS)溶液]对缓释片体外释药行为的影响。
-
结果表明,在设定的色谱条件下,所测得标准曲线为Y=59.445X−4.559 5,r=0.999 9,表明在2.5~25 μg/ml的浓度范围内,该测定方法展现出了良好的线性关系。在低、中、高3个浓度下,所测得的RSD值分别为0.61%、0.58%、0.23%。各样品的回收率在98.83%~101.36%之间,说明该方法的精密度及准确度均表现良好。
-
取6片自制缓释片,所测得的硬度结果如表1,其平均硬度为70.33 N。
表 1 西罗莫司自微乳-介孔硅缓释片的硬度
序号 1 2 3 4 5 6 x ± s 硬度(N) 73 69 70 67 75 68 70.33±2.81 -
取14片自制缓释片,进行脆碎度的检查结果见表2。根据2020年版《中国药典》四部通则0923规定,减失重量不得超过1%。因此,缓释片的脆碎度检查合格。
表 2 脆碎度结果
x1(m/mg) x2(m/mg) 减失重量(%) 6 726 6 683 0.64 -
根据2020年版《中国药典》四部通则0941相关规定,取自制缓释片10片,进行含量均匀度检查,所测得每片含药百分比均值为101.00%,标准偏差为0.012%,A+2.2s=1.03≤15。因此,缓释片的含量均匀度检查合格。
-
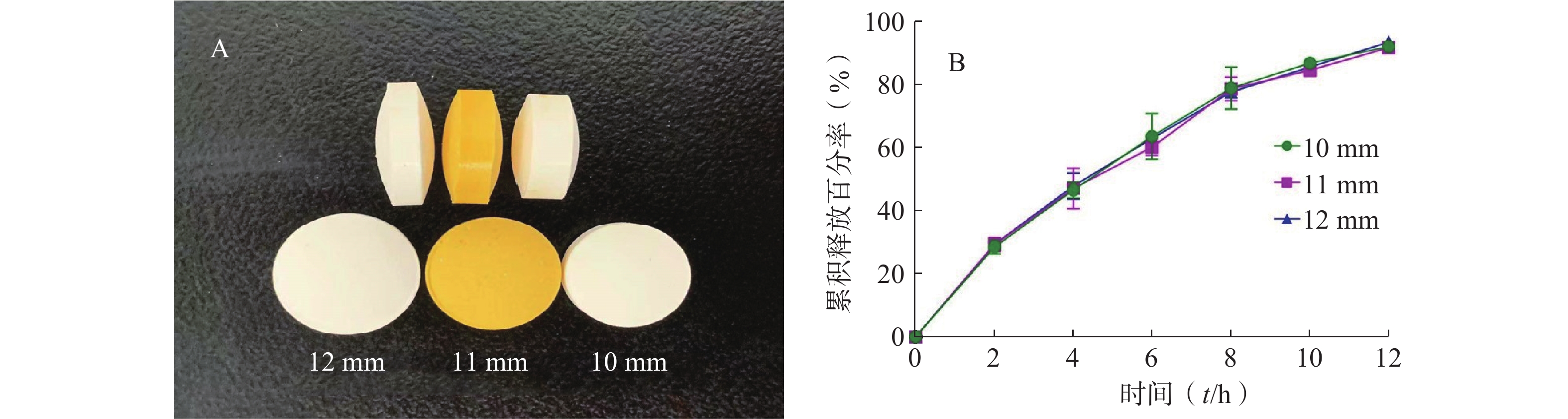
考察不同直径(10、11、12 mm)对缓释片体外释药行为的影响(图1),由图可知,直径的大小对缓释片体外释药行为没有影响。
-
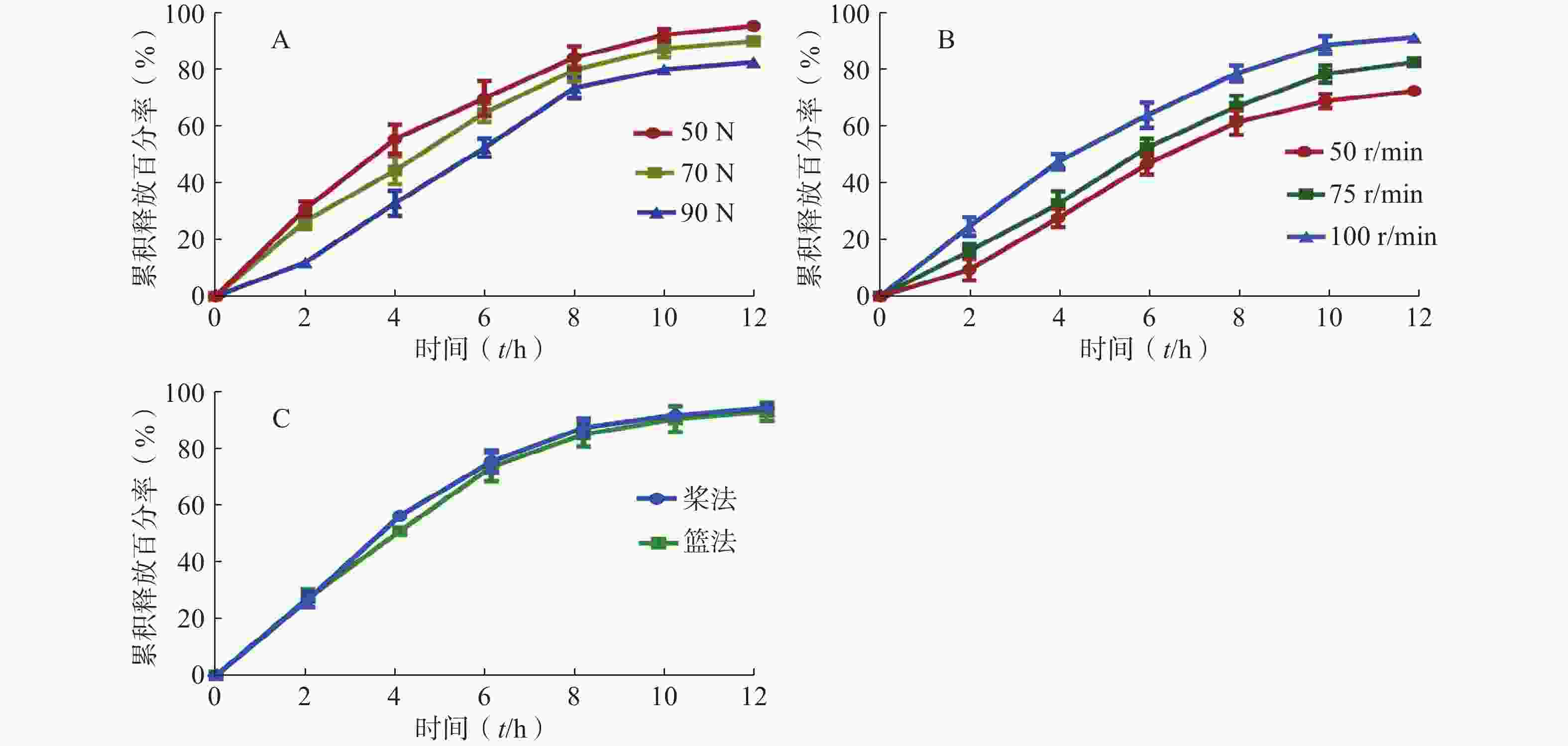
考察当缓释片的硬度分别为50、70、90 N,对其体外释药行为的影响(图2A)。硬度对释药行为的影响相对较大,随着硬度的增加,缓释片的释药速率变慢,且12 h累积释放百分率变小。
-
采用篮法考察不同转速(50、75、100 r/min),对药物释药行为的影响(图2B)。由图可知,随着转速增大,药物释放速率加快,12 h累积释放百分率随之变大。
-
采用不同的溶出方法,分别是桨法和篮法,考察缓释片体外释药行为的影响(图2C)。由图可知,溶出方法对缓释片的体外释药行为无影响。
-
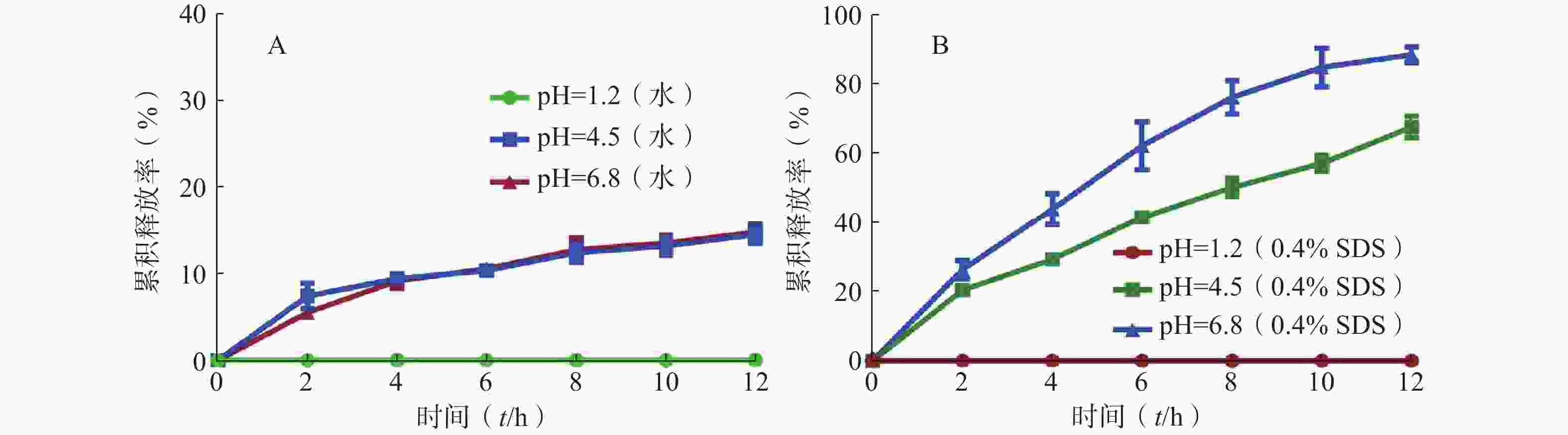
以蒸馏水为溶质,分别调配pH为1.2、4.5、6.8的释放介质,模拟缓释片在胃肠道中的体外释放情况(图3A)。由图可知,溶液pH为1.2时,西罗莫司发生了降解,检测不到药物,而溶液pH为4.5、6.8时,12 h累积释放百分率小于20%。
以0.4%SDS为溶质,分别调配pH为1.2、4.5、6.8的释放介质,缓释片的释药情况见图3B。缓释片在0.4%SDS中的累积释放百分率比在蒸馏水中明显变大,且pH为6.8的12 h累积释放百分率大于pH为4.5的累积释放百分率。
-
本研究试验结果表明,即使自制缓释片中含有自微乳,所制得的缓释片表面仍光洁、色泽均匀,进一步说明了介孔材料SBA-15的强吸附性能,是一种良好的药物载体。自制缓释片的体外释药行为考察结果显示,不同的片剂直径及体外溶出方法对缓释片的体外释药行为无影响;而不同的硬度、转速和不同pH值的释放介质具有一定影响。
缓释制剂和控释制剂的制备,其目的是对制剂的释药行为进行控制,以减缓药物的吸收,具有释药平稳、药效持久、副作用较小等优点。缓释制剂中药物的释放速度主要通过辅料来控制,即利用高分子材料阻止药物的释放,根据阻滞方式的不同,阻滞剂分为骨架型、包衣膜型和增稠剂等[13]。本研究是采用亲水凝胶骨架材料HPMC作为缓释片的骨架,释药模型以骨架溶蚀为主。本课题组考虑,由于缓释片中自微乳及介孔硅的存在会增强缓释片粉末间的结合力,缓释片的硬度越大,导致缓释片中各辅料之间的间隙越小,辅料之间的作用力越大,而转速越小,缓释片周围溶出介质的流动速度越慢,释放介质的渗透速率和药物的释放速度都会减慢。所以,硬度越大、转速越慢时,在相同时间内的药物累积释放百分率越小。
表面活性剂具有很强的表面活性,仅需添加微量就能使液体的表面张力显著下降,可实现多种功效,如增溶、乳化、润湿等作用[14]。SDS溶液是一种阴离子表面活性剂,具有良好的水溶性和乳化性。西罗莫司为难溶性药物,而自微乳是油溶性溶液,具有一定的疏水性。因此,缓释片在蒸馏水中的累积释药百分率较低,而以0.4%SDS为释放介质时,释放介质的表面张力变小,可以更好地渗透进入缓释片骨架材料及介孔材料的孔径内,促进药物的溶解和释放,使累积释药百分率显著提升。此外,很多药物的降解受H+或OH−催化,降解速度很大程度上受pH的影响[14]。西罗莫司在酸性介质中,受H+的影响迅速降解,导致在pH为1.2的释放介质中的累积释药百分率为0。因此,制备西罗莫司肠溶制剂具有重要的研究价值,可减少药物在胃内的降解,提高药物的吸收量和利用率。
Study on the quality and in vitro drug release behavior of sirolimus self-microemulsion-mesoporous silicon sustained release tablets
-
摘要:
目的 旨在考察西罗莫司自微乳-介孔硅缓释片的质量及其体外释药行为,以期为相关制剂的进一步研发提供依据。 方法 参考2020年版《中国药典》四部,对缓释片的硬度、脆碎度、含量均匀度进行检验,分别考察不同直径(10、11、12 mm)、不同硬度(50、70、90 N)、不同转速(50、75、100 r/min)、不同溶出方法(桨法、篮法)以及不同pH值的释放介质(pH分别为1.2、4.5、6.8的蒸馏水溶液、0.4%十二烷基硫酸钠溶液)条件下缓释片的释药情况。 结果 自制缓释片的硬度、脆碎度及含量均匀度均合格;不同的直径、溶出方法对缓释片的体外释药行为无影响;而不同硬度、不同转速和不同pH值的释放介质具有一定的影响。 结论 西罗莫司自微乳-介孔硅缓释片在体外表现出良好的缓释特性,值得进一步研究。 Abstract:Objective To investigate the quality and in vitro release behavior of the sirolimus self-microemulsion-mesoporous silicon sustained release tablets and provide a basis for further research and development of related preparations. Methods The hardness, brittleness and content uniformity of the sustained-release tablets were tested refer to Pharmacopoeia of the People’s Republic of China 2020. Different diameters (10, 11, 12 mm), different hardness (50, 70, 90 N), different speed (50, 75, 100 r/min), different dissolution methods (pulp method, basket method) were investigated. The release conditions of the sustained-release tablets with different pH solution (distilled water solution and 0.4% SDS solution with pH of 1.2, 4.5 and 6.8, respectively) and the in vitro release conditions of the sustained-release tablets were observed. Results The hardness, brittleness and content uniformity of the self-made sustained-release tablets were qualified; different diameters and dissolution methods had no effect on the drug release behavior of the sustained-release tablets in vitro, while the different hardness, different rotational speed and the different pH release media had certain effects. Conclusion The sirolimus self-microemulsion-mesoporous silicon sustained release tablets had good sustained-release effect in vitro and was deserved to further study. -
表 1 西罗莫司自微乳-介孔硅缓释片的硬度
序号 1 2 3 4 5 6 x ± s 硬度(N) 73 69 70 67 75 68 70.33±2.81 表 2 脆碎度结果
x1(m/mg) x2(m/mg) 减失重量(%) 6 726 6 683 0.64 -
[1] ZHANG Y, ZHANG X L, ZOU Y, et al. Population pharmacokinetics of sirolimus in Chinese adult liver transplant recipients: a retrospective study[J]. Xenobiotica, 2021, 51(12): 1408-1415. doi: 10.1080/00498254.2022.2025628 [2] MATHIYAZHAGAN G, HASAN F, CHAUHAN P, et al. Spondyloenchondrodysplasia with immune dysregulation: Role of sirolimus[J]. Pediatr Blood Cancer, 2022, 69(10): e29672. doi: 10.1002/pbc.29672 [3] MOES D J, GUCHELAAR H J, DE FIJTER J W. Sirolimus and everolimus in kidney transplantation[J]. Drug Discov Today, 2015, 20(10): 1243-1249. doi: 10.1016/j.drudis.2015.05.006 [4] ZHANG X T, CHEN Z Z, TAO C, et al. Effect of surface property on the release and oral absorption of solid sirolimus-containing self-microemulsifying drug delivery system[J]. AAPS PharmSciTech, 2021, 22(3): 108. doi: 10.1208/s12249-021-01978-z [5] HU X W, LIN C, CHEN D X, et al. Sirolimus solid self-microemulsifying pellets: formulation development, characterization and bioavailability evaluation[J]. Int J Pharm, 2012, 438(1-2): 123-133. doi: 10.1016/j.ijpharm.2012.07.055 [6] JANNIN V, MUSAKHANIAN J, MARCHAUD D. Approaches for the development of solid and semi-solid lipid-based formulations[J]. Adv Drug Deliv Rev, 2008, 60(6): 734-746. doi: 10.1016/j.addr.2007.09.006 [7] O’DRISCOLL C M, GRIFFIN B T. Biopharmaceutical challenges associated with drugs with low aqueous solubility: the potential impact of lipid-based formulations[J]. Adv Drug Deliv Rev, 2008, 60(6): 617-624. doi: 10.1016/j.addr.2007.10.012 [8] 余越, 陶春, 杨海跃, 等. 不同孔径介孔二氧化硅纳米粒的制备及其用于固化西罗莫司自微乳[J]. 药学学报, 2017, 52(6): 985-991. [9] 黄雯婷, 刘志宏, 张灵娜, 等. 基于介孔硅固化自微乳的西罗莫司缓释片的制备与评价[J]. 药学学报, 2023, 58(4): 1049-1058. [10] 程晓昆, 仇俊新, 王娅莉, 等. 关于体外溶出实验在仿制药一致性评价中的应用与思考[J]. 中国医药工业杂志, 2019, 5(9): 1065-1071. [11] 陶春, 陈菊明, 黄爱文, 等. 自微乳缓释片中西罗莫司的稳定性提高研究[J]. 中国医院药学杂志, 2017, 37(17): 1675-1679. [12] ZHAO D, FENG J, HUO Q, et al. Triblock copolymer syntheses of mesoporous silica with periodic 50 to 300 angstrom pores[J]. Science, 1998, 279(5350): 548-552. doi: 10.1126/science.279.5350.548 [13] 崔福德. 药剂学[M]. 7版. 北京: 人民卫生出版社, 2011: 420-436. [14] 潘卫三, 杨星钢. 工业药剂学[M]. 4版. 北京: 中国医药科技出版社, 2019: 533. -




 下载:
下载: