-
热分析技术是基于温度程序控制研究物质理化性质变化的一种检测方法。该技术体系通过实时监测样品在程序控温条件下发生的质量、能量及动力学参数变化,构建材料热转化过程的动态指纹图谱,揭示物质热行为特性。热分析技术具有操作简便、精准度高、信息维度广、样品量少的优势,为中药质量评价、炮制工艺优化及制剂稳定性评价提供相关分析策略与技术支撑,在中药领域应用广泛,促进了中药资源的大规模开发。
-
在中药现代化研究进程中,热分析技术中的热重法(TGA)、差热分析法(DTA)及差示扫描量热法(DSC)通过精准测定中药成分的热稳定性、相变过程及化学反应动力学参数,已成为中药复杂体系研究的常见技术。为了进一步提高检测范围,TGA常和其微分形式(DTG)与DTA或DSC同用,构成同步热分析法(STA),见表1。
表 1 3种热分析法对比表
方法 原理 适用范围 同步热分析
(STA)优点 缺点 TGA[1] 测量样品质量随温度变化,揭示热稳定性和挥发性成分含量 用于水分、溶剂残留、
热分解等研究与DTA、DSC联合,
提供质量与热流信息精准测定热稳定性,适用于热解、分解研究 只能提供质量变化信息,缺乏热流数据 DTA[2-3] 测量样品与参比物的温差变化,检测分解、相变等 化学反应、相变、分解、熔融等研究 与TGA、DSC联合,
补充温差和热流信息无质量损失下能够检测反应、分解和相变等 灵敏度较低,不能提供具体的质量变化信息 DSC[4-5] 测量样品在升温过程中吸放热过程 熔点、玻璃化转变、
相变、多晶型鉴别等与TGA、DTA联合,
分析热流和质量变化高灵敏度,快速测量相变和热力学参量,样品用量少 受气氛、坩埚、升温速率等实验条件影响较大 -
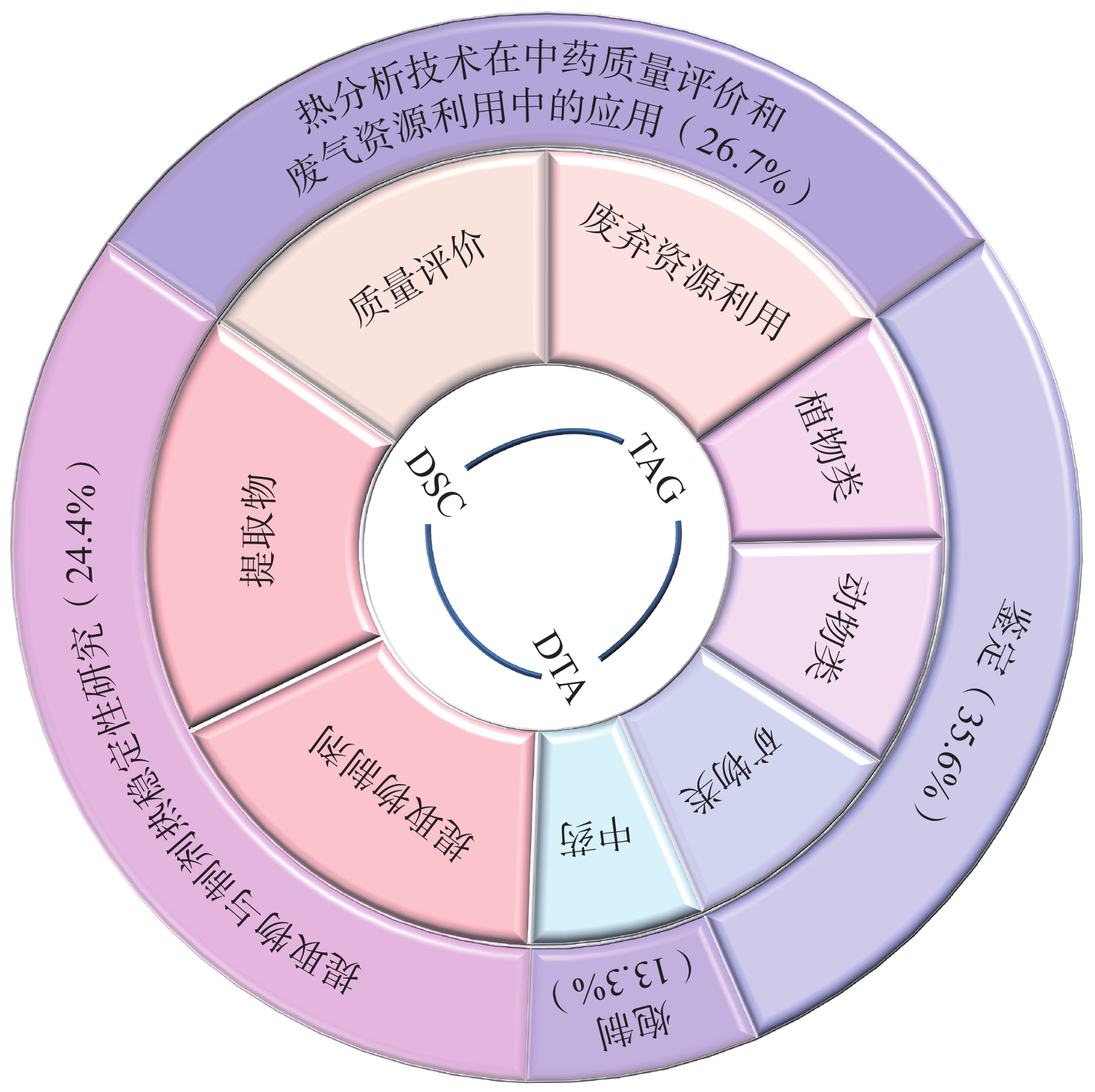
热分析技术广泛应用于中药各研究领域,本研究基于Web of Science、Pubmed和CNKI等数据库,以“热分析+中药”为关键词,系统检索2015−2025年的文献,纳入符合标准的文献有45篇(中文25篇、英文20篇),研究方向及应用分布详见图1。
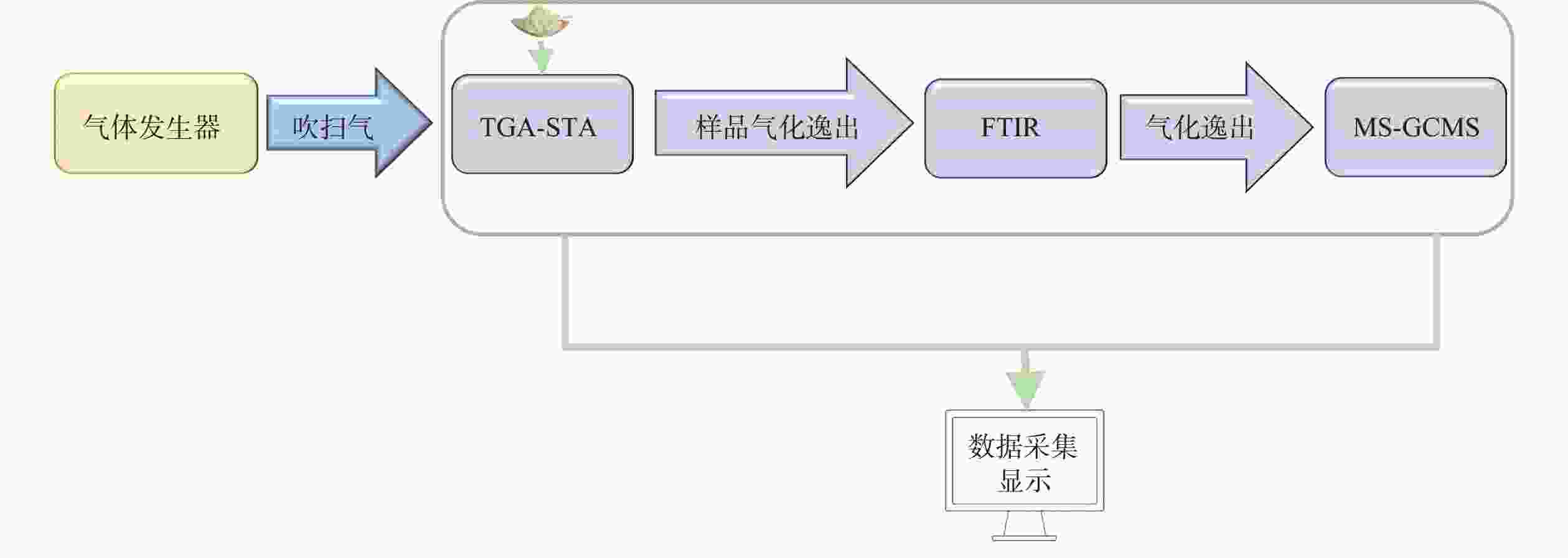
中药热解过程复杂,单一技术易受谱图叠加干扰,可通过与FTIR、MS、GC-MS等技术联用同步监测热解产物组成差异,突破单一热分析技术成分解析能力不足的局限性(图2)。
-
热分析法无需对样品进行预处理,具有操作便捷、图谱易分析的特点,可以快速有效地鉴别不同药材之间的差异(表2),在中药鉴别中的应用趋于成熟。
表 2 热分析技术在中药鉴定中的应用
序号 药材类别 鉴别类型 鉴定药材 样本量(批) 方法 升温范围(T/℃) 鉴别结果 参考文献 1 植物类 混伪品-成分差异大 血竭 26 TGA-DTA 50~850 快速鉴别国产、进口血竭及混伪品 [7] 2 不同基原、炮制品及混伪品-成分差异大 没药 30 DSC 25~550 鉴别能力:混伪品>炮制品 [8] 3 不同产地 附子 14 TGA-DSC 25~800 DSC峰差异, 可作为附子种质资源鉴别的依据 [9] 4 混伪品 中药乳香 25 TGA-DTA 50~750 鉴别能力:成分差异大>成分相似 [6] 5 不同产地 鱼腥草 16 DSC 60~350 只有同产地的DSC图谱才能几乎吻合 [10] 6 成分分析 艾叶 — STA-FTIR-GC-MS 20~650 可有效分析艾叶成分,从而鉴别不同产地艾叶 [11] 7 鉴别药材和其药渣及成分分析 接骨木 — FTIR-DSC 27~900 可快速鉴定接骨木果实及其饼粕 [12] 8 动物类 同属不同种 海胆药材的商品 7 TGA-DSC 27~900 可有效鉴别不同种类海胆 [13] 9 同属不同种 不同的海参 7 TGA-DTA 50~600 可快速鉴别不同种类海参 [14] 10 混伪品-成分差异大 石首鱼 3 TGA-DSC 30~800 可快速区分石首鱼和棘头梅童鱼 [15] 11 矿物类 主成分一致,功效不同 碳酸钙类矿物药 3 TGA-DSC 27~900 可快速鉴别碳酸钙类矿物药 [16] 12 石盐类矿物药 3 FTIR、XRD、DTA — 对比大青盐和光明盐的差异 [17] 13 硫酸盐类矿物药 30 DSC 30~400 可快速鉴别硫酸盐类矿物药 [18] 14 产地不同同种药材 不同来源的矿物药石膏矿物 — XRD、FTIR、DTA和微量元素光谱半定量分析 — 筛选符合矿物药的石膏 [19] 注:“—”表示文献中未注明。 -
植物类药材来源广泛、种类繁多,易受地域、气候、炮制方法等诸多因素的影响。热分析法通过程序化温度变化监测药材质量与热量响应,能够从宏观层面反映成分互作效应,兼具快速、高效的优势[6]。
郑志全等[7]通过TGA-DTA对26批进口血竭、国产血竭及其伪品进行对比,结合HJ Thermal Analysis计算TGA-DTG中的△H,对其进行有效区分。苏玉纯等[8]通过DSC技术分析天然没药、胶质没药及其炮制品,发现正品药材(包括天然没药与胶质没药)及其不同炮制品在DSC图谱中均呈现特征性吸热峰,但对应的相变温度及热焓值存在显著差异,而混伪品无此响应,表明特征热力学参数可作为真伪鉴别的核心指标。通过建立特征峰与热力学参数的联合检测标准,可有效区分正品没药的不同炮制品并准确识别伪品。
曹玲丽等[9]利用TGA-DSC对14批同源栽培附子的热解行为进行层次聚类分析。研究发现,尽管栽培条件一致,不同种质样本的热分解温度、失重速率等特征性热响应参数仍存在显著差异,表明遗传因素主导药材热稳定性。邹涛等[10]进一步构建鱼腥草DSC指纹图谱数据库,结合相似度计算实现不同产地样本的快速溯源,为鉴别道地药材提供新思路。Li等[20]将DSC指纹图谱应用于肉苁蓉的质量评价体系,成功建立优劣产品的分类模型。以上说明同产地药材的DSC曲线呈现高度重复性,而不同产地样本的特征峰参数(起始温度、峰值温度、反应焓ΔH)及拓扑结构存在显著差异。基于此,构建DSC特征峰聚类模型,可通过热分解动力学行为实现种质资源的快速分类,为道地药材的产地溯源与质量控制提供新方法。
-
热分析法常采用STA对动物类药材进行鉴别。多数动物类药材在加热过程中因脂肪融化、蛋白质变性等理化反应产生特征性热行为,其成分差异可通过热图谱中特征峰温度、峰形及热失重台阶等参数体现。
岳改月等[15]通过TGA-DSC分析石首鱼正品(小黄鱼、大黄鱼)及其混淆品(棘头梅童鱼),发现大小黄鱼蛋白质、脂质等有机物分解时的失重台阶和特征峰数一致,但大黄鱼总失重量较高,而混淆品热解数据显著偏离正品特征。崔洋洋等[13]对7种海胆的TGA-DSC研究表明,不同品种海胆的DSC特征峰出现的温度高低、峰形宽窄和峰值大小各不相同。王琪等[14]采用TGA-DTA在50℃~600℃内对7种不同区域、不同种属的海参进行热分析,各样品热分析曲线差异显著。
综上所述,热分析法可对多类型的动物药材进行鉴别,但对与成分较为单一且相似的药材,DTA的图谱差异较小,具有一定局限性,可使用灵敏度更高的DSC,或者与其他方法结合进行深层次鉴别。
-
矿物类药材作为中药的重要组成部分,在我国有着悠长的入药历史。矿物药在临床配方中多以细粉入药,且不同疗效的矿物药常含有相同的化学成分,仅以形状和化学鉴别难以区分。DSC可以捕捉其加热过程中的细微差别,在碳酸盐、硫酸盐和石盐类矿物药中皆有应用[17]。
沈紧治等[18]利用DSC图谱中特征峰的数量不同对5种硫酸盐类矿物进行鉴定,为建立硫酸盐类药材鉴定及质量评价标准提供参考。孙昭倩等[16]采用TGA-DSC解析3类珍珠的热分解行为特征,所有样品均呈现相似的有机物与碳酸钙分阶段热解特征,但海水珍珠(含野生/养殖)在439℃~447℃区间表现出特征性放热响应,其峰顶温度(野生439℃ vs养殖447℃)以及峰的强度具有显著差异,而淡水珍珠完全缺失该特征峰。结合TGA-DTG热失重曲线的阶段性分解特征,为海水珍珠种质鉴定及养殖溯源提供新技术路径。张丽倩等[19,21]采用X射线衍射、红外光谱法、DTA等技术,对不同产地的石膏和白石脂进行矿物学分析及鉴定,通过X射线衍射、红外光谱法等进行含量测定及成分分析,差热法验证不同产地样品的热差异,结果表明产地不同的同类矿物药,其主要成分和微量元素含量皆有差异,这种差异可直接反映到差热图谱中,因此可通过差热分析实现对不同产地的同种矿物药快速鉴别的目的。以上结果表明,虽然成分简单且组成相似的药材热分析图谱重叠度较高,但在初步鉴定中,仍然可以通过曲线的细微差异快速直接地对其进行判断。
STA与FTIR、GC-MS等技术联用是热分析技术的发展趋势,已成功应用于艾叶[11]、接骨木[12]等药材鉴别,通过关联热失重阶段与产物指纹谱,阐明成分热稳定性差异的化学本质,具体流程详见“1.2”项下技术联用。
-
热分析技术能够模拟炮制升温过程,检测成分分解温度,检验炮制方法的可行性,优化炮制温度,助力药效最大化。炮制工艺优化方面,Kong等[22]通过TGA-DTG比较太阳能/空气集热器风干与自然风干的三七根、须,发现两者热稳定性相近,但前者干燥时间显著缩短。任婧等[23]和苏晓娟等[24]通过TGA-DTG模拟生地黄炒碳过程,确定其温度上限为216.3℃,为炮制工艺提供科学依据,而后进一步利用TGA-DSC与响应曲面法优化焦山楂炮制条件,确定最佳炮制温度,通过胃动力障碍小鼠模型证实新工艺药效优于传统方法,实现对焦山楂药效的提升。在炮制品质量评价中,Du等[25]应用TGA-DTG对发酵前后的甘草茎叶进行检测,证明发酵后的茎叶热稳定性降低,纤维素含量显著下降。杨辛欣等[26]采用TGA证明朱砂锆球水飞前后热稳定性一致,表明新工艺未改变其化学组成。章茂森等[27]采用TGA-DTA、FTIR分析地黄炮制品,发现生/熟地黄因多糖和梓醇含量较高,在有机质分解阶段失重量更大,而炭制品含碳量显著增加,为炮制质量控制提供了成分-热行为关联依据。综上,热分析技术通过多维度热行为表征(如分解温度、失重特征、成分热稳定性差异),贯穿炮制工艺优化与质量评价全流程,既为传统炮制经验提供科学诠释,又为现代工艺标准化提供量化工具,推动中药炮制研究向精准化、科学化方向发展。
-
热分析技术常用于测定中药提取物的热稳定性和热分解特征,为提取物的质量控制、制剂工艺和药效研究提供科学依据。
在研究甘草多糖对附子中乌头碱、次乌头碱的影响时,Sun等 [28]采用DSC分析其单体和包合物的热差异,探讨其潜在的相互作用机制。Srivastava等[29]通过TGA-DTG对7种基因型的罗勒精油进行种内比较时发现,不同基因型精油热稳定性虽然有所差异,但集中表现为180℃前稳定,190℃~200℃开始降解。罗虹建等[30]通过TGA-DSC-IR-MS对灵芝多糖肽不同阶段丢失的质量成分进行分析,通过检测热反应过程中的数据,为研制标准物质和开发药物提供有效依据。人参皂苷的晶型表征研究中,Kuang等[31]通过TGA-DSC对人参皂苷CK多晶型的稳定性进行测试,不同晶型的分解温度和熔融峰数量各有差异,根据结果热分析法能够为中药提取物的质量控制提供重要依据。
热分析法作为一种重要检测手段,能够有效监测药物活性成分与赋形剂之间可能发生的化学反应、吸附作用或低共熔现象,通过分析物质在受热过程中的各项热变化特征,为制剂配方的相容性评价和工艺优化提供关键数据支持。热稳定性是材料学中的重要参数之一,Xiao等[32]通过TGA-DTG对脱支蜡质玉米淀粉、载姜黄素脱支淀粉/凉粉草多糖(不同浓度)微胶囊表征,通过对比分解温度证明姜黄素和凉粉多糖能够抑制脱支蜡质玉米淀粉的回生和再缔合。在提高黄芩素的纯化和万寿菊素的提取效率中,Wang等[33]和Quan等[34]通过TGA验证新工艺的稳定性。Yu等[35]采用TGA-DSC对鞣花酸包合物和包材进行验证,结果表明,羟丙基-β-环糊精可以将鞣花酸和水凝胶有效结合,其包合物热稳定性增加。车前子壳多糖具有优越成膜性,但是否能替代食品保鲜涂层和塑料包装还需能耐高温灭菌处理,杨磊等[36]用TGA测得其热解阶段为298.4℃~410℃,热稳定性满足食品包装耐高温需求。Xu等 [37]在阐述壳聚糖对生物碱和黄酮苷类成分的掩味机制中,通过DSC证明壳聚糖能有效掩蔽小檗碱和连翘苷的苦味。DSC曲线中晶体熔融峰通常呈尖锐状,非晶体熔融峰较为宽泛,成伟业等[38]通过DSC验证白藜芦醇苷(PD)主要结构为晶体,在其固体分散体(PD-SD)中以分子或无定型形式存在,因此生物利用度和体外溶出均有上升,提取物的晶型不同,成药性、溶解度、毒性和临床疗效都会受到影响,改变晶型会引起提取物熔点及热行为变化,这种变化能够灵敏地反应在热分析曲线上,通过对比提取物不同晶型的热解信息,可从宏观上对提取物多晶型现象进行探究。
-
热分析法通过监测药材升温过程中燃烧热、热重参数、脂肪含量等指标构建中药多维度评价体系,解析药材热特征(失重速率、特征温度、残余量)与成分关联规律(失重台阶、吸/放热峰特性),为质量评价提供理论支撑[39-41]。周利兵等[42]基于 TGA 数据建立药材热解两阶段模型(水分蒸发阶段 40℃~200℃、有机物分解阶段 200℃~460℃),结合残炭率等参数对比旱莲草、白茅根等 5 种药材的热差异,并证实该模型对复杂组分药材综合评价的有效性,为辨别中草药的品质及分类提供参考,促进中草药资源大规模开发。针对传统艾绒分级标准的局限性,易冰等[43-44]提出“非腺毛-纤维素-TGA/DSC”联用策略,通过半纤维素、纤维素和木质素的放热量、燃烧温度范围、燃烧速率差异等热力学参数,结合SEM形貌分析,证明叶绒比10∶1~15∶1为品质最优区间,并建立贮存年限与蕲艾和九牛草热稳定性的定量关系。在复方制剂评价中,DSC可表征体系总热能分布,Lan等[45-46]采用DSC、UV和HPLC对复方甘草片进行全面质量评价,又通过HPLC、EC与DSC多维技术融合,从化学组成、氧化还原活性和热力学特性构建栀子金花丸的指纹图谱,结合EQFM算法,实现中药质量的全方位一致性评价,DSC在此过程中揭示样品的热能分布,填补了传统色谱方法的不足,为复杂中药系统的质量控制提供了科学依据。
热分析技术的应用不仅局限于药材及制剂的质量控制,其揭示的热力学特性还可为中药废弃物的资源化利用提供关键参数。随着中药产业的规模化发展,药渣高效处理成为关键课题,中药渣热转化技术因流程短、高能效特性在中药渣大规模清洁中备受关注[47-48]。Zhu等[49]采用非等温TGA结合Starink模型,证实当K2CO3负载量为7%时催化效果最佳,可显著降低草药残渣表观活化能(由185.9 kJ/mol降至14.8~160.6 kJ/mol),加速热解进程。Wang等[50]通过TGA-MS探究药渣在平原地区和藏区不同气氛下的气化效果,通过优化参数(ER=0.24,1 000℃)在藏区低压条件下实现高效能源回收,基于TGA药渣热解特性及动力学分析,可推动反应设计优化,促进新型高效热化学转化技术开发。
药材的热特征数据(如分解温度、残炭率)能够指导药渣热解工艺的优化,而药渣的组分特征(如纤维素、木质素含量)亦可反向映射原料品质,形成“质量评价-资源循环”的闭环管理逻辑。这种双向关联凸显了热分析技术在中药全产业链中的贯通性价值,为质量管控与绿色生产的协同发展奠定基础。
-
不同药材组分具有独特的热响应行为,其热分析曲线能够形成具有鉴别意义的 “热指纹图谱”,热分析技术通过监测物质受热过程中的质量与能量变化,能够有效表征中药材及其提取物的热稳定性。依靠其前处理简单、测样量少、检测周期短和单次实验同步可获取多维度参数的优势,鉴别外形相似成分差异显著的药材效果突出,极大降低传统鉴别法主观因素的干扰。
除了常规的图谱分析,建立DSC指纹图谱库可更快更直接对药材进行产地鉴别,筛选优质药材。尽管当前此类研究尚未实现规模化应用,但初步实践已证实,通过系统构建中药DSC指纹数据库,能够突破传统热分析技术的单一检测维度,为大批量中药材及中成药的快速鉴别、质量一致性评价提供具有可扩展性的新型技术路径。
热分析技术结合数学模型对药材反应体系进行动力学分析模拟,不仅可应用于热转化机理研究,还可为预测药材贮存期提供科学依据,在药效衰减前及时用药,可避免有效成分降低影响治疗效果、降解产物蓄积产生潜在毒副作用以及过期药材处置造成的资源浪费与环境污染,研究不同温度对药材贮存期的影响,选择合适温度保存药材,可为优化中药材仓储条件、延长保质期提供理论依据。
-
热分析法作为物质宏观分析手段,在复杂体系成分解析中存在局限性,尤其在化学组成相近的中药样品鉴别中,单一温度点失重特征难以与特定成分建立绝对对应关系。通过联用色谱或光谱技术(如TGA-DSC-MS、TGA-FTIR等),可实现对多组分相互作用下热分解行为的精细化区分。目前,该联用技术已广泛应用于材料、化工、地质及食品领域,随着联用技术的深化发展,其在中药现代化研究中的价值将进一步突显,为中药质量控制及作用机制研究提供新思路。
Progress on application of thermal analysis in traditional Chinese medicine
-
摘要: 热分析技术凭借其高灵敏度、多参数同步检测等优势,已成为中药鉴别与质量控制的重要工具。本文综述了热重法(TGA)、差热分析法(DTA)及差示扫描量热法(DSC)在中药材真伪鉴别、炮制工艺优化、提取物热稳定性评价及质量评价体系构建中的应用进展。热分析技术通过构建“热指纹图谱”,可实现药材快速鉴别;结合FTIR、GC-MS等联用技术,可深入解析复杂成分的差异。未来,推动热分析数据库建设及多技术融合,可提升中药质量控制的标准化水平。Abstract: Thermal analysis technology has emerged as a pivotal tool for the identification and quality control of traditional Chinese medicine (TCM) owing to its advantages of high sensitivity and capability for simultaneous multi-parameter detection. The application progress on thermogravimetric analysis (TGA), differential thermal analysis (DTA), and differential scanning calorimetry (DSC) in four key areas: authenticity identification of herbal medicines, optimization of processing techniques, evaluation of extract thermal stability, and construction of quality evaluation systems were summarized. Thermal analysis technology enables rapid authentication of medicinal materials by establishing a thermal fingerprint. When integrated with hyphenated techniques (e.g., FTIR and GC-MS), it facilitates in-depth analysis of compositional differences in complex matrices. In Future, the development of thermal analysis databases and multi-technology integration will be expected to further promote the standardization of TCM quality control.
-
表 1 3种热分析法对比表
方法 原理 适用范围 同步热分析
(STA)优点 缺点 TGA[1] 测量样品质量随温度变化,揭示热稳定性和挥发性成分含量 用于水分、溶剂残留、
热分解等研究与DTA、DSC联合,
提供质量与热流信息精准测定热稳定性,适用于热解、分解研究 只能提供质量变化信息,缺乏热流数据 DTA[2-3] 测量样品与参比物的温差变化,检测分解、相变等 化学反应、相变、分解、熔融等研究 与TGA、DSC联合,
补充温差和热流信息无质量损失下能够检测反应、分解和相变等 灵敏度较低,不能提供具体的质量变化信息 DSC[4-5] 测量样品在升温过程中吸放热过程 熔点、玻璃化转变、
相变、多晶型鉴别等与TGA、DTA联合,
分析热流和质量变化高灵敏度,快速测量相变和热力学参量,样品用量少 受气氛、坩埚、升温速率等实验条件影响较大 表 2 热分析技术在中药鉴定中的应用
序号 药材类别 鉴别类型 鉴定药材 样本量(批) 方法 升温范围(T/℃) 鉴别结果 参考文献 1 植物类 混伪品-成分差异大 血竭 26 TGA-DTA 50~850 快速鉴别国产、进口血竭及混伪品 [7] 2 不同基原、炮制品及混伪品-成分差异大 没药 30 DSC 25~550 鉴别能力:混伪品>炮制品 [8] 3 不同产地 附子 14 TGA-DSC 25~800 DSC峰差异, 可作为附子种质资源鉴别的依据 [9] 4 混伪品 中药乳香 25 TGA-DTA 50~750 鉴别能力:成分差异大>成分相似 [6] 5 不同产地 鱼腥草 16 DSC 60~350 只有同产地的DSC图谱才能几乎吻合 [10] 6 成分分析 艾叶 — STA-FTIR-GC-MS 20~650 可有效分析艾叶成分,从而鉴别不同产地艾叶 [11] 7 鉴别药材和其药渣及成分分析 接骨木 — FTIR-DSC 27~900 可快速鉴定接骨木果实及其饼粕 [12] 8 动物类 同属不同种 海胆药材的商品 7 TGA-DSC 27~900 可有效鉴别不同种类海胆 [13] 9 同属不同种 不同的海参 7 TGA-DTA 50~600 可快速鉴别不同种类海参 [14] 10 混伪品-成分差异大 石首鱼 3 TGA-DSC 30~800 可快速区分石首鱼和棘头梅童鱼 [15] 11 矿物类 主成分一致,功效不同 碳酸钙类矿物药 3 TGA-DSC 27~900 可快速鉴别碳酸钙类矿物药 [16] 12 石盐类矿物药 3 FTIR、XRD、DTA — 对比大青盐和光明盐的差异 [17] 13 硫酸盐类矿物药 30 DSC 30~400 可快速鉴别硫酸盐类矿物药 [18] 14 产地不同同种药材 不同来源的矿物药石膏矿物 — XRD、FTIR、DTA和微量元素光谱半定量分析 — 筛选符合矿物药的石膏 [19] 注:“—”表示文献中未注明。 -
[1] KUMAR P, SUBBARAO P M V, KALA L D, et al. Thermogravimetry and associated characteristics of pearl millet cob and Eucalyptus biomass using differential thermal gravimetric analysis for thermochemical gasification[J]. Therm Sci Eng Prog, 2021, 26: 101104. doi: 10.1016/j.tsep.2021.101104 [2] RAMOS P, RACZAK B K, SILVESTRI D, et al. Application of TGA/c-DTA for distinguishing between two forms of naproxen in pharmaceutical preparations[J]. Pharmaceutics, 2023, 15(6): 1689. doi: 10.3390/pharmaceutics15061689 [3] STERLE D G, CASPARI H W, MINAS I S. Optimized differential thermal analysis sheds light on the effect of temperature on peach floral bud cold hardiness and transition from endo- to ecodormancy[J]. Plant Sci, 2023, 335: 111791. doi: 10.1016/j.plantsci.2023.111791 [4] JENNINGS C C, FREIDENBERGER M, CHRISTENSEN S A, et al. Thermal characterization and separation of whey proteins by differential scanning calorimetry[J]. Food Chem, 2024, 441: 138347. doi: 10.1016/j.foodchem.2023.138347 [5] YE D, DING D, PAN L Y, et al. Natural coptidis rhizoma nanoparticles improved the oral delivery of docetaxel[J]. Int J Nanomedicine, 2024, 19: 8417-8436. doi: 10.2147/IJN.S470853 [6] 魏永恒, 郑志全, 罗菊元, 等. 利用TGA-DTA热分析法快速鉴别中药乳香及质量分析研究[J]. 世界科学技术-中医药现代化, 2017, 19(4): 629-635. doi: 10.11842/wst.2017.04.014 [7] 郑志全, 石晋丽, 姜亦南, 等. TG-DTA分析法快速区分国产血竭、进口血竭及真伪鉴别研究[J]. 中医药信息, 2018, 35(3): 30-36. [8] 苏玉纯, 沈紧治, 谢素治, 等. 不同基原、炮制品及混伪品没药饮片的DSC图谱鉴别研究[J]. 山东中医药大学学报, 2024, 48(4): 478-484. [9] 曹玲丽, 余马, 舒晓燕, 等. 附子的热分析研究[J]. 时珍国医国药, 2015, 26(9): 2167-2169. [10] 邹涛, 陈宇迪, 莫单丹, 等. 差示扫描量热(DSC)图谱匹配识别法在鱼腥草产地快速鉴别中的应用[J]. 分析仪器, 2022,(1): 93-99. doi: 10.3969/j.issn.1001-232x.2022.01.017 [11] 赵迎春, 刘志达, 郭冉冉, 等. 同步热分析-傅里叶变换红外光谱-气相色谱/质谱联用法分析艾叶[J]. 青岛科技大学学报(自然科学版), 2024, 45(3): 75-80. [12] 郭希蕾, 孙昭倩, 李高燕, 等. 红外光谱及热重-差示扫描量热法鉴别接骨木果实及饼粕[J]. 理化检验-化学分册, 2025, 61(5): 568-576. doi: 10.11973/lhjy-hx230376 [13] 崔洋洋, 孙昭倩, 郭庆梅, 等. 海胆药材的商品调查及热重分析[J]. 中国海洋药物, 2019, 38(3): 71-76. [14] 王琪, 李建涛, 于雪妮, 等. 差热/热重分析法鉴别不同的海参[J]. 中国海洋药物, 2018, 37(6): 54-58. [15] 岳改月, 孙昭倩, 王百龙, 等. 海洋药材石首鱼的TG-DSC热分析研究[J]. 中国海洋药物, 2021, 40(1): 37-40. [16] 孙昭倩, 王虹熙, 郭庆梅, 等. 海水珍珠和淡水珍珠的热分析鉴别[J]. 现代中药研究与实践, 2016, 30(6): 14-17. [17] 张丽倩, 胡海燕, 杨蓉, 等. 石盐类矿物药的矿物学探究[J]. 中成药, 2019, 41(12): 3063-3066. doi: 10.3969/j.issn.1001-1528.2019.12.047 [18] 沈紧治, 王政, 苏玉纯. 差示扫描量热法对5种硫酸盐类矿物药的分析鉴别研究[J]. 中国医院用药评价与分析, 2019, 19(6): 717-720. [19] 张丽倩, 刘养杰. 两种不同来源的矿物药石膏矿物学分析及鉴定[J]. 吉林中医药, 2018, 38(10): 1206-1208. [20] LI X, YANG T, BU H Z, et al. Constructing a “Four in One” fingerprint quality evaluation system of Cistanche Herba[J]. Microchem J, 2023, 186: 108359. doi: 10.1016/j.microc.2022.108359 [21] 张丽倩, 刘养杰, 林炳岚, 等. 市售矿物药白石脂矿物学鉴定及谱学特征对比研究[J]. 光谱学与光谱分析, 2023, 43(3): 897-902. doi: 10.3964/j.issn.1000-0593(2023)03-0897-06 [22] KONG D C, WANG Y F, LI M, et al. Quality study on different parts of Panax notoginseng root drying with a hybrid drying system powered by a solar photovoltaic/thermal air collector and wind turbine[J]. Energy, 2022, 245: 123216. doi: 10.1016/j.energy.2022.123216 [23] 任婧, 张晓燕, 孟祥龙, 等. 基于热分析的生地黄炒炭炮制工艺研究[J]. 吉林中医药, 2021, 41(2): 248-251. [24] 苏晓娟, 宁晨旭, 刘晓琴, 等. 焦山楂炮制工艺及其改善胃动力障碍小鼠症状的研究[J]. 世界科学技术-中医药现代化, 2023, 25(3): 1168-1176. [25] DU J, LI X, LIU N, et al. Improving the quality of Glycyrrhiza stems and leaves through solid-state fermentation: flavonoid content, antioxidant activity, metabolic profile, and release mechanism[J]. Chem Biol Technol Agric, 2024, 11(1): 105. doi: 10.1186/s40538-024-00631-8 [26] 杨辛欣, 洪禹昕, 张睿, 等. 朱砂锆球水飞工艺及质量评价研究[J]. 中草药, 2022, 53(7): 1993-2002. doi: 10.7501/j.issn.0253-2670.2022.07.008 [27] 章茂森, 丁融, 吕年青. 4种地黄红外光谱、热分析及微观结构对比研究[J]. 食品与生物技术学报, 2023, 42(2): 73-79. doi: 10.3969/j.issn.1673-1689.2023.02.011 [28] SUN L L, YOU G J, ZHENG F X, et al. In vitro and in vivo evaluation of the influences of polysaccharides derived from Glycyrrhiza uralensis on three alkaloids and potential interaction mechanisms[J]. Int J Biol Macromol, 2020, 157: 452-460. doi: 10.1016/j.ijbiomac.2020.04.140 [29] SRIVASTAVA S, LAL R K, MAURYA R, et al. Chemical diversity of essential oil among basil genotypes (Ocimum viride Willd.) across the years[J]. Ind Crops Prod, 2021, 173: 114153. doi: 10.1016/j.indcrop.2021.114153 [30] 罗虹建, 王赛贞, 王联福, 等. 灵芝多糖肽GL-PPSQ2的热分析研究[J]. 药物分析杂志, 2023, 43(9): 1468-1475. [31] KUANG Y Y, GAO X, NIU Y J, et al. Polymorphic characterization, pharmacokinetics, and anti-inflammatory activity of ginsenoside compound K polymorphs[J]. Molecules, 2021, 26(7): 1983. doi: 10.3390/molecules26071983 [32] XIAO W H, SHEN M Y, LI J W, et al. Preparation and characterization of curcumin-loaded debranched starch/Mesona chinensis polysaccharide microcapsules: Loading levels and in vitro release[J]. Food Hydrocoll, 2023, 141: 108697. doi: 10.1016/j.foodhyd.2023.108697 [33] WANG D D, LUO X X, HUANG Y K, et al. Combined magnetic molecularly imprinted polymers with a ternary deep eutectic solvent to purify baicalein from the Scutellaria baicalensis Georgi by magnetic separation[J]. Microchem J, 2020, 157: 105109. doi: 10.1016/j.microc.2020.105109 [34] QUAN T, WANG D D, YANG L J, et al. Effective extraction methods based on hydrophobic deep eutectic solvent coupled with functional molecularly imprinted polymers: Application on quercetagetin extraction from natural medicine and blood[J]. Microchem J, 2022, 174: 107076. doi: 10.1016/j.microc.2021.107076 [35] YU C Q, NAEEM A, LIU Y L, et al. Ellagic acid inclusion complex-loaded hydrogels as an efficient controlled release system: design, fabrication and in vitro evaluation[J]. J Functional Biomater, 2023, 14(5): 278. doi: 10.3390/jfb14050278 [36] 杨磊, 邵荣, 吴梦霖, 等. 车前子壳多糖热水提取工艺优化及成膜性能研究[J]. 食品科技, 2022, 47(10): 197-220. [37] XU Y Q, SUN Q W, CHEN W, et al. The taste-masking mechanism of chitosan at the molecular level on bitter drugs of alkaloids and flavonoid glycosides from traditional Chinese medicine[J]. Molecules, 2022, 27(21): 7455. doi: 10.3390/molecules27217455 [38] 成伟业, 陈怡, 张彩云, 等. 白藜芦醇苷固体分散体的制备及体内外评价[J]. 中草药, 2017, 48(3): 468-473. [39] ZHOU L B, ZHANG Q. Multiple indicators metrological analysis for 5 kinds of tea produced in Yunnan, China[J]. Food Sci Technol, 2022, 42(12): e70922. [40] ZHOU L B, JIANG C Y, LIN Q X. Entropy analysis and grey cluster analysis of multiple indexes of 5 kinds of genuine medicinal materials[J]. Sci Rep, 2022, 12(1): 6618. doi: 10.1038/s41598-022-10509-0 [41] ZHANG S P, MEI Y Y, LIN G Y. Pyrolysis interaction of cellulose, hemicellulose and lignin studied by TG-DSC-MS[J]. J Energy Inst, 2024, 112: 101479. doi: 10.1016/j.joei.2023.101479 [42] 周利兵, 林清霞. 5种清热解毒类中草药燃烧分析[J]. 云南民族大学学报(自然科学版), 2021, 30(5): 509-514. doi: 10.3969/j.issn.1672-8513.2021.05.014 [43] 易冰, 康利平, 赵新宇, 等. 基于艾绒热重特性与其纤维素含量及非腺毛显微特征的关联性分析研究不同叶绒比艾绒的质量[J]. 中国中药杂志, 2023, 48(18): 4950-4958. [44] 易冰, 乔嘉祺, 赵立春, 等. 基于热分析研究蕲艾和九牛草的不同储存年份灸绒品质[J]. 中国中药杂志, 2023, 48(14): 3693-3700. [45] LAN L L, YANG T, FAN J J, et al. Anti-inflammation activity of Zhizi Jinhua Pills and overall quality consistency evaluation based on integrated HPLC, DSC and electrochemistry fingerprints[J]. J Ethnopharmacol, 2023, 311: 116442. doi: 10.1016/j.jep.2023.116442 [46] LAN L L, ZHANG Y J, ZHANG M T, et al. Evaluation of the quality of compound liquorice tablets by DSC and HPLC fingerprints assisted with dissolution[J]. J Pharm Biomed Anal, 2019, 175: 112715. doi: 10.1016/j.jpba.2019.06.012 [47] HUANG J J, LIU X, FU K X, et al. Selective microcrystalline cellulose extraction from Chinese medicine residues via direct PMS oxidation[J]. Engineering, 2024, 43: 139-145. doi: 10.1016/j.eng.2024.03.008 [48] LU Q, LI C L. Comprehensive utilization of Chinese medicine residues for industry and environment protection: Turning waste into treasure[J]. J Clean Prod, 2021, 279: 123856. doi: 10.1016/j.jclepro.2020.123856 [49] ZHU H Y, LANG L, FANG G, et al. Thermogravimetric characteristics and kinetics of herb residues catalyzed by potassium carbonate[J]. J Anal Appl Pyrolysis, 2021, 156: 105170. doi: 10.1016/j.jaap.2021.105170 [50] WANG X T, CUI X Q, CHE Y C, et al. Gasification of Tibetan herb residue: thermogravimetric analysis and experimental study[J]. Biomass Bioenergy, 2021, 146: 105952. doi: 10.1016/j.biombioe.2020.105952 -




 下载:
下载: