-
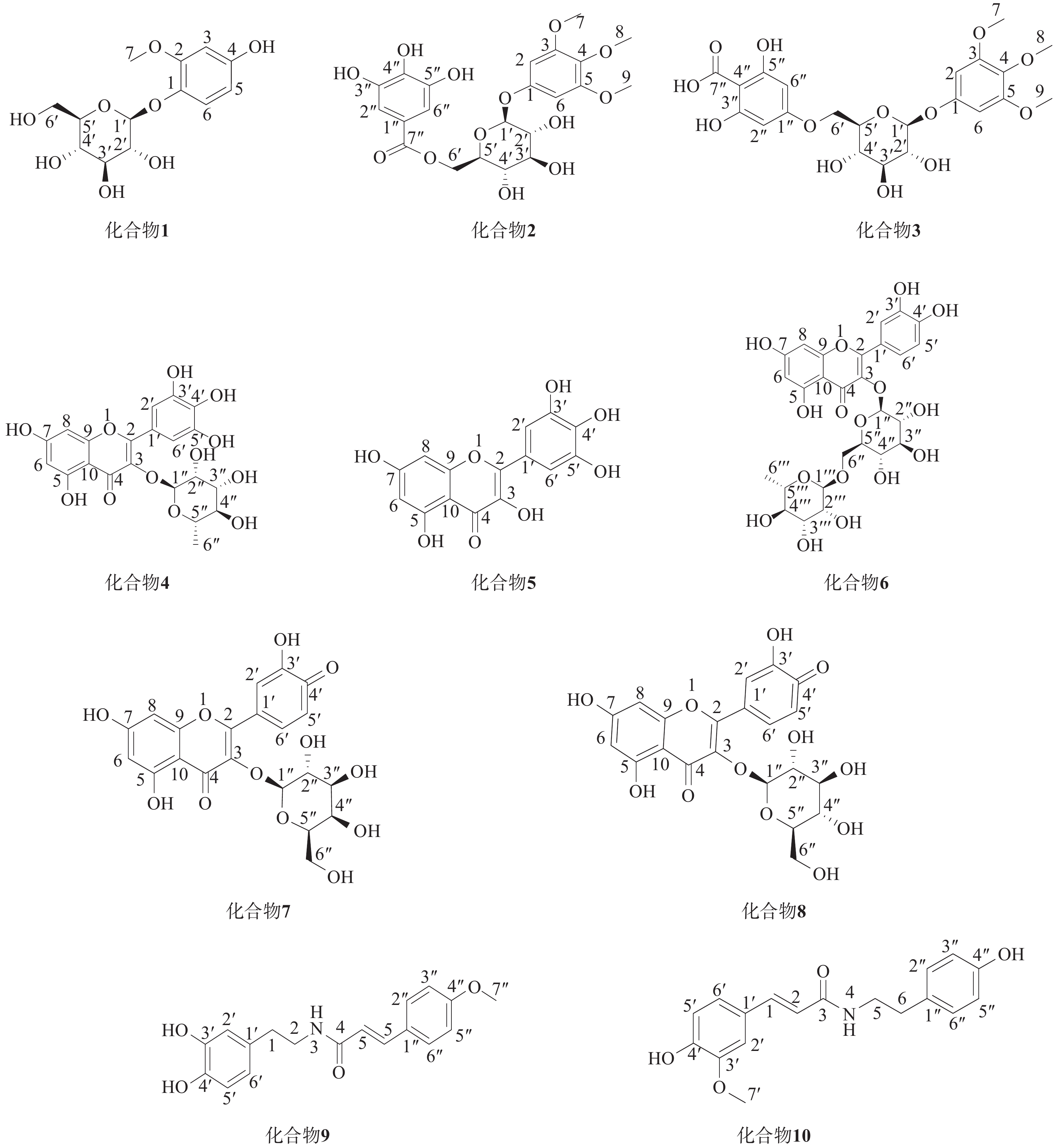
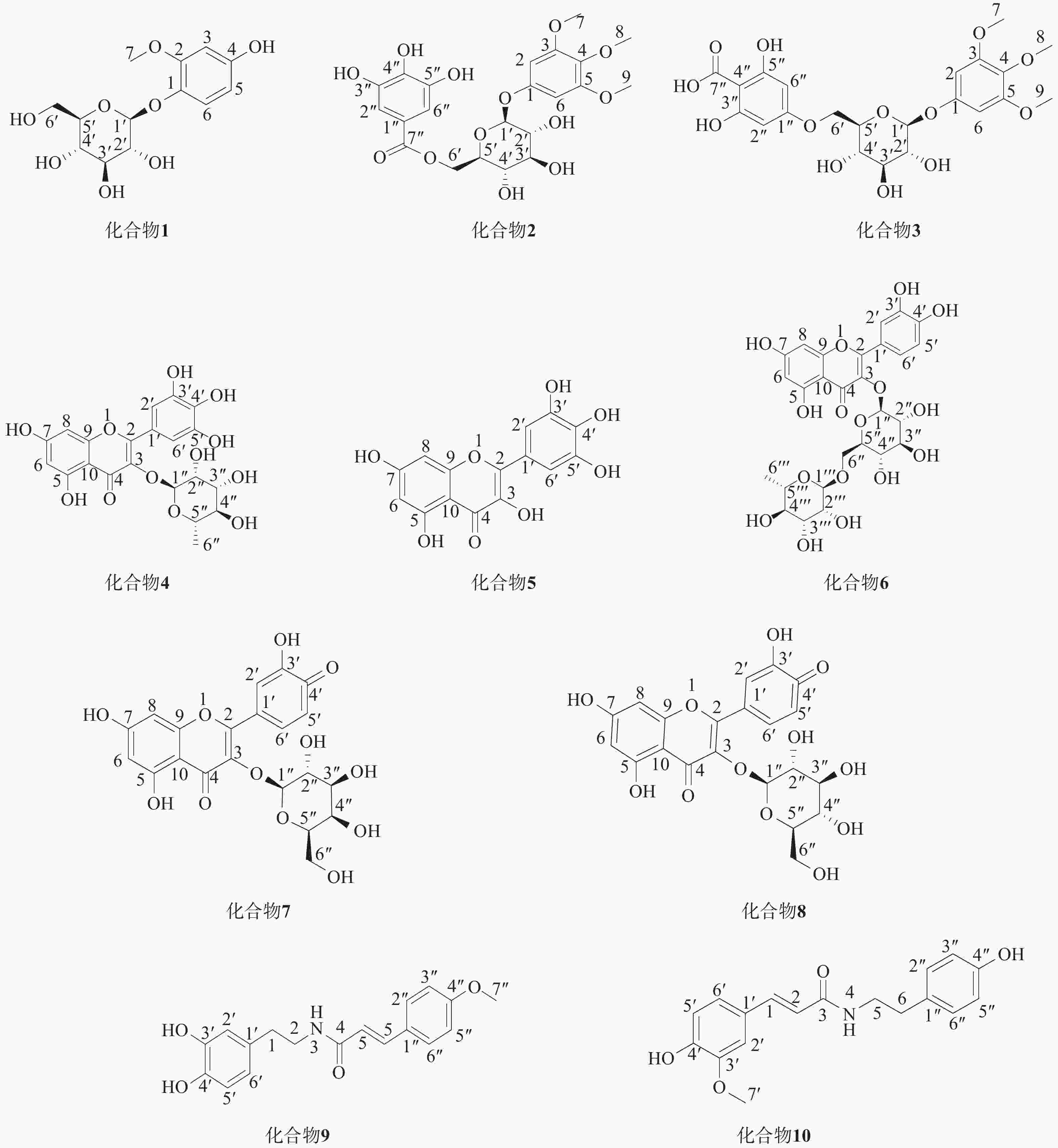
木藤蓼(Fallopia aubertii L.Henry Holub)为蓼科何首乌属植物,是常用藏药材,藏语名为“勒哲”,别名:木茎蓼、赤地胆、丛叶蓼。生长于海拔1 000~3 200 m的山坡草地、山谷灌丛,产于青海、甘肃、四川、云南、西藏、内蒙古(贺兰山)、山西、河南等地[1,2]。《晶珠本草》及《藏药志》中记载,木藤蓼味甘、苦、涩,功能清热解表,主要用于热性隆病,痹病、黄水病引起的关节肿胀、疼痛等,是青海、甘肃、四川阿坝等地治疗痛风、感冒发烧、风湿性关节炎、贫血等疾病的传统藏药[3-5]。藏药成分多样,存在大量结构相似的化合物,由于纯化过程复杂,对其化学成分的研究有限。传统天然产物分离纯化主要采用硅胶和大孔树脂的柱层析法,溶剂消耗量大、分离时间长,分离难度较大[6];与传统的柱层析方法相比,二维液相具有更高的分离度,能够通过色谱图有效分离并富集这些结构相似的化合物,显著提升分离效率,同时提高化合物的纯度,对藏药化学成分复杂体系全面分析以及目标化合物的纯化分离有明显的优势[7]。鉴于二维液相的高分离性能,笔者以木藤蓼为研究对象,采用二维制备液相对其化学成分进行研究,从木藤蓼乙酸乙酯部位分离鉴定了10个化合物,通过波谱数据分析确定化合物结构,化合物1~10的结构见图1。
-
药材于2022年7月采自西宁周边,经中国科学院西北高原生物研究所卢学峰研究员鉴定为蓼科何首乌属木藤蓼(Fallopiaaubertii L.Henry Holub)。
-
旋转蒸发仪Búchi Rotavapor R-205(瑞士Buchi公司);中压色谱塔、在线二维液相色谱仪、制备液相色谱仪、HT-ODS-P(10 mm×250 mm,5 μm)色谱柱、HPLCONE Nap-8(20 mm×250 mm,8 μm)色谱柱(江苏汇通色谱有限公司);FDU-
1100 冷冻干燥机(上海爱朗仪器有限公司);AL204电子天平(梅特勒-托利多仪器有限公司);MCI填料(日本三菱化学公司);石油醚、乙酸乙酯、正丁醇、甲醇、95%乙醇、乙醇、二甲基亚砜(DMSO)(分析纯,天津市红岩化学试剂厂);磷酸(分析纯,天津市化学试剂一厂);黄嘌呤氧化酶(LOT:X05N6Y5557)、黄嘌呤(LOT:N1903190023)、别嘌醇(LOT:L18A6Y3)均购自上海源叶生物科技有限公司;磷酸盐缓冲盐(PBS,PH=7.3北京索莱宝科技有限公司);氢氧化钠(天津市红岩化学试剂厂)。 -
取木藤蓼干燥茎1.5 kg,粉碎后,用10 L 95%乙醇浸泡3 d后过滤得滤液,将滤液减压浓缩,滤渣加入10倍量95%乙醇,用热回流提取两次,过滤合并滤液减压浓缩,得95%乙醇浸膏;用75%、60%乙醇同法操作分别得75%、60%乙醇浸膏。合并3份乙醇浓度的浸膏237.3 g,浸膏用水混悬,依次用等体积石油醚、乙酸乙酯、正丁醇进行萃取后得石油醚萃取部位27.3 g、乙酸乙酯萃取部位23.3 g、正丁醇萃取部位61.5 g和水部位123.1 g。将乙酸乙酯部分(23.3 g)干燥后,用甲醇溶解,0.45 μm有机滤膜过滤,得到粗样品溶液。样品溶液经量筒粗略测量后直接倒入装有MCI填料的中压色谱塔,单次上样量30 ml,用甲醇/水体系洗脱,以色谱纯水为流动相A,过膜甲醇为流动相B,按表1中的梯度室温条件下进行洗脱,流速为60 ml/min,检测波长为210 nm。
表 1 梯度洗脱条件
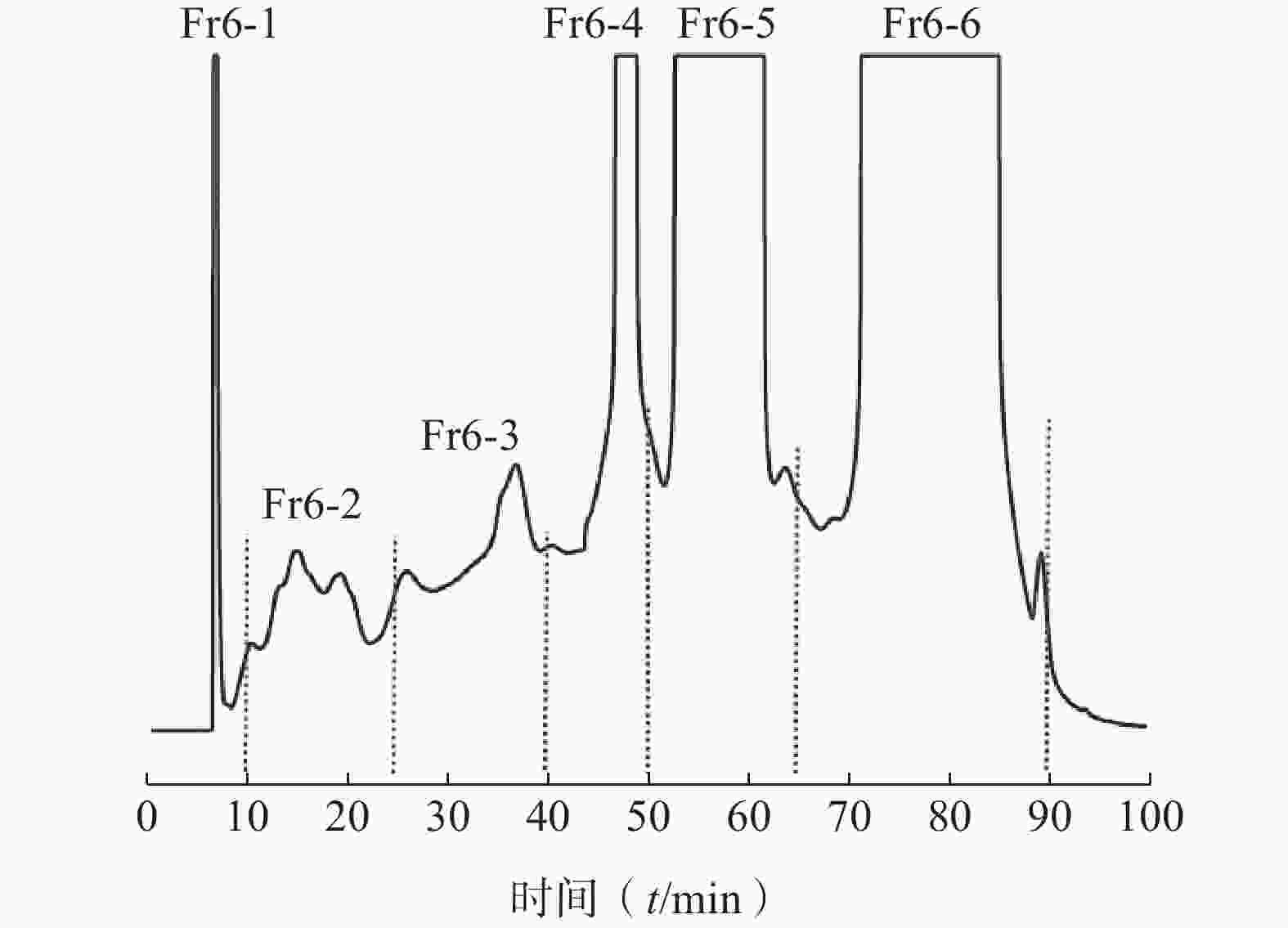
时间(t/min) 流动相A(%) 流动相B(%) 0~120 100~0 0~100 120~150 0 100 样品经过重复上样,最终收集得到7个组分(Fr1~Fr7),将收集到的各组分样品浓缩干燥。将Fr6(木藤蓼乙酸乙酯部位经中压色谱塔梯度洗脱后所得)组分(400 mg)溶解在10 ml的甲醇/水溶液(体积比5∶5)中,0.45 μm有机滤膜过滤,作为分离样品溶液。通过在线模式进行分离制备。一维制备采用HPLCONE Nap-8制备柱(20 mm×250 mm,8 μm)进行,流动相:A:0.1%甲酸-水溶液,B:甲醇,梯度条件:0~30 min,20%~23%B;30~60 min,23%~35%B;60~90 min,35%~80%B;90~100 min,80%~80%B;流速:10 ml/min;检测波长:280 nm;进样量均为10 ml;经过100 min的全自动制备分离,一维分离后的样品随着设置的保留时间分别进入 6根捕获柱(Fr6-1~Fr6-6)见图2,等待运行二维制备。
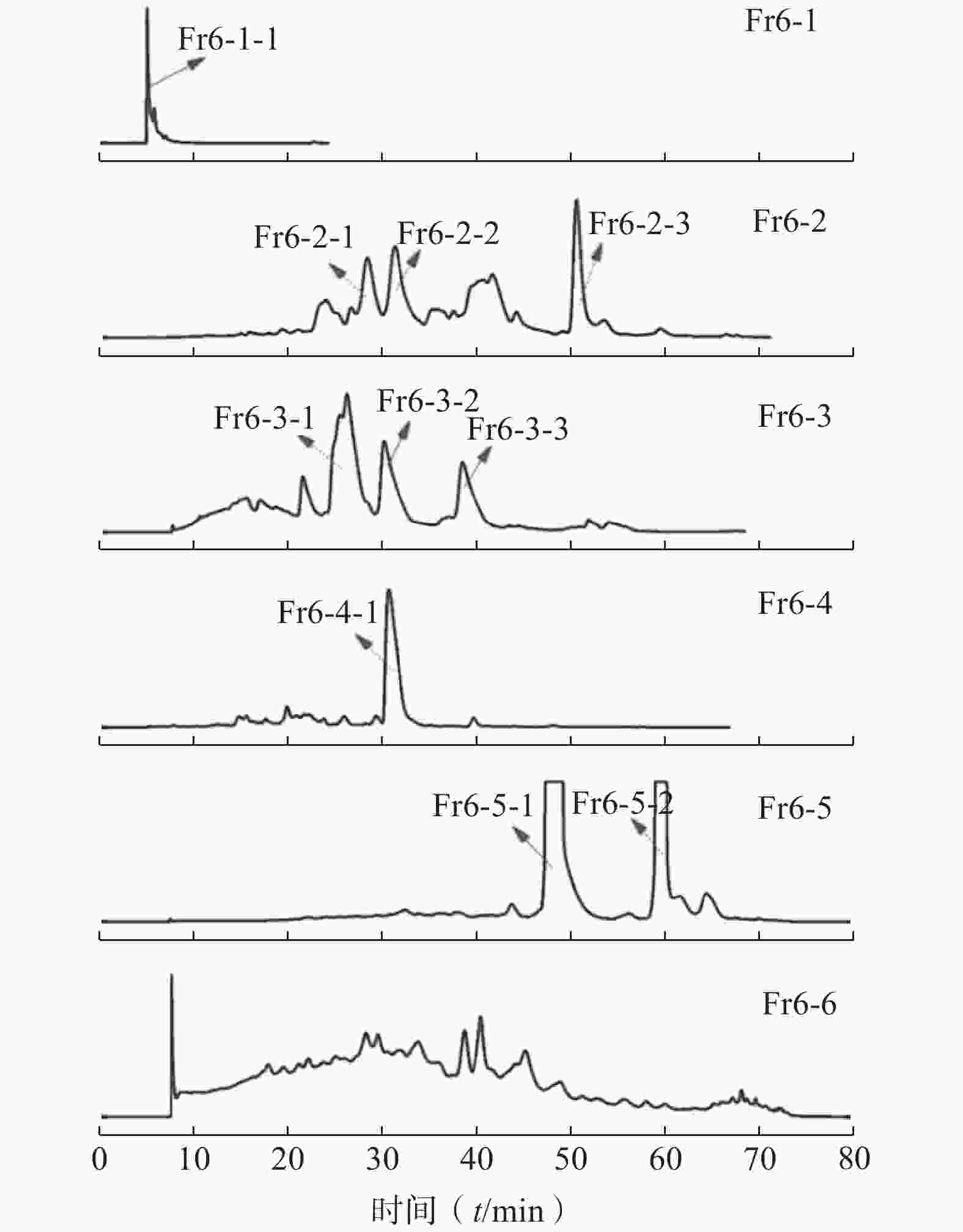
二维制备采用HT-ODS-P制备柱(20 mm×250 mm,5 μm)各馏分均采用相同的流动相A:0.1%甲酸-水溶液,B:甲醇;流速:10 ml/min;检测波长:280 nm。Fr6-1制备条件:0~40 min,30%~40%B;40~50 min,40%~60%B;50~90 min,60%~80%B;90~100 min,80%~80%B,得化合物1(42 mg);Fr6-2制备条件:0~5 min,30%~30%B;5~55 min,30%~45%B;55~65 min,45%~80%B;65~100 min,80%~80%B,得化合物2(17 mg);化合物3(9 mg)、化合物4(14 mg)、Fr6-3~Fr6-4均采用相同的制备条件:0~5 min,35%~35%B;5~55 min,35%~45%B;55~65 min,45%~80%B;65~100 min,80%~80%B;化合物5(16 mg)、化合物6(22 mg)、化合物7(29 mg)、化合物8(41 mg)、Fr6-5和Fr6-6也采用相同制备条件:0~5 min,40%~40%B;5~55 min,40%~50%B;55~65 min,50%~80%B;65~100 min,80%~80%B,得化合物9(54 mg)、化合物10(58 mg),见图3。其中,化合物1(Fr6-1-1)、化合物2(Fr6-2-1)、化合物3(Fr6-2-2)、化合物4(Fr6-2-3)、化合物8(Fr6-4-1)均是从木藤蓼中首次分离得到。
-
化合物1(Fr6-1-1):白色粉末,ESI-MSm/z:301.1 [M-H]−,化学式为C13H18O8,分子量为:302.10。1H NMR(600 MHz, MeOH-d4)7.01(1H, d, J = 8.6 Hz, H-6), 6.45(1H, d, J = 2.2 Hz, H- 3), 6.28(1H, dd, J = 8.6, 2.2 Hz, H-5), 4.69(1H, d, J = 7.4 Hz, H- 1'), 3.80(3H, s, H- 7), 3.85~3.31(5H, m, H-2"~6"); 13C NMR(151 MHz, MeOH-d4)154.9(C-2), 152.0(C-4), 141.0(C- 1), 120.5(C-6), 107.6(C-1'), 104.3(C-5), 101.8(C-3), 78.1(C-5'), 77.8(C-3'), 75.0(C-2'), 71.4(C-4'), 62.5(C-6'), 56.5(C-7)。以上数据与文献报道的数据一致,故化合物Fr6- 1- 1 鉴定为Isotachioside[8]。
化合物2(Fr6-2-1):白色粉末,ESI-MS m/z:497.35[M-H]-,化学式为C22H28O13,分子量为:498.13。1H NMR(600 MHz, MeOH-d4)7.07(2H, s, H-2", 6"), 6.40(2H, s, H-2, 6), 4.83(1H, d, J = 7.6 Hz, H- 1'), 4.65~3.42(5H, m, H-2'~6'), 3.66(9H, s, H-7, 8, 9); 13C NMR (151 MHz, MeOH-d4) 166.9 (C-7"), 154.5 (C-3, 5), 153.3(C-1),145.2(C-3",5"),138.5(C-4"), 133.3(C-4), 120.0(C- 1 "), 108.7(C-2",6"), 101.9(C- 1'), 94.9(C-2, 6), 76.3(C-5'), 74.4(C-3'), 73.5(C-2'), 70.3(C-4'), 63.7(C-6'), 59.8(C-8), 55.1(C-7,9).以上数据与文献报道一致,故化合物Fr6-2-1鉴定为 3,4,5-trimethoxyphenyl-(6'-O-galloyl)-O-β-D-glucopyranoside[9]。
化合物3(Fr6-2-2):白色粉末,ESI-MS m/z:497.34[M-H]−,化学式为C22H26O13,分子量为:498.14。1H NMR (600 MHz, MeOH-d4) 7.07 (2H, s, H-2, 6), 6.40 (2H, s, H-2", 6"), 4.83(1H, d, J = 7.5Hz, H-1'), 4.65~3.42(5H, m, H-2'~6'), 3.68(9H, s, H-7, 8, 9); 13C NMR(151 MHz, MeOH-d4) 168.2(C-7"), 155.8(C-1"), 154.7(C-3",5"), 146.5(C-3,5), 139.8(C-1), 134.6(C-4), 121.3(C-2,6), 110.1(C-2", 6"), 103.2(C-1'), 96.3(C-4"), 77.6(C-5'), 75.8(C-3'), 74.8(C-2'), 71.7(C-4'), 65.0(C-6'), 61.2(C-8), 56.4(C-7,9).以上数据与文献报道的数据一致,故化合物Fr6-2-2鉴定为1-hydroxy-3,4,5-1-O-[6'-O-(4''-carboxy-1'',3'',5'trihydrotrimethoxyphenylxy)-phenyl]-β-D-glucopyranoside[10]。
化合物4(Fr6-2-3):黄色粉末,ESI-MS m/z:463.28[M-H]−,化学式为C21H20O12,分子量为: 464.38。1H NMR(600 MHz, MeOH-d4)6.96(2H, s, H-2', 6'), 6.37(1H, d, J = 2.1 Hz, H-8), 6.21(1H, d, J = 2.1 Hz, H-6), 5.33(1H, d, J = 1.4 Hz, H- 1"), 4.23~3.35(4H, m, H-2"~5"), 0.98(3H, d, J = 6.2 Hz, H-6");13C NMR(151 MHz, MeOH-d4)179.6(C-4), 165.8(C-7), 163.2(C-5), 159.4(C-9), 158.5(C-2), 146.8(C- 3', 5'), 137.8(C-4'), 136.3(C-3), 121.9(C- 1'), 109.5(C-2', 6'), 105.8(C- 1"), 103.6(C- 10), 99.7(C-6), 94.6(C-8), 73.3(C-2"), 72.1(C-5"), 72.0(C-4"), 71.8(C-3"), 17.6(C-6").以上数据与文献报道的数据一致,故化合物Fr6-2-3鉴定为myricetrin[11]。
化合物5(Fr6-3-1):黄色粉末,ESI-MS m/z:317.10 [M-H]−化学式为 C15H10O8,分子量为:318.03。 1H NMR(CD3OD, 600 MHz)7.33(2H, s, H-2', H-6'), 6.37(1H, d, J =2.1 Hz, H-8), 6.17(1H, d, J = 2.1 Hz, H-6).13C NMR(CD3OD, 150 MHz): 177.3(s, C-4), 165.5(s, C-7), 162.5(s, C-5), 158.2(s, C-9), 148.0(s, C-2), 146.7(s, C-3', C-5'), 137.4(s, C- 4'), 136.9(s, C-3), 123.1(s, C- 1'), 108.5(d, C-2', C-6'), 104.5(s, C- 10), 99.2(d, C-6), 94.3(d, C-8).以上数据与文献报道的数据一致,故化合物 Fr6-3-1鉴定为Myricetin[12]。
化合物6(Fr6-3-2):黄色粉末,ESI-MS m/z:609.45[M-H]-,化学式为C27H30O16,分子量为:610.15。1H NMR(600 MHz, DMSO-d6): 7.53(1H, dd, J = 8.0, 2.2 Hz, H-6'), 7.52(1H, d, J = 2.2 Hz, H-2'), 6.83(1H, d, J = 8.0 Hz, H-5'), 6.37(1H, d, J = 1.9 Hz, H-8), 6.18(1H, d, J = 1.9 Hz, H-6), 5.34(1H, d, J = 7.3 Hz, H- 1''), 5.32(1H, d, J = 7.3 Hz, H- 1'''), 3.71~3.22(10H, m, H-2''~H-6'', H-2'''~H-6'''), 0.98(3H, d, J = 6.2 Hz, H-6'''); 13C NMR(151 MHz, DMSO-d6) 177.3(C-4), 164.2(C-7), 161.2(C-5), 156.5(C-9), 156.4(C-2), 148.4(C-4'), 144.7(C-3'), 133.2(C-3), 121.5(C-1'), 121.1(C-6'), 116.2(C-5'), 115.2(C-2'), 103.9(C-10), 101.1(C-1''), 100.7(C-1'''), 98.7(C-6), 93.5(C-8), 76.4(C-3''), 75.8(C-5''), 74.0(C-2''), 71.8(C-4'''), 70.5(C-3'''), 70.3(C-2'''), 69.9(C-4''), 68.2(C-5'''), 66.9(C-6''), 17.7(C-6'''). 以上数据与文献报道的数据一致,故化合物Fr6-3-2 鉴定为Rutin[13]。
化合物7(F6-3-3):黄色粉末,ESI-MS m/z:463.31[M-H]-,化学式为C22H23O12,分子量为:464.38。1H NMR(600 MHz, MeOH-d4)7.85(1H, d, J = 2.1 Hz, H-2'), 7.60(1H, dd, J = 8.4, 2.1 Hz, H-6'), 6.87(1H, d, J = 8.4 Hz, H-5'), 6.42(1H, d, J = 2.1 Hz, H-8), 6.22(1H, d, J = 2.1 Hz, H-6), 5.18(1H, d, J = 7.5 Hz, H- 1"), 3.86~3.47(5H, m, H-2"~6"); 13C NMR(151 MHz, MeOH-d4)179.5(C-4), 166.0(C-7), 163.0(C-5), 158.8(C-9), 158.4(C-2), 149.9(C-3'), 145.8(C-4'), 135.7(C-3), 122.9(C-1'), 122.8(C-6'), 117.7(C-5'), 116.0(C-2'), 105.6(C-1"), 105.3(C-10), 99.8(C-6), 94.6(C-8), 77.2(C-5"), 75.1(C-3"), 73.1(C-2"), 70.0(C-4"), 61.9(C-6").以上数据与文献报道的数据一致,故化合物Fr6-3-3鉴定为quercetin-3-O- β-D-galactoside[14]。
化合物8(F6-4-1):黄色粉末,ESI-MS m/z:463.30[M-H]-,化学式为C22H23O12,分子量为:464.38。1H NMR(600 MHz, MeOH-d4)7.72(1H, d, J = 2.1 Hz, H-2'), 7.60(1H, dd, J = 8.2, 2.1 Hz, H-6'), 6.89(1H, d, J = 8.2 Hz, H-5'), 6.41 (1H, d, J = 2.1Hz, H-8), 6.22 (1H, d, J = 2.1 Hz, H-6), 5.27 (1H, d, J = 7.5 Hz, H- 1"), 3.73~3.21 (6H,m, H-2"~6");13C NMR (151MHz, MeOH-d4) 179.5(C-4), 166.0(C-7), 163.1(C-5), 159.0(C-9), 158.5(C-2), 149.8(C-3'), 145.9(C-4'), 135.6(C-3), 123.1(C-1'), 123.0(C-6'), 117.5(C-5'), 116.0(C-2'), 105.7(C-1"), 104.2(C-10), 99.8(C-6), 94.6(C-8), 78.4(C-5"), 78.1(C-3"), 75.7(C-2"), 71.2(C-4"), 62.5(C-6").以上数据与文献报道的数据一致,故化合物Fr6-4-1鉴定为quercetin-3-O- β-D-glucopyranoside[15]。
化合物9(Fr6-5-1):白色粉末,ESI-MS m/z:312.25 [M-H]-,化学式为C18H19NO4,分子量为:313.13。1H NMR(600 MHz, MeOH-d4)7.37(1H, d, J = 2.0 Hz, H-3), 7.00(2H, d, J = 8.5 Hz, H-2", 6"), 6.94(1H, dd, J = 8.2, 2.0 Hz, H-6'), 6.75(1H, d, J= 8.2 Hz, H-5'), 6.70(2H, d, J = 8.5 Hz, H-3", 5"), 6.63(1H, d, J = 12.6 Hz, H-6), 5.83(1H, d, J = 12.6 Hz, H-5), 3.84(3H, s, H-7"), 3.42(2H, t, J = 7.3 Hz, H-2), 2.70(2H, t, J = 7.3 Hz, H-1); 13C NMR(151 MHz, MeOH-d4)170.3(C-4), 156.9(C-4"), 148.5(C- 3'), 142.0(C-4'), 138.3(C-6), 131.1(C- 1'), 130.6(C-2", 6"), 128.5(C- 1"), 124.8(C-6'), 121.6(C-5), 116.2(C-3", 5"), 115.8(C-5'), 113.9(C-2'), 56.3(C-7"), 42.3(C-2), 35.5(C- 1).以上数据与文献报道的数据一致,故化合物Fr6-5-1鉴定为lyciumideA[16]。
化合物10(Fr6-5-2):白色粉末,ESI-MS m/z:312.22[M-H]-,化学式为C18H19NO4,分子量为:313.13。1H NMR(600 MHz, MeOH-d4)7.45(1H, d, J = 15.5 Hz, H- 1), 7.12(1H, d, J = 2.0 Hz, H-2'), 7.05(2H, d, J = 8.6 Hz, H-2", 6"), 7.03(1H, dd, J = 8.0, 2.0 Hz, H-6'), 6.80(1H, d, J = 8.0 Hz, H-5'), 6.72(2H, d, J = 8.6 Hz, H-3", 5"), 6.42(1H, d, J = 15.5 Hz, H-2), 3.89(3H, s, H-7'), 3.47(2H, t, J = 7.3 Hz, H-5), 2.76(2H, t, J = 7.3 Hz, H-6);13C NMR(151 MHz, MeOH-d4)169.1(C-3), 156.9(C-4"), 149.8(C-3'), 149.2(C-4'), 142.0(C-1), 131.3(C-1"), 130.7(C-2", 6"), 128.2(C-1"), 123.2(C-6'), 118.7(C-2), 116.4(C-5'), 116.2(C-3", 5"), 115.5(C-2'), 56.3(C-7'), 42.5(C-5), 35.8(C-6).以上数据与文献报道的数据一致, 故化合物 Fr6-5-2鉴定为 N-trans-Feruloyltyramine[17]。
-
对分离所得化合物进行体外黄嘌呤氧化酶抑制活性测定,用1%DMSO溶解各化合物至浓度100 mg/ml,4 ℃保存,临用时用PBS溶液稀释至所需浓度进行测定,以黄嘌呤为底物,别嘌醇为阳性药,进行体外黄嘌呤氧化酶抑制活性测定。在25 ℃下,采用96孔板,加入50 μl酶溶液(反应终浓度为0.05 U/ml),50 μl样品溶液,反应体系总体积为200 μl,25 ℃温育15 min后,加入50 μl黄嘌呤(终浓度为100 μmol/L)启动反应,于295 nm下检测吸光度(A值),作为0 min时的A值。于25 ℃温育20 min后,加入1 mol/L的盐酸溶液50 μl终止反应,检测A值,取该值与温育0 min时A值的差值作为检测结果,计算抑制率。XOD抑制率计算公式为:抑制率(%)=[1−(样品A值−空白A值)/(酶A值−空白A值)]×100%。
采用Graphpad prism 6.0软件进行数据分析,计算半数黄嘌呤氧化酶被抑制时的药物浓度,即IC50。
结果表明,阳性对照品别嘌醇的IC50值为10.83 μmol/L,化合物5黄嘌呤氧化酶抑制活性最强,IC50值为15.92 μmol/L,其次为化合物6,IC50值为87.36 μmol/L,两个槲皮素衍生物,化合物7的IC50值为95.05 μmol/L,化合物8的IC50值为90.33 μmol/L,其他化合物没有明显的黄嘌呤氧化酶抑制作用(IC50值均大于100 μmol/L)。
-
近年来,藏药因其悠久的用药历史,显著的治疗效果受到广泛关注。本研究以传统藏药材木藤蓼为研究对象,以其乙酸乙酯萃取部位Fr6组分为分析对象,首先在色谱柱HPLCONE-8nap和HT-ODS-P进行HPLC分析,根据色谱峰的显示,确定了在线二维检测系统中色谱柱的位置,将摸索好的条件输入在线二维液相色谱仪之后,全部的工作在计算机控制下自动进行。建立一个全面的在线二维检测系统,快速高效的从该组分离得到10个单体化合物,其中,化合物1(Fr6-1-1)、化合物2(Fr6-2-1)、化合物3(Fr6-2-2)、化合物4(Fr6-2-3)、化合物8(Fr6-4-1)均是从木藤蓼中首次分离得到。
活性筛选方面,酶与底物浓度是否合适,会直接影响到筛选结果的准确性,需对XOD抑制活性体系进行优化,选择合适的底物浓度。在本实验中,样品加入后可与酶及底物发生酶促反应,设置空白并扣除空白值以减小每次读数的微小差异,保证实验结果的准确性。研究表明[18],底物溶液黄嘌呤浓度增加至100 μmol/L时,黄嘌呤已趋于饱和状态,继续增加底物溶液黄嘌呤浓度,则黄嘌呤溶解度不再增加;反应温度为37 ℃时,酶促反应速度很快,数据波动明显,容易产生误差;反应温度为25 ℃时,酶促反应温和,吸光度变化与时间线性关系良好,测定误差降低。实验证实当黄嘌呤浓度达到100 μmol/L,反应温度25 ℃,反应时间为5 min时,A值在0.6~1.2之间,系统误差最低。
从实验结果来看,黄酮类化合物对XOD的活性有较好的抑制作用。目前已有文献报道,芦丁可以抑制XOD的活性,降低尿酸的生成。槲皮素可以抑制URAT1蛋白的转运能力,减少肾脏对尿酸的重吸收,增加尿酸的排泄[19]。有研究结果显示,槲皮素对XOD有很好的抑制作用,黄酮类化合物对XOD的抑制作用与黄酮的氢键、脂溶性、羟基位置等结构有关[20]。黄酮类化合物大多来源于天然产物,来源广泛且安全性较高,不仅在降尿酸方面有着巨大的潜力,在抗氧化、抗炎方面也显示了一定的疗效[21]。李欣[22]等对木藤蓼抗炎镇痛作用的动物实验表明,木藤蓼醇提物可以明显缓解小鼠疼痛反应阈值及二甲苯导致的小鼠耳廓肿胀,而黄酮类成分是木藤蓼的主要成分,木藤蓼对黄嘌呤氧化酶的抑制作用可能与此有关,与藏医针对关节肿胀、痛风、风湿性关节等病症相关,但其对黄嘌呤氧化酶发挥抑制作用的具体机制还需进一步深入探究。
Separation of chemical constituents of Tibetan medicine Fallopia aubertii L.Henry Holub by two-dimensional liquid chromatography
-
摘要:
目的 研究藏药木藤蓼的化学成分。 方法 采用在线二维制备液相法对木藤蓼化学成分进行分离纯化,通过理化性质、理化常数和波谱分析鉴定化合物结构。采用紫外分光光度法测定黄嘌呤氧化酶的抑制活性。 结果 从木藤蓼提取物分离得到10个化合物,分别为:isotachioside( 1 )、3,4,5-trimethoxyphenyl-(6'-O-galloyl)-O-β-D-Glucopyranoside( 2 )、1-hydroxy-,4,5-1-O-[6'-O-(4''-carboxy-1'',3'',5'trihydrotrimethoxyphenylxy)-phenyl]-β-D-glucopyranoside( 3 )、myricetrin( 4 )、myricetin( 5 )、rutin( 6 )、quercetin-3-O-β-D-galactoside( 7 )、quercetin-3-O-β-D-glucopyranoside( 8 )、lyciumideA( 9 )、N-trans-feruloylty ramine( 10 )。活性测试结果表明,化合物 5 的IC50值为15.92 μmol/L,化合物 6 的IC50值为87.36 μmol/L。 结论 化合物 1 、 2 、 3 、 4 、 8 是首次从木藤蓼中分离得到;化合物 5 、 6 具有黄嘌呤氧化酶抑制活性。 Abstract:Objective To study the chemical constituents of Fallopia aubertii L.Henry Holub. Methods The chemical constituents of Fallopia aubertii L.Henry Holub. were separated and purified by online two-dimensional preparative liquid chromatography and identified by physical and chemical constants and spectral analysis. The inhibitory activities on xanthine oxidase were determined by ultraviolet spectrophotometry. Results Ten compounds were isolated from the extract of Fallopia aubertii L.Henry Holub, including isotachioside( 1 ), 3,4,5-trimethoxyphenyl-(6'-O-galloyl)-O-β-D-Glucopyranoside( 2 ), 1-hydroxy-,4,5-1-O-[6'-O-(4''-carboxy-1'',3'',5'trihydrotrimethoxyphenylxy)-phenyl]-β-D-glucopyranoside( 3 ), myricetrin( 4 ), myricetin( 5 ), rutin( 6 ), quercetin-3-O-β-D-galactoside( 7 ), quercetin-3-O-β-D-glucopyranoside( 8 ), lyciumideA( 9 ), and N-trans-Feruloyltyramine( 10 ). The inhibitory activity test results showed that the IC50 of compound 5 was 15.92 μmol/L, and the IC50 of compound 6 was 87.36 μmol/L. Conclusion Compounds 1 , 2 , 3 , 4 and 8 were isolated from Medicago polymorpha for the first time. Compounds 5 and 6 had xanthine oxidase inhibitory activity. -
表 1 梯度洗脱条件
时间(t/min) 流动相A(%) 流动相B(%) 0~120 100~0 0~100 120~150 0 100 -
[1] 中国植物志编辑委员会. 中国植物志(第25卷第1分册): 蓼科分册[M]. 北京: 科学出版社, 1998, 25(1): 10. [2] 罗达尚. 中华藏本草[M]. 北京: 民族出版社, 1997. [3] 蒂玛尔·丹增彭措著. 毛继祖等重译. 晶珠本草[M]. 上海: 上海科学技术出版社, 2012: 329. [4] 中国科学院西北高原生物研究所. 藏药志[M]. 西宁: 青海人民出版社, 1991. [5] 毛继祖, 吉守祥, 卢永昌, 等. 藏医药基础知识[M]. 西宁: 青海人民出版社, 2011. [6] 李文蔚, 朱子煜, 浩天瑞霖, 等. 新型分离纯化技术在天然产物中的应用[J]. 化学进展, 2024, 36(5): 667-678. [7] 刘向国, 刘向凌, 宿书芳, 等. 在线二维液相色谱法测定发酵虫草菌粉(Cs-4)中6种活性物质[J]. 中国药物评价, 2023, 40(1): 65-70. doi: 10.3969/j.issn.2095-3593.2023.01.013 [8] 张普照, 张亚梅. 瓦山安息香树皮的化学成分研究[J]. 中草药, 2015, 46(8): 1129-1132. [9] 达娃央宗. 两种虎耳草外源性自由基抑制剂活性成分研究[D]. 西宁: 青海师范大学, 2021. [10] CHEN S J, HUANG Y Z, JIAN LU, et al. Phenolic Components from Roots of Psidium guajava[J]. Plant Foods Hum Nutr, 2019, 74(3): 350-357. doi: 10.1007/s11130-019-00744-8 [11] 胡阿荣. 文冠果茶叶的化学成分及质量标准研究[D]. 通辽: 内蒙古民族大学, 2024. [12] 王东梅, 周敏, 刘燕, 等. 聚花野丁香的化学成分及其抗氧化活性[J]. 应用与环境生物学报, 2019, 25(6): 1492-1496. [13] 杨铭竹. 牡丹花粉中化学成分分离、结构修饰及抗炎活性研究[D]. 济南: 齐鲁工业大学, 2024. [14] OUYANG W, ZHU X A, HE C X, et al. Chemical constituents from ethyl acetate extract of Psidium guajava leaves(II)[J]. Zhong Yao Cai, 2015, 38(8): 1649-1652. [15] 王玉萍, 史波林, 刘珺琪, 等. 花椒果皮正丁醇部分化学成分研究[J]. 中草药, 2023, 54(5): 1353-1361. [16] 周童. 黄花三宝木中化学成分与生物活性研究[D]. 扬州: 扬州大学, 2019. [17] OTHMAN A, AMEN Y, MATSUMOTO M, et al. Bassiamide A, a new alkaloid from xero-halophyte Bassia indica Wight[J]. Nat Prod Res, 2022, 36(14): 3610-3618. doi: 10.1080/14786419.2021.1872572 [18] 杨琴芳, 袁红宇, 钱雅璐. 买麻藤提取物抑制黄嘌呤氧化酶活性实验研究[J]. 江苏中医药, 2009, 41(12): 77-78. [19] 张岑. 黄酮化合物抑制黄嘌呤氧化酶活性的分子机制及其包埋物的理化性质研究[D]. 南昌: 南昌大学, 2017. [20] 郝悦, 焦安妮, 于敏, 等. 30种黄酮抑制黄嘌呤氧化酶活性的筛选[J]. 中成药, 2019, 41(1): 55-59. doi: 10.3969/j.issn.1001-1528.2019.01.012 [21] 董渭雪. 樱桃黄酮组分及降尿酸作用研究[D]. 汉中: 陕西理工大学, 2020. [22] 李欣, 卢永昌, 任梅娟, 等. 藏药木藤蓼乙醇提取物镇痛抗炎及抗高尿酸血症作用的研究[J]. 湖南师范大学自然科学学报, 2019, 42(3): 49-54. -




 下载:
下载: