-
固相萃取技术是根据物质组分在固定相和流动相之间的分配系数及吸附力的不同所导致的差速迁移,使用特定的流动相洗脱可以达到特异性提取待测组分的作用[1-2]。联勤保障部队第九〇〇医院制剂复方甘草口服溶液中不仅加入了甘草流浸膏和复方樟脑酊等成分复杂的原料,还加入了愈创甘油醚和甘油等成分,组分十分复杂[3]。在《中华人民共和国药典》(二部)2020年版(简称《中国药典》)[4]中并未规定使用何种固相萃取柱测定复方甘草溶液中吗啡含量。日常测定复方甘草口服溶液吗啡含量时,使用固相萃取柱提取吗啡所消耗的时间长,影响制剂检测效率,给临床使用带来不便。现有文献中虽有比较不同厂家和规格的固相萃取柱测定复方甘草口服溶液的研究[5],但是没有对固相萃取柱在加压条件下流速的研究。本文从价格成本和时间成本两方面,探究固相萃取柱在检测复方甘草口服溶液吗啡含量中的最多重复使用次数;研究填料含量不同以及使用加压泵加压对吗啡含量测定的影响,为复方甘草口服溶液吗啡含量测定提供改进方案,对日常制剂检测具有重要的现实意义。
-
安捷伦1200型高效液相色谱仪(美国安捷伦公司);Simplicity纯水仪(美国Millipore公司)。复方甘草口服溶液(批号:20211231、20220323、20220507,联勤保障部队第九〇〇医院药剂科)、吗啡对照品(批号:171201-200521,中国药品生物制品检定所),甲醇、乙腈为色谱纯,水为超纯水,其他试剂均为分析纯。C18固相萃取柱(规格:100、200、250、500 mg,江苏绿盟科学仪器有限公司)。
-
根据《中国药典》[4]的规定,本品每1 ml 中含无水吗啡(C17H19NO3)应为
0.0765 ~0.1040 mg。 -
色谱柱:依利特C8色谱柱(4.6 mm×150 mm,5 μm);流动相:乙腈-2.5 mmol/L庚烷磺酸钠溶液-50 mmol/L磷酸二氢钾溶液(5∶18∶18);流速: 1 ml/min;检测波长:220 nm;进样量:20 μl;柱温:30℃。
-
精密称定吗啡对照品10 mg置于100 ml量瓶中,用5%的醋酸溶液溶解,稀释至刻度,作为对照品储备液。精密量取上述溶液2.5 ml置于25 ml量瓶中,加5%醋酸溶液稀释至刻度,摇匀,作为对照品溶液。
-
按照复方甘草口服溶液处方,将其中含有吗啡的复方樟脑酊除去,其余按照处方标准,制成阴性对照溶液。
-
取固相萃取柱,依次用甲醇-水(3∶1)15 ml 与水5 ml 冲洗,再用pH 值约为9 的氨水溶液(取水适量,滴加氨试液至pH 值为9)冲洗至流出液pH 值约为9,待用。
取本品,超声10 min, 取出摇匀;精密量取0.5 ml置于处理后的固相萃取柱上,滴加氨试液适量使柱内溶液的pH 值约为9,用水20 ml 淋洗,弃去淋洗液,用5% 醋酸溶液洗脱,用5 ml 量瓶收集洗脱液至刻度,摇匀。
-
选择国产品牌的市售不同填料含量的C18固相萃取柱,按“2.3.3”项下操作。对比4种不同填料含量的固相萃取柱对复方甘草口服溶液吗啡含量测定的影响,每种填料含量的固相萃取柱各取6支。如表1所示,在填料量为100 mg和200 mg时,固相萃取柱对复方甘草口服溶液吗啡的提取不完全,在250 mg 和500 mg填料含量规格时吗啡可以被固相萃取柱完全吸附,但是250 mg规格已停产市面上不再售卖。因此本实验最终选择使用500 mg的固相萃取柱进行复方甘草口服溶液吗啡含量测定。精密量取吗啡对照品适量,置于500 mg固相萃取柱中,每种浓度的吗啡对照品各取6份。活化和分离步骤按“2.3.3”项下操作,计算回收率和RSD值。如表2所示,500 mg填料含量固相萃取柱对吗啡回收率良好。
表 1 不同填料含量固相萃取柱对吗啡含量测定的影响(n=6)
填料含量(m/mg) 供试品吗啡平均含量(mg/ml) RSD(%) 100 0.047 5 1.81 200 0.077 4 1.33 250 0.087 0 0.98 500 0.087 1 1.39 表 2 500 mg填料含量固相萃取柱对吗啡回收率的影响(n=6)
浓度(mg/ml) 平均回收率(%) RSD(%) 0.08 98.13 1.36 0.10 98.53 0.35 0.12 98.81 0.68 -
根据上述实验选出的填料含量,按“2.3.3”项下方法处理同一批次的3份复方甘草口服溶液(批号:20220323)并分别重复使用,计算吗啡的平均含量和RSD值,探究其最大使用次数。如表3所示,固相萃取柱在前3次使用时含量同第1次并无明显区别。但在第4次使用检测时发现,固相萃取柱的吗啡含量均小于前3次测量的吗啡含量,同上一次相比下降了8%,且在第5次重复使用时测得的吗啡含量与前3次相比下降了15%。因此,固相萃取柱最多只可重复使用3次。
表 3 重复使用次数对吗啡含量测定的影响
使用次数 样品含量(mg/ml) 样品1 样品2 样品3 平均 RSD(%) 1 0.086 9 0.086 8 0.087 0 0.086 9 0.12 2 0.086 8 0.086 9 0.086 6 0.086 8 0.18 3 0.086 8 0.086 7 0.086 8 0.086 8 0.07 4 0.079 6 0.082 0 0.079 0 0.080 2 1.98 5 0.073 8 0.077 0 0.071 0 0.073 9 4.06 -
通过固相萃取加压装置控制流速与常压下流速进行比较,按“2.3.3”项下方法处理复方甘草口服溶液(批号:20220323)。如表4所示,在加压下,流速在0.5~30 ml/min之间所测得的供试品吗啡浓度呈不断下降的趋势。流速越快,吗啡含量越低。在控制流速为0.5 ml/min时吗啡含量测得与常压下0.24 ml/min测得的吗啡含量无明显的差异,且能显著提高检测效率。因此本实验选择在加压条件下控制流速约为0.5 ml/min进行复方甘草口服溶液吗啡含量测定。
表 4 加压条件下固相萃取柱对吗啡含量测定的影响
柱内流速(ml/min) 供试品吗啡浓度(mg/ml) 30.00 0.010 0 12.00 0.033 1 8.40 0.038 2 5.40 0.054 3 2.40 0.066 5 0.84 0.079 1 0.50 0.087 0 0.24 0.087 0 -
综上所述,本实验建议选用国产品牌500 mg的固相萃取柱在加压下控制流速约为0.5 ml/min进行复方甘草口服溶液吗啡的含量测定。现就此方法进行方法学验证。
-
取0.1 mg/ml的吗啡对照品0.5 ml置处理后的固相萃取柱上,按照供试品溶液相同的洗脱条件洗脱,收集洗脱液5 ml,摇匀,作为固相萃取柱系统适用性溶液。精密量取该溶液与对照品溶液各10 μl,分别注入液相色谱仪,记录色谱图。根据峰面积测得固相萃取柱系统适用性试验结果(fs)为0.99,符合规定要求(fs值应在0.97~1.03之间)。
-
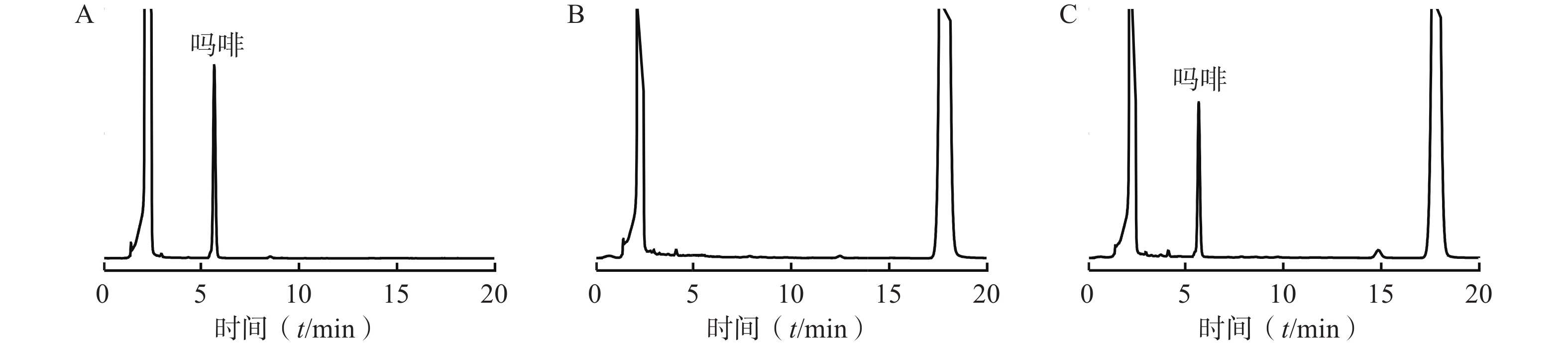
由图1所示,吗啡对照品溶液中吗啡在5~6 min时出峰,供试品溶液在此处有吗啡峰,而阴性对照在此时间段无吗啡峰,本实验专属性良好。
-
精密量取吗啡对照品储备液适量置50 ml量瓶中,加5% 醋酸溶液稀释至刻度,配制成浓度为2、5、10、16、20、30 µg/ml的标准曲线工作液,按“2.2”项下的色谱条件进行测定。以吗啡的浓度(µg/ml)为横坐标(X),峰面积为纵坐标(Y),进行线性回归,得Y=55.19 X−14.12(r=0.999 5),线性关系良好。
-
取吗啡对照品溶液,按“2.2”项下色谱条件重复进样6次,记录峰面积。结果显示吗啡峰面积的RSD为0.27%,表明仪器精密度良好。
-
取同一份供试品溶液(批号:20220323),分别于 0、2、4、6、8、10、12 h,按“2.2”项下色谱条件进样测定峰面积,吗啡峰面积的 RSD 为 1.06%,结果表明供试品溶液在 12 h 内稳定。
-
取同一批次的复方甘草口服溶液(批号:20220323)6份,按照“2.3.3”项下方法制备供试品溶液,按“2.2”项下色谱条件测定峰面积,结果显示吗啡峰面积的RSD值为1.05%,表明方法重复性良好。
-
精取量取已知含量的同一批次复方甘草口服溶液(批号:20220323)0.25 ml于固相萃取小柱内,共9份,分别精密加入低、高、中3个不同浓度(相当于吗啡含有量的80%、100%、120%)的吗啡对照品储备液(每个浓度各3份),按“2.3.3”项下供试品的制备方法操作,按“2.2”项下的色谱条件测定,记录吗啡峰面积并计算回收率。结果显示,吗啡的平均回收率分别为98.1%、98.3%、98.5%,RSD值分别为1.21%、0.63、0.45%,表明试验回收率良好。
-
精密量取3个批号复方甘草口服溶液(批号:20211231、20220323、20220507),按照“2.3.3”项下处理制备供试品溶液,按“2.2“项下条件测定,每个批号平行测定3次。测得吗啡平均含量分别为0.086 9、0.087 3、0.087 1 mg/ml。
综上所述,使用该国产品牌500 mg的固相萃取柱在加压下控制流速约为0.5 ml/min进行复方甘草口服溶液吗啡的含量测定,方法学验证效果良好,在此固相萃取柱使用条件下测定复方甘草口服溶液吗啡的含量方法可行,此方法可用于本院制剂复方甘草口服溶液吗啡含量测定。
-
市场上的固相萃取柱品牌多样,同样规格的C18固相萃取柱,不同厂家的价格具有非常大的差异,国外进口品牌的固相萃取柱价格是国产品牌的3~4倍[6-8]。固相萃取柱填料量少则会导致吗啡无法完全提取,含量测定不准确,填料过多则会导致吗啡的含量测定费时费力[9]。固相萃取柱使用成本较高,且通常使用一次就丢弃,若固相萃取柱重复多次使用,可大大对降低检测成本。此外,日常对复方甘草口服溶液吗啡含量测定时,使用固相萃取柱提取吗啡基本需要2 d的时间,给吗啡的含量测定效率产生很大的影响,延长了制剂检测报告和投入临床使用的时间。加压又可能因流速过快导致目标化合物在固相萃取柱内保留的不充分,随杂质一起流失,因此在保证复方甘草口服溶液吗啡回收率的前提下筛选出最佳流速可明显提高复方甘草口服溶液中吗啡含量测定的效率[10-13]。
本实验选用国产品牌500 mg的固相萃取柱,在加压下控制流速约为0.5 ml/min进行复方甘草口服溶液吗啡的含量测定,且固相萃取柱可以重复使用3次。实验经方法学验证效果良好,可用于复方甘草口服溶液吗啡含量测定,既节约了价格成本,又缩短了制剂检测和投入临床使用的时间,对本院制剂复方甘草口服溶液吗啡含量测定具有重要的现实意义。
Effect of different conditions of solid phase extraction column on determination of morphine in compound liquorice oral solution
-
摘要:
目的 探究不同填料含量、重复使用次数、加压条件的固相萃取柱对复方甘草口服溶液吗啡含量测定的影响。 方法 色谱柱为C8柱(4.6 mm×150 mm,5 μm),流动相:乙腈-2.5 mmol/L庚烷磺酸钠溶液-50 mmol/L磷酸二氢钾溶液(5∶18∶18),柱温:30℃,流速:1.0 ml/min,检测波长:220 nm,进样量:20 µl。 结果 规格为500 mg填料的固相萃取柱对吗啡有着较高的回收率,RSD值小;固相萃取柱最多可以重复使用3次;在加压条件下,流速为0.5 ml/min时,测得的吗啡含量与常压下测得的吗啡基本保持一致。 结论 复方甘草口服溶液吗啡含量测定可选择规格为500 mg的C18固相萃取柱在加压下调节流速约为0.5 ml/min下进行吗啡的提取,固相萃取柱能重复使用3次,既可完全提取复方甘草口服溶液中的吗啡,又能提高吗啡的检测效率。 Abstract:Objective To explore the effect of different packing contents of solid phase extraction column, repeated use times and solid phase extraction column under pressure on the determination of morphine content in compound liquorice oral solution. Methods The component was performed by high performance liquid chromatography (HPLC) equipped with the C8 (4.6 mm × 150 mm, 5 μm) chromatographic column. The mobile phase consisted of acetonitrile-2.5 mmol/L sodium heptanesulfonate solution-50 mmol/L potassium dihydrogen phosphate solution (5∶18∶18). The flow rate was 1.0 ml/min with the 220 nm detection wavelength, 20 μl injection volume and 30℃ column temperature. Results It was found that the SPE column produced of 500 mg had a higher recovery rate of morphine, and the RSD value was small. It was found that SPE column could be reused for up to 3 times under the condition of guaranteeing recovery rate.In the pressurized experiment,at the flow rate of 0.5 ml/min, the measured morphine content was basically consistent with that measured at atmospheric pressure. Conclusion The determination of morphine in compound liquorice oral solution could be carried out by C18 solid phase extraction column of 500 mg. Under pressure, the flow rate was about 0.5 ml/min for morphine recovery, which could achieve high recovery of morphine in compound liquorice oral solution and improve the detection efficiency of morphine. -
表 1 不同填料含量固相萃取柱对吗啡含量测定的影响(n=6)
填料含量(m/mg) 供试品吗啡平均含量(mg/ml) RSD(%) 100 0.047 5 1.81 200 0.077 4 1.33 250 0.087 0 0.98 500 0.087 1 1.39 表 2 500 mg填料含量固相萃取柱对吗啡回收率的影响(n=6)
浓度(mg/ml) 平均回收率(%) RSD(%) 0.08 98.13 1.36 0.10 98.53 0.35 0.12 98.81 0.68 表 3 重复使用次数对吗啡含量测定的影响
使用次数 样品含量(mg/ml) 样品1 样品2 样品3 平均 RSD(%) 1 0.086 9 0.086 8 0.087 0 0.086 9 0.12 2 0.086 8 0.086 9 0.086 6 0.086 8 0.18 3 0.086 8 0.086 7 0.086 8 0.086 8 0.07 4 0.079 6 0.082 0 0.079 0 0.080 2 1.98 5 0.073 8 0.077 0 0.071 0 0.073 9 4.06 表 4 加压条件下固相萃取柱对吗啡含量测定的影响
柱内流速(ml/min) 供试品吗啡浓度(mg/ml) 30.00 0.010 0 12.00 0.033 1 8.40 0.038 2 5.40 0.054 3 2.40 0.066 5 0.84 0.079 1 0.50 0.087 0 0.24 0.087 0 -
[1] 何婷婷, 齐冬琴, 宋姣. 食品检测前处理中固相萃取技术的应用[J]. 现代食品, 2022, 28(17): 41-43. [2] 华叙荣, 于涛, 徐哲婷. 固相萃取技术的作用机制及在化学分析中的应用进展[J]. 江西化工, 2019, (1): 26-29. [3] 曾庆花, 黄慧, 杨娜, 等. 高效液相色谱法测定复方甘草口服溶液中8种防腐剂[J]. 化学分析计量, 2022, 31(7): 18-22. [4] 国家药典委员会. 中华人民共和国药典(二部)2020年版[S]. 北京: 中国医药科技出版社, 2020: 959. [5] 秦庆芳, 林华, 廖艺. 31批复方甘草口服溶液的质量考察[J]. 中国药房, 2008, 19(9): 689-691. [6] 王海玲, 霍思宇, 余洋, 等. 不同C18固相萃取柱对鹌鹑蛋中6类兽药残留测定的影响研究[J]. 质量安全与检验检测, 2024, 34(1): 88-93. [7] 朱治国, 罗洁, 徐健君. 大体积水系中微量农药的固相萃取柱选择[J]. 中国法医学杂志, 2016, 31(6): 605-606. [8] 张振东, 刘希望, 马宁, 等. 两种固相萃取柱在乙酰氨基阿维菌素药动学前处理中的比较[J]. 中国动物检疫, 2018, 35(3): 86-89,103. [9] 陈铭, 刘文倩, 毛秀红, 等. 不同固相萃取填料对薏苡仁中油脂去除效率的研究[J]. 时珍国医国药, 2019, 30(5): 1135-1137. [10] 袁红英, 关景丽, 杨雪萍, 等. 固相萃取柱测定复方甘草口服液中吗啡含量效果[J]. 实用医药杂志, 2014, 31(4): 340-341. [11] JAVED H, ISLAM A, CHAUHAN A, et al. Efficacy of engineered GO Amberlite XAD-16 picolylamine sorbent for the trace determination of Pb(Ⅱ) and Cu(Ⅱ) in fishes by solid phase extraction column coupled with inductively coupled plasma optical emission spectrometry[J]. Sci Rep, 2018, 8(1): 17560. doi: 10.1038/s41598-018-35656-1 [12] LIANG N, HOU X H, HUANG P T, et al. Ionic liquid-based dispersive liquid-liquid microextraction combined with functionalized magnetic nanoparticle solid-phase extraction for determination of industrial dyes in water[J]. Sci Rep, 2017, 7(1): 13844. doi: 10.1038/s41598-017-14098-1 [13] 柯月娇, 张勇, 蔡斌, 等. 医院制剂复方甘草口服溶液质量回顾分析[J]. 安徽医药, 2022, 26(1): 205-208. doi: 10.3969/j.issn.1009-6469.2022.01.048 -




 下载:
下载: