-
玉米(Zea mays L.)属于禾本科玉蜀黍属一年生草本植物。玉米须(corn silk, maydis stigma)是玉米的干燥花柱及柱头,是我国传统中药材,《滇南本草》最早记载其入药,1985年版《中华人民共和国卫生部药材标准》将玉米须列为常用药材品种,并在1977年版《中国药典》中收录。
玉米须, 别名蜀黍须、玉蜀黍须、包谷须, 秋季玉米收获时采收,烘干或晒干。玉米须性平, 味甘、淡,具有利尿消肿、平肝利胆的功效,《黄帝内经》中记载,玉米须在治疗前列腺疾病方面具有良好的效果。玉米须还被广泛用作茶[1]、功能食品及食品添加剂[2-3]。现代研究表明,玉米须黄酮类化合物是玉米须治疗肥胖、高血糖、肾炎、膀胱炎、痛风、前列腺炎等疾病的重要药效成分[4-5]。本文通过对近10年文献的查阅, 综述了玉米须黄酮在提取工艺、成分表征、含量测定、药理作用及安全性方面的研究进展, 为玉米须黄酮的进一步开发应用提供参考。
-
热回流提取法是提取中药有效成分和有效部位最常用的方法。虽然热回流提取法的提取效率非常高,但样品在持续的受热过程中不稳定,导致有效成分分解,得到的产品品质也会降低。近年来,具有低温、高效、时间短等优点的超声波提取法、微波提取法被广泛用于中药有效部位的提取,提取效率要远高于普通浸提法和热回流提取法。近几年有多篇文献对玉米须总黄酮的提取工艺进行了研究,详细总结见表1。
表 1 玉米须总黄酮提取工艺
编号 提取方法 优化工艺条件 总黄酮提取率
(mg/g)参考
文献1 回流提取法
(单因素试验结合响应面法)温度80℃、时间2.5 h、pH值 2.0、乙醇体积分数72%、
液料比70 ml/g3.89 [6] 2 真空减压提取法
(单因素试验和正交试验)真空度 0.07 Mpa、时间35 min、乙醇体积分数 50%、
液料比 40 ml/g1.35 [7] 3 超声波提取法
(正交试验)超声功率 500 W、超声温度70℃、超声提取时间10 min、
乙醇体积分数60%、料液比70 ml/g34.58 [8] 4 超声波提取法
(响应面优化法)超声功率 500 W、超声温度57℃、超声时间45 min、
乙醇体积分数70%、液料比26 ml/g23.37 [9] 5 超声波-双酶协同提取法
(Box-Behnken 响应面设计法)超声功率 173 W、超声时间35 min、乙醇体积分数60%、
液料比 31 ml/g、酶解时间 42 min、加酶比(果胶酶∶纤维素酶)1.9∶17.2 [10] 6 超声波辅助提取法 超声功率 260 W、超声温度63℃、超声时间 l7 min、
乙醇体积分数60%5.63 [11] 7 微波辅助提取法(正交试验优化) 提取时间 8 min、乙醇体积分数 60%、液料比50 ml/g 7.87 [11] -
采用溶剂法提取获得的玉米须黄酮提取物总黄酮含量比较低,一般要经过色谱方法进行纯化才能获得高含量的总黄酮。包京姗等[12]考察了D101大孔吸附树脂对超声提取的玉米须总黄酮的纯化效果,5 g大孔吸附树脂、总黄酮上样液质量浓度7 mg/ml、上样液体积1 ml、盐酸调pH值为3、60%乙醇洗脱、洗脱体积为5 倍柱体积、流速1.0 ml/min,纯化后总黄酮的纯度质量分数由41.35%提高到69.20%。刘杰等[13]比较了5种大孔吸附树脂的静态吸附-解吸总黄酮的效果,发现AB-8型大孔吸附树脂纯化玉米须总黄酮效果最佳。单因素试验结合响应面法确定了AB-8大孔吸附树脂柱色谱的最佳参数为:总黄酮上样液质量浓度1.41 mg/ml、洗脱液流速2.00 ml/min、乙醇体积分数为70%、总黄酮的平均解吸率为96.52%。上述研究为玉米须总黄酮的纯化提供了理论参考。
-
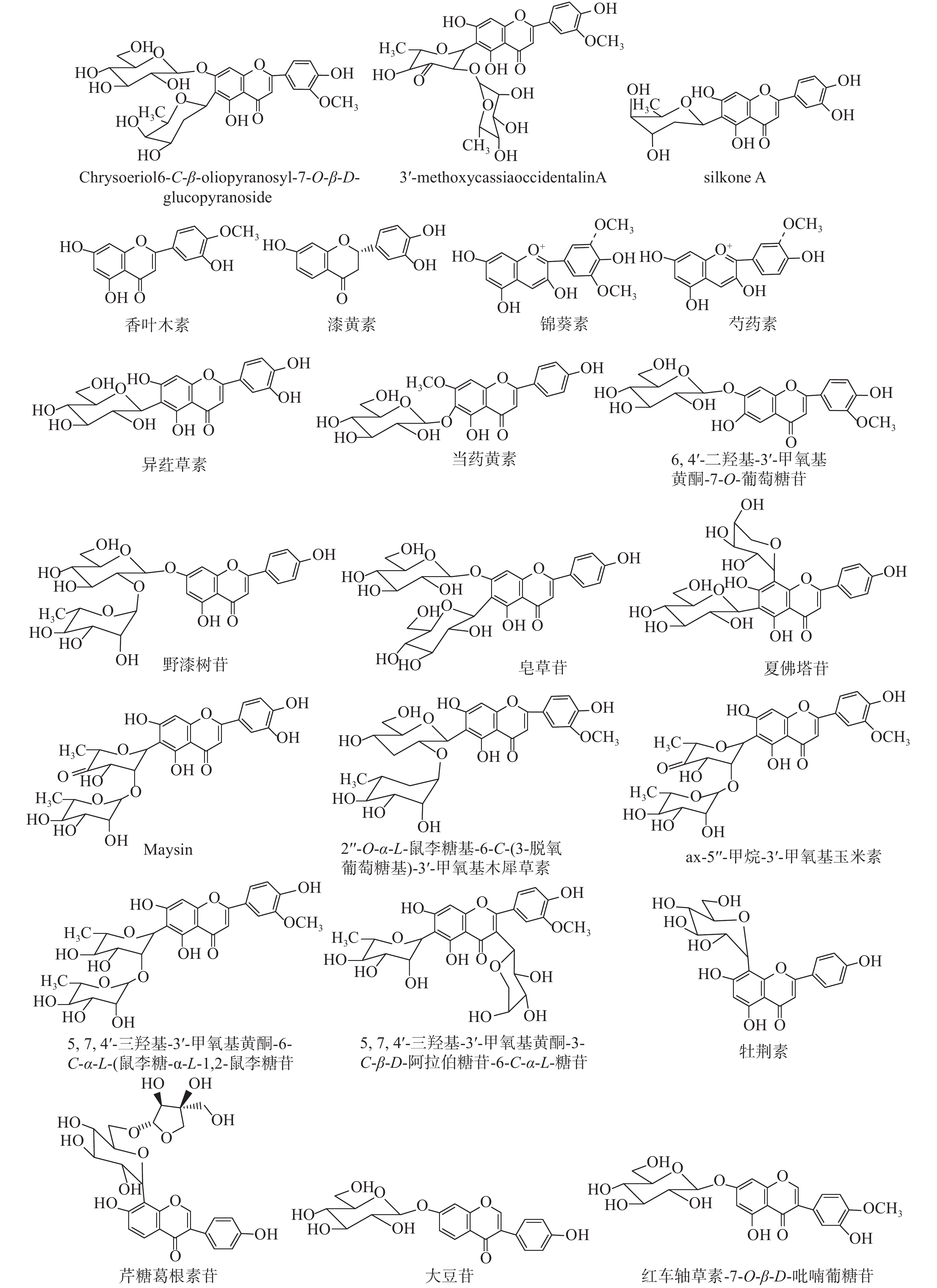
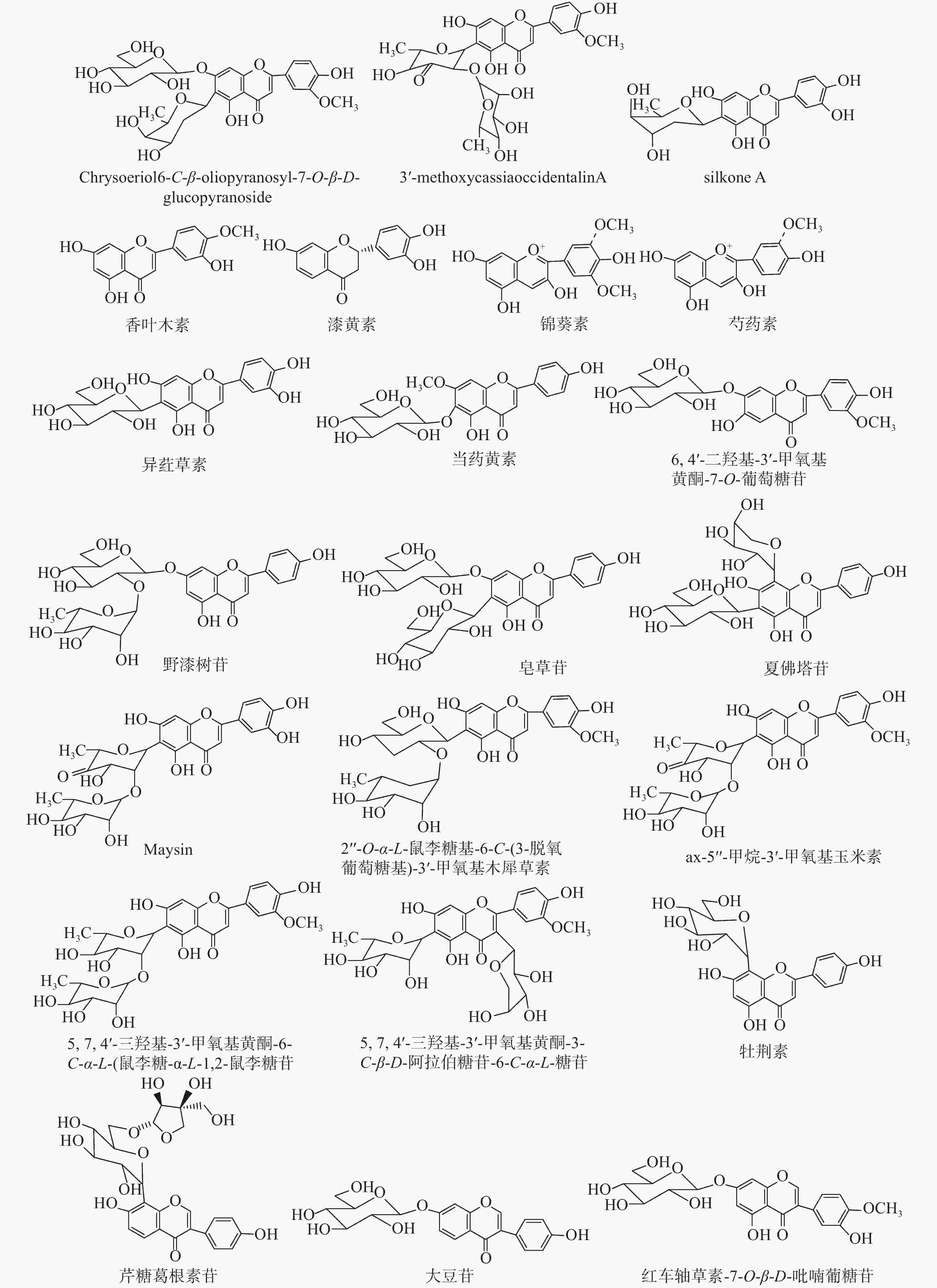
目前,已从玉米须中分离得到的黄酮类成分类型众多,包括黄酮及其苷类、黄酮醇及其苷类、二氢黄酮及其苷类、异黄酮及其苷类、黄烷类、花青素类等,且苷类成分既有氧苷也有碳苷。由于黄酮类成分极性适中,容易分离得到,所以前期已经分离获得了大量的玉米须黄酮类化合物。近几年从玉米须中分离得到的新黄酮类化合物并不多,仅检索到3个新黄酮碳苷。Sarfare等[14]运用多种色谱分离技术及光谱鉴定技术,从玉米须中分离得到2个为新黄酮碳苷:chrysoeriol 6-C-β-oliopyranosyl-7-O-β-D-glucopyranoside, 3'-methoxycassiaoccidentalin A,以及2个已知的黄酮类成分chrysoeriol 6-C-β-boivinopyranosyl-7-O-β-D-glucopyranoside和ax-4"- hydroxy-3'-methoxymaysin。宋少江课题组[15]从玉米须中分离得到1个新黄酮碳苷silkone A,以及3个已知的黄酮类成分莲子草素 (alternanthin), [(2S)-7,4'-二羟基-3'-异戊烯基-黄烷]和 [(2S)-7,3'-二羟基-4'-甲氧基黄烷]。新黄酮碳苷及玉米须中主要黄酮类化合物的结构如图1所示。
与传统的色谱分离方法相比,液相色谱-质谱联用技术(LC-MS)越来越多地应用于复杂体系化学成分全面表征的研究中。高分辨率质谱法提供了精确的分子质量信息,从而有助于识别未知化合物;生物信息学的发展提升了化学分析和质谱数据处理的能力;各种工具和成倍增加的网络平台有助于代谢产物的鉴定研究。例如,Fougère等[16]采用超高效液相色谱/高分辨二级串联质谱(UHPLC/HRMS2)方法共表征了玉米须中的104个化合物,并进一步结合全球天然产物社会分子网络(GNPS)平台和Cytoscape软件以及文献对照等方法鉴定了其中的19个黄酮类化合物,但由于缺乏对照品,最终并没有全部确定这些化合物的结构。目前已报道从玉米须中鉴定的黄酮类化合物有:5,7,4′-三羟基-3′-甲氧基黄酮-6-C-α-L-(鼠李糖-α-L-1,2-鼠李糖苷)[17]、ax-5"-甲烷-3′-甲氧基玉米素(ax-5"-methane-3′-methoxy maysin)[17]、5,7,4′-三羟基-3′-甲氧基黄酮-3-C-β-D-阿拉伯糖苷-6-C-α-L-鼠李糖苷[17]、香叶木素(Diosmetin)[18]、夏佛塔苷(Schaftoside)[18]、异荭草素(Isoorientin)[18]、大豆苷(Daidzin)[18]、当药黄素(Swertisin)[18]、红车轴草素-7-O-β-D-吡喃葡糖苷(Pratensein 7-O-β-glucopyranoside)[18]、芹糖葛根素苷(Mirificin)[18]、漆黄素(Butin)[18]、牡荆素(Vitexin)[18]、野漆树苷(Rhoifolin)[18-19]、皂草苷(Saponarin)[18] 、李属异黄酮苷(Prunetrin)[19]、木犀草素(Luteolin)[19]、2"-O-α-L-鼠李糖基-6-C-(3-脱氧葡萄糖基)-3'-甲氧基木犀草素(2"-O-α-L-rhamnosyl-6-C-3-deoxyglucosyl-3′-methoxyluteolin)[20]、6,4'-二羟基-3'-甲氧基黄酮-7-O-β-葡萄糖苷(6,4′-dihydroxy-3′-methoxyflavone-7-O-β-glucoside)[20]、锦葵素(Malvidin)[20]、芍药素(Peonidin)[20]。
-
总黄酮是玉米须的主要有效部位之一。玉米须及其相关产品的质控也多以总黄酮为指标,其含量也将直接影响玉米须的品质及相关产品的功效。徐建霞等[21]对比分析了贵州常用的8种骨干玉米在3个不同生长时期(吐丝未授粉期、灌浆期和成熟期)的玉米须总黄酮的含量。研究结果显示,未授粉期6号(1703)材料总黄酮含量最高,品质最优。研究结果为筛选玉米须原料和选择采收期提供了科学依据。彭磊等[22]建立了紫外分光光度法测定玉米须黄酮含量的方法,测定波长为 400 nm,共测定了15 批样品,总黄酮的含量范围是3.896 ~ 9.512 mg/g。侯少平等[23] 以芦丁为对照品,利用紫外-可见分光光度法对陕西兴平种植的3种玉米须的乙醇提取物总黄酮含量进行测定,郑单958含量最高达10.739 mg/g,申单9号含量为8.174 mg/g,武科 2号含量最低为 4.684 mg/g。
彭磊等[22]采用HPLC方法对购于河南河北的15批玉米须中芹菜素的含量进行了测定,芹菜素的含量范围为0.047~0.246 mg/g,含量差异可达5倍以上。张晓明等[24] 测定了山西原平、定襄、五台、忻州4个不同产地的玉米须样品中芦丁的含量,其中忻州样品的芦丁含量最高为0.623 mg/g。研究结果显示不同产地不同品种所含有效成分的含量也具有较大的差异,这也进一步说明了优质品种筛选的重要性。上述2篇文献分别以芹菜素和芦丁作为指标成分对玉米须的品质评价进行了研究。芹菜素和芦丁两个黄酮类化合物在植物中广泛存在,以此为标准评价玉米须的品质缺乏专属性和选择性。如能结合药理学研究结果,选用具有生物活性的黄酮类化合物为指标成分,可更好地评价玉米须的品质。
-
玉米须黄酮具有显著抗糖尿病作用。Zhang等[25]采用链脲佐菌素(STZ)诱导的糖尿病小鼠模型评价玉米须粗黄酮(CSFs)的抗糖尿病活性。研究结果显示,CSFs给药4周后,可显著降低糖尿病小鼠的体重及耗水量,尤其是血糖浓度,且CSFs高剂量组(500 mg/kg)降低糖尿病小鼠体重的作用最强;与糖尿病模型对照组相比,CSFs高剂量组可显著降低糖尿病小鼠血清甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、丙二醛(MDA)和肝糖原水平,高密度脂蛋白胆固醇(HDL-C)和超氧化物歧化酶(SOD)水平略有升高。研究结果说明,CSFs可能是通过调节脂质代谢、清除氧自由基以保护机体的新陈代谢和修复机体的抗氧化能力等途径发挥抗糖尿病作用。
杨生辉等[26]研究发现,玉米须总黄酮对晚期糖基化终产物、乙酰胆碱酯酶和α-葡萄糖苷酶具有一定抑制活性,且呈现浓度依赖性。采用Pearson相关分析法对玉米须黄酮含量与抗糖基化、乙酰胆碱酯酶和α-葡萄糖苷酶抑制能力进行相关性分析,发现抗糖基化、乙酰胆碱酯酶和α-葡萄糖苷酶抑制活性与黄酮含量呈正相关(相关系数r分别为0.83、0.90和0.57,P<0.05)。
Li等[9]采用网络药理学方法计算发现,芦丁、木犀草素、高车前素是玉米须抑制高血糖活性的主要活性成分。Chaudhary等[27]采用分子对接的方法预测玉米须中生物活性物质对糖尿病相关靶点的结合亲和力。26种生物活性物质与5个不同的靶标(蛋白酪氨酸磷酸酶1-B、葡萄糖转运蛋白-1、二肽基肽酶-4、α-葡萄糖苷酶和α-淀粉酶)对接,发现儿茶素、槲皮素、芦丁、山柰酚等化合物对蛋白酪氨酸磷酸酶1-B(PTPN-1B)具有最高的结合亲和力,结合能最高为 −8.5 kcal/mol,可用于研究和开发新的抗糖尿病分子。
-
Jeong等[28]采用乙酸诱导的小鼠扭体反应和二甲苯诱导的美国癌症研究所(ICR)小鼠耳肿胀模型研究玉米须黄酮提取物(MSE)的体内镇痛和抗炎作用。ICR小鼠灌胃不同剂量的MSE(100 mg/kg、200 mg/kg、300 mg/kg),发现300 mg/kg的MSE可显著抑制乙酸注射引起的扭体反应(52.40%),并显著减少二甲苯诱导的小鼠耳肿胀度(77.61%)。组化分析结果显示,MSE能以剂量依赖的方式减少水肿引起的小鼠耳组织细胞浸润或肿胀,其中300 mg/kg 玉米须黄酮提取物的抑制作用比阳性药吲哚美辛更显著。采用二甲苯致小鼠耳肿胀实验、热板实验和扭体实验等方法,律广富等[29]研究了玉米须总黄酮的抗炎、镇痛作用。小鼠以玉米须总黄酮(2.12 g/kg、1.06 g/kg、 0.53 g/kg)预灌胃给药7 d后,与模型对照组相比,药物中、高剂量组小鼠耳肿胀度显著降低(P<0.05),出现舔足时间显著延长(P<0.05);药物高剂量组出现扭体时间显著延长、扭体次数显著减少(P<0.05)。
采用脂多糖(LPS)诱导的巨噬细胞炎症模型,研究玉米须黄酮的体外抗炎特性及其分子机制[28],结果表明,玉米须黄酮(10 μg/ml、100 μg/ml、 200 μg/ml)可显著降低LPS诱导巨噬细胞的诱导型一氧化氮合酶(iNOS)和环氧合酶(COX-2)水平,剂量依赖性地抑制NO的分泌,且不会产生细胞毒性。深入研究发现,玉米须黄酮对LPS诱导的巨噬细胞的抗炎活性可能与急性期蛋白(AP-1)信号通路的抑制有关。
-
已有多项研究报道,玉米须黄酮对急性痛风性关节炎具有改善作用。律广富等[29]采用尿酸钠诱导家兔急性痛风性关节炎模型,研究了玉米须黄酮抗炎、镇痛活性,及其对家兔急性痛风关节炎的改善作用。玉米须黄酮(0.58 g/kg、0.29 g/kg、0.15 g/kg)预灌胃给药7 d后,与模型组比较,药物组滑膜组织炎症明显减轻,充血、水肿、滑膜增生不明显,并显著减少炎细胞浸润。林贺等[30]测试了玉米须黄酮提取物对尿酸钠诱导大鼠痛风性关节炎的影响。研究结果显示,玉米须黄酮提取物高、中剂量组(1 g/kg、0.5 g/kg) 可显著减轻踝关节肿胀度(P<0.01),降低血浆白细胞介素-1α(IL-1α)、白细胞介素-6(IL-6)、肿瘤生长因子-α(TNF-α)及血浆细胞间粘附分子1(ICAM-1)、基质金属蛋白酶-1 (MMP-1)水平(P<0.05),显著改善大鼠关节滑膜组织的病理变化。
李萍等[31]采用氧嗪酸钾和单钠尿酸盐(MSU)联合诱导的大鼠改良痛风模型,研究玉米须黄酮提取物对改良急性痛风模型大鼠的改善作用及可能的作用机制。结果表明,造模 24 h 后,黄酮提取物高、中剂量组及秋水仙碱组大鼠的踝关节肿胀度均显著减轻(P<0.05)。给药 7 d 后,与模型组相比,黄酮提取物高、中剂量组及秋水仙碱组大鼠血清 IL-1β水平均显著降低(P<0.05),黄酮提取物高、中剂量组及苯溴马隆组大鼠血清尿酸(UA)水平均显著减少(P<0.01)。研究结果表明,玉米须黄酮可能是通过抑制炎性细胞因子 IL-1β 的表达缓解急性痛风性关节炎的急性炎症反应。
-
冯小童[32]研究了玉米须总黄酮(STF)对β-淀粉样蛋白(Aβ25-35)所致阿尔兹海默症(AD)模型小鼠学习记忆能力的影响。玉米须总黄酮灌胃治疗3 周后,通过检测小鼠空间学习记忆能力、脑组织中ROS 和MDA 含量评价其药效。结果显示,STF 高剂量组较AD 模型组可显著增加空间学习记忆能力(P<0.01),明显降低脑组织中 ROS 和 MDA 含量(P<0.01)。玉米须总黄酮具有改善 Aβ25-35 所致 AD 小鼠学习记忆的能力,可能与抑制 AD 小鼠脑内氧化应激反应有关。
Ryuk等[33]则考察了玉米须黄酮水提取物(CSW)对缓解蒙古沙土鼠短暂性脑缺血再灌注(I/R)的缺血性卒中症状和卒中后高血糖的影响。在其 40% 能量脂肪饮食中给予0.05% CSW(I/R-L)和0.2% CSW(I/R-H)、0.02% 阿司匹林(I/R-阿司匹林)和纤维素(I/R-对照)3周后,对蒙古沙土鼠进行8 min的动脉闭塞和再灌注,并按照规定的饮食继续喂养3周。CSW的摄入减少了I/R损伤蒙古沙土鼠的神经元细胞死亡,并剂量依赖性地改善了神经症状,包括下垂的眼睛、蹲姿、屈肌反射和行走模式;减轻了短期记忆、自发变化和握力;对缺血性卒中症状的保护作用与TNF-α、IL-1β、超氧化物和脂质过氧化物水平降低有关,从而促进海马组织超氧化物歧化酶活性;改善血流等。此外,CSW可预防与降低胰腺β细胞质量相关的卒中后高血糖,并且与保护β细胞凋亡有关,恢复了与假手术组类似的β细胞质量。与I/R对照组相比,CSW摄入提高了乳酸杆菌、双歧杆菌、异杆菌和阿克曼菌的相对丰度。Picrust2分析表明,与I/R对照组相比,CSW增加了丙酸盐和丁酸盐的代谢以及淀粉和葡萄糖的代谢,但减少了脂多糖的合成。总之,CSW通过减少氧化应激和炎症、增加血流量和β细胞质量来预防神经元细胞死亡和高血糖症,这种缓解可能是通过改善肠-脑轴相关的肠道微生物组群落来实现的。
-
玉米须在美白保健护肤方面也具有很大潜在价值。Wang等[15]建立了微量2'-联氮-二(3-乙基苯并噻唑啉-6-磺酸)(ABTS)自由基清除法,评价从玉米须中分离得到的1个新黄酮化合物silkone A以及3个已知的黄酮类物质,莲子草素 (alternanthin),(2S)-7,4'-二羟基-3'-异戊烯基-黄烷和 (2S)-7,3'-二羟基-4'-甲氧基黄烷对自由基清除能力的大小。其半数抑制浓度 (IC50)值31.34~37.04 μmol/L,显示比阳性药Trolox具有更强的自由基清除活性。2个黄烷化合物 [(2S)-7,4'-二羟基-3'-异戊烯基-黄烷、(2S)-7,3'-二羟基-4'-甲氧基黄烷] 对酪氨酸酶表现出中等的抑制活性,IC50 值分别为0.49 mmol/L和0.21 mmol/L。通过分子对接计算进一步研究推测,2个黄酮配体与活性位点残基之间的氢键相互作用可能是其发挥抑制酪氨酸酶活性的关键。研究证实了玉米须黄酮类化合物在抗氧化和抑制酪氨酸酶活性方面的潜力,并为开发玉米须护肤产品提供依据。
紫外线B(UVB)照射会对皮肤产生不良影响。玉米须含有的黄酮类化合物可通过抗氧化和抗炎作用防止皮肤光老化。Kim等[34]研究了膳食玉米须对UVB诱导的小鼠皮肤损伤的潜在光保护作用以及作用机制。口服玉米须水提取物 (CS)2 g/(kg·d)或4 g/(kg·d)19周,显著降低了UVB照射的SKH-1无毛小鼠的表皮厚度、皱纹形成和增殖细胞核抗原 (PCNA)、Ki67和8-OHdG阳性染色,并增加了胶原染色。CS组的促炎核因子κB (NF-κB)靶基因 (IL-1β、iNOS和COX-2)和MMP-9的表达较低,转化生长因子β/Smad (TGF-β/Smad)信号传导增加。检测到皮肤脂质过氧化和血液DNA氧化水平较低,血液谷胱甘肽含量较高,抗氧化转录因子Nrf2相关的过氧化氢酶和人超氧化物歧化酶1 (SOD1)蛋白以及谷胱甘肽信使核糖核酸水平增加。CS提取物可以通过抗氧化和抗炎机制减少UVB诱导的皮肤损伤。
李浩楠等[35]在对玉米须总黄酮活性成分研究的基础上,通过正交设计对一款含玉米须总黄酮美容产品的基质进行优化,确定了最终制剂处方。优化后的制剂处方为,水相组分:氮酮 2%、尼泊金乙酯 0.1%、甘油 10%、单硬脂酸甘油酯 5%、乳化剂三乙醇胺 4%、玉米须总黄酮 5%;油相组分:液状石蜡 10%、白凡士林5%、硬脂酸 10%。该研究结果为进一步研制一款具有抗氧化作用的美容产品奠定基础。
-
玉米须总黄酮提取物具有显著的抗肿瘤活性,已有报道玉米须提取物(SME)可显著抑制荷瘤小鼠的肿瘤生长,显著延长S180 荷瘤鼠存活时间,并增强体外淋巴细胞转化功能[36]。Lee等[37]研究了玉米须提取物主要活性成分maysin 对雄激素依赖性人前列腺癌症细胞(PC-3)的细胞毒活性。结果表明,maysin可剂量依赖性地降低PC-3 细胞的活性,在200 μg/ml剂量时抑制了87%的PC-3细胞活性。Maysin可显著诱导凋亡细胞死亡、DNA断裂、MMP去极化,并降低B淋巴细胞瘤-2基因(Bcl-2)和半胱天冬酶-3酶原抗体(PRO-CASPASE-3)表达水平;显著减少蛋白激酶B(Akt)和细胞外调节蛋白激酶(ERK)的磷酸化;与其他已知抗癌药物 [包括氟尿嘧啶(5-FU)、依托泊苷、顺铂或喜树碱] 联合,可协同增强PC-3细胞凋亡性死亡的作用。这些结果首次证实,maysin可通过线粒体依赖性通路诱导PC-3癌细胞株的细胞凋亡,并可能对化疗耐药或雄激素依赖性人类前列腺癌具有强大的治疗潜力。
-
长期以来,玉米须及其提取物作为一种传统的民间药物在世界许多地方被广泛应用,玉米须提取物作为茶和功能食品添加剂具有抗高脂血症和抗糖尿病的特性[38]。然而,这些研究大多是使用玉米须的粗提取物进行的,关于玉米须提取物中单个成分的生物和药理活性的研究一直很少。
Lee等[39]利用小鼠前脂肪细胞(3T3-L1)和C57BL/6小鼠模型,研究了玉米须中主要黄酮类化合物maysin 在体外和体内的潜在抗肥胖作用。Maysin能降低细胞内脂滴和TG的水平,并下调了3T3-L1细胞中转录因子CCAAT/增强子结合蛋白α(C/EBP-α)、转录因子CCAAT/增强子结合蛋白β(C/EBP-β)、过氧化物酶体增殖物激活受体-γ(PPAR-γ)和急性期蛋白2(aP2)的蛋白质表达水平,抑制细胞内脂质积聚和脂肪细胞分化。Maysin通过激活胱天蛋白酶级联反应和线粒体功能障碍诱导3T3-L1细胞凋亡,最终导致脂肪组织质量减少。动物实验表明,maysin(25 mg/kg体重)可降低高脂饮食(HFD)喂养的C57BL/6小鼠的体重增重和附睾脂肪重量,降低了小鼠血清TG、总胆固醇、LDL胆固醇和葡萄糖的水平。这些结果首次表明maysin在体外和体内具有降脂活性,发挥抗肥胖作用,是玉米须提取物的主要有效成分。
-
玉米须在中国和许多其他国家作为传统草药或功能性食品使用历史悠久,曾被1977版《中国药典》收载。因此,对玉米须的安全性评价具有重要意义。Peng等[40]评估了玉米须黄酮苷提取物(FMS)对小鼠的亚慢性毒性和遗传毒性。在亚慢性毒性研究中,小鼠口服FMS 2.50 g/(kg·d)、5.00 g/(kg·d)和10.00 g/(kg·d),连续28 d。实验结束时,检查一般临床症状、死亡率、血液学、生化和组织病理学参数。通过微核实验和精子畸形实验对FMS的遗传毒性进行评价。结果显示,实验期间所有动物均存活,与对照组相比,所有FMS治疗组均未观察到统计学显著差异或毒理学相关的差异;未观察到的不良反应水平(NOAEL)剂量确定为10 g/(kg·d)。根据微核实验和精子畸形实验的结果,即使在实验上限剂量10 g/(kg·d)时,也没有在体细胞或生殖细胞中发现遗传毒性的证据。
Ha等[41]报道了玉米须提取物对ICR小鼠的急性和亚急性毒性。小鼠口服灌胃玉米须提取物2 g/(kg·d),测试其急性毒性,记录14 d的临床症状、死亡率和体重变化。在实验期间,所有药物组均未观察到死亡或异常症状。与对照组相比,体重没有任何显著变化。玉米须提取物的致死剂量估计超过2 g/kg。小鼠口服灌胃玉米须提取物500 mg/(kg·d),连续4周,测定体重、水和食物消耗量以及器官重量。玉米须提取物对体重、水分摄入、食物消耗、尿液参数、临床化学或器官重量没有相关毒性影响。组织病理学检查显示没有异常,确定玉米须提取物的最大无毒剂量超过500 mg/kg。
Saheed等[42]评估了Wistar大鼠给予100、200、400 mg/kg体重的玉米须水提取物1、7、14、21和28 d后,对血液学指标的毒理学影响,并在实验结束后分析了其脂质参数。在所有测试剂量下,玉米须水提取物对红细胞、红细胞压积、血红蛋白、平均红细胞体积、平均红血球血红蛋白、平均白细胞血红蛋白浓度和平均血小板体积没有任何显著影响(P>0.05)。研究还表明,玉米须水提取物可显著升高血清白细胞、血小板、淋巴细胞、高密度脂蛋白胆固醇水平;显著降低总胆固醇、低密度脂蛋白胆固醇和动脉硬化指数。研究结果显示,在实验剂量范围内,玉米须水提取物不具有血液毒性,并且可能是治疗冠心病的良好候选药物。以上研究结果表明,玉米须提取物作为功能性食品、食品添加剂和天然药物的使用是安全的。
-
近10年来,玉米须黄酮在食品、保健品及药品领域的应用越来越广泛,相关研究受到了国内外众多学者的关注。玉米须黄酮化学成分的研究发现了新的黄酮碳苷,丰富了玉米须黄酮类化合物的种类;多项药理学研究证实玉米须黄酮具有抗糖尿病、抗炎镇痛、细胞毒、护肤、神经保护、抗痛风以及降脂等作用,拓展了玉米须应用功效;安全性评价为玉米须黄酮的安全应用提供了理论依据。综上,玉米须黄酮的应用及市场仍具有很大的潜力,还需要深入系统的研究为玉米须黄酮的应用提供理论依据。
Flavonoids from Corn Silk (Zea mays L.) and its pharmacological effects
-
摘要: 玉米须是玉米的干燥花柱和柱头,我国常用传统中药,具有平肝利胆、利尿消肿之功效。玉米须还被广泛用作茶和功能食品。玉米须富含黄酮类化合物,为玉米须中主要的生物活性成分。近年来,玉米须黄酮的化学、分析、药理、药代动力学及安全性评价方面的研究取得了较多的进展。黄酮化学成分的研究丰富了玉米须中黄酮类化合物的种类,多项药理学研究证实和拓展了玉米须黄酮的功效,安全性评价为玉米须黄酮的安全应用提供了理论依据。通过文献查阅,综述近10年来玉米须黄酮的提取工艺、成分表征、含量测定、药理作用及安全性等方面的研究进展,为玉米须黄酮的进一步开发及应用提供依据。Abstract: Corn silk, a Traditional Chinese Medicine, has the effect of calming liver, cholagogue, detumescence and diuresis. Corn silk is also widely used as tea and functional food. Natural flavonoids have multiple biological activities, which are also the main bioactive components of corn silk. In the past decade, many new advances have been made in the chemistry, analysis, pharmacology, pharmacokinetics, and safety evaluation of corn silk flavonoids. The chemical composition research of flavonoids has enriched the variety of flavonoids in corn silk. Pharmacological studies have confirmed and expanded the efficacy of corn silk flavonoids. And safety evaluation has provided a theoretical basis for the safe application of corn silk flavonoids. Through literature search, the extraction, separation, compositional analysis, content determination, pharmacological effect, pharmacokinetics, and safety research progress of corn silk flavonoids in the past ten years were reviewed in this paper.
-
Key words:
- corn silk /
- flavonoid /
- chemical constituents /
- pharmacological effects /
- safety
-
表 1 玉米须总黄酮提取工艺
编号 提取方法 优化工艺条件 总黄酮提取率
(mg/g)参考
文献1 回流提取法
(单因素试验结合响应面法)温度80℃、时间2.5 h、pH值 2.0、乙醇体积分数72%、
液料比70 ml/g3.89 [6] 2 真空减压提取法
(单因素试验和正交试验)真空度 0.07 Mpa、时间35 min、乙醇体积分数 50%、
液料比 40 ml/g1.35 [7] 3 超声波提取法
(正交试验)超声功率 500 W、超声温度70℃、超声提取时间10 min、
乙醇体积分数60%、料液比70 ml/g34.58 [8] 4 超声波提取法
(响应面优化法)超声功率 500 W、超声温度57℃、超声时间45 min、
乙醇体积分数70%、液料比26 ml/g23.37 [9] 5 超声波-双酶协同提取法
(Box-Behnken 响应面设计法)超声功率 173 W、超声时间35 min、乙醇体积分数60%、
液料比 31 ml/g、酶解时间 42 min、加酶比(果胶酶∶纤维素酶)1.9∶17.2 [10] 6 超声波辅助提取法 超声功率 260 W、超声温度63℃、超声时间 l7 min、
乙醇体积分数60%5.63 [11] 7 微波辅助提取法(正交试验优化) 提取时间 8 min、乙醇体积分数 60%、液料比50 ml/g 7.87 [11] -
[1] SHI S H, LI S M, LI W H, et al. Corn silk tea for hypertension: a systematic review and meta-analysis of randomized controlled trials[J]. Evid Based Complement Alternat Med, 2019, 2019:2915498. [2] GUO Q W, CHEN Z Q, SANTHANAM R K, et al. Hypoglycemic effects of polysaccharides from corn silk (Maydis stigma) and their beneficial roles via regulating the PI3K/Akt signaling pathway in L6 skeletal muscle myotubes[J]. Int J Biol Macromol, 2019, 121:981-988. doi: 10.1016/j.ijbiomac.2018.10.100 [3] HALDAR S, GAN L, TAY S L, et al. Postprandial glycemic and insulinemic effects of the addition of aqueous extracts of dried corn silk, cumin seed powder or tamarind pulp, in two forms, consumed with high glycemic index rice[J]. Foods, 2019, 8(10):437. doi: 10.3390/foods8100437 [4] WANG K J, ZHAO J L. Corn silk (Zea mays L. ), a source of natural antioxidants with α-amylase, α-glucosidase, advanced glycation and diabetic nephropathy inhibitory activities[J]. Biomed Pharmacother, 2019, 110:510-517. doi: 10.1016/j.biopha.2018.11.126 [5] ZHANG D W, WANG Y Z, LIU H L. Corn silk extract inhibit the formation of Nε-carboxymethyllysine by scavenging glyoxal/methyl glyoxal in a casein glucose-fatty acid model system[J]. Food Chem, 2020, 309:125708. doi: 10.1016/j.foodchem.2019.125708 [6] 马菲菲, 李俊龙, 丁志刚. 玉米须黄酮的提取工艺优化[J]. 蚌埠学院学报, 2022, 11(2):7-12. [7] 常影, 焦岩, 郑喜群, 等. 真空减压法提取玉米须黄酮工艺优化[J]. 食品研究与开发, 2016, 37(22):84-87. doi: 10.3969/j.issn.1005-6521.2016.22.020 [8] 常惟智, 陈威, 隋方宇, 等. 超声波法优化提取玉米须中总黄酮的研究[J]. 中国民间疗法, 2023, 31(4):78-80. [9] LI P, REN G X, SUN Y F, et al. Extraction optimization, preliminary identification, and bioactivities in corn silk[J]. Evid Based Complement Alternat Med, 2023, 2023:5685174. [10] 李侠, 马艳梅, 孙慧娟, 等. 超声波-双酶法协同提取玉米须黄酮工艺的优化[J]. 西北农林科技大学学报(自然科学版), 2014, 42(4):221-228. [11] 吴俊男, 马森, 王晓曦, 等. 玉米须活性物质的提取工艺研究[J]. 粮食与油脂, 2017, 30(5):66-70. [12] 包京姗, 韩凤波, 毕博, 等. D-101大孔吸附树脂纯化玉米须总黄酮工艺研究[J]. 中国酿造, 2016, 35(5):171-174. [13] 刘杰, 梁亚蓝, 李浩楠, 等. 玉米须中总黄酮的大孔树脂纯化工艺优化[J]. 粮食与油脂, 2022, 35(3):76-80. [14] SARFARE S, KHAN S I, ZULFIQAR F, et al. Undescribed C-glycosylflavones from corn silk and potential anti-inflammatory activity evaluation of isolates[J]. Planta Med, 2022, 88(9/10):745-752. doi: 10.1055/a-1728-1347 [15] WANG J Y, ZHOU W Y, HUANG X X, et al. Flavonoids with antioxidant and tyrosinase inhibitory activity from corn silk (Stigma maydis)[J]. Nat Prod Res, 2023, 37(5):835-839. doi: 10.1080/14786419.2022.2089986 [16] FOUGÈRE L, ZUBRZYCKI S, ELFAKIR C, et al. Characterization of corn silk extract using HPLC/HRMS/MS analyses and bioinformatic data processing[J]. Plants, 2023, 12(4):721. doi: 10.3390/plants12040721 [17] 李强, 李婷, 王丹丹, 等. HPLC-MS法分析玉米须中黄酮苷类化合物[J]. 食品科学技术学报, 2016, 34(2):56-61. [18] 庄岩, 孙国东, 谭冰, 等. 基于UPLC-Q-TOF/MS技术的玉米须化学成分分析[J]. 中国中医药科技, 2023, 30(2):239-247. [19] WANG Y M, LIU Q, FAN S J, et al. Rapid analysis and characterization of multiple constituents of corn silk aqueous extract using ultra-high-performance liquid chromatography combined with quadrupole time-of-flight mass spectrometry[J]. J Sep Sci, 2019, 42(19):3054-3066. doi: 10.1002/jssc.201900407 [20] DA HORA N R S, SANTANA L F, DA SILVA V D A, et al. Identification of bioactive metabolites from corn silk extracts by a combination of metabolite profiling, univariate statistical analysis and chemometrics[J]. Food Chem, 2021, 365:130479. doi: 10.1016/j.foodchem.2021.130479 [21] 徐建霞, 郑常祥, 邵明波, 等. 不同玉米材料及生长期玉米须中总黄酮和多糖含量分析[J]. 江苏农业科学, 2022, 50(5):162-167. [22] 彭磊, 刘蕊, 王丽娜, 等. 紫光分光光度法、高效液相色谱法测定玉米须中多糖及黄酮类物质的含量[J]. 中国医院用药评价与分析, 2017, 17(2):222-224,231. [23] 侯少平, 侯敏娜. 陕西兴平不同品种玉米须中总黄酮含量分析[J]. 陕西农业科学, 2017, 63(1):17-18. [24] 张晓明, 赵二劳, 胡芳馨. 反相高效液相色谱法测定玉米须中绿原酸和芦丁的含量[J]. 贵州农业科学, 2013, 41(6):90-92. [25] ZHANG Y, WU L Y, MA Z S, et al. Anti-diabetic, anti-oxidant and anti-hyperlipidemic activities of flavonoids from corn silk on STZ-induced diabetic mice[J]. Molecules, 2015, 21(1):E7. doi: 10.3390/molecules21010007 [26] 杨生辉, 陈海亮, 王文琴, 等. 玉米须总黄酮抗糖基化、乙酰胆碱酯酶和α-葡萄糖甘酶抑制活性分析[J]. 天然产物研究与开发, 2019, 31(7):1230-1239,1264. [27] CHAUDHARY R K, KAROLI S S, DWIVEDI P S R, et al. Anti-diabetic potential of Corn silk (Stigma maydis): an in-silico approach[J]. J Diabetes Metab Disord, 2022, 21(1):445-454. doi: 10.1007/s40200-022-00992-7 [28] JEONG Y H, OH Y C, CHO W K, et al. Maydis stigma elicits analgesia and blocks edema in mice and inhibits inflammation in macrophages[J]. Am J Chin Med, 2017, 45(7):1477-1496. doi: 10.1142/S0192415X1750080X [29] 律广富, 仇志凯, 常诗卓, 等. 玉米须总黄酮抗炎镇痛及对急性痛风性关节炎的改善作用研究[J]. 药物评价研究, 2018, 41(2):206-209. [30] 林贺, 董金香, 邱智东, 等. 玉米须黄酮提取物对痛风性关节炎大鼠的影响[J]. 现代食品科技, 2015, 31(4):13-16,7. [31] 李萍, 宋娟, 李清漪, 等. 玉米须黄酮提取物对改良急性痛风性关节炎模型大鼠的疗效分析[J]. 中国当代医药, 2018, 25(34):8-11. [32] 冯小童. 玉米须总黄酮对阿尔茨海默症小鼠学习记忆功能的影响[J]. 山西农经, 2017,(20):68-69. [33] RYUK J A, KO B S, MOON N R, et al. Protection against neurological symptoms by consuming corn silk water extract in artery-occluded gerbils with reducing oxidative stress, inflammation, and post-stroke hyperglycemia through the gut-brain axis[J]. Antioxidants, 2022, 11(1):168. doi: 10.3390/antiox11010168 [34] KIM Y H, CHO A, KWON S A, et al. Potential photoprotective effect of dietary corn silk extract on ultraviolet B-induced skin damage[J]. Molecules, 2019, 24(14):2587. doi: 10.3390/molecules24142587 [35] 李浩楠, 刘杰, 梁亚蓝, 等. 玉米须总黄酮护肤霜的研制[J]. 广州化工, 2022, 50(1):77-79. [36] 昌友权, 王维佳, 杨世杰, 等. 玉米须提取物抗肿瘤作用的实验研究[J]. 营养学报, 2005, 27(6):498-501. [37] LEE J S, LEE S, KIM S L, et al. Corn silk maysin induces apoptotic cell death in PC-3 prostate cancer cells via mitochondria-dependent pathway[J]. Life Sci, 2014, 119(1-2):47-55. doi: 10.1016/j.lfs.2014.10.012 [38] ZHAO W Z, YIN Y G, YU Z P, et al. Comparison of anti-diabetic effects of polysaccharides from corn silk on normal and hyperglycemia rats[J]. Int J Biol Macromol, 2012, 50(4):1133-1137. doi: 10.1016/j.ijbiomac.2012.02.004 [39] LEE C W, SEO J Y, KIM S L, et al. Corn silk maysin ameliorates obesity in vitro and in vivo via suppression of lipogenesis, differentiation, and function of adipocytes[J]. Biomed Pharmacother, 2017, 93:267-275. doi: 10.1016/j.biopha.2017.06.039 [40] PENG K Z, ZHANG S Y, ZHOU H L. Toxicological evaluation of the flavonoid-rich extract from Maydis stigma: Subchronic toxicity and genotoxicity studies in mice[J]. J Ethnopharmacol, 2016, 192:161-169. doi: 10.1016/j.jep.2016.07.012 [41] HA A W, KANG H J, KIM S L, et al. Acute and subacute toxicity evaluation of corn silk extract[J]. Prev Nutr Food Sci, 2018, 23(1):70-76. doi: 10.3746/pnf.2018.23.1.70 [42] SAHEED S, OLADIPIPO A E, ABDULAZEEZ A A, et al. Toxicological evaluations of Stigma maydis (corn silk) aqueous extract on hematological and lipid parameters in Wistar rats[J]. Toxicol Rep, 2015, 2:638-644. doi: 10.1016/j.toxrep.2015.04.001 -




 下载:
下载: