-
活性氧(ROS)是生物体内含氧自由基和易形成自由基的过氧化物的总称,与细胞代谢和线粒体呼吸等过程相关。当细胞内有大量ROS生成,导致ROS含量超过抗氧化防御系统的缓冲能力时,细胞将出现氧化应激。此时,若ROS无法有效消耗将进一步诱发细胞脂质过氧化,从而破坏细胞膜和脂蛋白,导致细胞发生死亡,若该过程出现致命的铁依赖性脂质过氧化特征,则称为细胞铁死亡[1]。铁死亡是近些年的研究热点,它在肾脏、心脏、肝脏和脑等多种疾病模型中起到关键作用。脂质过氧化作为铁死亡的关键特征之一,不仅会导致膜损伤,还会产生丙二醛(MDA)和4-羟基壬烯醛(4-HNE)等毒性醛类产物,加剧ROS的形成。而醛脱氢酶2(ALDH2)能降解这些醛类物质,从而降低甚至消除这种影响,最终使ROS的生成不能形成循环,大幅减轻氧化应激对细胞的损伤。本文对铁死亡和ALDH2进行简要介绍,并总结目前ALDH2改善铁死亡相关疾病预后的研究工作,可为后续铁死亡相关疾病的治疗研究拓展新的方向。
-
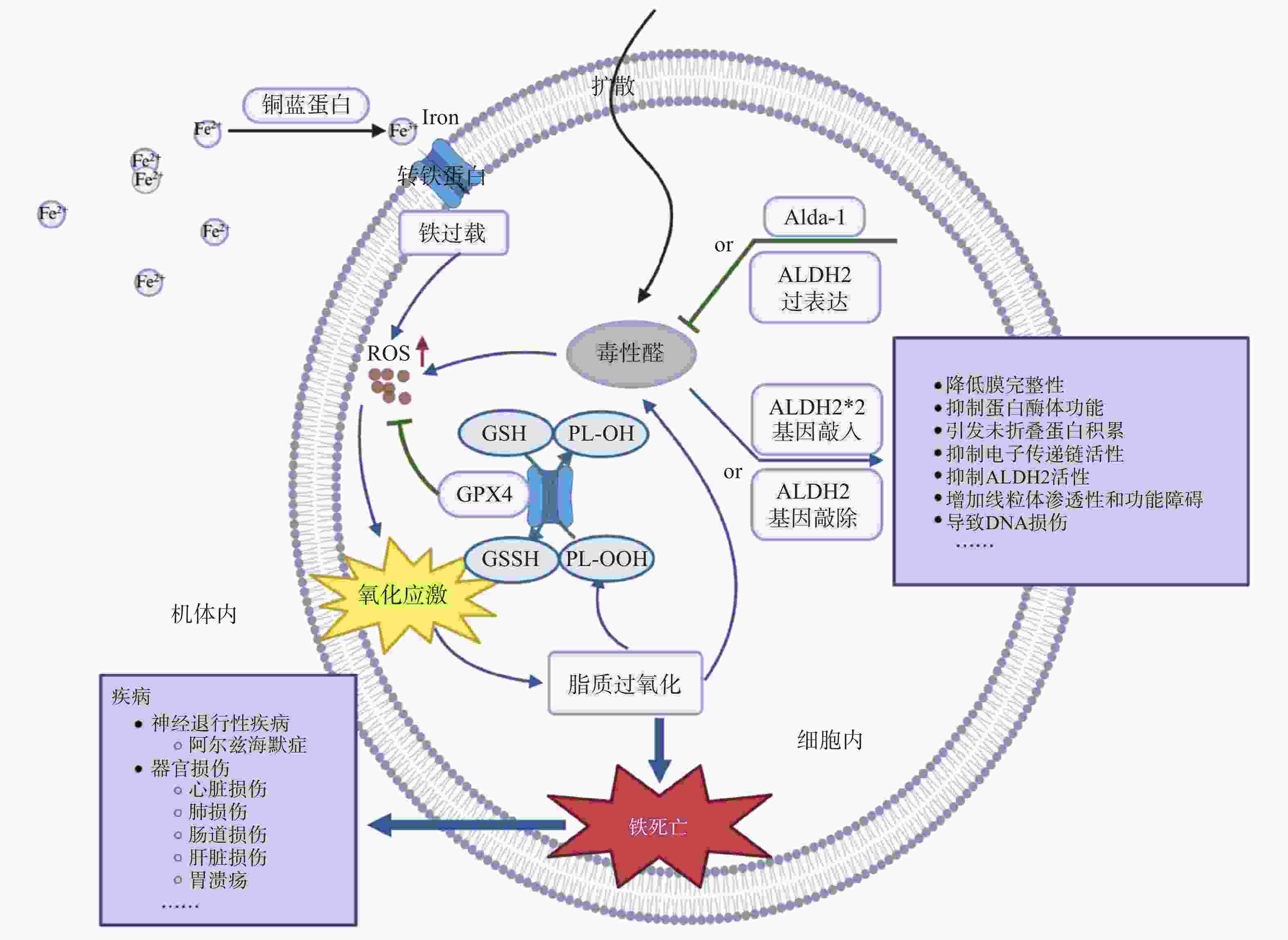
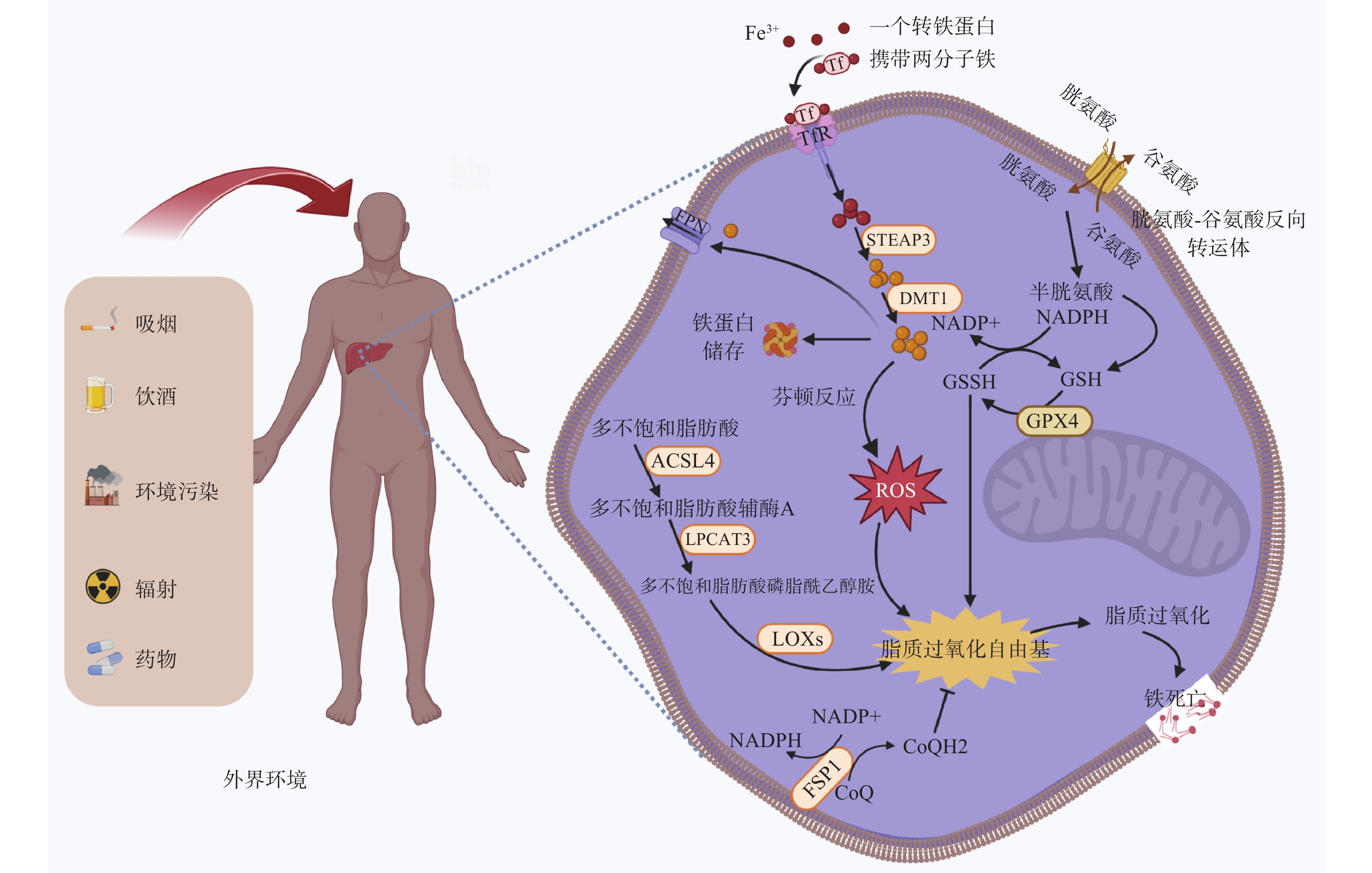
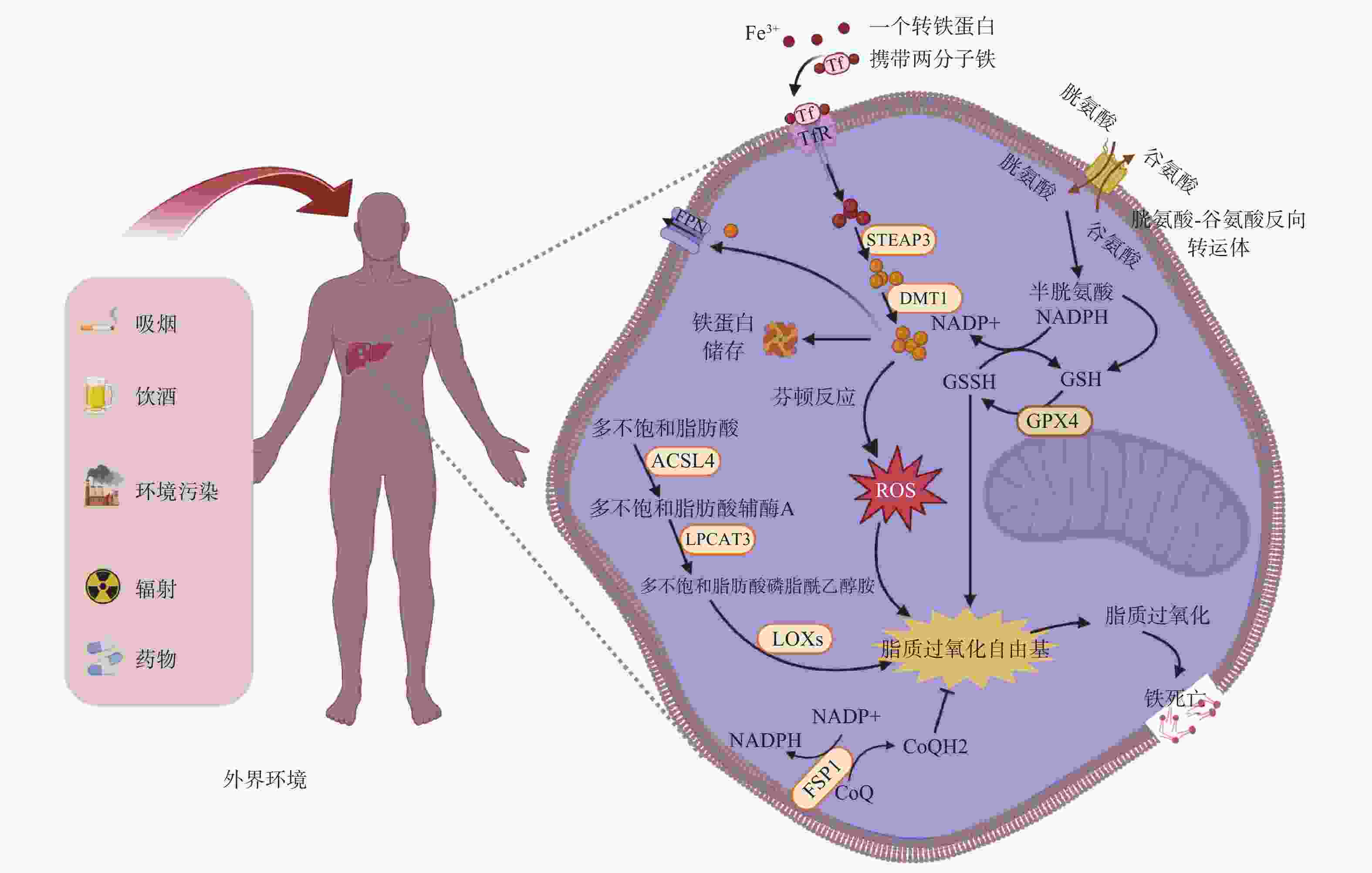
机体通过氧化还原反应来保障自身正常生理功能,该反应发生依赖氧气与过渡金属铁离子,这个过程中不可避免产生ROS副产物,其中包含磷脂氢过氧化物(PL-OOH,基于脂质的ROS形式)。谷胱甘肽过氧化物酶4(GPX4)是主要的PL-OOH中和酶,它介导谷胱甘肽(GSH)转化为氧化型谷胱甘肽(GSSG),并将PL-OOH还原生成相应的醇类(PL-OH)[2]。当细胞内PL-OOH水平超过一定阈值时,细胞将发生铁死亡。铁死亡是一种依赖于铁的独特的新型细胞程序性死亡,这种铁依赖性调节细胞死亡的特征就是不受控制的脂质过氧化介导的大量膜损伤[3]。
与传统的细胞死亡机制不同,铁死亡细胞会出现线粒体萎缩、外膜密度高、嵴退化的形态特征[4]。如图1所示,目前已确定有4种广泛的机制可以诱导铁死亡:①胱氨酸-谷氨酸反向转运蛋白系统(Xc–系统)失活;②GPX4抑制/降解/失活;③CoQ10(主要的电子传递链成分之一)的消耗减少;④通过过氧化物、铁或多不饱和脂肪酸(PUFA)过载诱导脂质过氧化。其中,前3种机制为抑制通路,主要由GPX4和铁死亡抑制蛋白1(FSP1)介导;最后一种机制为诱导通路,是由酰基辅酶A合成酶长链家族成员4(ACSL4)介导的异常的脂肪酸代谢和铁代谢。在诱导通路的铁代谢过程中,肠道吸收的Fe2+经由机体中的铜蓝蛋白转化为Fe3+,得到的Fe3+经转铁蛋白运送入细胞,再经加工成为Fe2+。细胞内过多的游离Fe2+可以通过芬顿反应直接产生过量的ROS,增加氧化损伤,并促进白介素-1β(IL-1β)和肿瘤坏死因子α等炎症因子以及MDA和4-HNE等有毒脂质过氧化产物的生成,从而对细胞造成严重损伤。
铁死亡已被证明在癌症、神经退行性疾病、缺血性器官损伤、肿瘤抑制和免疫中具有潜在的生理功能。大量研究证明,细胞脂质过氧化物与抗氧化防御系统之间的平衡是治疗这些疾病的切入点。由于氧化应激增加是神经退行性疾病与缺血性器官损伤这两种疾病的重要特征,在治疗此类疾病时,通常通过抑制细胞发生铁死亡来阻断疾病进展,而在某些肿瘤的治疗过程中,为了延缓肿瘤的发展与转移,促使肿瘤抑制,则主要通过促进肿瘤细胞铁死亡来实现治疗目的[5]。这些结果均表明,铁死亡对疾病的影响已成为某些疾病的治疗新方向,然而,如何针对疾病去调节细胞铁死亡以改善疾病预后则成为了下一个亟待解决的问题。
-
醛脱氢酶(ALDH)是一个Ⅰ相氧化酶超家族,负责内源性醛和外源性醛的解毒[6]。机体内存在19种ALDH同工酶,ALDH2是研究最充分的成员。它由位于染色体12q24的核基因编码,为具有517个氨基酸的多肽[7]。线粒体内的ALDH2由4个亚基构成,其中两个亚基组成一个二聚体,两个二聚体共同构成ALDH2结构。通常情况下,ALDH2有3种表型:野生型(ALDH2*1/*1)、杂合突变型(ALDH2*2/*1)以及纯合突变型(ALDH2*2/*2)。研究表明,约有5.6亿人存在ALDH2基因ALDH2*2半显性多态性[7],表现为ALDH2 487位的谷氨酸被赖氨酸取代,这种单核苷酸突变导致酶活性急剧降低,细胞内毒性醛积聚,ROS含量升高。
大量研究表明,ALDH2突变增加了氧化应激、炎症和细胞凋亡。针对ALDH2*2多态性人群研究发现,ALDH2*2突变患者易患食管癌、胃癌和肝细胞癌。在肝细胞癌(HCC)中,肝癌细胞调节HCC进展的机制之一便是通过下调ALDH2表达使细胞内乙醛蓄积,肝癌细胞出现氧化还原状态,然后增加AMP活化蛋白激酶(AMPK)通路的激活,从而导致癌症细胞的迁移和侵袭[8]。因此,HCC/ALDH2*2突变患者较HCC/ALDH2正常患者癌症预后效果更差。而在顺铂构建的急性肾损伤(AKI)研究模型中,研究人员发现尽管ALDH2缺乏通过破坏线粒体稳态加重了细胞凋亡和肾损伤,但通过ALDH2小分子激动剂Alda-1治疗,可减轻AKI中的线粒体功能障碍[9]。这些研究均表明ALDH2能够对许多疾病有明显的改善作用。由于ALDH2突变增加了氧化应激,而氧化应激是铁死亡的前因,许多研究将方向瞄准在氧化应激造成的铁死亡过程中ALDH2的作用。
-
如图2所示,GPX4作为调节铁死亡过程的关键酶之一,在细胞正常的生理功能中发挥至关重要的作用,细胞内过量的ROS导致GPX4活性下降,而醛类化合物的累积则是过量ROS产生的重要原因。当细胞内产生醛类化合物(如4-HNE)后,将激活ALDH2参与代谢醛类化合物,使其不能刺激细胞产生大量ROS。而当ALDH2发生突变时,4-HNE不能快速被降解,将与大分子(包括DNA、脂质和蛋白质)形成加合物,导致其羰基化,从而破坏其结构和功能。研究表明,4-HNE的积累与许多氧化应激相关疾病的发病机制有关,如癌症、代谢综合征、神经退行性疾病以及心血管疾病。理论上,通过ALDH2来减轻4-HNE诱导的毒性,具有治疗以上疾病的潜力。之前针对铁死亡相关疾病的研究多集中于抗氧化酶、铁过载等对氧化应激过程或铁死亡过程影响的探索,而近些年针对解决氧化应激过程中形成循环的关键物质—醛类化合物的研究为其提供了新的方向。下面总结了目前ALDH2改善一些铁死亡相关疾病的研究工作。
-
截至2021年,我国60岁以上人群中阿尔兹海默症(AD)患者高达983万例,预计到2050年,我国AD患者将超过3 000万人[10]。AD是一种特征为淀粉样蛋白沉积(Aβ)和神经原纤维缠结(NFT)的神经退行性认知疾病,患者表现出记忆力和认知功能进行性下降的临床症状。此前大量研究表明ALDH2多态性在神经退行性疾病起着重要作用。人类淀粉样蛋白前体/人类早老性痴呆基因1(APP/PS1)双转小鼠广泛用于研究神经系统疾病,特别是与AD、淀粉样斑块形成和晚期衰老相关的疾病[11]。近期的一项研究验证了ALDH2转基因对APP/PS1突变诱导的认知缺陷、心脏重塑和功能障碍、线粒体缺陷、凋亡、蛋白质损伤和炎症具有明显的保护作用[12]。APP/PS1突变将引起转录因子SP1、ACSL4上调,而ACSL4在大量参与细胞内脂质储存、胆固醇从内质网转运到线粒体以及花生四烯酸及其代谢物调节的情况下,其启动子区域的GC盒元件与SP1这个转录子结合形成SP1-ACSL4靶基因,随即该靶基因介导细胞发生脂质过氧化及铁死亡。在此过程中发现ALDH2能够通过下调SP1-ACSL4靶基因消除线粒体损伤和细胞铁死亡,进而对AD具有明显治疗作用。这个结果表明,ALDH2有望通过改善细胞铁死亡成为治疗AD的新靶点。
-
自2012年以来,铁死亡作为器官损伤的驱动因素已在多种生物系统中被发现[13]。心肌缺血再灌注(I/R)损伤作为发生在心肌缺血后的冠状动脉再灌注期间的常见器官损伤,是一种增强性心肌细胞损伤过程,同时也是心肌梗死后死亡率高的原因之一。在急性心肌缺血期间,线粒体中电子传递链(ETC)的功能障碍导致线粒体ATP产生减少、无氧呼吸增加和电解质交换异常。再灌注阶段后,ETC被重新激活,各种来源导致ROS爆发,细胞内形成氧化应激状态,过量的ROS介导线粒体功能障碍。这些异常的细胞内病理生理过程通过多种机制介导心肌损伤和心肌细胞死亡。最近的研究报道,I/R能够促进4-HNE积累,累积的4-HNE能够与GPX4的C93处以及卵巢肿瘤去泛素化酶5(OTUD5)的C247处的半胱氨酸残基羰基化来阻断GPX4与OTUD5之间的相互作用,从而促进GPX4泛素化和降解,最终触发心肌细胞铁死亡[14]。然而,由于体内蓄积的4-HNE无法通过正常途径降解,ALDH2突变患者在心脏再灌注后铁死亡较正常患者显著加剧,使用ALDH2小分子激动剂Alda-1治疗后,心肌细胞铁死亡得到明显改善。因此,ALDH2小分子激动剂将给与铁死亡有关的心脏再灌注的损伤治疗带来新的思考方向。
-
脓毒症是一种机体对感染反应失调而导致的危及生命的多器官功能障碍综合征(MODS),其特点是同时出现过度炎症反应和免疫紊乱,它的发病率和病死率均很高,同时,它也能诱导许多并发症如脓毒性急性呼吸窘迫综合征(ARDS)以及急性肺损伤(ALI)[15]。ALDH2作为一个治疗脓毒症的新方向,已有研究发现ALDH2能通过改善铁死亡从而对脓毒症有治疗作用。ALI作为脓毒症并发症之一,最近一篇研究发现,在盲肠结扎穿孔术(CLP)小鼠模型中,ALDH2被Alda-1激活后,肺损伤得到缓解,ROS水平和MDA以及4-HNE含量降低,组织铁含量和前列腺素内过氧化物酶合酶2(PTGS2,铁死亡生物标志物)蛋白表达也降低,GPX4蛋白表达增加[16]。这些数据表明,ALDH2的激活抑制了铁死亡。此外,还有研究发现ALDH2在抑制铁死亡、缓解肺损伤的同时也通过抑制焦亡(与铁死亡为不同类型的细胞程序性死亡)改善肺损伤。而在另一个猪心脏骤停(CA)/心肺复苏(CPR)后的肺损伤模型中也发现Alda-1处理能有效缓解CA/CPR引起的肺损伤,该保护作用可能与抑制细胞凋亡和铁死亡有关[17]。此外,在其他疾病,如重症急性胰腺炎(SAP,ALI是其常见后果和死亡原因)中也可以通过促进ALDH2的表达来防止SAP诱导的肺铁死亡和凋亡[18]。这些结果均表明,脓毒症及其衍生的疾病能通过激活ALDH2,抑制细胞铁死亡得到缓解。
-
脓毒症和脓毒性休克期间大多数受累器官包括肾脏、肺和心血管系统,近些年的研究表明肠道组织也是研究脓毒症最初的病理机制需要考虑的必要因素[19]。脓毒症诱导的炎症反应会导致肠道严重损伤和菌群失调,引起发展至全身的感染,从而导致机体死亡。此前,一项研究首次证明,Alda-1治疗可以通过抑制氧化应激、炎症反应和细胞凋亡,缓解肠道IR损伤[20]。另一项研究也证明Alda-1治疗对肾脏和肠道损伤有缓解作用,但却是通过改善铁死亡作用来实现的[21]。在这项研究中,复苏动物肾脏和肠道中铁沉积量、MDA和4-HNE含量、ACSL4表达显著增加,GSH含量和GPX4表达显著降低。然而,与CPR组相比,通过Alda-1治疗激活ALDH2,显著降低了肾脏和肠道损伤的生物标志物水平,肾脏和肠道细胞凋亡和铁死亡也有明显改善。因此,可以证明Alda-1治疗通过抑制细胞凋亡和铁死亡来缓解复苏后的肾脏和肠道损伤。脓毒症除了影响肠道、肾脏、肺以及心血管系统外,脓毒症期间的肠道屏障破坏和肠道菌群失调导致肠道病原体相关分子模式和损伤相关分子模式也可以转位到肝脏和体循环中。肝脏对于全身感染期间的免疫防御至关重要。当肝脏中发生不适当的免疫反应或压倒性的炎症时,其病原体清除能力受损和肝脏代谢紊乱会导致肠道屏障的进一步损害,同时也会增加肠道微生物群的组成和多样性的破坏[22]。因此,在研究肝脏的损伤时常常要考虑肝脏与肠道之间的相互作用。
-
肝纤维化是在有慢性肝损伤的情况下伤口修复功能失调的结果,其特征为纤维状胶原蛋白和瘢痕基质的异常积累。肝纤维化始于简单的良性脂肪变性,逐渐成为非酒精性脂肪性肝病(NAFLD),进而演变为非酒精性脂肪性肝炎(NASH),最终发展成肝纤维化、肝硬化以及肝癌。这种疾病的发病机制很复杂,可以通过两种主要影响或损伤来解释:一方面,脂质在肝细胞中积累对肝组织的影响,其次是氧化应激对肝组织的损伤[23]。其中,氧化应激是肝纤维化进程中的一个重要参与因素,可诱导细胞凋亡,启动慢性炎症应答及纤维化进程,此过程也包含了肝损伤。在肝纤维化发生和进展过程中,肝星形细胞(HSCs)的活化是其中的关键环节。活化的HSCs聚集于受损部位,转变为肌成纤维样细胞表型,分泌大量的细胞外基质,最终启动肝纤维化进程。GPX4激活已被证明可以防止铁死亡诱导的小鼠肝损伤。在针对CCl4诱导肝纤维化模型的研究表明,粗叶榕可以通过上调GPX4的表达调节铁死亡,缓解炎症、氧化应激,从而对肝纤维化发生作用[24]。在相同模型研究中,研究人员发现[25]ALDH2敲除相较ALDH2正常个体可以进一步增加转化因子β1(TGF-β1,具有控制细胞生长、增殖、分化以及凋亡的功能)诱导的ROS生成,从而通过增加α-平滑肌肌动蛋白(α-SMA)的表达来促进肝星形细胞HSCs的活化,最终推动肝纤维化的发生。肝纤维化小鼠通过Alda-1治疗后,除了能通过激活ALDH2来缓解肝的氧化应激损伤,达到治疗肝纤维化的目的外也能通过Alda-1激活核因子红细胞2相关因子2/血红素加氧酶-1(Nrf2/HO-1)抗氧化途径和线粒体自噬缓解肝纤维化。
-
全球每年约有400万人患有胃溃疡[26]。胃溃疡(GU)是由防御因子(黏液分泌、血流、抗氧化剂、细胞更新和表面活性磷脂)与破坏性因素(如胃酸、胃蛋白酶和ROS)之间的不平衡引起的[27],尤其是胃黏膜中ROS生成过多,常导致胃溃疡。ALDH2功能可保护胃粘膜细胞免受氧化应激过程中产生的4-HNE诱导的DNA损伤。已有研究表明拉米夫定可以直接激活磷酸甘油酸激酶1(PGK1),该激酶结合并刺激超氧化物歧化酶1(SOD1)抑制铁死亡并最终改善胃溃疡[28]。近期的一篇研究[29]报道,HCl/乙醇诱导的大鼠GU模型的胃组织中,SOD、CAT(过氧化氢酶)水平降低,MDA、ROS水平升高,而NLRP3、ASC和cleaved-caspase1/caspase1的表达得到增强。此外,在该模型中HCl/乙醇处理也增加了铁沉积、铁含量以及强化了ACSL4的表达,对于GPX4表达则降低了,而通过Alda-1治疗后这些影响都得以消除。因此,可以通过Alda-1给药激活ALDH2,改善铁死亡,从而治疗GU。
-
根据来源不同,机体内的醛分为内源性醛和外源性醛,外源性醛通过扩散进入细胞,与内源性醛共同作用产生ROS,大量的ROS生成使其在细胞中的含量超过了细胞抗氧化防御系统的缓冲能力,导致细胞进入氧化应激状态,此时若无法及时消耗多余的ROS,细胞将发生脂质过氧化,从而使细胞铁死亡。ALDH2与GPX4是细胞毒性醛消耗过程以及抗氧化防御过程的重要酶,两者都能通过毒性醛—ROS—氧化应激—脂质过氧化循环调控细胞铁死亡。ALDH2突变使该酶的活性急剧下降,无法及时消耗毒性醛,导致细胞出现铁死亡,ALDH2小分子激动剂Alda-1能消除或缓解这种影响。
研究证明,铁死亡与神经退行性疾病、器官损伤、癌症、传染病、自身免疫性疾病等的发生与发展密切相关。而ALDH2突变携带者在患这些疾病时较普通人会有更差的预后,此时,若通过ALDH2小分子激动剂干预,这些疾病情况将通过一条或多条通路得到改善,包括抑制铁死亡、线粒体自噬、细胞焦亡、凋亡等。因此,在研究这些疾病时需要考虑ALDH2突变对其存在的影响,这将有助于治疗铁死亡相关的疾病。此外,在对铁死亡相关的疾病进行总结时,本文发现许多疾病表面相互独立,实则内在联系紧密,比如脑缺血再灌注损伤与AD有相似的患病特征。而肝、肠损伤两个疾病之间,肠道屏障受损、菌群失调,和肝脏病原体清除能力受损和肝脏代谢紊乱会互相影响。因此,今后在研究这些疾病时也可以去探索机体疾病之间的相互联系,这也将有助于我们更好、更全面的了解疾病的致病机制,为后续临床诊断、管理提供更好的参考。
Research on aldehyde dehydrogenase 2 in improving the prognosis of ferroptosis-related diseases
-
摘要: 氧化应激是铁死亡发展和进展的重要病理生理途径。病理条件下,大量的活性氧(ROS)的产生超过了抗氧化防御系统的缓冲能力,导致细胞在氧化应激状态下脂质过氧化,进而出现细胞铁死亡。细胞脂质过氧化还会生成毒性醛,从而与重要生物大分子作用,破环细胞正常功能。目前研究发现醛脱氢酶2(ALDH2)能消除这些醛类物质,调控毒性醛-ROS-氧化应激-脂质过氧化这个循环,从而起到改善与铁死亡相关的疾病预后效果。简要介绍铁死亡和ALDH2,并总结了目前ALDH2改善铁死亡相关疾病的研究工作,可为后续与铁死亡相关的疾病治疗研究拓展新的方向。Abstract: Oxidative stress is an important pathophysiological pathway for the development and progression of ferroptosis. Under pathological conditions, the production of a large amount of reactive oxygen species(ROS)exceeds the buffering capacity of the antioxidant defense system, resulting in lipid peroxidation and cell ferroptosis in the state of oxidative stress. Cellular lipid peroxidation can generate toxic aldehydes, which interact with important biological macromolecules and break the normal function of cells. At present, it has been found that aldehyde dehydrogenase 2(ALDH2)can eliminate these aldehydes and regulate the cycle of toxic aldehydes-ROS-oxidative stress-lipid peroxidation, thereby improving the prognosis of diseases associated with iron death. Ferroptosis and ALDH2 were introduced, and the current researches on ALDH2 were summarized to improve diseases associated with iron death, which can open up new directions for the subsequent research on the treatment of diseases associated with iron death.
-
Key words:
- oxidative stress /
- reactive oxygen species /
- ferroptosis /
- aldehyde dehydrogenase 2 /
- toxic aldehydes
-
-
[1] FENG H, STOCKWELL B R. Unsolved mysteries: How does lipid peroxidation cause ferroptosis?[J]. PLoS Biology, 2018, 16(5):e2006203. doi: 10.1371/journal.pbio.2006203 [2] XUEJUN J, R. S B, MARCUS C. Ferroptosis: mechanisms, biology and role in disease[J]. Nature Reviews Molecular Cell Biology, 2021, 22(4):266-82. doi: 10.1038/s41580-020-00324-8 [3] CORADDUZZA D, CONGIARGIU A, CHEN Z, et al. Ferroptosis and Senescence: A Systematic Review [J]. Int J Mol Sci, 2023, 24(4). [4] DIXON S J, LEMBERG K M, LAMPRECHT M R, et al. Ferroptosis: An Iron-Dependent Form of Nonapoptotic Cell Death[J]. Cell, 2012, 149(5):1060-72. doi: 10.1016/j.cell.2012.03.042 [5] HE Y, LING Y, ZHANG Z, et al. Butyrate reverses ferroptosis resistance in colorectal cancer by inducing c-Fos-dependent xCT suppression[J]. Redox Biol, 2023, 65:102822. doi: 10.1016/j.redox.2023.102822 [6] MAO Q-Q, HUANG Z, ZHONG X-M, et al. Brain-derived neurotrophic factor signalling mediates the antidepressant-like effect of piperine in chronically stressed mice[J]. Behavioural Brain Research, 2014, 261:140-5. doi: 10.1016/j.bbr.2013.12.020 [7] GROSS E R, ZAMBELLI V O, SMALL B A, et al. A personalized medicine approach for Asian Americans with the aldehyde dehydrogenase 2*2 variant[J]. Annu Rev Pharmacol Toxicol, 2015, 55:107-27. doi: 10.1146/annurev-pharmtox-010814-124915 [8] ZHANG H, FU L. The role of ALDH2 in tumorigenesis and tumor progression: Targeting ALDH2 as a potential cancer treatment[J]. Acta Pharm Sin B, 2021, 11(6):1400-11. doi: 10.1016/j.apsb.2021.02.008 [9] LI J, SHI X, CHEN Z, et al. Aldehyde dehydrogenase 2 alleviates mitochondrial dysfunction by promoting PGC-1α-mediated biogenesis in acute kidney injury[J]. Cell Death Dis, 2023, 14(1):45. doi: 10.1038/s41419-023-05557-x [10] RUJING R, JINLEI Q, SHAOHUI L, et al. The China Alzheimer Report 2022[J]. General psychiatry, 2022, 35(1):e100751-e. doi: 10.1136/gpsych-2022-100751 [11] WEBSTER S J, BACHSTETTER A D, NELSON P T, et al. Using mice to model Alzheimer’s dementia: an overview of the clinical disease and the preclinical behavioral changes in ten mouse models[J]. Frontiers in Genetics, 2014, 5:88. [12] YUN Z Z, DONG L Y, YAN G, et al. Mitochondrial aldehyde dehydrogenase(ALDH2)rescues cardiac contractile dysfunction in an APP/PS1 murine model of Alzheimer’s disease via inhibition of ACSL4-dependent ferroptosis[J]. Acta Pharmacologica Sinica, 2021, 43(1):39-49. [13] ZHAO K, CHEN X, BIAN Y, et al. Broadening horizons: The role of ferroptosis in myocardial ischemia-reperfusion injury[J]. Naunyn Schmiedebergs Arch Pharmacol, 2023, 396(10):2269-86. doi: 10.1007/s00210-023-02506-5 [14] LIU L, PANG J, QIN D, et al. Deubiquitinase OTUD5 as a Novel Protector against 4-HNE-Triggered Ferroptosis in Myocardial Ischemia/Reperfusion Injury[J]. Adv Sci(Weinh), 2023, 10(28):e2301852. [15] FUJISHIMA S. Organ dysfunction as a new standard for defining sepsis[J]. Inflamm Regen, 2016, 36:24. doi: 10.1186/s41232-016-0029-y [16] CAO Z, QIN H, HUANG Y, et al. Crosstalk of pyroptosis, ferroptosis, and mitochondrial aldehyde dehydrogenase 2-related mechanisms in sepsis-induced lung injury in a mouse model[J]. Bioengineered, 2022, 13(3):4810-20. doi: 10.1080/21655979.2022.2033381 [17] WU H, XU S, DIAO M, et al. Alda-1 Treatment Alleviates Lung Injury after Cardiac Arrest and Resuscitation in Swine[J]. Shock, 2022, 58(5):464-9. [18] GE P, LUO Y, YANG Q, et al. Ferroptosis in Rat Lung Tissue during Severe Acute Pancreatitis-Associated Acute Lung Injury: Protection of Qingyi Decoction[J]. Oxid Med Cell Longev, 2023, 2023:5827613. [19] SERTARIDOU E, PAPAIOANNOU V, KOLIOS G, et al. Gut failure in critical care: old school versus new school[J]. Ann Gastroenterol, 2015, 28(3):309-22. [20] ZHU Q, HE G, WANG J, et al. Pretreatment with the ALDH2 agonist Alda-1 reduces intestinal injury induced by ischaemia and reperfusion in mice[J]. Clin Sci(Lond), 2017, 131(11):1123-36. doi: 10.1042/CS20170074 [21] YU Q, GAO J, SHAO X, et al. The Effects of Alda-1 Treatment on Renal and Intestinal Injuries After Cardiopulmonary Resuscitation in Pigs[J]. Front Med(Lausanne), 2022, 9:892472. [22] ZHANG X, LIU H, HASHIMOTO K, et al. The gut-liver axis in sepsis: interaction mechanisms and therapeutic potential[J]. Crit Care, 2022, 26(1):213. doi: 10.1186/s13054-022-04090-1 [23] BUZZETTI E, PINZANI M, TSOCHATZIS E A. The multiple-hit pathogenesis of non-alcoholic fatty liver disease(NAFLD)[J]. Metabolism, 2016, 65(8):1038-48. doi: 10.1016/j.metabol.2015.12.012 [24] YANG Y, CHEN Y, FENG D, et al. Ficus hirta Vahl. ameliorates liver fibrosis by triggering hepatic stellate cell ferroptosis through GSH/GPX4 pathway[J]. Journal of Ethnopharmacology, 2024, 334:118557. doi: 10.1016/j.jep.2024.118557 [25] MA X, LUO Q, ZHU H, et al. Aldehyde dehydrogenase 2 activation ameliorates CCl(4)-induced chronic liver fibrosis in mice by up-regulating Nrf2/HO-1 antioxidant pathway[J]. J Cell Mol Med, 2018, 22(8):3965-78. doi: 10.1111/jcmm.13677 [26] SELMI M A, AL-HADDABI B, YAHMED M H, et al. Does Maturity Status Affect the Relationship Between Anaerobic Speed Reserve and Multiple Sprint Sets Performance in Young Soccer Players?[J]. The Journal of Strength & Conditioning Research, 2020, 34(12):3600-6. [27] SALAHELDIN A T, SHEHATA M R, SAKR H I, et al. Therapeutic Potency of Ovothiol A on Ethanol-Induced Gastric Ulcers in Wistar Rats[J]. Marine Drugs, 2023, 21(1):25. [28] MENG X, LIU J, KANG J, et al. Lamivudine protects mice from gastric ulcer by activating PGK1 to suppress ferroptosis[J]. Biochemical Pharmacology, 2024, 227:116440. doi: 10.1016/j.bcp.2024.116440 [29] ZHANG Y, YUAN Z, CHAI J, et al. ALDH2 ameliorates ethanol-induced gastric ulcer through suppressing NLPR3 inflammasome activation and ferroptosis[J]. Archives of Biochemistry and Biophysics, 2023, 743:109621. doi: 10.1016/j.abb.2023.109621 -




 下载:
下载: