-
花椒为芸香科植物红花椒Zanthoxylum bungeanum Maxim.或青花椒Zanthoxylum schinifolium Sieb.et Zucc.的干燥成熟果皮,味辛,性温,具有温中止痛、杀虫止痒的功效,主治脘腹冷痛、呕吐泄泻、虫积腹痛[1]。生物碱是花椒的主要特征性成分,组成丰富、结构多样,具有抗炎、镇痛、抗菌、抗氧化、降脂和抗肿瘤等多种药理活性[2-8]。其中,不饱和脂肪酰胺类生物碱如羟基-α-山椒素(HAS)、羟基-β-山椒素(HBS)已经被证实能够调节脂质代谢,对非酒精性脂肪肝病等代谢性疾病的预防具有潜在效果[9]。然而,对花椒生物碱的制备、富集纯化工艺优化的研究较少。花椒生物碱高效提取与纯化是其后续活性评价和产品开发的基础,有利于花椒药用价值的深度开发,因此优化花椒生物碱的富集纯化工艺具有重要意义。
大孔吸附树脂法是最常用的富集纯化手段,具有选择性好、吸附能力强、富集效果好、环保绿色等优点,在中药材、中药制剂方面应用广泛[10-11]。因此,本实验以HAS、HBS的得率为指标,筛选适宜纯化花椒生物碱的大孔树脂类型,采用单因素实验和正交试验确定树脂的最佳吸附、除杂、洗脱条件,建立大孔树脂富集纯化花椒生物碱的最佳工艺。采用超高效液相色谱-四级杆-飞行时间质谱(UPLC-Q-TOF-MSE)技术鉴定成分,以期为花椒生物碱的物质基础研究和进一步的综合开发利用提供科学依据。
-
花椒药材(批号:20220705-2,购于陕西省渭南韩城市),经海军军医大学张成中副教授鉴定为芸香科花椒属红花椒(Zanthoxylum bungeanum Maxim)的干燥果皮。
-
1260型高效液相色谱仪(美国安捷伦公司);Acquity I-CLASSTM UPLC 超高效液相色谱系统、Xevo G2-XS 四级杆串联飞行时间质谱(美国沃特世科技有限公司);R-100型旋转蒸发仪(瑞士步琦有限公司);DZF-6050型真空干燥箱(巩义市予华仪器有限责任公司);XS205DU电子分析天平(梅特勒托利多科技公司)。
HAS对照品(纯度≥98%,批号:P2834270,源叶);HBS对照品(纯度≥98%,批号:P2832664,诗丹德);95%乙醇(分析纯,上海泰坦科技股份有限公司);甲酸、甲醇、乙腈(色谱纯,赛默飞世尔科技公司);APS-17型、NKA-9型、HP-20型、AB-8型大孔吸附树脂(沧州宝恩吸附材料科技有限公司);HPD-400型大孔吸附树脂(上海一飞生物科技有限公司);HP-20型大孔吸附树脂(日本三菱化学株式会社)。
-
称取50 g花椒于圆底烧瓶中,加入500 ml的50%乙醇,95℃水浴加热,回流提取1 h,共提取3次。过滤后合并滤液,45℃减压浓缩至无醇味,过滤,加水分散至250 ml,即得上样液。
取216 ml上样液,上样于直径为2.7 cm、高度为18.9 cm的三菱HP-20型大孔树脂柱,动态吸附30 min,静置1 h后,取216 ml 20%乙醇除杂24 min;540 ml 80%乙醇洗脱1 h。收集洗脱液,45℃减压浓缩并干燥,即得提取物粉末。
对照品溶液:精密称定HAS、HBS对照品适量,加50%乙醇定容,分别制成0.61 mg/ml、0.11 mg/ml的对照品溶液。
供试品溶液:精密称定适量提取物粉末,加50%乙醇定容后,0.45 μm微孔滤膜过滤,即为供试品溶液。
-
色谱柱:Agilent ZORBAX Eclipse Plus-C18柱(2.1 mm×100 mm, 1.8 μm);流速:0.3 ml/min;检测波长:270 nm;柱温:30℃;进样量:5 μl。流动相:乙腈(A)-0.1%三乙胺(B);洗脱梯度:0~18 min,10%→35%A;18~30 min,35%→50%A;30~36 min,50%→90%A,36~39 min,90%A,39~40 min,90%→10%A。
-
取HAS对照品溶液、HBS对照品溶液0.2、0.5、1.0、2.0、4.0 ml置于5个5 ml容量瓶中,50%乙醇定容至刻度,摇匀后得到系列梯度浓度的标准工作溶液,0.45 μm微孔滤膜过滤,在“2.1.2”项下色谱条件下进样。
-
取“2.1.1”项下对照品溶液2.0 ml置于5 ml容量瓶中,50%乙醇定容至刻度,混匀后0.45 μm微孔滤膜过滤,连续进样6次。
-
取“2.1.1”项下的供试品溶液,于0、1、2、4、8、24 h分别进样。
-
按照“2.1.1”项方法平行制备供试品溶液 6 份,在“2.1.2”项下色谱条件进样测定。
-
精密称取已知HAS、HBS含量的花椒生物碱粉末适量, 共取9份,分别准确加入HAS、HBS对照品适量,按“2.1.1”项下方法制备供试品溶液,进样分析并计算加样回收率。
-
95%乙醇浸泡树脂24 h,充分溶胀后湿法装柱,95%乙醇淋至洗脱液澄清透明,水洗至洗脱液无醇味,备用。取预处理后的不同类型的大孔树脂,按“2.1.1”项下方法制备供试品溶液并进样,计算HAS、HBS的总得率。
-
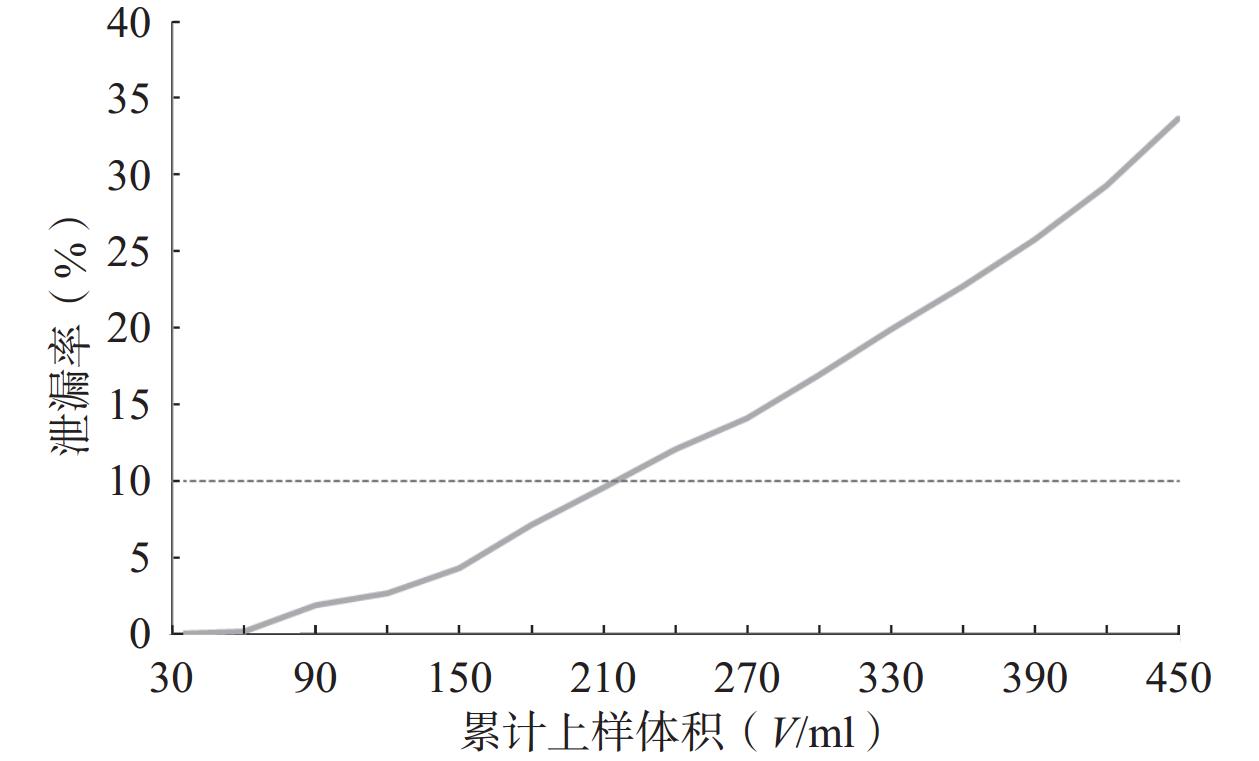
湿法装柱,取“2.1.1”项下制备的上样液450 ml,以2 BV/h上样,流出液每30 ml收集1份。按“2.1.2”项下色谱条件进样,以累计上样体积(V/ml)为横坐标(X),以HAS、HBS的总泄漏率(%)为纵坐标(Y),绘制泄漏曲线。
-
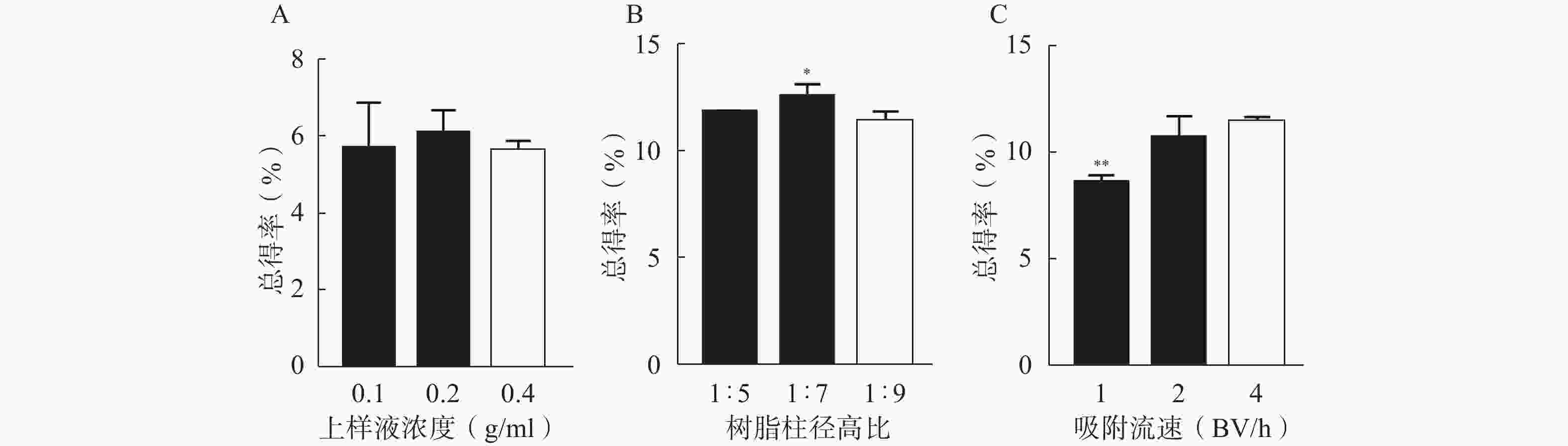
除变量外固定其他工艺条件(树脂类型、上样量与树脂体积比、除杂溶剂、除杂体积、除杂流速、洗脱溶剂、洗脱体积及洗脱流速分别为三菱HP-20型、1 g∶2.5 ml、10%乙醇,2 BV、5 BV/h、70%乙醇、5 BV及5 BV/h)不变的情况下,分别考察上样液浓度(0.1、0.2、0.4 g生药/ml)、树脂柱径高比(1∶5、1∶7、1∶9)及吸附流速(1、2、4 BV/h)对花椒生物碱中HAS、HBS总得率的影响。
-
在单因素实验的基础上,采用L9(33)正交试验进一步分析除杂条件(除杂溶剂、体积、流速)、洗脱条件(洗脱溶剂、体积、流速)对花椒生物碱中HAS、HBS总得率的影响(表1),总结最佳工艺并进行验证。统计分析使用SPSS 26.0 软件。
表 1 除杂、洗脱条件正交试验因素水平表
条件 水平 因素 A因素溶剂 B因素体积(BV) C因素流速(BV/h) 除杂 1 蒸馏水 1 2 2 10%乙醇 2 3 3 20%乙醇 3 5 洗脱 1 55%乙醇 3 2 2 70%乙醇 5 3 3 80%乙醇 8 5 -
精密称定“2.2.4”项下以最佳工艺制备的花椒生物碱粉末5.0 mg,50%甲醇定容至25 ml,0.45 μm微孔滤膜过滤备用。
-
色谱柱:Waters ACQUITY HSS T3柱(2.1×100 mm, 1.7 μm);检测波长:270 nm;流速:0.3 ml/min;柱温:30℃;进样量:3 μl。流动相:乙腈(A)-0.1%甲酸水(B),洗脱梯度:0~18 min,10%→35%A;18~24 min,35%→46%A;24~30 min,46%→90%A;30~32 min,90%A;32~33 min,90%~10%A;33~36 min,10%A。
-
电喷雾离子源(ESI),正离子模式扫描。离子源温度120℃,雾化气流速为800 L/h,毛细管电压为3.0 kV。锥孔电压40 V,补偿电压80 V。低能量扫描电压6 eV,高能量扫描电压30~60 eV;喷雾器压力为6.5×105 Pa,气帘气体积流量为50 L/h,扫描范围m/z为50~
1500 。亮氨酸-脑啡肽(m/z∶ 554.261 5 [M-H]−)和(m/z∶ 556.277 1[M+H]+)作为外标进行质量实时校正,体积流量设为5 μl/min。MassLynx V4.1工作站使用MSE模式采集质谱数据。
-
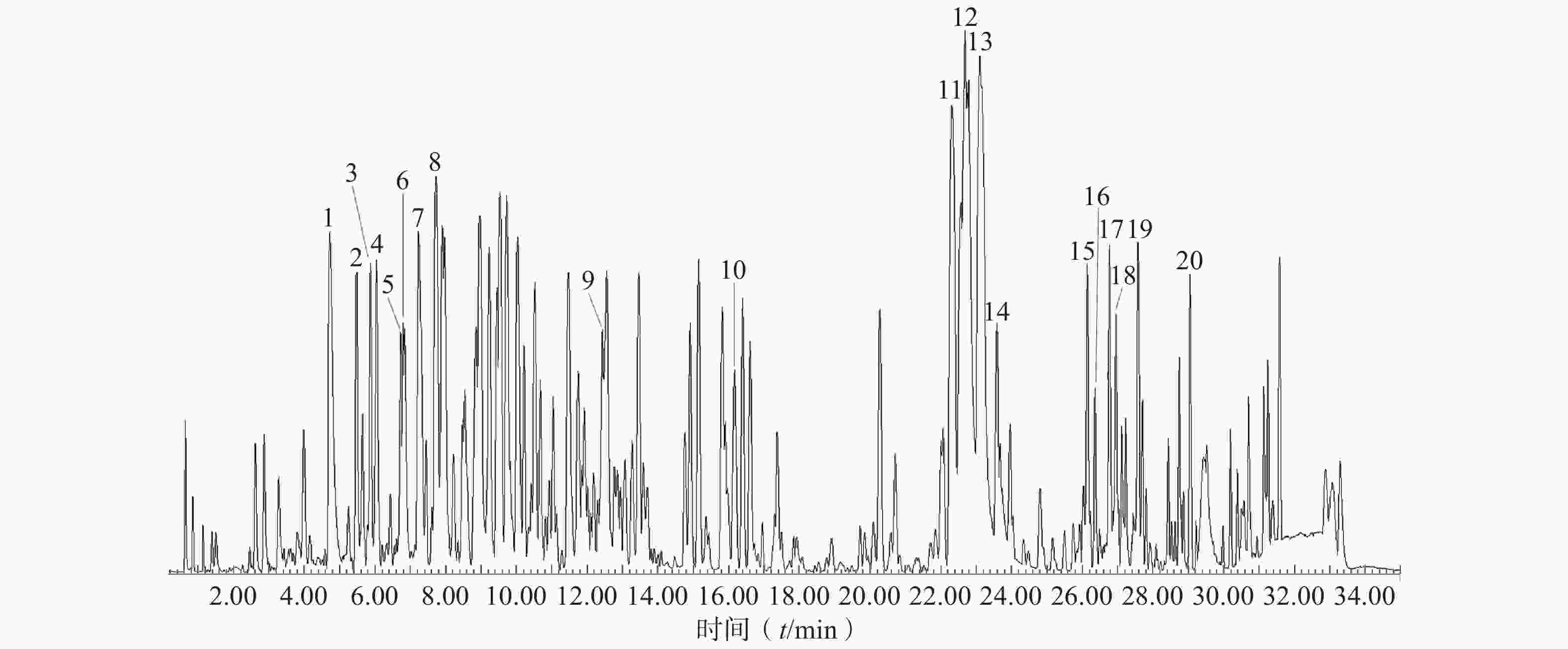
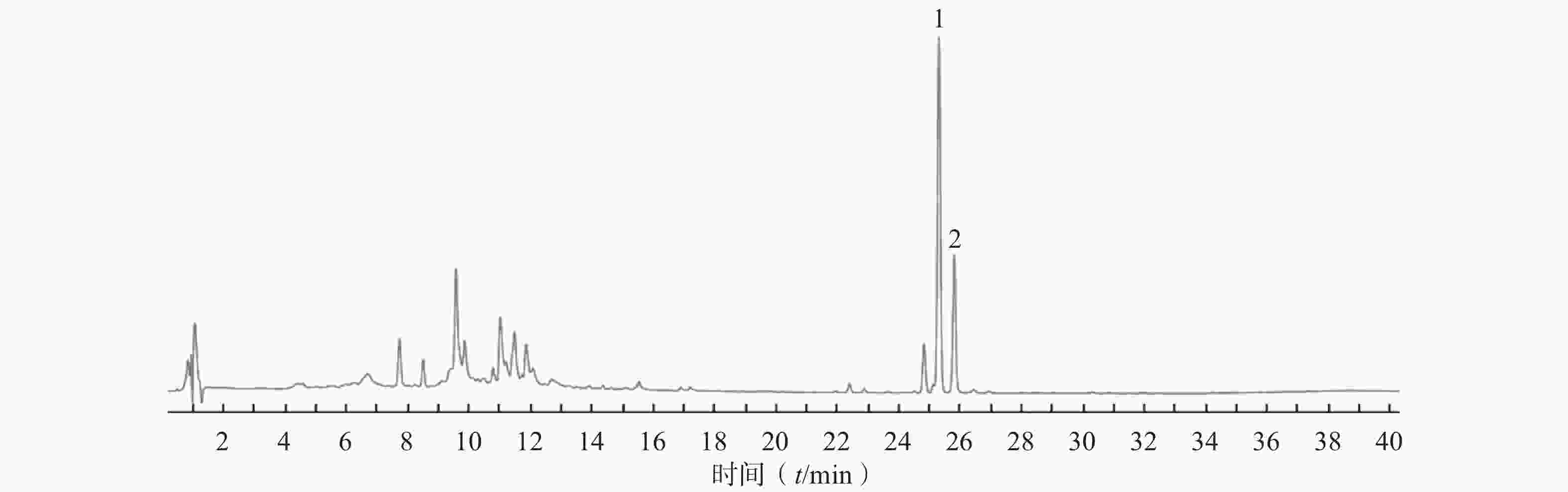
供试品HPLC图如图1所示,该色谱条件下,HAS与HBS色谱峰分离度大于1.5、理论塔板数均大于
30000 、峰形稳定、无干扰,能够满足样品分析检测要求。 -
以对照品溶液的浓度为横坐标(X),峰面积为纵坐标(Y),得到HAS的回归方程Y=
3312.7 X−8.887,r=0.999;HBS的回归方程Y=33030 X+12.061,r=0.999。即HAS、HBS分别在进样浓度为24.4~488 μg/ml、4.4~88 μg/ml范围内呈良好的线性关系。 -
HAS、HBS峰面积的RSD分别为0.94%、0.34%,仪器精密度良好,符合定量测定要求。
-
HAS、HBS峰面积的RSD分别为0.20%、0.43%,表明供试品溶液在室温条件下24 h内稳定。
-
HAS、HBS峰面积的RSD分别为0.26% 和0.26%,表明方法重复性良好。
-
计算得到HAS低、中、高浓度的加样回收率分别为(103.66±0.62)%、(100.22±3.10)%、(102.47±1.24)%;HBS的低、中、高浓度的加样回收率分别为(101.35±0.89)%、(98.58±2.48)%、(98.86±1.02)%。结果表明该测定方法准确性好,可用于样品中HAS、HBS的含量测定。
-
使用三菱HP-20型树脂富集花椒生物碱类成分时,HAS、HBS两成分的总含量(X)最高且结果稳定,结果见表2。因此,优选三菱HP-20型大孔吸附树脂进行后续实验。
表 2 不同类型树脂对HAS、HBS总得率的影响(n=3)
树脂类型 HAS、HBS
总浓度(mg/ml)HAS、HBS
总含量(%)$ \bar{X} $±SD(%) APS-17 2.42 4.06 4.06±2.17 NKA-9 2.08 3.50 3.50±1.76 宝恩HP-20 3.68 6.19 6.19±1.09 AB-8 3.58 6.02 6.02±1.28 HPD-400 3.59 6.03 6.03±0.98 三菱HP-20 4.10 6.89 6.89±0.62 -
由图2可知,当上样液体积为90 ml时,花椒生物碱开始少量泄漏;随着上样体积增加,流出液中生物碱浓度呈现上升趋势;当上样液为210 ml时,累计泄漏率为9.61%,接近上样液中HAS、HBS总浓度的10%[12]。因此确定最大上样量为210 ml,即上样生药量与树脂体积比约为1 g∶2.5 ml。
-
由图3可知,当上样液浓度为0.2 g生药/ml时,HAS和HBS的得率最高;随着浓度升高,杂质增多,与生物碱竞争吸附活性位点,得率下降;此外高浓度上样液在静置吸附过程中较容易发生絮凝和沉淀现象[13-14]。故优选上样液浓度为0.2 g生药/ml。树脂径高比为1∶7、吸附流速为4 BV/h时,HAS和HBS的总得率最高。故选用树脂径高比为1∶7的三菱HP-20型树脂柱,动态吸附流速为4 BV/h。
-
如表3所示,以HAS、HBS总得率为指标时,影响三菱HP-20型大孔树脂纯化花椒总生物碱的除杂因素依次为除杂溶剂(A)>除杂流速(C)>除杂体积(B)。除杂的最佳条件为20%乙醇、流速为5 BV/h。除杂体积由2 BV提升到3 BV,结果差异并不明显,为节约溶剂、提高效率,优选2 BV为除杂体积。
表 3 除杂条件L9(33)正交设计及结果
编号 因素 总得率(%) 除杂溶剂(A) 除杂体积(B) 除杂流速(C) 1 1 1 1 7.87 2 1 2 2 9.09 3 1 3 3 9.31 4 2 1 2 10.33 5 2 2 3 10.42 6 2 3 1 10.67 7 3 1 3 11.82 8 3 2 1 10.73 9 3 3 2 11.66 k1 8.75 10.06 9.71 − k2 10.44 10.07 10.34 − k3 11.37 10.48 10.52 − R 2.62 0.64 0.81 − 由表4可知,洗脱因素对HAS、HBS总得率的影响次序依次为洗脱溶剂(A)>洗脱流速(C)>洗脱体积(B);最佳组合条件为洗脱溶剂80%乙醇,洗脱体积为5 BV,洗脱流速5 BV/h。
表 4 洗脱条件L9(33)正交设计及结果
编号 因素 总得率
(%)洗脱溶剂(A) 洗脱体积(B) 洗脱流速(C) 1 1 1 1 2.55 2 1 2 2 5.38 3 1 3 3 7.15 4 2 1 2 5.75 5 2 2 3 8.11 6 2 3 1 9.57 7 3 1 3 9.20 8 3 2 1 8.28 9 3 3 2 6.36 k1 5.03 5.83 6.80 − k2 7.81 7.26 5.83 − k3 7.95 7.69 8.15 − R 2.92 1.86 2.32 − -
实验确立花椒生物碱制备的最佳工艺为料液比1∶10,溶剂为50%乙醇,95℃水浴加热,每次回流提取1 h,提取3次,过滤后合并滤液;45℃减压浓缩至无醇味,纱布过滤,加水分散至生药浓度相当于0.2 g/ml的上样液;按上样生药量与大孔吸附树脂的体积比1 g∶2.5 ml,上样于三菱HP-20型大孔树脂,树脂柱径高比1∶7,动态吸附流速4 BV/h,静置1 h后,2 BV、20%乙醇以5 BV/h除杂;80%乙醇洗脱,体积5 BV,流速5 BV/h。收集洗脱液,45℃减压浓缩并干燥,即得花椒生物碱提取物。
由表5可知,三次重复实验花椒生物碱得膏率相近,富集纯化后HAS、HBS总含量的RSD为0.87%,证明本方法确定的大孔树脂富集纯化花椒生物碱的工艺稳定可靠,重复性高。此外,经纯化后花椒生物碱中HAS、HBS的含量分别为4.71%、1.02%,与富集纯化前相比,花椒生物碱的含量得到明显升高。
表 5 最佳工艺验证结果
编号 得膏率
(%)富集前
总含量(%)富集后
总含量(%)富集后
总含量RSD(%)1 6.88 0.82 5.73 0.87 2 6.91 0.81 5.72 0.87 3 6.95 0.82 5.64 0.87 -
通过中药系统药理学数据库与分析平台、PubChem、Web of science等数据库和国内外文献,收集花椒的化学成分信息,包括绘制化学结构、整理化合物名称与分子式、利用MasslynxV4.1计算化合物精确质量等,建立共包含95种生物碱的花椒化学成分数据库。
由图4可知,在正离子模式下,生物碱类化合物得到了较好的分离。结合质谱数据、相关文献对照品的裂解规律和紫外吸收,并与自建的花椒化学成分数据库进行对比分析,共识别鉴定或推导出20种生物碱类化合物,包括木兰花碱、茵芋碱、HAS、HBS等(见表6)。
表 6 正离子模式下花椒生物碱类成分碎片离子及鉴定结果
峰号 保留时
间(t/min)化合物 分子式 离子模式 理论值
(m/z)实测值
(m/z)误差
(ppm)碎片离子
(m/z)参考
文献1 4.716 木兰花碱 C20H24NO4+ [M]+ 342.170 5 342.169 0 −4.38 342.169 0[M]+, 297.110 6[M-C2H7N]+, 282.088 2[M-C2H7N-CH3]+, 265.085 2[C17H13O3]+, 222.065 3[C15H10O2]+, 191.084 6[C15H11]+, 194.071 4[C14H10O]+, 165.069 3[C13H9]+ [17] 2 5.483 ZP-amide D C16H27NO4 [M+Na]+ 320.183 8 320.182 5 −4.06 321.186 4[M+H+Na]+, 320.182 5[M+Na]+ [18] 3 5.877 ZP-amide E C16H27NO4 [M+Na]+ 320.183 8 320.182 5 −4.06 320.182 5[M+Na]+ [18] 4 6.043 ZP-amide A C16H25NO4 [M+Na]+ 318.168 1 318.168 5 1.26 613.338 5[2M+Na]+, 319.169 2[M+H+Na]+, 318.168 5[M+Na]+, 296.183 8[M+H]+, 278.175 6[M-OH]+ [18-19] 5 6.724 ZP-amide B C16H25NO4 [M+Na]+ 318.168 1 318.168 5 1.26 613.338 5[2M+Na]+, 319.169 2[M+H+Na]+, 318.168 5[M+Na]+, 296.183 8[M+H]+, 278.175 6[M-OH]+ [18-19] 6 6.793 ZP-amide C C16H27NO4 [M+Na]+ 320.183 8 320.182 5 −4.06 321.186 4[M+H+Na]+, 320.182 5[M+Na]+ [18, 20] 7 7.222 ZP-amide L C16H27NO4 [M+Na]+ 320.183 8 320.182 5 −4.06 321.186 4[M+H+Na]+, 320.182 5[M+Na]+ [18] 8 7.902 ZP-amide K C16H27NO4 [M+Na]+ 320.183 8 320.182 5 −4.06 321.186 4[M+H+Na]+, 320.182 5[M+Na]+ [18] 9 12.427 ZP-amide N C18H31NO4 [M+Na]+ 348.215 1 348.213 0 −6.03 349.217 7[M+H+Na]+, 348.213 0[M+Na]+ [18] 10 16.168 茵芋碱 C14H13NO4 [M+H]+ 260.092 3 260.092 3 0.00 229.037 0[M-2CH3]+, 227.056 6[C13H9NO3]+, 202.046 8[C11H8NO3]+, 199.062 5[C12H9NO2], 184.037 9[C11H6NO2]+, 156.043 4[C10H6NO]+, 77.037 7[C6H5]+ [21] 11 22.312 羟基-ε-山椒素 C16H25NO2 [M+Na]+ 286.178 3 286.178 3 0.00 302.171 4[M+K]+, 286.178 3[M+Na]+, 246.184 4[M-OH]+ [22] 12* 22.701 羟基-α−
山椒素C16H25NO2 [M+Na]+ 286.178 3 286.178 3 0.00 287.179 5[M+H+Na]+, 286.178 3[M+Na]+, 246.184 4[M-OH]+ [23] 13* 23.113 羟基-β−
山椒素C16H25NO2 [M+Na]+ 286.178 3 286.178 3 0.00 287.179 5[M+H+Na]+, 286.178 3[M+Na]+, 246.187 5[M-OH]+ [23] 14 23.605 Zanthoamides A C18H27NO4 [M-OH]+ 304.191 3 304.191 3 0.00 345.184 4[M+H+Na]+, 344.181 6[M+Na]+ [24] 15 26.156 羟基-γ−山椒素 C18H27NO2 [M+Na]+ 312.193 9 312.193 5 −1.28 601.398 7[2M+Na]+, 313.164 8[M+H+Na]+, 312.193 5[M+Na]+, 272.200 9[M-OH]+ [22] 16 26.379 羟基-γ−
异山椒素C18H27NO2 [M+Na]+ 312.193 9 312.193 5 −1.28 601.398 7[2M+Na]+, 313.164 8[M+H+Na]+, 312.193 5[M+Na]+, 272.200 9[M-OH]+ [22] 17 26.786 bungeanool C18H29NO2 [M-OH]+ 274.217 1 274.216 5 −2.19 565.363 6[2M-OH]+, 314.210 3[M+Na]+ [15] 18 26.957 isobungeanool C18H29NO2 [M-OH]+ 274.217 1 274.216 5 −2.19 565.363 6[2M-OH]+, 314.210 3[M+Na]+ [15] 19 27.586 α−山椒素 C16H25NO [M+H]+ 248.201 4 248.201 2 −0.81 286.178 3[M+K]+ [23] 20 29.068 四氢花椒素 C18H33NO2 [M+H]+ 296.259 0 296.257 7 −4.39 318.237 8[M+Na]+, 279.137 4[M+H-OH]+ [25] *:为与对照品比对的化合物。 -
实验前期,考察了酸提碱沉法与乙醇回流提取法,经比较发现两方法制备得到的花椒生物碱中HAS、HBS含量差别不显著。但以酸性溶液浸提生物碱时,耗时长、水溶性杂质较多,而且酸性溶液可能会使部分生物碱吸收氢离子导致质子化从而发生重排反应,破坏分子结构,综合考虑下本实验选择乙醇回流提取法。
HAS、HBS是花椒的代表性酰胺类生物碱,具有降脂、抗氧化、麻醉、神经营养等多种活性,受到研究者的广泛关注[15-16]。本实验确立的工艺能够有效富集花椒生物碱,显著提高HAS、HBS含量,为后续HAS、HBS单体化合物的制备提供了基础。实验过程中尝试通过优化除杂条件、分段收集乙醇洗脱液等方法分离黄酮与生物碱类成分,但UPLC-Q-TOF-MSE得到的BPI图中,8~11 min仍存在着部分响应较高的黄酮类物质无法完全分离,后续还需要探索其他有效的方法进一步去除黄酮类成分。
本实验在单因素实验基础上采用正交设计考察了花椒生物碱的最佳纯化工艺,利用UPLC-Q-TOF-MSE对生物碱成分进行分析鉴定,使用HPLC对制备得到的花椒生物碱中的HAS、HBS进行含量测定。本纯化工艺简单可行、稳定有效,可为花椒生物碱的综合开发利用及工业化生产提供科学依据,对提升花椒的综合经济价值具有深远意义。
Optimization of purification process and component analysis of alkaloids from Zanthoxylum bungeanum Maxim
-
摘要:
目的 优化大孔树脂富集纯化花椒生物碱的工艺条件,并进行成分分析。 方法 单因素实验与正交试验相结合,以羟基-α-山椒素(HAS)、羟基-β-山椒素(HBS)含量为指标,确定最佳工艺参数。利用超高效液相色谱-四级杆-飞行时间质谱(UPLC-Q-TOF-MSE)技术定性分析生物碱类化学成分。 结果 最佳条件为选用三菱HP-20型大孔树脂,上样液浓度为0.2 g生药/ml,生药量与树脂体积比为1 g∶2.5 ml,树脂柱径高比为1∶7,以每小时4倍柱体积(BV)的速率动态吸附,静置1 h;20%乙醇2 BV除杂;80%乙醇5 BV洗脱。HAS、HBS的含量分别为4.71%、1.02%,共鉴定出20种生物碱。 结论 该方法稳定可行,得到高纯度多种类的花椒生物碱,可用于花椒生物碱的富集纯化。 -
关键词:
- 花椒 /
- 生物碱 /
- 大孔树脂 /
- 正交设计 /
- 超高效液相色谱-四级杆-飞行时间质谱
Abstract:Objective To optimize the process conditions and analyze the components of alkaloids from Zanthoxylum bungeanum Maxim(Z. bungeanum)using macroporous resin. Methods Combining single factor tests and orthogonal tests, the content of hydroxy-α-sanshool(HAS)and hydroxy-β-sanshool(HBS)were considered as indexes to determine the best process parameters. Ultra-performance liquid chromatography-quadrupole tandem time-of-flight mass spectrometry(UPLC-Q-TOF-MSE)was used to identify the structures of alkaloids. Results The optimal conditions were Mitsubishi HP-20 macroporous resin, the loading solution concentration was 0.2 g crude drug/ml, the ratio of crude drug to resin volume was 1 g∶2.5 ml, the diameter/height ratio of resin column was 1∶7, the dynamic adsorption flow rate was 4 times of bed volume(BV)per hour, and the adsorption time was 1 h. Impurities were removed by using 2 BV of 20% ethanol, 5 BV of 80% ethanol was used to elution, and the content of HAS and HBS was 4.71% and 1.02%, respectively. A total of 20 alkaloids were identified from Z. bungeanum. Conclusion This method was stable and feasible, obtaining high purity and various kinds of alkaloids, which could be used for the enrichment and purification of alkaloids from Z. bungeanum. -
Key words:
- Zanthoxylum bungeanum Maxim /
- alkaloids /
- macroporous resin /
- orthogonal design /
- UPLC-Q-TOF-MSE
-
表 1 除杂、洗脱条件正交试验因素水平表
条件 水平 因素 A因素溶剂 B因素体积(BV) C因素流速(BV/h) 除杂 1 蒸馏水 1 2 2 10%乙醇 2 3 3 20%乙醇 3 5 洗脱 1 55%乙醇 3 2 2 70%乙醇 5 3 3 80%乙醇 8 5 表 2 不同类型树脂对HAS、HBS总得率的影响(n=3)
树脂类型 HAS、HBS
总浓度(mg/ml)HAS、HBS
总含量(%)$ \bar{X} $ ±SD(%)APS-17 2.42 4.06 4.06±2.17 NKA-9 2.08 3.50 3.50±1.76 宝恩HP-20 3.68 6.19 6.19±1.09 AB-8 3.58 6.02 6.02±1.28 HPD-400 3.59 6.03 6.03±0.98 三菱HP-20 4.10 6.89 6.89±0.62 表 3 除杂条件L9(33)正交设计及结果
编号 因素 总得率(%) 除杂溶剂(A) 除杂体积(B) 除杂流速(C) 1 1 1 1 7.87 2 1 2 2 9.09 3 1 3 3 9.31 4 2 1 2 10.33 5 2 2 3 10.42 6 2 3 1 10.67 7 3 1 3 11.82 8 3 2 1 10.73 9 3 3 2 11.66 k1 8.75 10.06 9.71 − k2 10.44 10.07 10.34 − k3 11.37 10.48 10.52 − R 2.62 0.64 0.81 − 表 4 洗脱条件L9(33)正交设计及结果
编号 因素 总得率
(%)洗脱溶剂(A) 洗脱体积(B) 洗脱流速(C) 1 1 1 1 2.55 2 1 2 2 5.38 3 1 3 3 7.15 4 2 1 2 5.75 5 2 2 3 8.11 6 2 3 1 9.57 7 3 1 3 9.20 8 3 2 1 8.28 9 3 3 2 6.36 k1 5.03 5.83 6.80 − k2 7.81 7.26 5.83 − k3 7.95 7.69 8.15 − R 2.92 1.86 2.32 − 表 5 最佳工艺验证结果
编号 得膏率
(%)富集前
总含量(%)富集后
总含量(%)富集后
总含量RSD(%)1 6.88 0.82 5.73 0.87 2 6.91 0.81 5.72 0.87 3 6.95 0.82 5.64 0.87 表 6 正离子模式下花椒生物碱类成分碎片离子及鉴定结果
峰号 保留时
间(t/min)化合物 分子式 离子模式 理论值
(m/z)实测值
(m/z)误差
(ppm)碎片离子
(m/z)参考
文献1 4.716 木兰花碱 C20H24NO4+ [M]+ 342.170 5 342.169 0 −4.38 342.169 0[M]+, 297.110 6[M-C2H7N]+, 282.088 2[M-C2H7N-CH3]+, 265.085 2[C17H13O3]+, 222.065 3[C15H10O2]+, 191.084 6[C15H11]+, 194.071 4[C14H10O]+, 165.069 3[C13H9]+ [17] 2 5.483 ZP-amide D C16H27NO4 [M+Na]+ 320.183 8 320.182 5 −4.06 321.186 4[M+H+Na]+, 320.182 5[M+Na]+ [18] 3 5.877 ZP-amide E C16H27NO4 [M+Na]+ 320.183 8 320.182 5 −4.06 320.182 5[M+Na]+ [18] 4 6.043 ZP-amide A C16H25NO4 [M+Na]+ 318.168 1 318.168 5 1.26 613.338 5[2M+Na]+, 319.169 2[M+H+Na]+, 318.168 5[M+Na]+, 296.183 8[M+H]+, 278.175 6[M-OH]+ [18-19] 5 6.724 ZP-amide B C16H25NO4 [M+Na]+ 318.168 1 318.168 5 1.26 613.338 5[2M+Na]+, 319.169 2[M+H+Na]+, 318.168 5[M+Na]+, 296.183 8[M+H]+, 278.175 6[M-OH]+ [18-19] 6 6.793 ZP-amide C C16H27NO4 [M+Na]+ 320.183 8 320.182 5 −4.06 321.186 4[M+H+Na]+, 320.182 5[M+Na]+ [18, 20] 7 7.222 ZP-amide L C16H27NO4 [M+Na]+ 320.183 8 320.182 5 −4.06 321.186 4[M+H+Na]+, 320.182 5[M+Na]+ [18] 8 7.902 ZP-amide K C16H27NO4 [M+Na]+ 320.183 8 320.182 5 −4.06 321.186 4[M+H+Na]+, 320.182 5[M+Na]+ [18] 9 12.427 ZP-amide N C18H31NO4 [M+Na]+ 348.215 1 348.213 0 −6.03 349.217 7[M+H+Na]+, 348.213 0[M+Na]+ [18] 10 16.168 茵芋碱 C14H13NO4 [M+H]+ 260.092 3 260.092 3 0.00 229.037 0[M-2CH3]+, 227.056 6[C13H9NO3]+, 202.046 8[C11H8NO3]+, 199.062 5[C12H9NO2], 184.037 9[C11H6NO2]+, 156.043 4[C10H6NO]+, 77.037 7[C6H5]+ [21] 11 22.312 羟基-ε-山椒素 C16H25NO2 [M+Na]+ 286.178 3 286.178 3 0.00 302.171 4[M+K]+, 286.178 3[M+Na]+, 246.184 4[M-OH]+ [22] 12* 22.701 羟基-α−
山椒素C16H25NO2 [M+Na]+ 286.178 3 286.178 3 0.00 287.179 5[M+H+Na]+, 286.178 3[M+Na]+, 246.184 4[M-OH]+ [23] 13* 23.113 羟基-β−
山椒素C16H25NO2 [M+Na]+ 286.178 3 286.178 3 0.00 287.179 5[M+H+Na]+, 286.178 3[M+Na]+, 246.187 5[M-OH]+ [23] 14 23.605 Zanthoamides A C18H27NO4 [M-OH]+ 304.191 3 304.191 3 0.00 345.184 4[M+H+Na]+, 344.181 6[M+Na]+ [24] 15 26.156 羟基-γ−山椒素 C18H27NO2 [M+Na]+ 312.193 9 312.193 5 −1.28 601.398 7[2M+Na]+, 313.164 8[M+H+Na]+, 312.193 5[M+Na]+, 272.200 9[M-OH]+ [22] 16 26.379 羟基-γ−
异山椒素C18H27NO2 [M+Na]+ 312.193 9 312.193 5 −1.28 601.398 7[2M+Na]+, 313.164 8[M+H+Na]+, 312.193 5[M+Na]+, 272.200 9[M-OH]+ [22] 17 26.786 bungeanool C18H29NO2 [M-OH]+ 274.217 1 274.216 5 −2.19 565.363 6[2M-OH]+, 314.210 3[M+Na]+ [15] 18 26.957 isobungeanool C18H29NO2 [M-OH]+ 274.217 1 274.216 5 −2.19 565.363 6[2M-OH]+, 314.210 3[M+Na]+ [15] 19 27.586 α−山椒素 C16H25NO [M+H]+ 248.201 4 248.201 2 −0.81 286.178 3[M+K]+ [23] 20 29.068 四氢花椒素 C18H33NO2 [M+H]+ 296.259 0 296.257 7 −4.39 318.237 8[M+Na]+, 279.137 4[M+H-OH]+ [25] *:为与对照品比对的化合物。 -
[1] 国家药典委员会. 中华人民共和国药典(一部) 2020年版[S]. 北京: 中国医药科技出版社, 2020: 169-171. [2] SHAN C, SHU C, NIE W, et al. RETRACTED ARTICLE: Anti-aging effect of polysaccharides from the peel of Zanthoxylum schinifolium Sieb. et Zucc. on the nematode Caenorhabditis elegans[J]. Acta Agric Scand Sect B, 2022, 72:476-484. [3] 杨成峻, 陈明舜, 刘成梅, 等. 花椒果皮多酚类成分鉴定及降血糖活性[J]. 食品科学, 2023, 44(2):271-278. [4] LIANG W Y, YANG H Y, LEI H X, et al. Phytochemistry and health functions of Zanthoxylum bungeanum Maxim and Zanthoxylum schinifolium Sieb. et Zucc as pharma-foods: a systematic review[J]. Trends Food Sci Technol, 2024, 143:104225. doi: 10.1016/j.jpgs.2023.104225 [5] ZHANG B C, LUO S H, WU S S, et al. Anti-inflammatory and anti-osteoclastogenesis activities of different kinds of Zanthoxylum bungeanum seed oil in vitro[J]. Chem Biodivers, 2023, 20(5):e202201157. doi: 10.1002/cbdv.202201157 [6] 叶倩女, 石晓峰, 杨军丽. 花椒属植物中酰胺类成分的结构与功能研究进展[J]. 中国中药杂志, 2023, 48(9):2406-2418. [7] 吴蓉蓉, 田书璎, 陈勇, 等. 青花椒生物碱类化学成分及生物活性研究[J]. 中草药, 2019, 50(6):1305-1309. [8] 孟亚琴, 王雅, 郭涛. 花椒生物碱活性成分研究现状[J]. 中国食品工业, 2022,(10):110-113. [9] PENG W, HE C X, LI R L, et al. Zanthoxylum bungeanum amides ameliorates nonalcoholic fatty liver via regulating gut microbiota and activating AMPK/Nrf2 signaling[J]. J Ethnopharmacol, 2024, 318(Pt A): 116848. [10] 胡迎丽, 夏璐, 雷福厚. 大孔吸附树脂在天然产物的分离纯化中的应用进展[J]. 化工技术与开发, 2021, 50(11):29-34. [11] 刘岩, 陈伟豪, 亢迪, 等. 大孔树脂分离富集生物碱类成分研究进展[J]. 中草药, 2020, 51(6):1650-1659. [12] 骆党委, 叶静, 黄雅燕, 等. AB-8大孔吸附树脂精制芦柑皮总黄酮及黄酮类化合物的分离[J]. 食品科学, 2014, 35(6):30-35. [13] 蔡淑慧, 丁梦磊, 甘逸夫, 等. 附子总生物碱纯化工艺优化[J]. 中成药, 2023, 45(9):3023-3028. [14] 贾凯, 刘俊, 耿晓桐, 等. 细叶十大功劳叶中总生物碱大孔树脂纯化及抗氧化研究[J]. 广西植物, 2023, 43(1):183-189. [15] ZHANG L L, ZHAO L, WANG H Y, et al. The relationship between alkylamide compound content and pungency intensity of Zanthoxylum bungeanum based on sensory evaluation and ultra-performance liquid chromatography-mass spectrometry/mass spectrometry(UPLC-MS/MS)analysis[J]. J Sci Food Agric, 2019, 99(4):1475-1483. doi: 10.1002/jsfa.9319 [16] LIU Y, MENG X, SUN L, et al. Protective effects of hydroxy-α-sanshool from the pericarp of Zanthoxylum bungeanum Maxim. On D-galactose/AlCl3-induced Alzheimer’s disease-like mice via Nrf2/HO-1 signaling pathways[J]. Eur J Pharmacol, 2022, 914:174691. doi: 10.1016/j.ejphar.2021.174691 [17] HUANG A H, CHI Y G, LIU J W, et al. Profiling and pharmacokinetic studies of alkaloids in rats after oral administration of Zanthoxylum nitidum decoction by UPLC-Q-TOF-MS/MS and HPLC-MS/MS[J]. Molecules, 2019, 24(3):585. doi: 10.3390/molecules24030585 [18] CHEN J H, ZHANG T, ZHANG Q B, et al. Isobutylhydroxyamides from Sichuan pepper and their protective activity on PC12 cells damaged by corticosterone[J]. J Agric Food Chem, 2018, 66(13):3408-3416. doi: 10.1021/acs.jafc.7b06057 [19] HATANO T, INADA K, OGAWA T O, et al. Aliphatic acid amides of the fruits of Zanthoxylum piperitum[J]. Phytochemistry, 2004, 65(18):2599-2604. doi: 10.1016/j.phytochem.2004.08.018 [20] WANG Y, LIAO Z B, CAO R, et al. Isolation, structural characterization and neurotrophic activity of alkylamides from Zanthoxylum bungeanum[J]. Nat Prod Commun, 2017, 12(7): 1934578X1701200. [21] HUANG A H, XU H, ZHAN R T, et al. Metabolic profile of skimmianine in rats determined by ultra-performance liquid chromatography coupled with quadrupole time-of-flight tandem mass spectrometry[J]. Molecules, 2017, 22(4):489. doi: 10.3390/molecules22040489 [22] BADER M, STARK T D, DAWID C, et al. All-trans-configuration in Zanthoxylum alkylamides swaps the tingling with a numbing sensation and diminishes salivation[J]. J Agric Food Chem, 2014, 62(12):2479-2488. doi: 10.1021/jf500399w [23] LI W L, WU Y, LIU Y S, et al. Chemical profiles and screening of potential α-glucosidase inhibitors from Sichuan pepper using ultra-filtration combined with UHPLC-Q-TOF[J]. Ind Crops Prod, 2020, 143:111874. doi: 10.1016/j.indcrop.2019.111874 [24] WANG Y, LI C H, LUO B, et al. Isobutylhydroxyamides from Zanthoxylum bungeanum and their suppression of NO production[J]. Molecules, 2016, 21(10):1416. doi: 10.3390/molecules21101416 [25] XIONG Q B, SHI D W, YAMAMOTO H, et al. Alkylamides from pericarps of Zanthoxylum bungeanum[J]. Phytochemistry, 1997, 46(6):1123-1126. doi: 10.1016/S0031-9422(97)84398-1 -




 下载:
下载: