-
皮肤外用制剂应用于皮肤表面,有些药物还可以经毛细血管吸收进入体循环,产生全身治疗作用,包括软膏剂、乳膏剂、凝胶剂、散剂、水剂及洗剂等[1]。皮肤外用制剂处方复杂,质量影响因素较多,但在相当长一段时间内其质量研究未得到足够重视和发展。1997年美国FDA首次提出非无菌半固体制剂扩大规模和上市后变更应开展体外释放和体内生物等效性研究[2]。我国药品审评中心分别于2021年和2022年发布了《化学仿制药透皮贴剂药学研究技术指导原则》[3]和《皮肤外用化学仿制药研究技术指导原则(试行)》[1],对皮肤外用制剂质量研究提出了新的技术要求。拉曼光谱法因样品前处理方法简单、无损、变异性低,结合成像技术及化学计量学方法能够可视化药物结晶及渗透深度,有潜力作为皮肤外用制剂质量研究技术手段,有助于多角度科学认识制剂质量,提高皮肤外用制剂的质量研究水平。本文综述了拉曼光谱在皮肤外用制剂质量及体外透皮研究中的最新进展。
-
1928年印度物理学家Chandrasekhara Venkata Raman首次发现了拉曼散射效应,即当光与物质碰撞时,小部分光子发生能量变化,散射光子与入射光子频率不同,称为非弹性散射(拉曼散射)。在非弹性散射中,散射光子比入射光子能量小,称为斯托克斯散射;相反,称为反斯托克斯散射[4]。拉曼光谱反映了从入射光子到散射光子的波数偏移和散射强度的关系。
-
早期的拉曼光谱由于灵敏度低,其应用发展受到较大限制。20世纪60年代,激光光源问世,提高了拉曼光谱的灵敏度;70年代末,引入了拉曼光谱与光学显微镜相结合的方法,并将其应用于多个领域的微量分析[5];80年代,Fleischmann等将光滑银电极表面进行粗糙化处理,得到高质量拉曼光谱,开启了对表面增强拉曼光谱研究;90年代,Hirschfeld发明了近红外傅里叶变换拉曼光谱技术[6]。傅里叶变换型拉曼光谱仪采用干涉仪代替分光仪,减少了由样品或杂质吸收激光后发射荧光造成的干扰。
为了进一步提高分辨率,出现了更先进的技术。相干拉曼散射显微镜包括受激拉曼散射显微镜(SRS)和相干反斯托克斯拉曼散射显微镜(CARS)两种,这两种技术都需要两个激光光场,通过调谐激光之间的差频以匹配目标物的分子振动,可以产生比传统拉曼光谱高出几个数量级的信号[7]。表面增强拉曼光谱(SERS)就是将非常薄的样品吸附在纳米结构的金属(金或银)上,当用与样品表面等离子体共振的激发波长照射样品时,就会产生强电磁场,尤其是靠近金属表面的分子[8]。由于该技术需要制备大量非常薄的样品,很少用于皮肤渗透分析[9]。共聚焦拉曼光谱技术(CRS)是最常用的拉曼技术,使光源、样品和检测器三点共轭聚焦,消除杂散光的干扰,进而达到增强信号的目的,可以用于研究外源物质对皮肤的渗透或分析健康和患病状态下的皮肤。结合可移动的扫描平台,可以在三维空间中精确定位样品,进行二维或三维成像,也称为共聚焦拉曼显微镜(CRM)。共聚焦拉曼显微镜由激光光源、物镜、分束器、针孔、电动扫描台、探测器和光纤组成,用于引导激光光源到物镜和物镜到探测器的光。此外,光纤还可以用作针孔,以实现共聚光[10]。
-
拉曼光谱是一种振动光谱技术,具有高空间分辨率和良好的穿透能力,其不需要特殊的制样方法,具有无损、原位分析的特点。图谱中携带丰富的指纹信息,可以识别不同样品(如不同皮肤)之间的微小差别。与红外光谱相比,共价键的伸缩振动在拉曼光谱中信号更强,因此,拉曼光谱在生物样本的检测中更具优势。此外,水的拉曼信号非常弱,样品测定可以不受水分干扰[11]。
-
多数皮肤外用制剂处方组成复杂,工艺参数控制难度大,微小的处方工艺变化都有可能导致产品质量的显著差异。因此,需要基于产品特征,多个角度开展皮肤外用制剂的质量研究,加强制剂产品的质量控制,保证皮肤外用制剂的安全、有效、质量可控。皮肤外用制剂的关键质量属性包括但不限于:晶型、粒度分布、体外释放实验(in vitro release testing, IVRT)和体外透皮实验(in vitro permeation testing, IVPT)等[1]。拉曼光谱在这些关键质量属性的研究中得到越来越多的应用。
-
皮肤外用制剂的疗效与药物在制剂中的存在状态密切相关。混悬型外用制剂中活性药物成分以固体形式分散于基质中,其晶型直接影响药物的稳定性、溶解度、生物利用度等性质。一般而言,晶型的质量控制方法首选粉末X射线衍射法(powder X-ray diffraction, PXRD) [12],其次是红外光谱法、拉曼光谱法、差示扫描量热法等。但是半固体制剂中活性药物成分(active pharmaceutical ingredient, API)含量低,可能无法测出PXRD响应[12],且PXRD制样研磨过程可能引起转晶,而拉曼光谱在药物晶型的研究方面有独特的优势,其无需样品制备,可减少研磨制样造成的转晶现象[13]。拉曼光谱对同一药物不同晶型的定性研究主要通过峰形和峰位的解析进行;定量研究则主要通过结合化学计量学的方法开展,常用的方法有主成分分析、聚类分析和多元曲线分辨率交替最小二乘法等[14]。
为提高生物利用度,增加和维持给药时间,皮肤外用制剂中API的浓度通常尽可能接近或高于最大药物浓度(即饱和或过饱和状态),所以易受环境因素影响而结晶。Belsey等[15]将接近饱和的布洛芬丙二醇溶液使用30 min后,用SRS捕捉到了布洛芬-d3晶体在皮肤上的图像。2008年罗替高汀透皮贴剂因析晶被美国FDA要求召回[16],原因是药物形成了一种新的晶型,这种晶型在贴剂的硅酮基质中更稳定,但溶解度低[17]。由此可见检查皮肤外用制剂结晶的必要性。
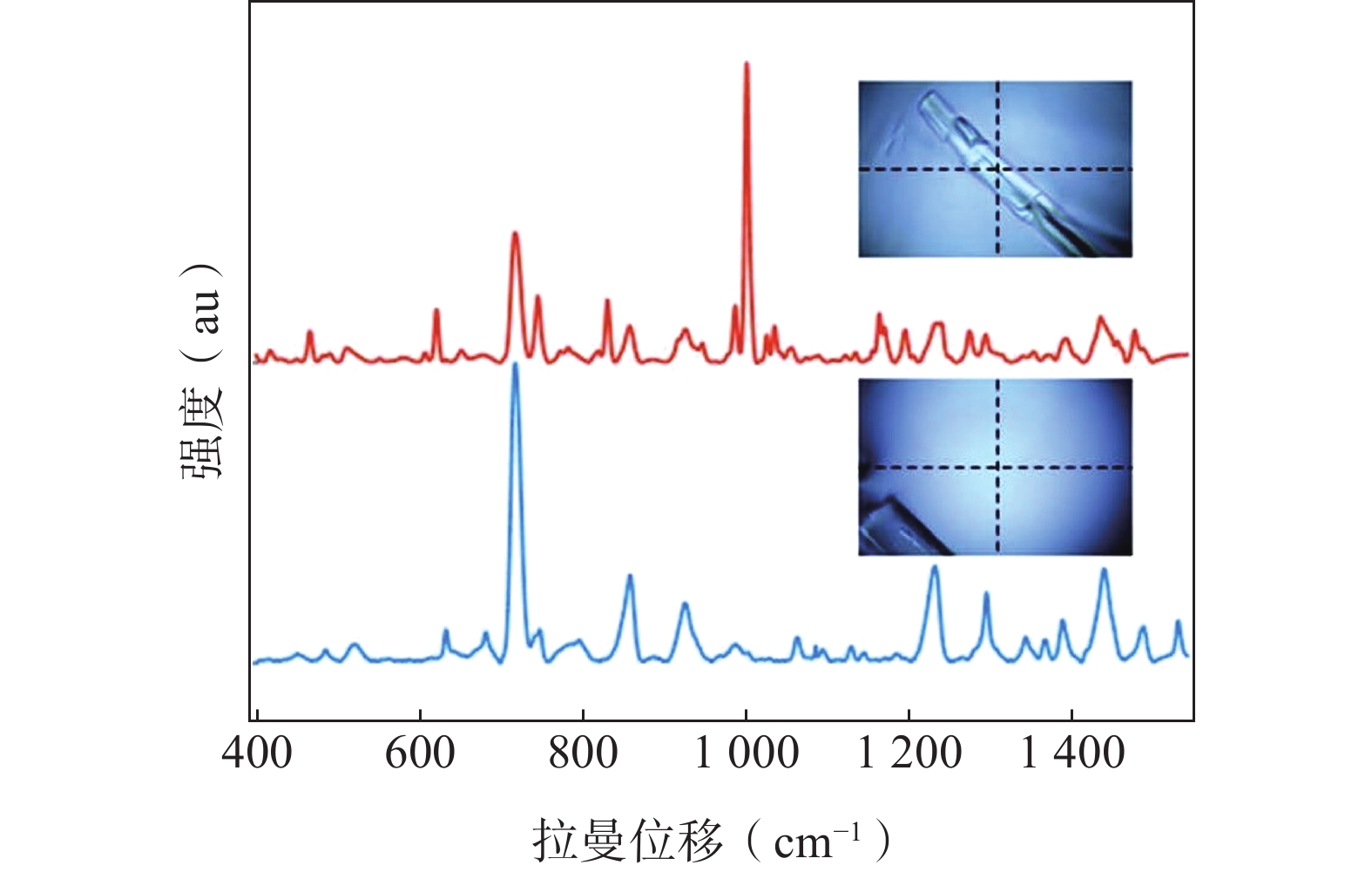
Yilmaz等[18]使用光学显微镜和CRM观察芬太尼贴剂有晶体和无晶体区域,发现有晶体析出区域在1 001 cm−1附近有一个强峰(图1),而无晶体区域无该峰,该差异可以用于生产质量监控。Norio等[19]使用拉曼光谱确定了两种尿素乳膏中尿素及辅料的特征光谱峰,并对乳膏中晶体形成的过程进行了光谱分析,随着时间变化观察到尿素的特征峰发生位移,结合显微镜图像进一步观察到晶体的沉积状态。综合来看,两种尿素乳膏晶体结构不同,晶体形成的速率也不相同。Yannick等[20]通过观察布洛芬和萜烯类形成的二元混合体系的C=H和C=O拉曼带的位移,说明将布洛芬溶解在萜烯类天然深共晶溶剂中,再通过熔融法制备共无定形布洛芬−精氨酸共混物是避免布洛芬结晶的最佳途径,该发现可以降低药物结晶对皮肤渗透的负面影响,同时也为制剂处方优化提供新的方法。
图 1 来自晶体和非晶体区域的拉曼光谱图和光学显微镜图像[18]
-
API在基质中以混悬状态存在时,其颗粒的粒径分布影响药物的溶解度、释放速率,粒径过大还会影响肤感。《中国药典》2020年版四部0109软膏剂通则要求混悬型软膏中不得检出大于180 μm的粒子。乳膏剂、乳剂产品为包含油/水两相的热力学不稳定体系,制剂的液滴粒径等指标反映了处方工艺的合理性,并可能会影响到药物的释放性能和透皮性能。《中国药典》2020年版四部0982粒度和粒度分布测定法规定第一法(显微镜法)和第二法(筛分法)用于测定药物制剂的粒子大小,第三法(光散射法)用于测定原料药或药物制剂的粒度分布。显然,筛分法和光散射法不适用于半固体的粒度检测,显微镜法是半固体制剂粒度检测的主要手段。
制剂产品中的粒度分析难点在于如何有效区分API和辅料中的粒子,显微镜与拉曼光谱技术的联用则能有效地解决该问题,在获得图像的同时可以开展定性分析,甚至进行粒度统计。刘绪平等[21]照第一法检查盐酸金霉素眼膏的粒度,并利用显微拉曼光谱完成粒度检测的基础上进一步开展粒子归属探索性研究。测定盐酸金霉素对照品、原料药及各种辅料的拉曼光谱,将粒径大于50 μm的微粒作为研究对象,经过图谱对比,发现粒径大于50 μm的微粒均来自盐酸金霉素的原料。
皮肤的渗透效果受粒径大小的影响,小颗粒药物通过毛囊进入角质层,溶解的药物通过跨细胞途径,另外还有细胞间途径[22]。 Patel等[23]发现微乳的粒径越小,药物渗透率越高,药物在皮下组织中的浓度越高,给药效率越高。另一项研究表明[24],通过在聚合物粘合剂基质中使用API的悬浮液,然后依靠颗粒的溶解作为速率控制步骤,可以控制药物的递送速度。对于治疗窗口窄的药物,能够达到更好的效果。可见颗粒粒径并不是越小越好,显微拉曼光谱有潜力在控制粒度大小方面发挥作用。
-
皮肤外用制剂成分复杂,为了增加药物稳定性及生物利用度,需要多种添加剂,如透皮促进剂、增溶剂、增黏剂、抗氧剂、防腐剂、矫味剂和结晶抑制剂等。拉曼光谱在多元复杂体系中的解析功能具有独特的优势。
拉曼光谱可用于药用辅料的掺假或污染研究。Jason等[25]利用拉曼光谱及拉曼光谱图库,构建了1种数学模型,研究了3种辅料/污染物系统,甘油/二甘醇、丙二醇/二甘醇和乳糖/三聚氰胺,发现每种系统对污染物的检测灵敏度分别为18%、32%和4%。拉曼光谱对辅料的鉴别也可以用于药品溯源。罗思恒等[26]通过观察9种联苯苄唑乳膏的拉曼光谱,发现由于辅料的差别,导致拉曼图谱在1 600 cm−1和1 650 cm−1处存在微小差异,结合主成分分析,在无需获得每种辅料图谱的情况下,成功完成药品溯源。
-
IVPT是模拟外用药物在生理条件下的透皮过程,以反映外用制剂的质量[1]。皮肤的选择及处理是影响IVPT实验结果的重要因素。拉曼光谱不仅可以帮助合理地选择皮肤样本,还可以表征药物在皮肤中空间分布及药物与皮肤的相互作用等。
-
皮肤作为人体最大的器官,由表皮、真皮、皮下组织组成,具有一定的复杂性和个体间的差异性。因为拉曼散射光谱对特定的官能团具有唯一性,所以可以清楚观察到不同物种皮肤的差别。Tfail等[27]利用CRS在660 nm(15 151 cm−1)波段对人腹部皮肤和猪耳皮肤进行了光谱比较,结果表明深层皮肤光谱中的脂质含量和角质层光谱中的透明质酸和类胡萝卜素含量存在显著差异。一项研究表明,猪皮肤的渗透性与人最为相似,1 047 cm−1和1 526 cm−1处的拉曼振动是猪皮和离体人皮之间唯一存在显著差异的振动(图2) [28]。IVPT试验中,猪皮是除离体人皮以外的次要选择[29]。
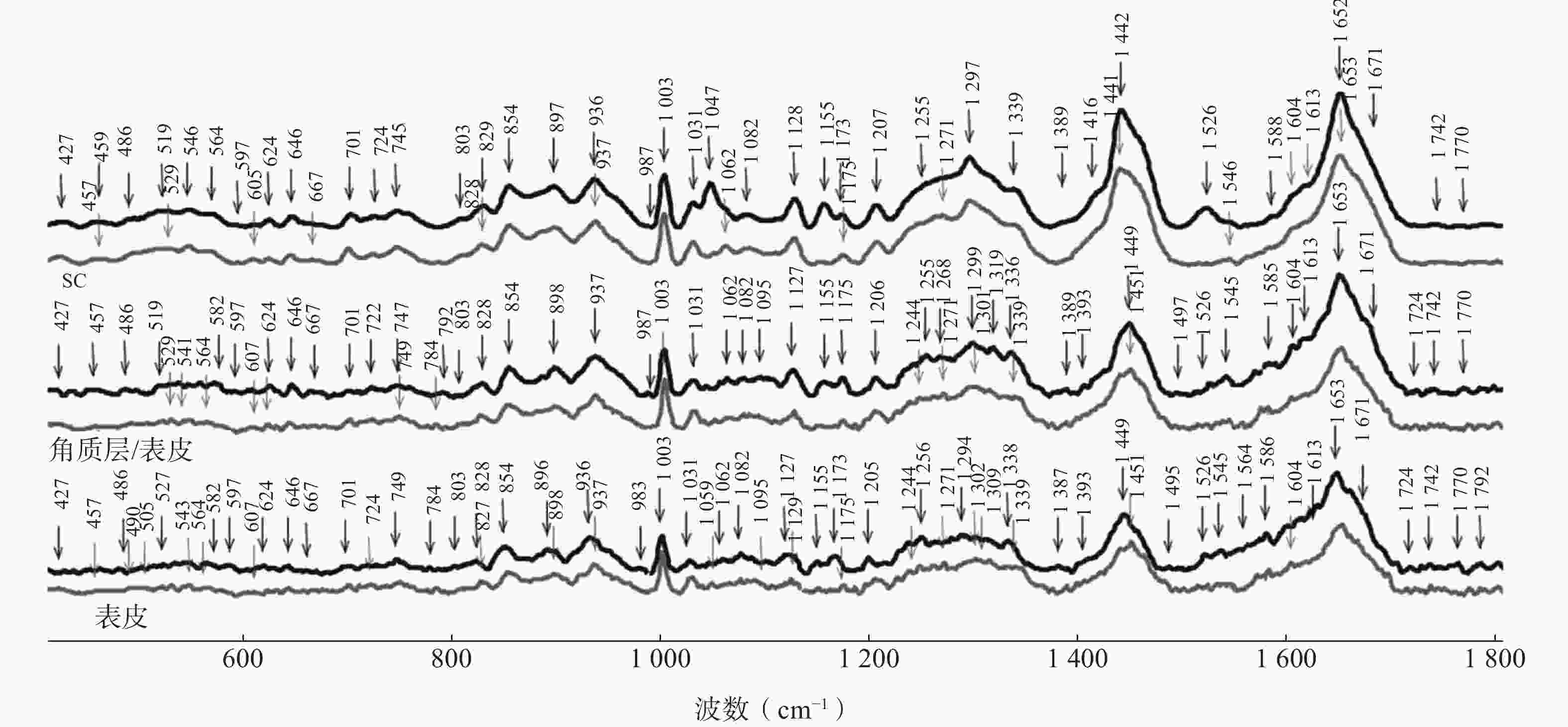
图 2 离体人皮(黑色)和猪皮(灰色)在400~1 800 cm−1光谱范围内的拉曼图谱[28]
IVPT实验前需要对皮肤样本进行筛选。FDA与EMA 均要求在试验前进行皮肤屏障完整性测试,包括经皮水分散失法、氚化水渗透法和经皮电阻法等。此外,FDA要求每组供体皮肤需要相同的解剖区域、冻融循环次数及厚度等[30-31]。
孟茹[32]用CRS观察到脂质(2 881 cm−1)、角蛋白(2 933 cm−1)和酰胺Ⅰ带蛋白(1 653 cm−1)的拉曼峰随皮肤深度增加而降低,酰胺Ⅰ带蛋白(1 653 cm−1)在28 μm后保持稳定(图3),确定其为角质层的边界,并利用主成分分析、聚类分析和HE切片染色对结论进行验证,角质层厚度的确定为紫外吸收剂安全性的评价标准的建立及紫外吸收剂的阻渗实验提供了理论支持。刘娟等[33]为研究面霜中的β-熊果苷在角质层中的渗透情况,利用拉曼光谱测量皮肤含水量在角质层和表皮层随深度的变化曲线,并对两段曲线进行拟合,确定交点对应的深度为角质层的厚度,保证了所有皮肤样本角质层厚度的一致性。
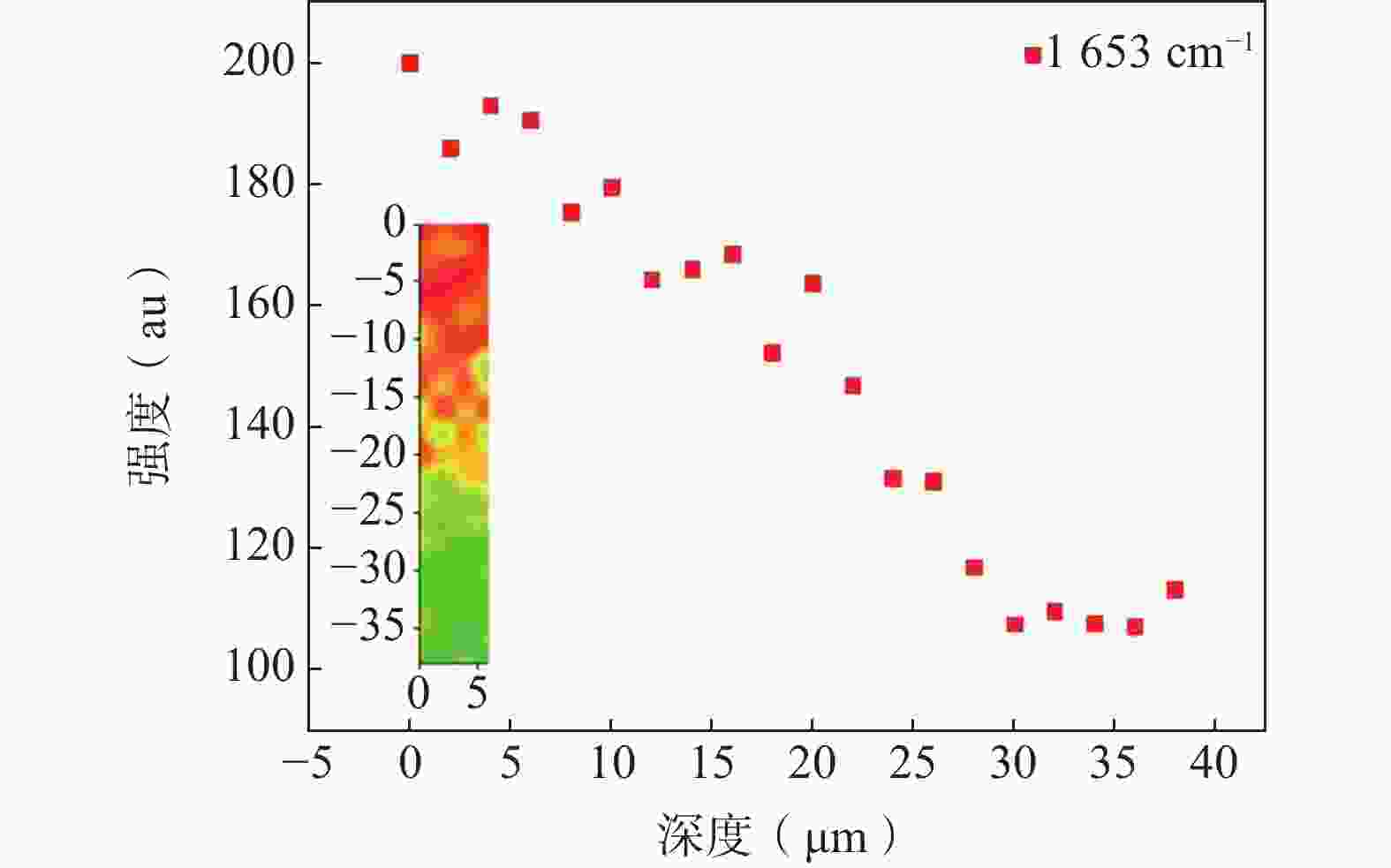
图 3 酰胺Ⅰ带蛋白峰强沿深度变化的散点图及拉曼成像对比图[32]
-
研究皮肤外用制剂的空间分布,可以为处方优化和质量评价提供数据支撑。一般采用黏性胶带剥离角质层,再对胶带及皮肤残留物超声提取药物[34]。尽管EMA对胶带剥离法做出比较详细的规定,如要求胶带黏合剂不干扰药物定量测定、胶带黏合力应满足少量高效、剥离角质层的量应大于75%[31],但如何确保黏合剂不干扰测定以及如何评价胶带的黏附性给实验带来困扰,且胶带剥离法受采样者施加压力、采样次数影响。拉曼光谱无需胶带剥离,且可以表征皮肤结构,结合Matlab及R 语言等可以确定角质层厚度,提高实验准确性[32]。
沈心怡等[34] 用CRS采集了皮肤的拉曼光谱,结合数学模型,建立了光谱信号与目标物浓度的线性回归方程,通过Matlab程序算出皮肤中目标物浓度的贡献系数,并以热图的形式表现出来,实现了皮肤中大分子分布的可视化,也为不适用于传统胶带剥离法研究的药物提供了参考。Kang等[35]也采取了类似的方法,将拉曼映射技术与多元线性回归结合,计算出离体人体皮肤组织中利多卡因的浓度贡献因子,并以热图的形式展示渗透深度。Zhang等[36]为探究双氯芬酸是否在表皮或真皮中形成药物储库,分别测出用药和未用药的皮肤拉曼光谱,建立了双氯芬酸相对浓度[双氯芬酸(445 cm−1)与皮肤特征带的积分面积之比]的检测限,结合聚类分析确定真皮和表皮的连接处。处理后的图像表明,双氯芬酸会在表皮形成药物储库,而真皮中的浓度非常低,接近于检测限。拉曼光谱不仅适用于离体皮肤,也适用于临床的皮肤活检,有潜力作为评估局部镇痛药的生物等效性研究的辅助工具。
由于皮肤的本底信号高,因此研究药物空间分布首先需要准确寻找药物的特征峰位,确保皮肤本底信号的峰不干扰药物测定,同时注意识别并去除宇宙射线[34]。Krombholz和Lunter确定咖啡因在556 cm−1处拉曼峰不受皮肤信号干扰,利用CRS绘制出咖啡因渗透深度随时间的变化曲线[37]。拉曼光谱的信号会随着皮肤深度的增加而逐渐衰减,Zarmpi等[38]发现来自角蛋白酰胺Ⅰ带蛋白信号较为恒定,可以用来校正信号衰减,利用4-氰酚作为强拉曼活性的渗透增强剂,建立了一个校正函数,并成功用于皮肤药物的拉曼测定。
-
郭世奇等[39]为研究盐酸特比萘芬高角质层滞留的原因,利用衰减全反射傅里叶变换红外光谱、差示扫描量热法、拉曼光谱等技术研究药物与皮肤的相互作用,通过观察脂质和角蛋白特征峰强度的变化,说明盐酸特比萘芬改变脂质和角蛋白的结构,使角质层的脂质堆叠更加致密,流动性降低,皮肤透过性降低。Wanjiku等[40]为全面了解乙醇增强皮肤透过性的机制,利用扫描透射X射线显微镜和SRS,以蛋白质和脂质之间的比值为观察指标,得到了不同乙醇浓度和暴露时间条件下,人类角质层、小鼠皮肤和蛋白/脂质比率变化规律。当乙醇浓度是12%时,小鼠皮肤的蛋白脂比与人类皮肤相似,随着乙醇浓度和暴露时间的增加,脂质在小鼠皮肤中以更高的速率溶解(图5)。Wanjiku等创建的方法可以用于指导处方优化,利用动物皮肤模型选择合适的渗透促进剂等。
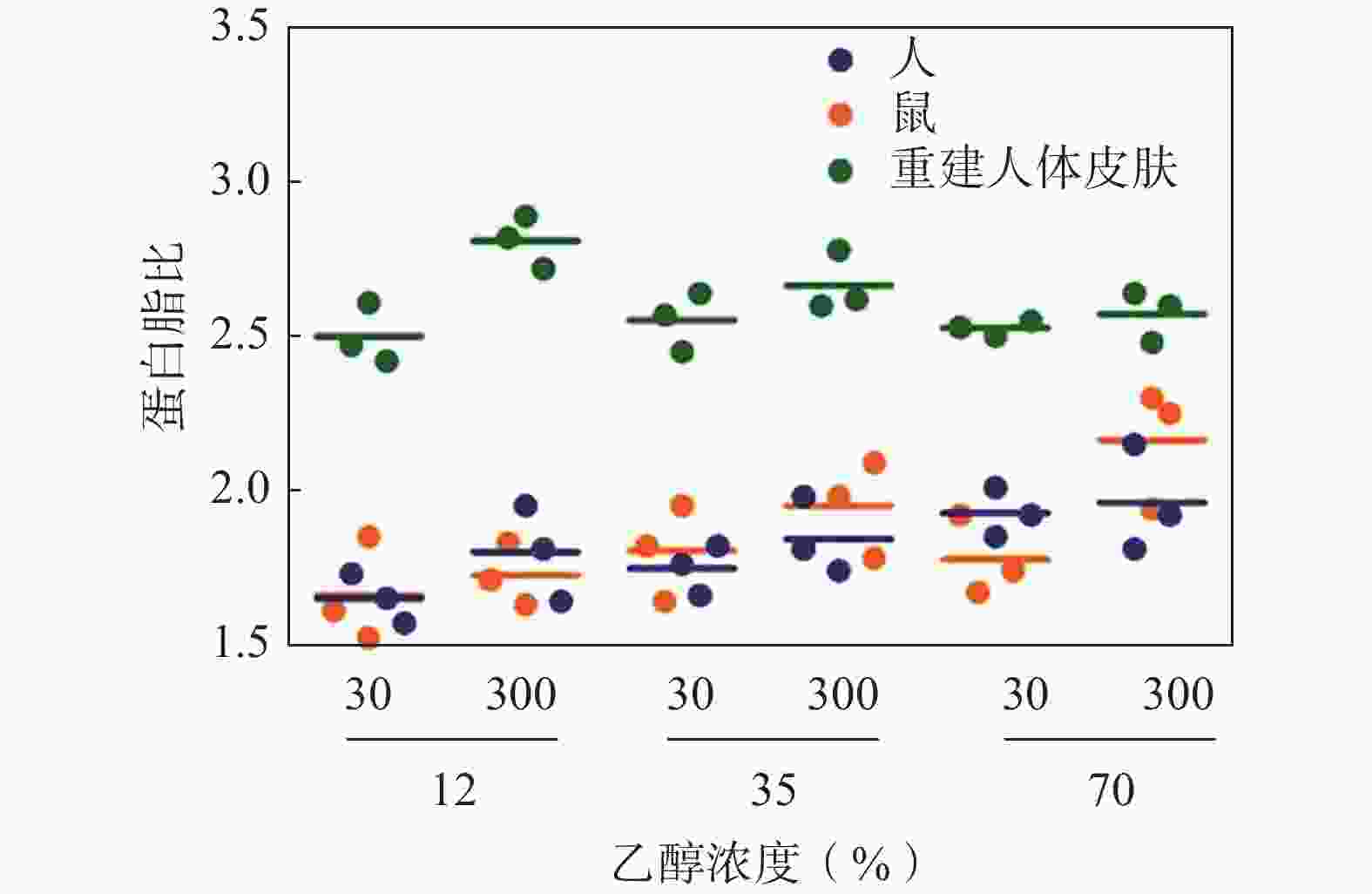
图 5 蛋白脂比30 min和300 min的组织暴露比较[40]
-
拉曼光谱具有高空间分辨率、良好的穿透能力、无损、原位分析等特点,与化学计量学的结合,与成像技术的联用使拉曼光谱在皮肤外用制剂质量研究中获得了更多的应用,不仅可用于鉴别、晶型研究,还可用于粒度、辅料研究和体外透皮研究等。拉曼光谱技术在皮肤个性化给药制剂研发、局部镇痛药生物等效性研究、现场便携化检测设备开发以及借助数学模型高效处理数据等方面表现出的应用潜力,值得科研人员进一步研究和转化应用。
Application of Raman spectroscopy to study the quality of dermal drug administration and transdermal in vitro
-
摘要: 经皮给药具有安全、便利和依从性高等特点。然而皮肤结构复杂且个体差异大,特别是角质层的阻隔导致皮肤外用制剂的生物利用度普遍不高。皮肤外用制剂处方组成复杂,质量影响因素较多,需严格控制产品质量。拉曼光谱作为一种非破坏性的振动光谱,结合化学计量学方法、成像技术和其他光谱技术,可以用于表征皮肤外用制剂的关键质量属性。本文综述拉曼光谱在皮肤外用制剂的晶型、粒度分布、辅料研究以及体外透皮实验等研究中的应用。在体外透皮试验中,着重探讨了拉曼光谱用于选择实验用皮肤样本、研究药物在皮肤中的空间分布及药物与皮肤相互作用等。Abstract: Percutaneous administration is safety, convenience and high compliance. However, the skin structure is complex and individual differences are large, especially the barrier of the stratum corneum leads to the poor bioavailability of topical preparations for the skin. The composition of the prescription for dermal drug administration is complicated, and the quality of the product should be strictly controlled. Raman spectroscopy, as a non-destructive vibrational spectrum can be used to characterize key quality properties of dermal drug administration combined with stoichiometric methods, imaging techniques and other spectral techniques. The purpose of this paper is to review the application of Raman spectroscopy in the study of crystal form, particle size distribution, excipients and in vitro transdermal experiments of dermal drug administration. In vitro transdermal tests, Raman spectroscopy was used to distinguish skin of different species, study the spatial distribution of drugs in skin and the interaction between drugs and skin
-
Key words:
- dermal drug administration /
- Raman spectroscopy /
- quality study /
- skin
-
图 1 来自晶体和非晶体区域的拉曼光谱图和光学显微镜图像[18]
图 2 离体人皮(黑色)和猪皮(灰色)在400~1 800 cm−1光谱范围内的拉曼图谱[28]
图 3 酰胺Ⅰ带蛋白峰强沿深度变化的散点图及拉曼成像对比图[32]
图 5 蛋白脂比30 min和300 min的组织暴露比较[40]
注:实心圆代表30 min,空心圆代表300 min
-
[1] 国家药品监督管理局药品审评中心. 皮肤外用制剂仿制药研究技术指导原则(试行)[S]. 2022: 6. [2] FDA. Nonsterile semisolid dosage forms; scaleup and post-approval changes: chemistry, manufacturing and controls; in vitro release testing and in vivo bioequivalence documentation [EB/OL].(1997-05)[2024-8-16]. https://www.fda.gov/regulatory-information/searchfda-guidance-documents/supac-ss-nonsterile-semisoliddosage-forms-scale-and-post-approval-changes-chemistrymanufacturing. [3] 国家药品监督管理局药品审评中心. 化学仿制药透皮贴剂药学研究技术指导原则[S]. 2021. [4] TANG Y C, WANG X, ZHOU G M, et al. Research progress of Raman spectroscopy and imaging techniques for the pharmaceutical analysis[J]. J Anal Test, 2025, 9(1): 136-152. doi: 10.1007/s41664-024-00327-w [5] EDITORIAL, B. R. A history of raman spectroscopy. https://blog.bccresearch.com/a-history-of-raman-spectroscopy. [6] 何蔚, 孙贤君. 拉曼光谱应用技术研究[J]. 标准科学, 2018(3): 70-75. [7] PENA A M, CHEN X Q, PENCE I J, et al. Imaging and quantifying drug delivery in skin–Part 2: Fluorescence andvibrational spectroscopic imaging methods[J]. Adv Drug Deliv Rev, 2020, 153: 147-168. doi: 10.1016/j.addr.2020.03.003 [8] ZHU Y J, CHOE C S, AHLBERG S, et al. Penetration of silver nanoparticles into porcine skin ex vivo using fluorescence lifetime imaging microscopy, Raman microscopy, and surface-enhanced Raman scattering microscopy[J]. J Biomed Opt, 2015, 20(5): 051006. [9] FALAMAS A, DEHELEAN C A, CINTA PINZARU S. Monitoring of betulin nanoemulsion treatment and molecular changes in mouse skin cancer using surface enhanced Raman spectroscopy[J]. Vib Spectrosc, 2018, 95: 44-50. doi: 10.1016/j.vibspec.2018.01.004 [10] LUNTER D, KLANG V, KOCSIS D, et al. Novel aspects of Raman spectroscopy in skin research[J]. Exp Dermatol, 2022, 31(9): 1311-1329. doi: 10.1111/exd.14645 [11] FERRARO J, NAKAMOTO K. Introductory Raman Spectroscopy[M]. 2rd Ed. America: Elsevier Science, 2003: 96. [12] 武余波, 黄乐乐, 卢望丁, 等. 皮肤局部外用制剂Q3等同性研究技术要点解析[J]. 中国医药工业杂志, 2022, 53(5): 601-610. doi: 10.16522/j.cnki.cjph.2022.05.002 [13] 国家药典委员会. 中华人民共和国药典-四部: 2020年版[M]. 北京: 中国医药科技出版社, 2020: 47. [14] 周健, 杨世颖, 靳桂民, 等. 拉曼光谱技术在药物晶型研究中应用进展[J]. 医药导报, 2019, 38(2): 197-202. [15] BELSEY, N. A.; GARRETT, N. L.; CONTRERAS-ROJAS, L. R, et al. Evaluation of Drug Delivery to Intact and Porated Skin by Coherent Raman Scattering and Fluorescence Microscopies. J. Control. Release 2014, 174, 37–42. [16] European Medicines Agency. Scientific conclusions and grounds for the amendment of the marketing authorisation of Neupro presented by the EMEA [J/OL]. Europa. eu(2023-09-21)[2024-08-16]. https://www.ema.europa.eu/en/documents/scientific-conclusion/neupro-h-c-626-ii-24-epar-scientific-conclusion-variation_en.pdf. [17] CHAUDHURI K R. Crystallisation within transdermal rotigotine patch: is there cause for concern?[J]. Expert Opin Drug Deliv, 2008, 5(11): 1169-1171. doi: 10.1517/17425240802500870 [18] XU T, YILMAZ H, WILLETT D R, et al. Raman mapping of fentanyl transdermal delivery systems with off-label modifications[J]. Analyst, 2020, 145(3): 953-962. doi: 10.1039/C9AN01289C [19] GOTO N, MORITA Y, TERADA K. Deposits from Creams Containing 20%(w/w)Urea and Suppression of Crystallization(Part 3): Novel Analytical Methods Based on Raman Spectroscopy for the Characterization of Deposits and Deposition Phenomena of Creams Containing 20%(w/w)Urea. Chem Pharm Bull(Tokyo). 2016;64(8): 1099-1107. [20] GUINET Y, PACCOU L, HéDOUX A. Co-Amorphous Versus Deep Eutectic Solvents Formulations for Transdermal Administration. Pharmaceutics. [J/OL]. Europa. eu(2023-09-21)[2024-08-16]. https://www.ema.europa.eu/en/documents/scientific-conclusion/neupro-h-c-626-ii-24-epar-scientific-conclusion-variation_en.pdf. [21] 刘绪平, 张银花, 陈希, 等. 盐酸金霉素眼膏粒度及显微拉曼光谱分析研究[J]. 药物分析杂志, 2020, 40(10): 1897-1904. doi: 10.16155/j.0254-1793.2020.10.20 [22] KAHRAMAN E, GÜNGÖR S, ÖZSOY Y. Potential enhancement and targeting strategies of polymeric and lipid-based nanocarriers in dermal drug delivery[J]. Ther Deliv, 2017, 8(11): 967-985. doi: 10.4155/tde-2017-0075 [23] PATEL H K, BAROT B S, PAREJIYA P B, et al. Topical delivery of clobetasol propionate loaded microemulsion based gel for effective treatment of vitiligo: ex vivo permeation and skin irritation studies[J]. Colloids Surf B Biointerfaces, 2013, 102: 86-94. doi: 10.1016/j.colsurfb.2012.08.011 [24] BENSON H A E, WATKINSON A C. Topical and Transdermal Drug Delivery Principles and Practices[M]. Canada : John Wiley, 2012: 287-308. [25] RODRIGUEZ J D, WESTENBERGER B J, BUHSE L F, et al. Quantitative evaluation of the sensitivity of library-based Raman spectral correlation methods[J]. Anal Chem, 2011, 83(11): 4061-4067. doi: 10.1021/ac200040b [26] 罗思恒, 周志明, 黄剑英, 等. 基于拉曼光谱技术的联苯苄唑药物有效成分的快速鉴定和生产溯源研究[J]. 分析化学, 2020, 48(9): 1210-1220. doi: 10.19756/j.issn.0253-3820.191462 [27] TFAILI S, GOBINET C, JOSSE G, et al. Confocal Raman microspectroscopy for skin characterization: a comparative study between human skin and pig skin[J]. Analyst, 2012, 137(16): 3673-3682. doi: 10.1039/C2AN16292J [28] BARTEK MJ, LABUDDE JA, MAIBACH HI. Skin permeability in vivo: comparison in rat, rabbit, pig and man[J]. J Invest Dermatol, 1972, 58(3): 114-23. doi: 10.1111/1523-1747.ep12538909 [29] USP. General Chapters 1724: Semisolid drug products-performance tests[S]. 2022, PF48(3). [30] EMA. Draft guideline on quality and equivalence of topical products [S]. 2018. [31] FDA. Guidance for industry in vitro permeation test studies for topical drug products submitted in ANDAs [S]. 2022. [32] 孟茹. 基于共聚焦拉曼成像技术研究化学防晒剂的皮肤渗透[D]. 上海: 上海师范大学, 2021. [33] 刘娟, 杨丽, 庞建平, 等. 共聚焦拉曼光谱法在β-熊果苷经皮渗透性研究中的应用[J]. 日用化学工业, 2019, 49(7): 452-455. doi: 10.3969/j.issn.1001-1803.2019.07.006 [34] 沈心怡, 胡韵池, 熊訚然, 等. 拉曼光谱成像技术在药物经皮渗透行为考察中的应用[J]. 中国医药工业杂志, 2023, 54(5): 683-690. doi: 10.16522/j.cnki.cjph.2023.05.006 [35] KANG Y, ZHANG F Y. Image of the distribution profile of targets in skin by Raman spectroscopy-based multivariate analysis[J]. Skin Res Technol, 2022, 28(3): 402-409. doi: 10.1111/srt.13114 [36] ZHANG Q H, FLACH C R, MENDELSOHN R, et al. Visualization of epidermal reservoir formation from topical diclofenac gels by Raman spectroscopy[J]. J Pain Res, 2020, 13: 1621-1627. doi: 10.2147/JPR.S253069 [37] KROMBHOLZ R, LUNTER D. A new method for In-Situ skin penetration analysis by confocal raman microscopy. Molecules. 2020 Sep 15;25(18): 4222. [38] ZARMPI P, TABOSA MAM, VITRY P, et al. Confocal Raman Spectroscopic Characterization of Dermatopharmacokinetics Ex Vivo. Mol Pharm. 2023 Nov 6;20(11): 5910-5920. [39] 郭世奇, 赖蓉蓉, 罗炜璇, 等. 基于药物-皮肤的相互作用探究盐酸特比萘芬体外透皮特性[J]. 中国现代应用药学, 2022, 8(8): 1019-1025. doi: 10.13748/j.cnki.issn1007-7693.2022.08.003 [40] WANJIKU B, YAMAMOTO K, KLOSSEK A, et al. Qualifying X-ray and stimulated Raman spectromicroscopy for mapping cutaneous drug penetration[J]. Anal Chem, 2019, 91(11): 7208-7214. doi: 10.1021/acs.analchem.9b00519 -




 下载:
下载: