-
胶质母细胞瘤(GBM)是中枢神经系统中最具侵袭性和致命性的肿瘤之一,预后极差,5年生存率仅5%[1]。临床常规的治疗手段是最大范围的切除肿瘤组织,术后辅助替莫唑胺化疗以及放疗。这些治疗方式虽在一定程度上控制肿瘤,但面对血脑屏障(BBB)、肿瘤耐药性、免疫微环境抑制等难题,神经外科医生与肿瘤学家仍在探索更有效的解决方案[2-3]。因此,迫切需要研发出能够穿透BBB、有效递送药物的治疗方式。
多柔比星(Dox)是一种效力强大的蒽环类化疗药物,被广泛应用于肿瘤治疗。它主要通过插入DNA双螺旋结构、抑制拓扑异构酶Ⅱ的活性以及产生活性氧,在快速增殖的癌细胞中诱导DNA损伤和细胞凋亡,发挥抗肿瘤作用[4]。虽然Dox对多种恶性肿瘤(如乳腺癌、白血病和淋巴瘤)具有良好疗效,但由于BBB的穿透能力较差,以及剂量依赖性的全身毒性(尤其是心脏毒性和骨髓抑制),其在脑肿瘤中的临床应用受到限制[5]。
细胞外囊泡(EVs)是细胞之间通讯的重要工具,具有天然的纳米级尺寸、良好的生物相容性和低免疫原性等优势,是一种良好的药物递送平台[6]。而细菌外囊泡(BEVs)是细菌分泌的天然囊泡,已经被证明是细菌和宿主之间传递通讯信号的通信介质,具有独特的性质和功能[7]。与哺乳动物来源的EVs相比,BEVs具有来源广泛、易于工程化改造、可以大规模生产等优点,在中枢神经系统疾病以及GBM的治疗应用中具有巨大潜力[8]。此外,BEVs中还具有许多免疫刺激因子,能抑制改变肿瘤的微环境并抑制肿瘤细胞的生长[4]。E. coli Nissle 1917(ECN)是一种肠道益生菌,不携带致病因子,其分泌的BEVs常被应用于药物递送的载体[9-10]。
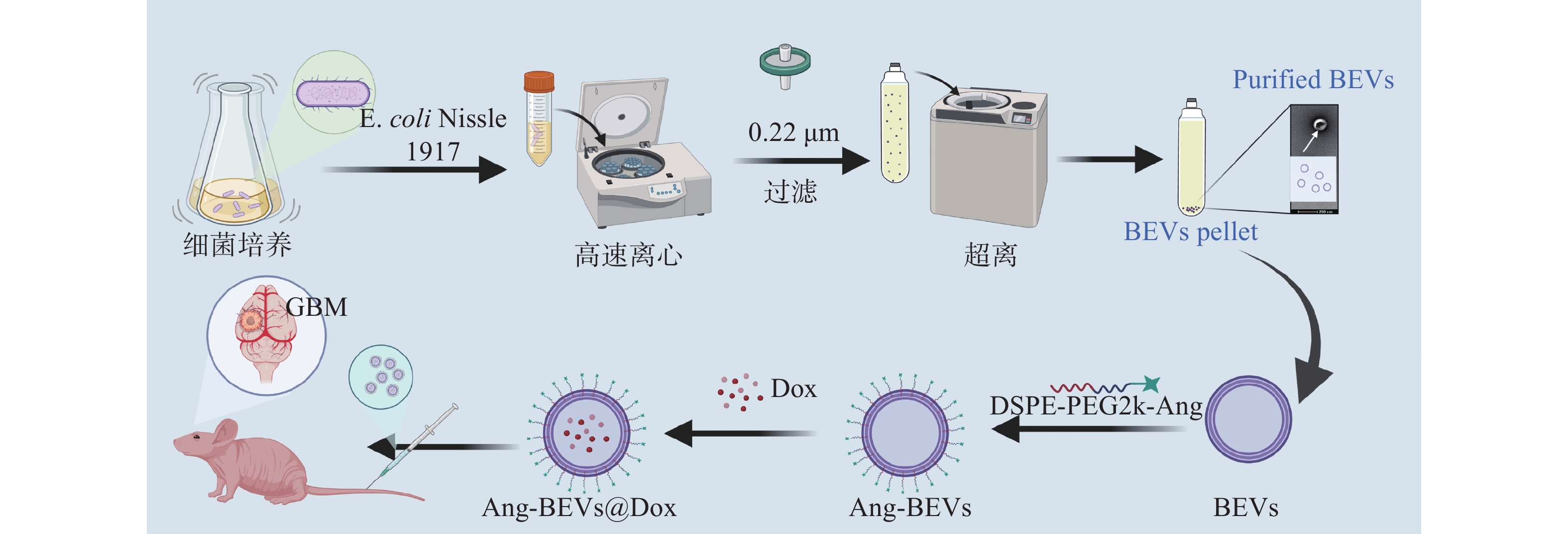
Angiopep-2肽是一种能与BBB和GBM上高表达的低密度脂蛋白受体相关蛋白-1(LRP-1)相结合的多肽,常用于药物递送载体的修饰[11]。本研究基于ECN分泌的BEVs,开发了一种Angiopep-2肽修饰、负载Dox的药物递送平台(图1)。该平台利用BEVs表面的Angiopep-2肽与BBB及GBM细胞膜表面高表达的LRP-1结合,从而介导药物载体穿透BBB并靶向肿瘤,实现对GBM的有效治疗。
-
实验耗材:BCA蛋白浓度测定试剂盒(批号:P0010)、DAPI细胞核染料(批号:G1407)、细胞膜红色荧光探针(DiL)(批号:C1036)、细胞膜远红外探针DiD(批号:C1039)[碧云天生物(上海)];Cy5-NHs(批号:MB12193)、细胞膜荧光探针DiR(批号:MB12482)[美仑生物(大连)];DMEM生长培养基(批号:11995)、胰蛋白酶-EDTA(0.25%)(批号:T1320)和磷酸盐缓冲盐水溶液(PBS,pH 7.2)(批号:1020)[索莱宝生命科学(北京)];胎牛血清(FBS)(批号:A5256701)、1%青霉素-链霉素(批号:15140122)[Gibco公司(美国)];Dox(批号:41701I)、D-荧光素钾盐(批号:15547C)[探索平台(上海)];Annexin V-FITC/7-AAD细胞凋亡检测试剂盒(批号:40311ES20)[翌圣生物(上海)];LB培养基(批号:O.A507002)[生工生物(上海)];DSPE-PEG2k-Angiopep-2(Ang,TFFYGGSRGKRNNFKT EEYC)[强耀生物(上海)];针式过滤器(批号:SLGPR33RS)、超滤管(批号:UFC9100)[Millipore公司(美国)]。
实验仪器:超高速低温离心机(型号:CP80NX,HITACHI公司);透射电镜(TEM)(型号:Tecnai Spirit,FEI公司);动态光散射(DLS)(型号:Nano ZS90Zetasizer,Malvern公司);多功能酶标仪(型号:Cytation5,BioTek公司);激光共聚焦显微镜(型号:FV3000,Olympus公司);流式细胞仪(型号:CytoFLEX,Beckman公司)。
细胞与实验动物:U87MG(批号:CL-0238)、U87MG-Luc(批号:CL-0935)和bEnd.3(批号:CL-0598)细胞购自普诺赛生命科技有限公司(武汉),并在含10%胎牛血清和1%青霉素-链霉素的DMEM培养基中,于37℃、5% CO2条件下培养。4~6周龄雌性BALB/c裸鼠由卡文斯生物(常州)提供。所有涉及动物的实验均按照海军军医大学第一附属医院伦理委员会评估并批准的指南进行。
-
以大肠杆菌E. coli Nissle 1917为母菌株。将活化后的菌株接种于LB液体培养基(10 g/L胰蛋白胨、5 g/L酵母提取物、10 g/L NaCl),在37℃、220 r/min条件下进行两阶段扩增培养(初级培养12 h后以1%接种量转接二级培养12 h)。收集菌液后,首先通过5 000×g离心10 min去除菌体。上清液经0.22 μm针式过滤器预过滤后,使用超滤管浓缩10倍。浓缩的液体通过超速离心(150 000×g,4℃,2 h)富集BEVs沉淀。沉淀用预冷PBS重悬后,再次超离洗涤纯化,采用BCA法测定蛋白浓度,分装后保存于−80℃冰箱备用。
-
提取的BEVs用TEM电镜检测。将BEVs滴加到铜网格上,并用1%醋酸铀染液在4℃下负染。通过DLS测量Zeta电位和平均粒径。按照生产商说明书的要求使用DiL、DiR以及Cy5对BEVs进行标记。纯化的BEVs与荧光染料在37℃、避光条件下孵育30 min,超速离心(150 000×g,4℃,2 h)去除游离的染料,PBS洗1次。
-
将100 μg的DSPE-PEG2k-Angiopep-2混于1 ml BEVs溶液(1 mg/ml),吹打混匀后37℃孵育4 h,通过超滤管离心去除未结合配体,制得Angiopep-2修饰的BEVs(Ang-BEVs)。对照组BEVs采用相同的工艺以避免实验操作造成的影响。
-
基于文献[12]报道的超声载药法,将1 ml的Ang-BEVs(1×1011 /ml)与1 mg Dox混匀,在37℃条件下预孵育30 min,采用脉冲式超声处理(100 W功率,30 s超声/10 s间歇占空比,4℃冰浴控温)进行6次循环加载,每循环间冰浴静置2 min以维持囊泡稳定性。随后经37℃再孵育30 min完成膜结构恢复,通过超高速离心(参数同前)去除未包封Dox,最终获得Ang-BEVs@Dox。未修饰BEVs对照组采用相同流程制备。载药BEVs经纯化后,采用1% Triton X-100/DMSO混合溶液重悬并孵育过夜以裂解囊泡膜释放药物,Dox的载药量通过多功能酶标仪进行定量(Ex/Em=480/590 nm)。
-
首先将灭菌处理的圆形盖玻片预置于12孔板(100 μl PBS预润湿),接种对数生长期U87MG GBM细胞或bEnd.3小鼠脑血脑内皮细胞(5×104/孔)培养过夜贴壁。待细胞融合度达80%时,分别与等剂量(5 μg/ml)的DiL荧光标记BEVs、Ang-BEVs、Ang-BEVs@Dox共孵育4 h。移除培养基后经预冷PBS轻柔洗涤3次,4%多聚甲醛固定20 min(4℃避光)。采用DAPI进行核复染。通过共聚焦激光扫描显微镜(CLSM)同步采集DiL红色荧光(Ex/Em=549/565 nm)与DAPI蓝色荧光信号,对比不同组BEVs在肿瘤细胞内的荧光强度及分布特征,评估其靶向摄取效率。
-
在48孔的超低吸附培养板中,每个孔接种200个U87MG细胞,每3 d换液一次,约3周后肿瘤球直径约为500 μm。更换含有等量Cy5标记的BEVs、Ang-BEVs,Ang-BEVs@Dox共同培养6 h。使用PBS洗涤3次后转移到共聚焦小皿中。使用CLSM从球的底部到中部,间隔40 μm进行z轴层扫描检测Cy5荧光信号的强度。
-
将处于对数生长期的U87MG细胞以2×105/孔的密度接种于12孔板,放置于孵箱中继续培养24 h。对照组为PBS,给药组分别为Free Dox组、BEVs组、BEVs@Dox组、Ang-BEVs@Dox组,临用前用DMEM培养基将Dox的浓度稀释到10 μg/ml,每组3个复孔。24 h后收集细胞培养液,以及胰酶消化后的细胞悬液,离心(500×g,4℃,5 min),再用PBS洗涤2次,收集细胞沉淀。按凋亡试剂盒的方法,先加入100 μl 1×Binding Buffer重悬细胞,然后加入5 μl的Annexin V-FITC和10 μl的7-AAD,轻轻吹打混匀。避光条件下,室温反应15 min,再加入400 μl 1×Binding Buffer,轻轻吹打混匀,置于冰盒中,1 h内完成流式检测。
-
BALB/c裸鼠,雌性,4~6周龄,体质量18~22 g,小鼠在12 h光暗周期、20℃~24℃以及45%~65%相对湿度的条件下饲养。通过立体定向注射方法利用U87-Luc细胞构建GBM原位异种移植模型(PDX模型)(2×105个细胞重悬于8 μl PBS中)。注射细胞的位置为前囟点前方1 mm、从头骨中线向侧面偏移1.5 mm处,注射深度为2.5 mm(先插入3.0 mm,再缓慢退出0.5 mm),注射完成后间歇5 min拔出针头。1周后,腹腔注射D-荧光素钾盐(15 mg/ml,150 mg/kg),异氟烷麻醉后通过生物发光成像系统评估GBM的生长状况。
-
GBM建模10 d后,将构建的模型随机分为3组(n=3),分别为:DiR标记的BEVs组、Ang-BEVs组、Ang-BEVs@Dox组。各组通过尾静脉注射200 μl等量DiR标记BEVs。在注射后在第2、4、6、8、12、24 h,异氟烷麻醉,使用荧光成像系统捕捉DiR荧光图像,评估BEVs在脑部的分布情况。24 h后,收集小鼠的器官(包括脑、心脏、肺、肝脏、脾脏和肾脏),并利用相同的方法对BEVs分布进行体外荧光成像及荧光定量分析。
-
将造模成功的小鼠,随机分为5组(n=9,6只做生存分析和药效学评价,3只做组织切片),分别设置PBS对照组、Free Dox组、BEVs@Dox组以及Ang-BEVs组、Ang-BEVs@Dox组。从第10天开始,按照等效5 mg/kg的Dox剂量,采用尾静脉注射的方式进行给药,每3 d给药一次,共给药4次。在整个治疗过程中,定期使用小动物活体成像仪,检测荧光发光情况,以此反映肿瘤的生长或抑制情况。在第22天,给药终止,每组随机选择3只老鼠取脑和各重要器官进行组织病理学分析。最后记录各组小鼠存活时间,绘制生存分析曲线。
-
收集的脑、心、肺、肝、脾和肾,使用4%的多聚甲醛固定24 h后,石蜡包埋并制成4 μm厚的切片,进行H&E染色后,使用显微镜进行观察。
-
石蜡包埋的脑组织,4 μm厚的脑切片贴附在载玻片上。在脱蜡与水化步骤中,通过梯度酒精和蒸馏水处理来除去石蜡,使样本重新水化。接着,样本在高温缓冲液中进行抗原修复,以揭示抗原位点。为减少非特异性结合,切片用3%BSA封闭液处理30 min。随后样本加入抗体孵育:①LRP-1免疫荧光染色:加入针对LRP-1的特异性一抗(anti-LRP-1,rab,塞维尔);②Ki67免疫荧光染色:加入针对Ki67的特异性一抗(anti-Ki67抗体,rab,塞维尔)。加入抗体后,4℃孵育过夜,并用PBS洗涤3次,每次5 min,以去除未结合的一抗。加入对应的二抗(FITC标记山羊抗兔IgG,塞维尔)。使用DAPI复染细胞核,抗荧光淬灭封片剂封片,然后在荧光显微镜下观察染色结果。
-
石蜡切片按流程脱水后,脑组织区滴加1∶9稀释的蛋白酶K工作液,37℃温育20 min,PBS震荡清洗3次(5 min/次)。使用0.1% Triton X-100覆盖组织,室温处理20 min,同法PBS清洗。甩去残留液滴加平衡缓冲液,室温静置10 min。按1∶5∶50比例现配TDT酶混合液,置于湿盒中在37℃条件下反应1 h(保持湿度)。PBS清洗后DAPI避光复染,同前清洗3次。抗淬灭封片剂封固,在荧光显微镜下观察。
-
对多组数据进行统计分析,采用单因素方差分析(One-Way ANOVA),随后进行corresponding Tukey’s multiple comparisons比较多组数据之间的差异。所有数据均以平均值±标准差(mean ±SD)表示。为评估组间生存差异,采用log-rank检验比较Kaplan-Meier生存曲线。统计学显著性标准设定为:P<0.05,即差异有统计学意义。
-
本研究采用超速离心法提取BEVs:首先以5 000×g离心去除菌液中的细菌及残骸,菌液过滤后在150 000×g下离心收集沉淀的BEVs。
DSPE-PEG2k-Angiopep-2由磷脂DSPE(1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺)、聚乙二醇(PEG2k)和Angiopep-2多肽通过共价连接而成。DSPE作为亲脂性磷脂可嵌入BEVs膜表面;PEG2k常用作生物材料连接臂,在本结构中连接DSPE与Angiopep-2。这种磷脂-聚乙二醇-多肽复合物是修饰EVs或脂质体表面功能多肽的常用策略。本研究通过将DSPE-PEG2k-Angiopep-2与BEVs共孵育,将其修饰至BEVs表面,构建了穿透BBB并靶向GBM的药物载体。最后,采用超声法将Dox装载入BEVs中。
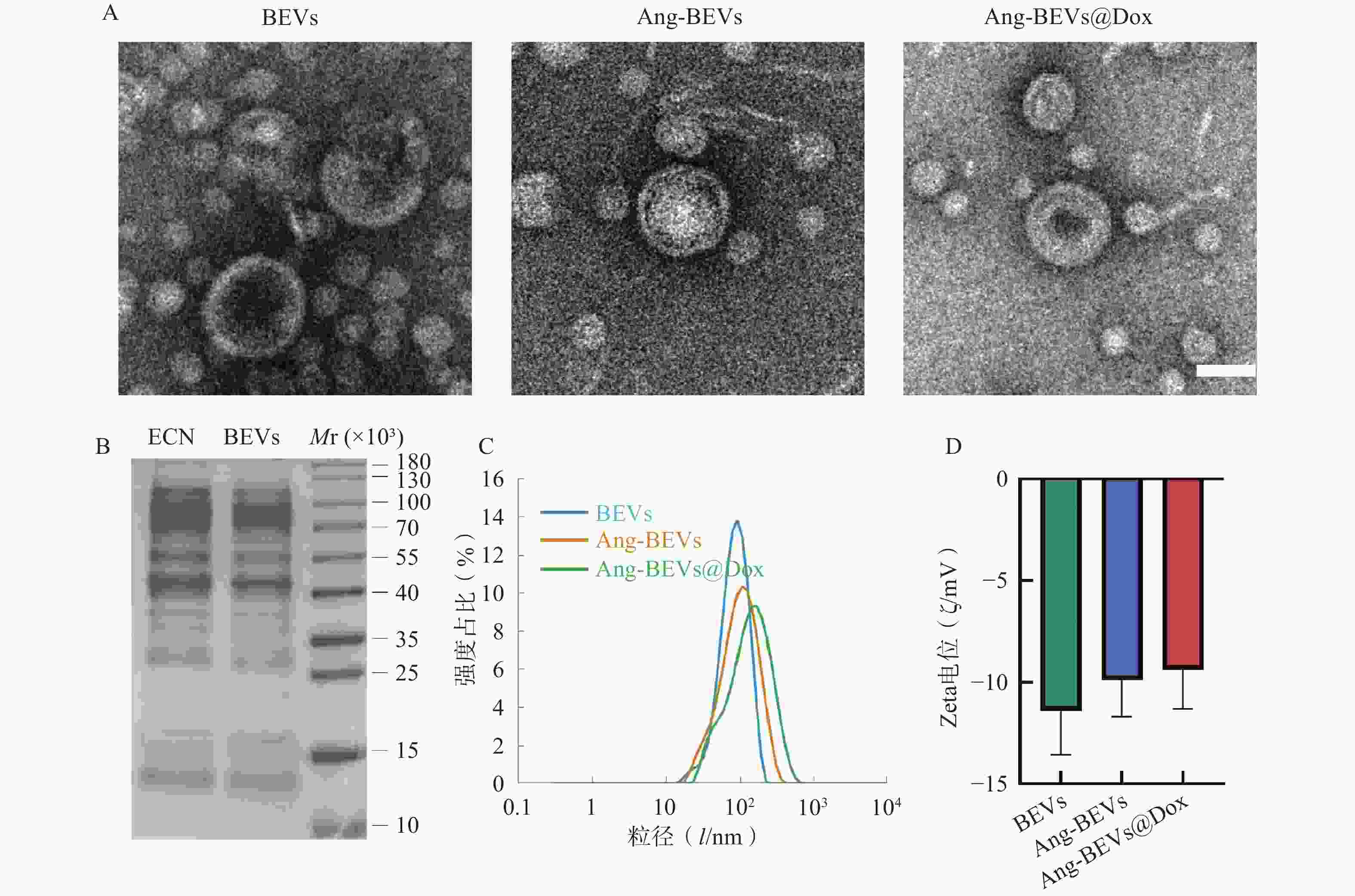
如图2A所示,TEM观察结果显示,提取的BEVs具有典型的囊泡状结构(可见清晰的双层膜)。Angiopep-2修饰及Dox负载后,其形貌结构未发生明显改变。SDS-PAGE分析显示(图2B),提取的BEVs蛋白图谱与ECN菌株基本一致。DLS分析显示BEVs、Ang-BEVs及Ang-BEVs@Dox均呈现良好的单分散性,粒径分布均匀,平均粒径约为100 nm(图2C),与TEM观测结果基本一致,且Zeta电位未发生显著变化(图2D),表明工程化BEVs在Angiopep-2多肽修饰及Dox负载过程中能够保持稳定。
-
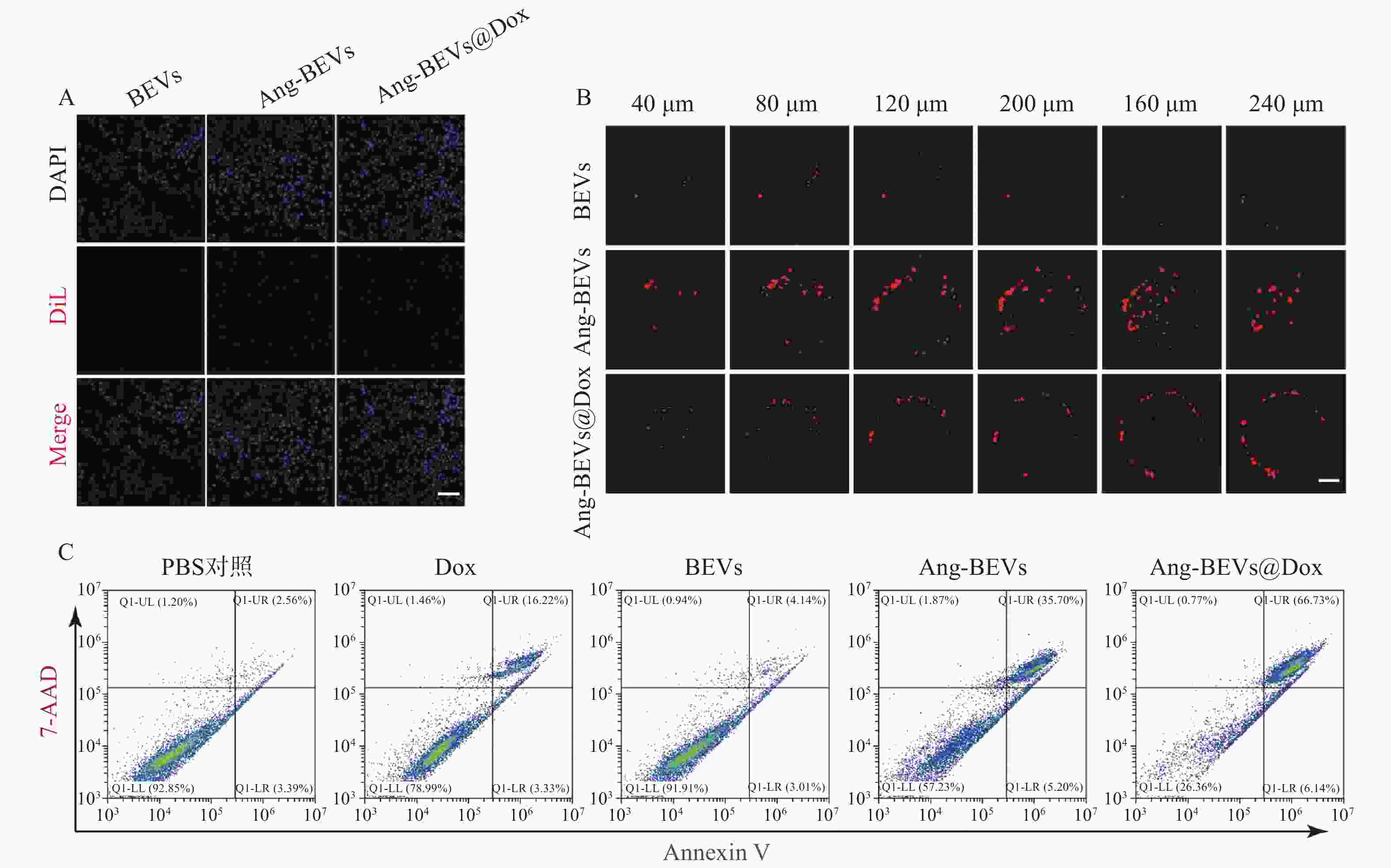
细胞摄取是增强药物生物活性的关键环节。为评估靶向修饰对摄取效率的影响,将DiL标记的BEVs、Ang-BEVs及Ang-BEVs@Dox分别与U87MG细胞共孵育,并通过CLSM观察。如图3A所示,Ang-BEVs和Ang-BEVs@Dox组均展现出比未修饰BEVs组更强的DiL荧光信号,表明Angiopep-2多肽修饰显著提升了BEVs被GBM细胞摄取的效率。该效应主要归因于Angiopep-2肽特异性靶向GBM细胞和BBB内皮细胞表面高表达的LRP-1受体,通过受体介导的内吞作用实现高效靶向递送,为后续的细胞毒性及体内抗肿瘤效应奠定了细胞学基础[11]。
-
采用U87MG细胞构建的GBM三维肿瘤球模型(该模型能有效模拟肿瘤微环境的关键特征[13]),评估Ang-BEVs@Dox的穿透能力。在共聚焦显微镜Z轴扫描至240 µm深度时,未修饰BEVs组荧光信号微弱且主要局限于肿瘤球外周,未能有效渗透(图3B)。相比之下,Ang-BEVs和Ang-BEVs@Dox处理组则显示出显著的荧光信号向肿瘤球内部渗透,进一步证实了Ang-BEVs体系的靶向穿透能力。
-
流式细胞术检测细胞毒性结果显示(图3C),Ang-BEVs@Dox展现出比游离Dox、BEVs及Ang-BEVs更强的抗肿瘤活性。值得注意的是,未修饰的BEVs也表现出一定的细胞毒性,这可能与其携带的细菌源性生物活性成分(如RNA、蛋白质)有关。Ang-BEVs的细胞毒性则显著高于BEVs。该增强的细胞毒性效应主要源于Angiopep-2修饰大幅提升的细胞摄取效率,使得更多BEVs载体及其装载的Dox能够高效递送至肿瘤细胞内,发挥双重抗肿瘤作用。此外,BEVs载体可能通过保护Dox免受降解并改善其胞内释放行为,进一步协同增强抗肿瘤活性[14]。
-
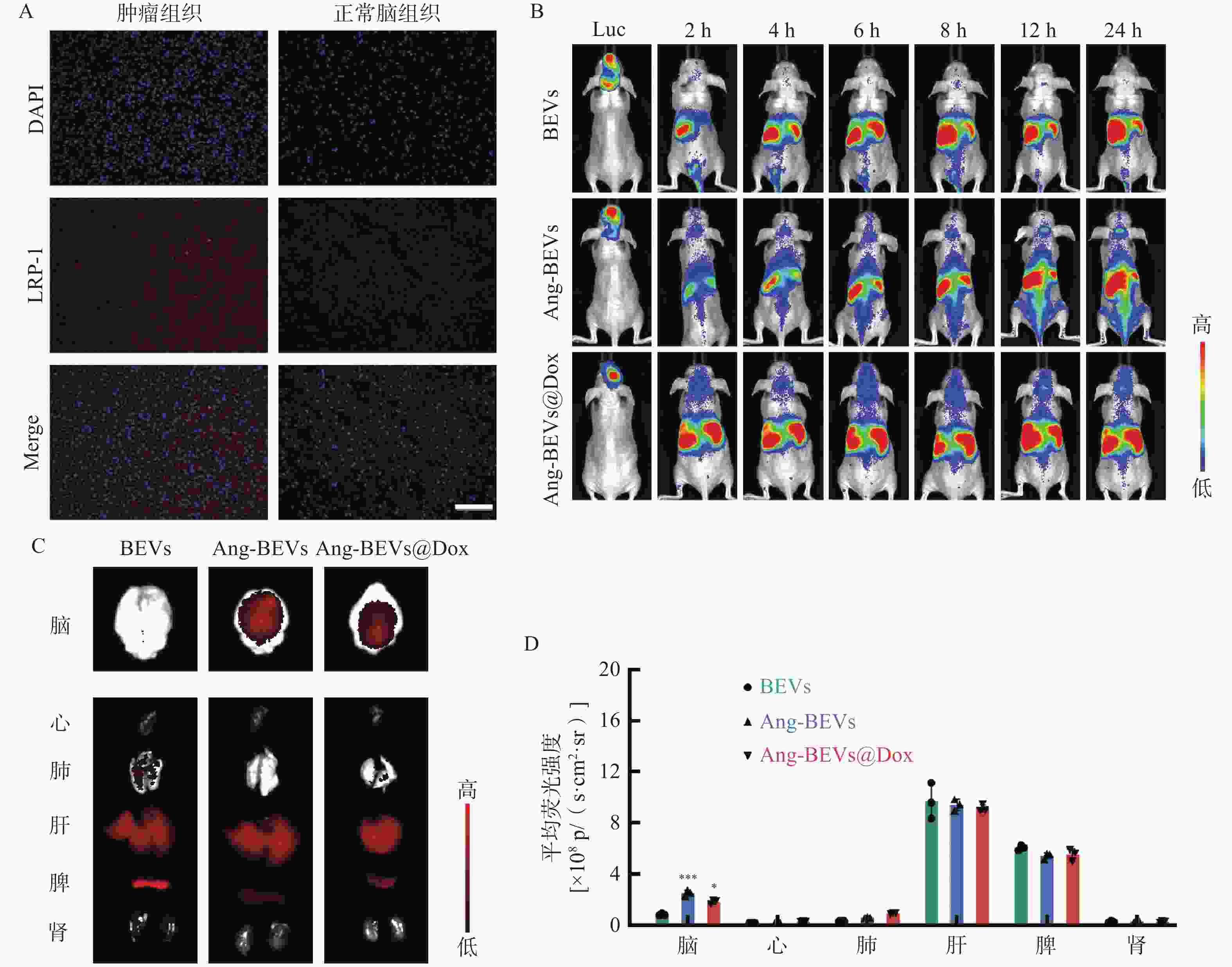
为进一步评估Ang-BEVs穿越BBB并靶向GBM组织的能力,利用U87MG-Luc细胞系构建了GBM原位异种移植模型(PDX模型)。造模1周后,经腹腔注射D-荧光素钾盐溶液,观察到小鼠脑部出现明显的荧光信号(图4B),表明PDX模型构建成功。随后,取一只造模成功小鼠的脑组织切片并进行LRP-1免疫荧光切片染色,结果显示肿瘤组织区域的荧光信号强度高于周围脑组织(图4A),与研究报道的结果一致[15]。
进一步通过尾静脉注射亲脂性膜染料DiR标记的不同BEVs制剂(BEVs、Ang-BEVs、Ang-BEVs@Dox)。DiR是一种近红外染料(Ex/Em=745/780 nm),与其他膜染料(如DiL、DiD、DiO)相比,能够更好地穿透组织,并反映BEVs在体内的分布情况。给药后,使用小动物活体成像系统监测各组小鼠脑部的荧光信号强度随着时间的变化。结果显示(图4B),Ang-BEVs和Ang-BEVs@Dox 组在脑部的荧光信号随着时间的推移明显增加,并在12 h后达到峰值,相较于未修饰的BEVs组有显著富集。
为全面评估BEVs在体内的生物分布,对小鼠的脑组织及主要器官进行了离体成像分析。结果表明,Ang-BEVs组在荷瘤小鼠脑部显示出更强的荧光信号(图4C)。荧光定量结果显示,小鼠脑部Ang-BEVs和Ang-BEVs@Dox组与BEVs组之间存在显著差异(P<0.01),而在各主要器官组织中的荧光信号定量无统计学差异(图4D,P>0.05)。
-
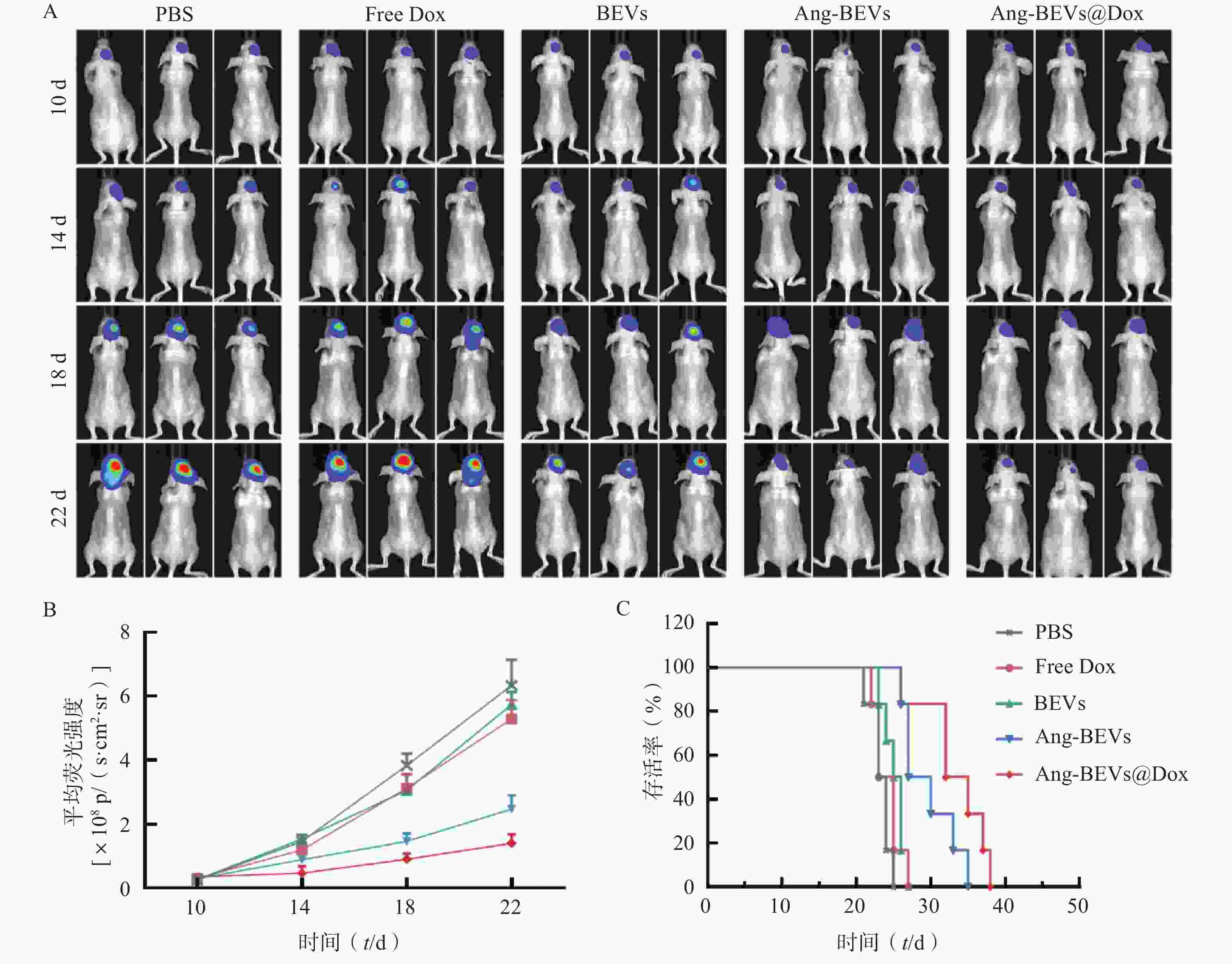
为系统评估Ang-BEVs@Dox对GBM的治疗效果,本研究采用PDX小鼠模型进行系列实验。通过活体成像系统定时监测小鼠脑部荧光变化,动态反应肿瘤生长状况(图5A)。PDX模型构建后第10天,将荷瘤小鼠随机分为5组(n=9):PBS对照组、游离多柔比星(Free Dox)组、BEVs组、Ang-BEVs组以及Ang-BEVs@Dox组(除BEVs组外,均给予等量Dox,5 mg/kg),经尾静脉每3 d给药一次,共给药4次。
活体成像结果显示,Ang-BEVs@Dox组和Ang-BEVs组相较于PBS组、Free Dox组以及BEVs组,显著抑制了肿瘤增殖(图5A、5B)。这一结果表明,单纯的Dox以及未经修饰的BEVs难以有效穿透BBB。生存分析显示(图5C),Ang-BEVs@Dox组和Ang-BEVs组的中位生存期分别达到33.5 d和28.5 d,显著优于PBS组(23.5 d)、Free Dox组(24.0 d)及BEVs组(25.5 d)(图5C,P<0.001)。这突显了经Angiopep-2修饰的BEVs负载Dox后,在靶向抑制肿瘤生长方面具有协同增强优势。
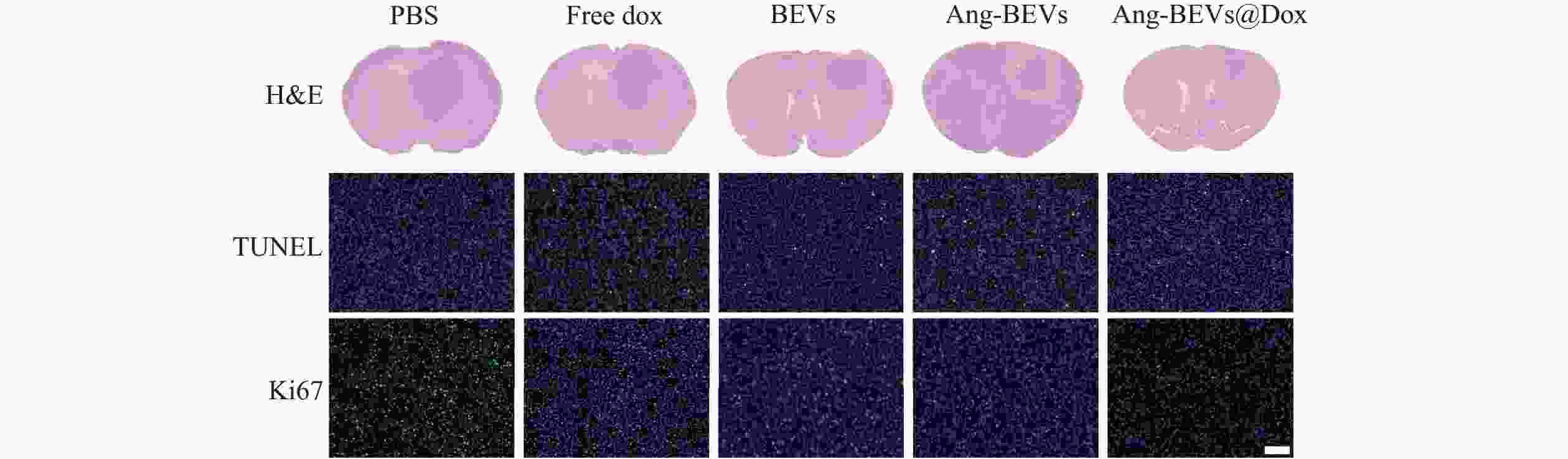
治疗结束后,每组随机选取3只小鼠进行组织切片和染色。病理学分析进一步验证了Ang-BEVs@Dox的治疗优势(图6)。H&E染色示,Ang-BEVs@Dox组的肿瘤面积相较于PBS组、Free Dox组、BEVs组、Ang-BEVs组及Ang-BEVs@Dox组显著缩小。TUNEL检测揭示该组细胞凋亡显著增加,其荧光信号强度明显强于PBS组、Free Dox组及BEVs组。Ki-67染色则呈相反趋势,表明Ang-BEVs@Dox组的细胞增殖水平显著降低。
以上结果充分证明了Ang-BEVs@Dox递送系统在克服BBB障碍、实现靶向递送化疗药物并有效抑制GBM生长方面的优越性。
-
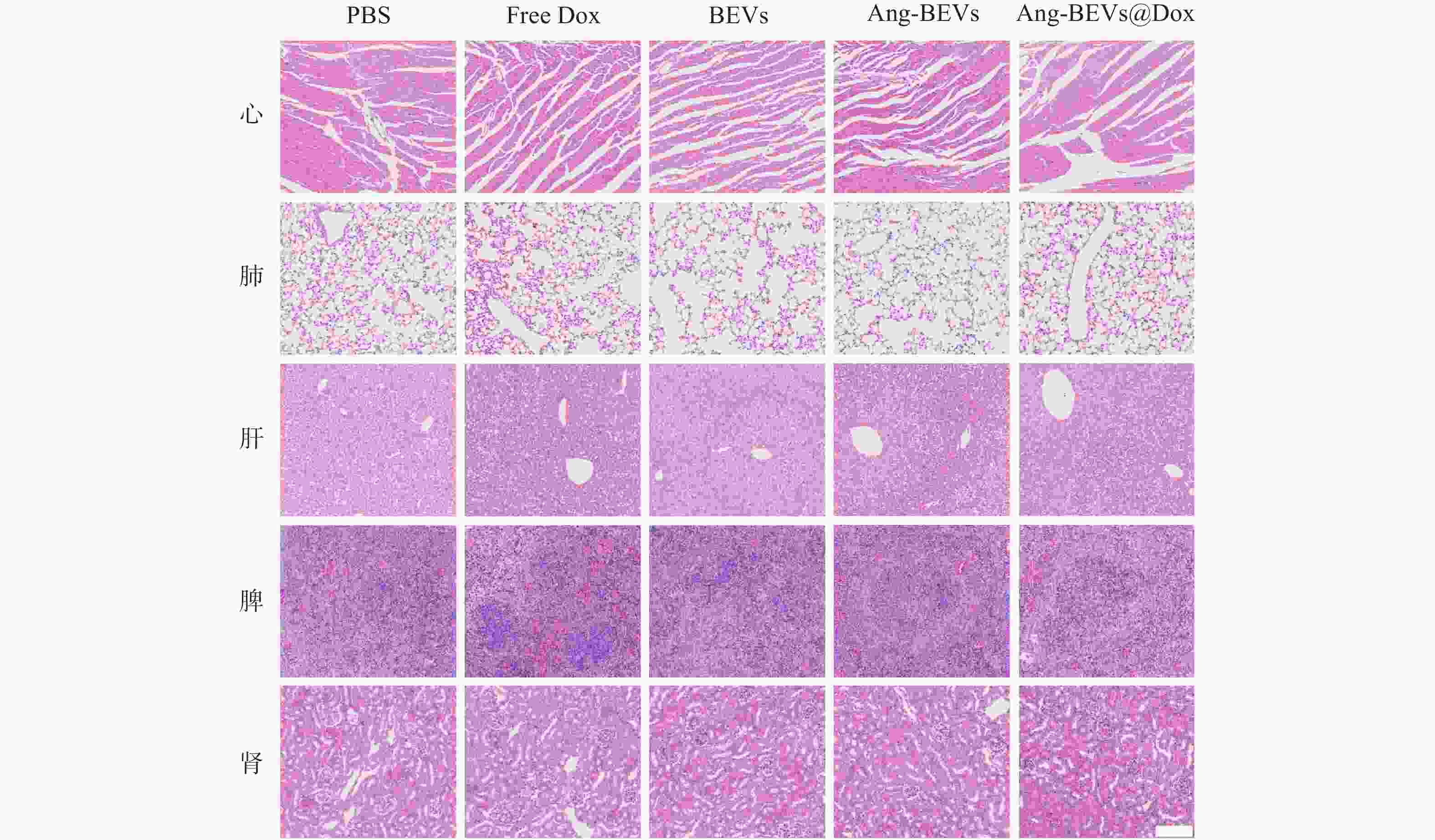
初步的药物安全性评估表明,Ang-BEVs@Dox递送系统治疗周期内具有较好的安全性。如图7所示,心脏、肝脏和肾脏等主要器官的没有明显的组织病理学损伤。空白Ang-BEVs组未观察到明显的毒性反应,表明载体本身具有良好的生物相容性。
-
本研究证实,Angiopep-2修饰的BEVs(Ang-BEVs)作为Dox递送载体,通过三重协同机制显著提升GBM治疗效果。Angiopep-2肽介导的LRP-1受体靶向使BEVs在GBM组织的蓄积量显著提升,成功突破BBB限制;同时,BEVs的天然纳米结构有效保护药物在循环中的稳定性,并且其中细菌衍生的物质能够协同Dox发挥双重的抗肿瘤作用。在一定程度上,该载体可通过定向递送特性显著降低心脏等关键器官的药物暴露,实现了“增效减毒”的协同效应。这一策略为GBM的靶向化疗提供了新范式。
BEVs的纳米级脂质双分子层结构赋予其不可替代的载体优势。其天然膜蛋白成分可促进BBB穿透,而Angiopep-2等靶向肽的修饰能进一步优化肿瘤富集效率[16-17]。值得注意的是,BEVs具有内在免疫调节潜能——来源于特定菌株(如E. coli BL 21)的囊泡携带免疫刺激分子,可逆转胶质瘤微环境的免疫抑制状态,为化疗-免疫联合治疗提供理想平台[18]。此外,BEVs的多功能载药特性支持同时负载化疗药物、基因治疗组件(如靶向MGMT的siRNA)或基因编辑工具,实现多机制协同抗肿瘤,这是传统合成载体难以实现的[12]。
基于本研究构建的Ang-BEVs@Dox系统,BEVs的临床转化可沿3条路径拓展:①开发双重靶向系统(如Angiopep-2/TAT肽复合修饰)以应对肿瘤异质性[19];②通过亲本菌株基因编辑实现治疗性蛋白的原位表达[20];③利用患者特异性肿瘤抗原修饰BEVs开发个体化疫苗[21]。然而,临床转化仍面临关键挑战:①在生产工艺方面,亟需建立符合临床标准的BEVs发酵、纯化及载药流程;②在安全性方面,需通过构建LPS缺陷菌株或采用仿生涂层技术精准调控免疫原性;③此外,必须阐明BEVs在脑组织内的长期代谢机制,建议采用放射性同位素标记结合多模态影像技术实时追踪体内动力学行为。
BEVs凭借其独特的生物学特性与可工程化优势,已展现出突破GBM治疗壁垒的巨大潜力[4-5, 22]。本研究不仅验证了“受体靶向-天然载体”协同策略的可行性,更开辟了BEVs作为多功能神经肿瘤治疗平台的新方向。未来研究需聚焦于大型动物模型疗效验证、符合临床规范的生产工艺开发以及载体-宿主相互作用的长期安全性评价[23]。通过跨学科协作推动BEVs从基础研究向临床转化,有望为GBM患者提供兼具精准靶向性、高效穿透性和优异安全性的新一代治疗方案。
Effect of Angiopep-2-functionalized bacterial extracellular vesicles system on glioblastoma
-
摘要:
目的 为克服胶质母细胞瘤(GBM)化疗中面临的血脑屏障(BBB)穿透障碍及全身毒性问题,构建Angiopep-2肽修饰的细菌外囊泡(BEVs)负载多柔比星(Dox)的靶向递送系统(Ang-BEVs@Dox),旨在提升药物对脑肿瘤的靶向性并降低其毒副作用。 方法 采用超高速离心法提取大肠杆菌来源的BEVs,并将靶向LRP-1受体的Angiopep-2肽修饰至BEVs表面,构建靶向载体(Ang-BEVs)。利用低频超声法将Dox载入Ang-BEVs,形成Ang-BEVs@Dox。通过透射电镜和动态光散射表征载体形态与粒径等理化性质;通过细胞摄取实验、三维肿瘤球模型及原位荷瘤小鼠模型评估该系统的跨BBB递送能力、体外/体内抗肿瘤效果及生物安全性。 结果 ①载体表征与体外效果:Ang-BEVs@Dox粒径约为100 nm,负载Dox后结构保持稳定。其可显著增强U87MG细胞的摄取效率,并在三维肿瘤球中实现深度渗透。细胞毒性实验表明,Ang-BEVs@Dox中BEVs与Dox具有协同抗肿瘤作用。②体内靶向性与抗肿瘤效果:在原位荷瘤小鼠模型中,Ang-BEVs@Dox能有效穿透BBB并显著抑制肿瘤生长,将GBM荷瘤小鼠的中位生存期延长至33.5 d(空白对照组为23.5 d,P<0.001)。免疫组化分析显示其显著抑制肿瘤细胞增殖标志物Ki-67表达,并增强凋亡标志物TUNEL信号。③生物安全性:Ang-BEVs@Dox治疗组小鼠的主要器官未观察到明显病理损伤,表明其具有良好的生物安全性。 结论 成功构建的Ang-BEVs@Dox靶向递药系统,能够有效克服BBB,协同发挥BEVs与Dox的抗肿瘤作用,显著提升药物在GBM部位的富集和治疗效果,为克服GBM的治疗瓶颈提供了一种创新性解决方案。 -
关键词:
- 胶质母细胞瘤 /
- 血脑屏障 /
- 细菌外囊泡 /
- Angiopep-2肽 /
- 多柔比星
Abstract:Objective To construct a targeted drug delivery system, Ang-BEVs@Dox, based on Angiopep-2 peptide-modified bacterial extracellular vesicles (BEVs) loaded with doxorubicin (Dox), overcome the challenges of blood-brain barrier (BBB) penetration and systemic toxicity in chemotherapy for glioblastoma (GBM), enhance drug targeting to brain tumors and reduce its toxic side effects. Methods BEVs derived from Escherichia coli were isolated using ultracentrifugation. The targeting ligand Angiopep-2, specific for the LRP-1 receptor, was conjugated onto the surface of BEVs to construct the targeted carrier (Ang-BEVs). Dox was loaded into Ang-BEVs using low-frequency sonication to form Ang-BEVs@Dox. The physicochemical properties (morphology and size) of the carriers were characterized by transmission electron microscopy (TEM) and dynamic light scattering (DLS). The BBB-penetrating capability, in vitro/in vivo anti-tumor efficacy, and biosafety of the system were evaluated using cellular uptake assays, 3D tumor spheroid models, and orthotopic tumor-bearing mouse models. Results ① Carrier characterization and in vitro efficacy: Ang-BEVs@Dox exhibited a particle size of approximately 100 nm and maintained structural stability after Dox loading. It significantly enhanced cellular uptake efficiency in U87MG cells and achieved deep penetration within 3D tumor spheroids. Cytotoxicity assays demonstrated synergistic anti-tumor effects between the BEVs and Dox in the Ang-BEVs@Dox system. ② In vivo targeting and anti-tumor efficacy: In orthotopic tumor-bearing mouse models, Ang-BEVs@Dox effectively penetrated the BBB and significantly inhibited tumor growth, extending the median survival time of tumor-bearing mice to 33.5 days (compared to 23.5 days in the blank control group, P<0.001). Immunohistochemical analysis revealed significant suppression of the tumor cell proliferation marker Ki-67 and enhancement of the apoptosis marker TUNEL staining signals. ③ Biosafety: Major organs from mice in the Ang-BEVs@Dox treatment group showed no observable pathological damage, indicating good biosafety. Conclusion This study successfully constructed an Angiopep-2 peptide-modified engineered BEVs delivery system (Ang-BEVs@Dox). Through Angiopep-2-mediated BBB penetration and tumor targeting, it significantly enhanced the accumulation and therapeutic efficacy of BEVs at the GBM site. This method combined efficient delivery, low systemic toxicity, and clinical translation potential, which provided an innovative solution to overcome the therapeutic bottleneck in GBM treatment. -
Key words:
- glioblastoma /
- blood brain barrier /
- bacterial extracellular vesicles /
- Angiopep-2 /
- Dox
-
-
[1] LONG G V, SHKLOVSKAYA E, SATGUNASEELAN L, et al. Neoadjuvant triplet immune checkpoint blockade in newly diagnosed glioblastoma[J]. Nat Med, 2025, 31(5): 1557-1566. doi: 10.1038/s41591-025-03512-1 [2] TERSTAPPEN G C, MEYER A H, BELL R D, et al. Strategies for delivering therapeutics across the blood-brain barrier[J]. Nat Rev Drug Discov, 2021, 20(5): 362-383. doi: 10.1038/s41573-021-00139-y [3] MATHUR R, WANG Q X, SCHUPP P G, et al. Glioblastoma evolution and heterogeneity from a 3D whole-tumor perspective[J]. Cell, 2024, 187(2): 446-463. e16. [4] YOU H Y, ZHANG S L, ZHANG Y W, et al. Engineered bacterial outer membrane vesicles-based doxorubicin and CD47-siRNA co-delivery nanoplatform overcomes immune resistance to potentiate the immunotherapy of glioblastoma[J]. Adv Mater, 2025, 37(15): e2418053. doi: 10.1002/adma.202418053 [5] MI Z, YAO Q, QI Y, et al. Salmonella-mediated blood‒brain barrier penetration, tumor homing and tumor microenvironment regulation for enhanced chemo/bacterial glioma therapy[J]. Acta Pharm Sin B, 2023, 13(2): 819-833. doi: 10.1016/j.apsb.2022.09.016 [6] HERRMANN I K, WOOD M J A, FUHRMANN G. Extracellular vesicles as a next-generation drug delivery platform[J]. Nat Nanotechnol, 2021, 16(7): 748-759. doi: 10.1038/s41565-021-00931-2 [7] TOYOFUKU M, SCHILD S, KAPARAKIS-LIASKOS M, et al. Composition and functions of bacterial membrane vesicles[J]. Nat Rev Microbiol, 2023, 21(7): 415-430. doi: 10.1038/s41579-023-00875-5 [8] JI N, WANG F X, WANG M M, et al. Engineered bacterial extracellular vesicles for central nervous system diseases[J]. J Control Release, 2023, 364: 46-60. doi: 10.1016/j.jconrel.2023.10.027 [9] LIU H, ZHANG H, WANG S C, et al. Bone-targeted bioengineered bacterial extracellular vesicles delivering siRNA to ameliorate osteoporosis[J]. Compos Part B Eng, 2023, 255: 110610. doi: 10.1016/j.compositesb.2023.110610 [10] YAN X, LIU X Y, ZHANG D, et al. Construction of a sustainable 3-hydroxybutyrate-producing probiotic Escherichia coli for treatment of colitis[J]. Cell Mol Immunol, 2021, 18(10): 2344-2357. doi: 10.1038/s41423-021-00760-2 [11] XU X X, ZHANG Z Q, DU J W, et al. Recruiting T-cells toward the brain for enhanced glioblastoma immunotherapeutic efficacy by co-delivery of cytokines and immune checkpoint antibodies with macrophage-membrane-camouflaged nanovesicles[J]. Adv Mater, 2023, 35(25): e2209785. doi: 10.1002/adma.202209785 [12] REHMAN F U, LIU Y, YANG Q S, et al. Heme Oxygenase-1 targeting exosomes for temozolomide resistant glioblastoma synergistic therapy[J]. J Control Release, 2022, 345: 696-708. doi: 10.1016/j.jconrel.2022.03.036 [13] PÉREZ-LÓPEZ A, TORRES-SUÁREZ A I, MARTÍN-SABROSO C, et al. An overview of in vitro 3D models of the blood-brain barrier as a tool to predict the in vivo permeability of nanomedicines[J]. Adv Drug Deliv Rev, 2023, 196: 114816. doi: 10.1016/j.addr.2023.114816 [14] ZHU Z C, ZHAI Y X, HAO Y, et al. Specific anti-glioma targeted-delivery strategy of engineered small extracellular vesicles dual-functionalised by Angiopep-2 and TAT peptides[J]. J Extracell Vesicles, 2022, 11(8): e12255. doi: 10.1002/jev2.12255 [15] JIANG Y, YANG W J, ZHANG J, et al. Protein toxin chaperoned by LRP-1-targeted virus-mimicking vesicles induces high-efficiency glioblastoma therapy in vivo[J]. Adv Mater, 2018, 30(30): e1800316. doi: 10.1002/adma.201800316 [16] ZHAO Y, QIN J, YU D H, et al. Polymer-locking fusogenic liposomes for glioblastoma-targeted siRNA delivery and CRISPR-Cas gene editing[J]. Nat Nanotechnol, 2024, 19(12): 1869-1879. doi: 10.1038/s41565-024-01769-0 [17] RICHTER R, KAMAL M A M, KOCH M, et al. An outer membrane vesicle-based permeation assay(OMPA)for assessing bacterial bioavailability[J]. Adv Healthc Mater, 2022, 11(5): e2101180. doi: 10.1002/adhm.202101180 [18] PAN J M, LI X L, SHAO B F, et al. Self-blockade of PD-L1 with bacteria-derived outer-membrane vesicle for enhanced cancer immunotherapy[J]. Adv Mater, 2022, 34(7): e2106307. doi: 10.1002/adma.202106307 [19] TIAN T, LIANG R Y, EREL-AKBABA G, et al. Immune checkpoint inhibition in GBM primed with radiation by engineered extracellular vesicles[J]. ACS Nano, 2022, 16(2): 1940-1953. doi: 10.1021/acsnano.1c05505 [20] YUE Y L, XU J Q, LI Y, et al. Antigen-bearing outer membrane vesicles as tumour vaccines produced in situ by ingested genetically engineered bacteria[J]. Nat Biomed Eng, 2022, 6(7): 898-909. doi: 10.1038/s41551-022-00886-2 [21] LI Y, ZHAO R F, CHENG K M, et al. Bacterial outer membrane vesicles presenting programmed death 1 for improved cancer immunotherapy via immune activation and checkpoint inhibition[J]. ACS Nano, 2020, 14(12): 16698-16711. doi: 10.1021/acsnano.0c03776 [22] ZHANG H Y, LI Z S, GAO C Y, et al. Dual-responsive biohybrid neutrobots for active target delivery[J]. Sci Robot, 2021, 6(52): eaaz9519. doi: 10.1126/scirobotics.aaz9519 [23] SUN B, LI R, JI N, et al. Brain-targeting drug delivery systems: the state of the art in treatment of glioblastoma[J]. Mater Today Bio, 2025, 30: 101443. doi: 10.1016/j.mtbio.2025.101443 -




 下载:
下载: