-
肺癌起源于支气管黏膜上皮,是临床常见的一种恶性肿瘤,病死率居各类恶性肿瘤之首[1]。目前临床上对肺癌的主要治疗手段有手术、放疗、化疗和生物靶向药物,尽管这些疗法都有了长足的进步,但由于肺癌早期症状不明显,容易被忽视,80%以上的患者发现时已为中晚期,错过了最佳手术期,无法进行根治性治疗;而其他一些患者也因无法耐受放疗或化疗的副作用,或由于药物治疗后产生耐药性,至今肺癌的5年生存率仍徘徊在15%左右[2-3]。
光动力疗法(PDT)是利用光敏剂(Ps),在一定波长光激发下,通过光动力效应选择性地杀伤肿瘤细胞的一种非侵入性肿瘤治疗新方法,具有不良反应轻微、特异性高、无耐药性、可重复使用等优点,可用于肺癌早期的治疗及肺癌晚期的姑息治疗[3-5]。光敏剂是光动力治疗最重要的因素。目前,已有一个抗肺癌光敏剂他拉泊芬(talaporfin,商品名Laserphyrin)在日本上市,该药为叶绿素衍生物,具有皮肤光毒性较小、肿瘤组织选择性高、给药-照光时间短等优点,但其光动力学活性相对较差,且制备困难、价格昂贵,难以推广使用[6]。近年来,叶绿素降解产物类二氢卟吩化合物在光动力抗肿瘤新药研究中备受瞩目,该类化合物Q带位于650~700 nm,并且具有较强的吸收强度和高单线态氧产率,因此可能成为潜在的光敏剂候选化合物[7]。
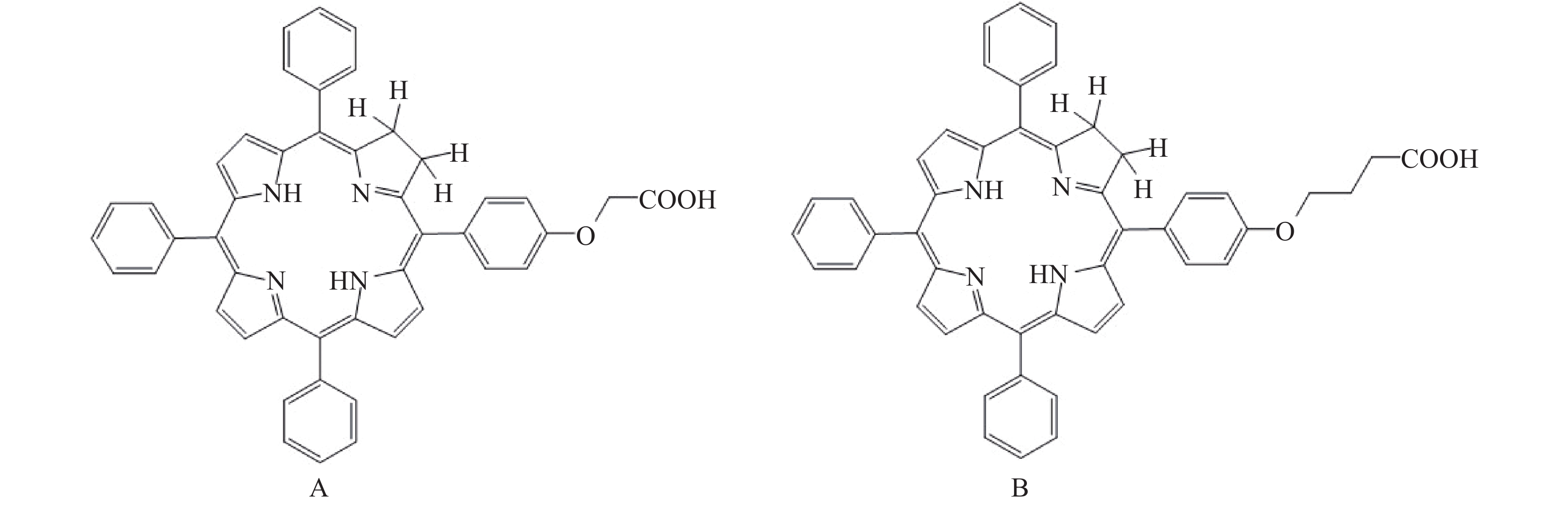
为了发现针对肺癌的具有高效、高选择性、价廉的单体新药候选物,本实验拟对课题组自主设计合成的二氢卟吩化合物5-(4-羧甲氧基苯基)-10,15,20-三苯基-二氢卟吩(D1)和5-(4-羧丙氧基苯基)-10,15,20-三苯基-二氢卟吩(D2)进行体内体外药理学评价(结构式见图1),探讨其介导的光动力学作用对肺癌的杀伤效果,为其下一步的临床应用提供坚实的基础理论支持。
-
人肺腺癌细胞株A549购自中国科学院上海细胞生物学研究所,用含10%胎牛血清的F-12K培养基在37 ℃、5% CO2饱和湿度条件下培养,2~3 d传代一次。
雄性Balb/c nude裸鼠(5~6周龄,20~22 g)购自上海杰斯捷实验动物有限公司,在每天12 h光照与12 h黑暗交替、25 ℃的条件下饲养于东华大学实验动物中心,饲料、饮水及垫料经过121 ℃、15 min高温高压灭菌,自由取食。
-
二氢卟吩化合物D1和D2由本实验室自制;替莫泊芬(m-THPC)购自上海先辉医药科技有限公司;均以DMSO作为溶剂,将化合物配制成浓度为10 mmol/L的药物储备母液,摇匀使其充分溶解后,过滤、灭菌、分装、避光保存于4 ℃。
胎牛血清、F-12K培养基、0.25%EDTA胰酶购自上海骄荣生物科技有限公司;1,3-二苯基异苯并呋喃(DPBF)购自百灵威科技有限公司;Annexin V-FITC 细胞凋亡检测试剂盒、Hoechst
33342 试剂盒、Lyso-Tracker Blue、Mito-Tracker Green、HE染色试剂盒购自碧云天生物技术有限公司。异氟烷购自瑞沃德生命科技有限公司。 -
激光器(MRL-III-650)购自上海衍涉光电技术有限公司;激光功率计(XLP12-3S-H2-D0)购自加拿大Gentec-EO光电公司;紫外可见分光光度计(7600-1CRT)购自上海菁华科技仪器有限公司;荧光分光光度计(FluoroMax-4)购自天美科技有限公司;倒置荧光显微镜(XSP-15C)购自上海长方光学仪器有限公司;激光共聚焦显微镜(LSM700)购自德国Zeiss股份有限公司;二氧化碳细胞培养箱(BB-15)和酶标仪(Mk3)购自Thermo Fisher Scientific公司。
-
(1)紫外-可见吸收光谱
用DMSO将D1、D2和m-THPC的储备液稀释至5 μmol/L浓度的待测液,取3 ml待测液放置于石英比色皿中,利用紫外分光光度计检测化合物的紫外吸收光谱,并根据朗格比尔定律公式计算出对应的摩尔消光系数ε=吸光度/(比色皿厚度×待测液的浓度)。
(2)荧光吸收光谱
用DMSO将D1、D2和m-THPC的储备液稀释至5 μmol/L浓度的待测液,取3 ml待测液放置于四通石英比色皿中,用荧光分光光度计测定3D荧光激发-吸收光谱,并确定各化合物的最佳激发和发射波长。荧光分光光度计的激发和发射狭缝均设置为1 nm,在测试期间保持不变。
-
以DMF作为溶剂,将D1、D2和DPBF分别配制成浓度为2 μmol/L的药物溶液和DPBF溶液,分别取1.5 ml、2 μmol/L的药物溶液与1.5 ml、60 μmol/L的DPBF稀释液,充分混匀后放置于石英比色皿中,使用波长为650 nm的激光器,功率设定为5 mW/cm2,每隔10 s照射一次样品,并使用紫外分光光度计测量样品的紫外吸收图谱。
-
(1)细胞摄取实验
收集处于对数生长期的A549细胞,将细胞以1×105个/ml的密度接种于24孔板中并培养24 h,吸除旧的培养液后,分别在各孔中加入用培养液稀释的光敏剂溶液(终浓度为4 μmol/L),并继续孵育。于不同时间点吸除旧培养液,用PBS缓冲液冲洗2遍,加入0.25%胰酶消化细胞并收集至15 ml离心管中,1 000 r/min离心5 min后吸除上清液,加入3 ml DMSO,超声破碎10 min后,再次于1 000 r/min离心5 min,随后取上清液3 ml于四通石英比色皿中,使用荧光分光光度计检测各待测液的荧光强度。以不同时间点的荧光强度为纵坐标,检测时间t为横坐标绘制曲线图。
(2)MTT法检测细胞活性
收集处于对数生长期的A549细胞,将细胞以5×104个/ml的密度接种于96孔板中并放入二氧化碳培养箱中,实验设空白对照组、单纯药物组和光动力组,每组5复孔。培养至细胞单层铺满孔底时,吸除旧培养液,Hanks溶液冲洗两遍后,分别在单纯药物组和光动力组的每孔中加入100 μl用培养液进行梯度稀释的光敏剂溶液。避光孵育24 h后,于倒置显微镜下观察细胞状态,弃去上清液,加入新鲜培养液后,分别用激光器(波长650 nm,功率密度25 mW/cm2,光照剂量1 J/cm2,光照时间40 s)对单纯激光组和光动力组的细胞进行照射。照光后继续避光培养24 h,吸除药液后,分别在每孔中加入20 μl、5 mg/ml MTT溶液,继续培养4 h后弃去孔内培养液,并加入150 μl DMSO,置摇床上低速振荡10 min,使结晶物充分溶解;随后利用酶联免疫检测仪在570 nm处测量各孔的吸光度(A)。
按照公式计算细胞存活率:细胞存活率(%)=(实验组A值−空白孔A值)/(对照组A值-空白孔A值)×100%,并利用SPSS软件计算IC50值。
-
(1)人肺腺癌细胞A549皮下异位移植瘤模型的建立
收集处于对数生长期的A549细胞,调整浓度为1×107个/ml的细胞悬液,并取0.2 ml接种于Balb/c nude裸鼠右下肢。饲养2周后,肿瘤长至直径约为10 mm时,裸鼠异氟烷吸入麻醉后,于无菌条件下处死。剥离肿瘤组织,并去除坏死组织和正常组织后,将其切成1 mm左右的瘤块,随后使用肿瘤接种套针将其移植于新裸鼠的右前肢。接种后每隔1 d用电子游标卡尺测量肿瘤长度(a),宽度(b),求出近似瘤体积(V)=0.5×a×b2。
(2)PDT体内抑瘤作用研究
当荷瘤裸鼠的肿瘤直径大约为7 mm时,随机将其分为空白对照组和光动力组,每组5只。单纯药物组和光动力组荷瘤裸鼠经尾静脉缓慢注入0.2 ml含2.5 mg/kg光敏剂(D1、D2或m-THPC)的氯化钠溶液,30 min后异氟烷吸入麻醉单纯激光组和光动力组的裸鼠,使用激光器照射其肿瘤部位,照射光纤距肿瘤为2~3 cm,光斑面积约为1.5 cm;光斑覆盖肿瘤激光功率为200 mW/cm2,能量密度为100 J/cm2。分别在PDT后每隔1 d对小鼠进行拍照,监测小鼠的体重,测量肿瘤体积。
-
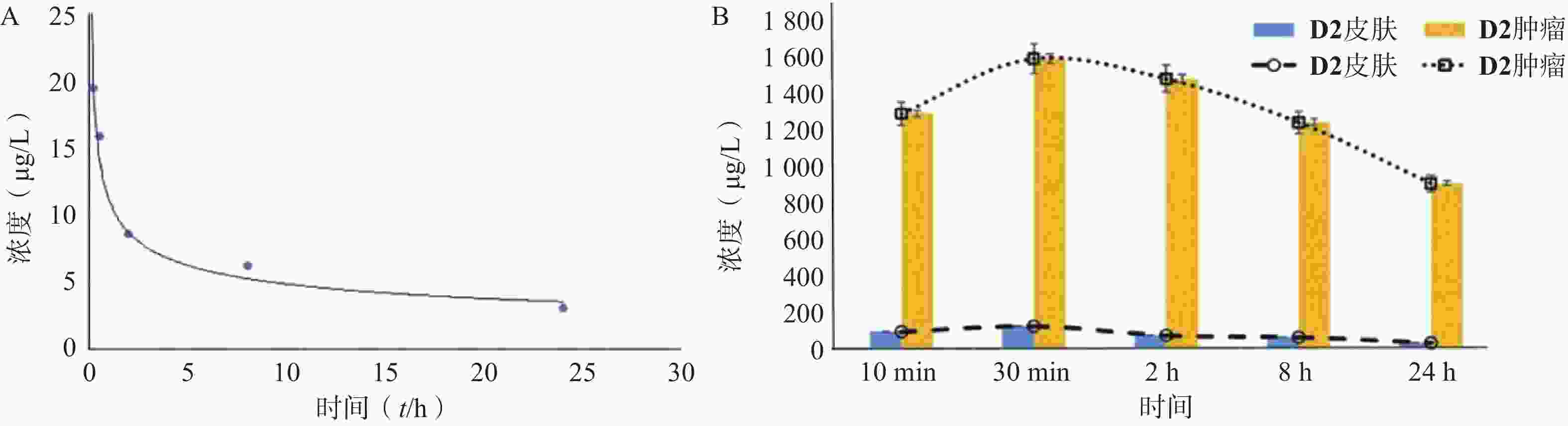
当肿瘤体积长至150 ~170 mm3时,18只荷瘤裸鼠分别经尾静脉缓慢注入0.2 ml含2.5 mg/kg D2的氯化钠溶液,分别于给药前和给药后10、30 min、2、8和24 h经异氟烷吸入麻醉后处死,每个时间点处死3只裸鼠。
采集静脉血和肿瘤、肺脏、肝脏、皮肤等组织。静脉血以肝素抗凝后,离心分离出血浆,取血浆0.5 ml,加入1.5 ml生理盐水充分混匀后,以416 nm为激发波长测定其在676 nm处的荧光强度。
组织样品用生理盐水冲洗后,各取100 mg,剪碎后加入1.5 ml生理盐水充分匀浆,5 000 r/min离心10 min后取0.5 ml上清液,加入1.5 ml生理盐水充分混匀后,以416 nm为激发波长测定其在676 nm处的荧光强度。
标准工作曲线的制备:用空白血浆分别配制浓度分别为0、1、2、5、10、20 μg/L的光敏剂标准品溶液,按样品测定处理程序测定各样品峰高,以浓度为横坐标,以峰高为纵坐标作图,得标准曲线。
-
数据结果以均数±标准偏差(mean±SD)表示,组间差异采用独立样本t检验,P<0.05为具有显著性统计学差异。多组样本采用方差分析。多个样本与对照组比较采用LSD法。
-
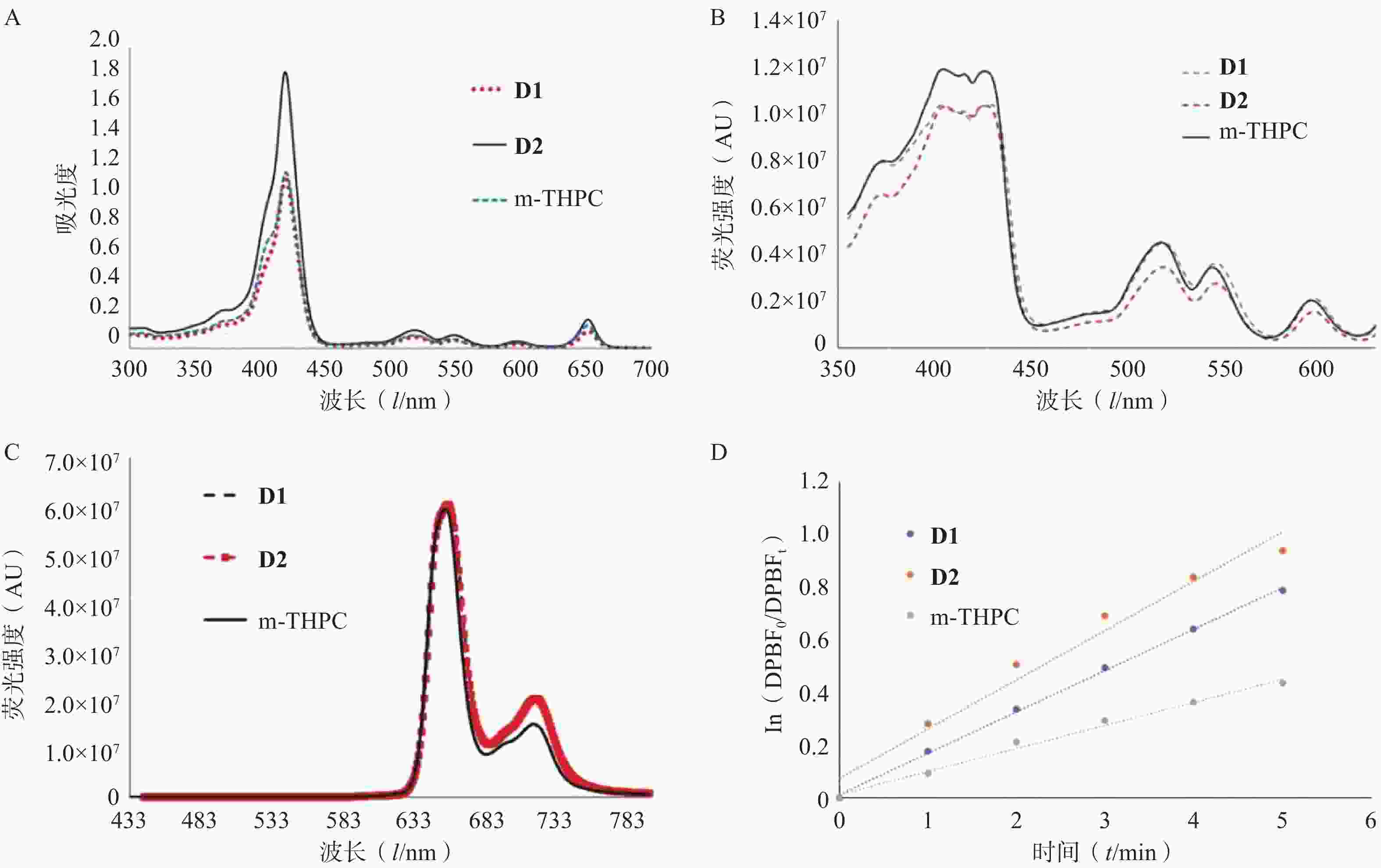
如图2A所示,浓度为5 μmol/L的D1、D2和m-THPC在DMF溶液中的紫外吸收波谱基本相似,最强吸收峰(索瑞峰)位于419 nm附近,在519~597 nm范围内有3个弱吸收的Q带,在652 nm处具有一个次强峰,其中,D2在Q带各吸收峰对应的摩尔消光系数均高于m-THPC和D1(表1)。
表 1 D1、D2和m-THPC的摩尔消光系数
光敏剂 摩尔消光系数(ε) D1 14 400(λ=519 nm) 10 400(λ=549 nm) 5 400(λ=597 nm) 23 200(λ=652 nm) D2 23 800(λ=519 nm) 17 200(λ=549 nm) 9 000(λ=597 nm) 38 200(λ=652 nm) m-THPC 16 800(λ=518 nm) 11 800(λ=546 nm) 6 800(λ=597 nm) 30 000(λ=651 nm) D1、D2和m-THPC在DMF溶液中的荧光激发-发射特性也基本相似,如图2B的荧光光谱所示,D1、D2和m-THPC共有4个激发峰,最佳激发波长分别是429 nm(D1),427 nm(D2)和405 nm(m-THPC),当分别以最佳激发波长激光激发时,都可在658 nm和714 nm处检测到一强一弱两个明显的荧光信号,D1和D2在658 nm处荧光强度与m-THPC基本相同,分别为60804500(D1)、60367900(D2)和59434600(m-THPC),见图2C。
-
DPBF在417 nm处有强烈的吸收峰,与单线态氧能够快速反应从而破坏其共轭结构,生成无色产物。因此,利用紫外-可见光谱测量在417 nm处的吸光度变化,便能间接了解光敏剂生成单线态氧的能力[8]。如图2D所示,化合物D1、D2和m-THPC与DPBF混合之后,在417 nm处的吸光度随着光照逐渐下降,且与光照时间呈现良好的线性关系(R2=0.998)。表明D1、D2和m-THPC在650 nm激光照射后可产生单线态氧,从而使DPBF发生降解。根据DPBF降解速度可推测D2的单线态氧生成速率最快,其次为D1和m-THPC(表2)。
表 2 D1、D2和m-THPC的单线态氧生成速率
光敏剂 单线态氧生成速率k(min−1) D1 0.160 1 D2 0.206 9 m-THPC 0.086 1 -
如图3所示,化合物D1、D2和m-THPC均可被A549细胞摄取,且随着共孵育时间的增长,A549细胞对各化合物的摄取量也随之增加。共孵育的0~4 h内,摄取量呈直线增长,随后摄取速度变缓,于18~24 h时基本达到饱和,其中A549细胞对D2的摄取量最高,其次为D1和m-THPC。
-
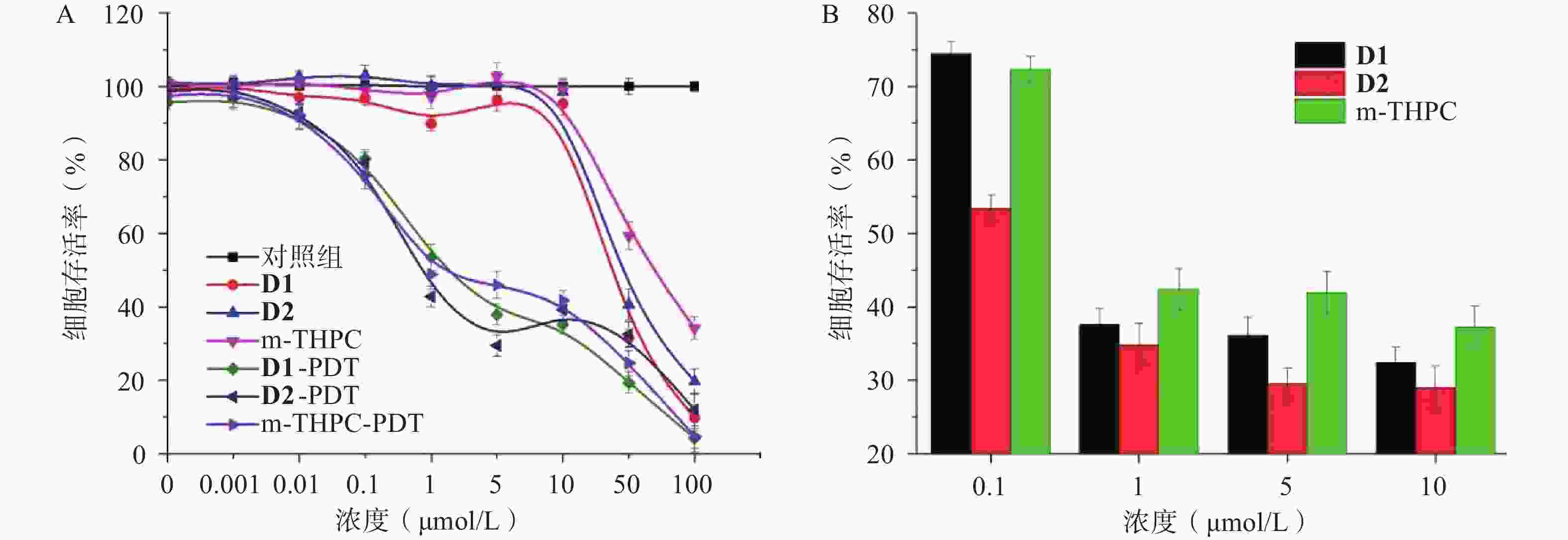
当光照剂量为0 J/cm2时,D1、D2在10 μmol/L以下的浓度基本没有暗毒性,与空白对照组相比,无统计学差异(P>0.05),表明D1、D2在此浓度下是安全的。当光照剂量为1 J/cm2时,D1、D2和m-THPC均呈对A549细胞具有杀伤作用,且随着化合物浓度增大,细胞存活率随之下降。与空白对照组相比,有显著的统计学差异(P<0.01,图4A)。其中,在药物浓度低于10 μmol/L时,D1、D2的光动力杀伤肿瘤细胞作用均高于相同浓度水平的m-THPC,IC50值分别为0.869(D1)、0.13(D2)和1.227(m-THPC),见图4B。综合暗毒性结果,可发现D2对A549细胞的PDT杀伤作用最好,其次为D1和m-THPC。
-
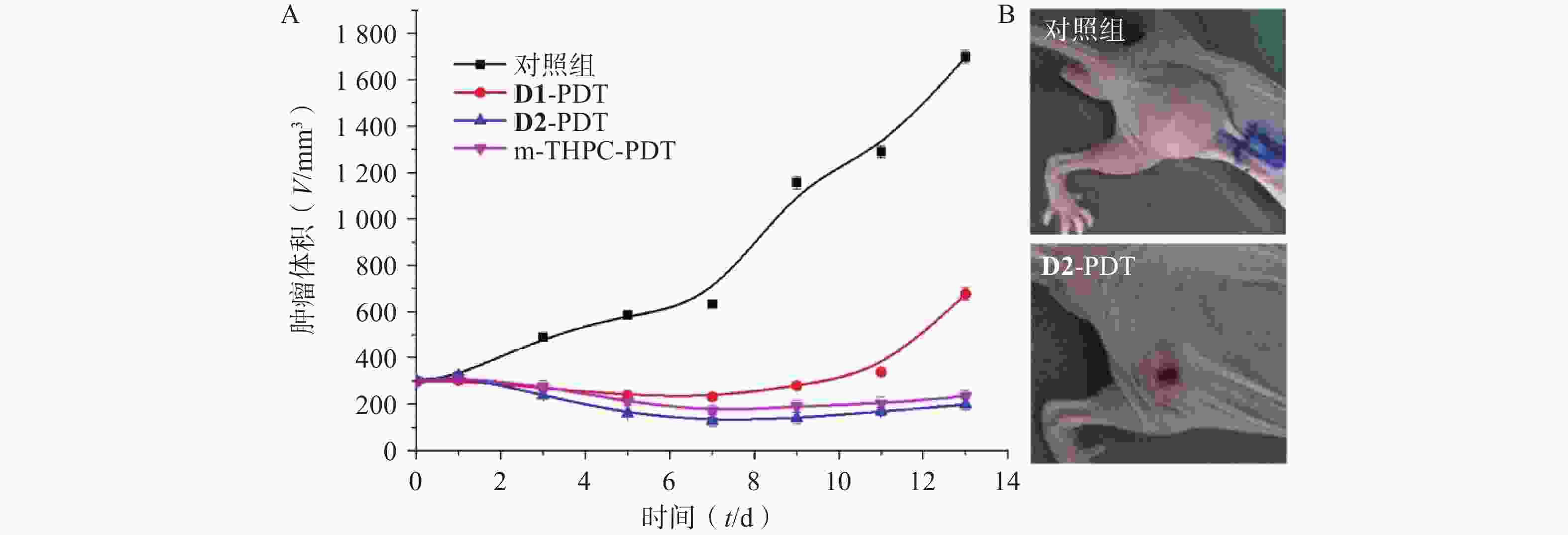
荷瘤裸鼠在进行D1、D2和m-THPC PDT后第1天可见肿瘤部位皮肤发红,出现明显的水肿,随之在第3天出现结痂,直至7 d后结痂开始退去,在13 d后生长出新生组织。如图5所示,与对照组相比,D1、D2和m-THPC PDT组的肿瘤生长都受到了不同程度的抑制,且差异具有统计学意义(P<0.01),其中,化合物D2的治疗效果优于m-THPC,在PDT治疗后的第1~7天各组肿瘤体积逐渐减小,随后会随时间的延长缓慢增长。提示在光动力作用后7 d可再次进行光动力治疗以防止肿瘤复发。
-
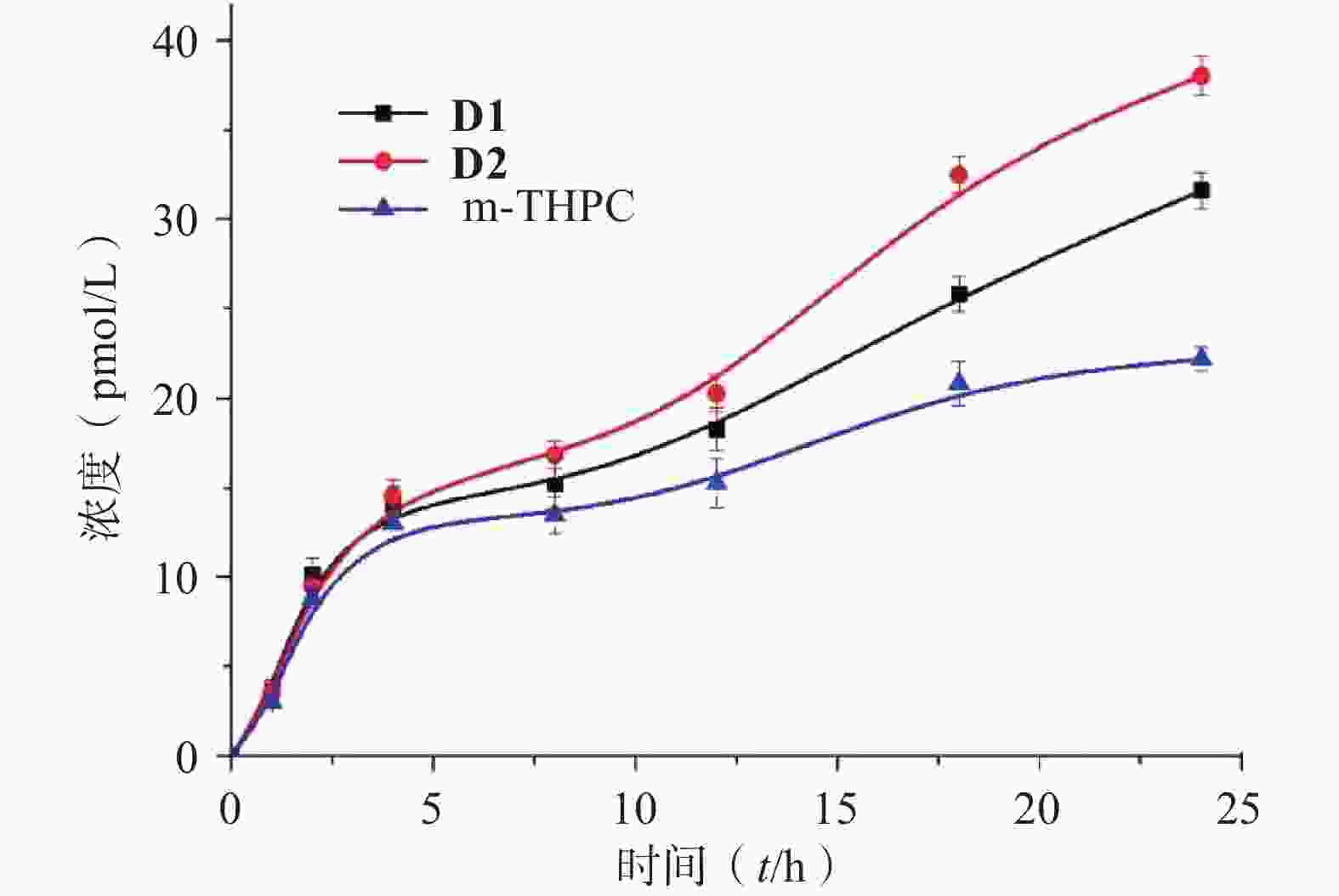
上述研究表明化合物D2在体内外都具有较强的光动力治疗效果,因此,本研究进一步对D2在荷瘤裸鼠血浆、皮肤组织和肿瘤组织中的浓度进行了检测。结果表明,给药后即刻D2在裸鼠体内的血药浓度达到最高,随后随着时间的延长而下降;给药后0.5~2 h,血药浓度即下降到一半,随后下降趋势放缓,在24 h内仍能维持一定的血药浓度(图6A)。而由图6B所示,D2进入体内后30 min内,在皮肤组织中有较高的分布,随后快速代谢;在肿瘤组织内的分布也呈现出先低-后高-再低的特点,于给药后30 min达到最高,随后以较高浓度在肿瘤组织中潴留,代谢较慢。D2在肿瘤组织与皮肤组织的分布比在给药后30 min达到8.8,提示D2在给药后最佳的治疗窗口应在30 min以内。
-
光动力治疗无耐药性,选择性高,是完全不同于手术、放疗、化疗和免疫治疗之后的又一种正在研究、快速发展的崭新疗法,在恶性肿瘤和各种良性疾病的治疗中都取得了令人瞩目的成就[5,9]。光敏剂的研究是影响光动力治疗前景的关键所在,长久以来,为了适应光动力治疗疾病的需要,人们研发了多种光敏剂用于PDT治疗,但仍然存在种类较少、成本较高、可能存在皮肤毒性等问题[9],且目前我国具有自主知识产权的光敏药物并不多。本研究以对m-THPC4个苯环上的羟基进行结构改造后得到的化合物D1、D2为研究对象,对它们的光学性能和抗肿瘤活性进行研究。D1、D2在652 nm长波长处具有良好的吸收峰,且摩尔消光系数都达到了104以上,并具有较高的单线态氧生成速率和体内外抗肿瘤活性,可用于治疗真皮以下的深层病变和体积较大的肿瘤。
由于电子激发态光敏剂不仅能产生细胞毒性作用,还能在转变为基态过程时发出荧光,因此光敏剂既能作为PDT治疗过程中的药物,又能作为光动力成像的造影剂[5,10]。目前,国内外已经有大量关于利用光敏剂光动力成像技术进行实验室实验和临床诊断、治疗的研究,本研究对D1和D2的荧光光谱进行了检测,发现D1和D2的荧光强度均稍高于已有大量临床光动力成像应用的m-THPC,提示D1和D2也具有成为光动力成像造影剂的可能。
为了进一步了解化合物的最佳给药时间及避光时间,本研究对在体内外具有较好抗肿瘤活性的D2进行了血药浓度和组织分布研究,结果表明,D2对肿瘤组织具有一定的选择性,最佳治疗窗口应在给药后30 min以内,但D2的血药浓度代谢较慢,在24 h内仍能维持一定的血药浓度,提示在临床使用中应注意避光。
以上研究结果表明,二氢卟吩化合物D2在长波长处具有强吸收,并拥有荧光光谱性质、单线态氧生成速率以及抗肿瘤活性,具备成为肿瘤诊治光敏剂候选药物的潜力,值得进一步的研究。
Photodynamic performance and anti-lung cancer effect of novel chlorin compounds
-
摘要:
目的 研究新型二氢卟吩化合物5-(4-羧甲氧基苯基)-10,15,20-三苯基-二氢卟吩( D1 )和5-(4-羧丙氧基苯基)-10,15,20-三苯基-二氢卟吩( D2 )的光动力学性能及其介导的光动力学作用对肺癌的杀伤效果。 方法 测定新化合物 D1 和 D2 的紫外-可见吸收光谱和荧光光谱;以1,3-二苯基异苯并呋喃(DPBF)作为单线态氧捕捉剂检测 D1 和 D2 的单线态氧生成能力;利用荧光法检测化合物在人肺腺癌细胞A549内的细胞吞噬率,用MTT法检测化合物的暗毒性和光毒性;建立肺癌荷瘤裸鼠模型,考察化合物介导的光动力作用在体内的抗肿瘤活性,并进一步检测 D2 在荷瘤裸鼠体内的血药浓度以及在肿瘤组织和皮肤组织中的分布。 结果 D1 和 D2 在652 nm长波长处具有强吸收,最佳激发波长位于429 nm和427 nm处,最佳发射波长位于659 nm左右,并具有高于对照药替莫泊芬(m-THPC)的单线态氧生成速率; D1 和 D2 在10 μmol/L以下的浓度基本没有暗毒性,并可被人肺腺癌细胞A549摄取,于18~24 h基本达到饱和;在650 nm波长激光照射后, D1 和 D2 在体内外均具有明显的抗肿瘤活性(P<0.01),其中,化合物 D2 在给药后可选择性地聚集于肿瘤组织,最佳治疗时间为给药后30 min内。 结论 D2 具有优秀的光动力抗肿瘤活性,并能选择性聚集于肿瘤组织,具备成为肺癌诊治光敏剂候选药物的潜力,值得进一步的研究。 Abstract:Objective To study the photodynamic performance and the killing effect of photodynamic therapy on lung cancer of novel chlorin compounds 2-(4-(5,15,20-triphenyl-7H,8H-porphyrin-10-yl) phenoxy) acetic acid( D1 )and 4-(4-(5,15,20-triphenyl-7H,8H-porphyrin-10-yl) phenoxy) butanoic acid ( D2 ). Methods The ultraviolet visible absorption spectrum and fluorescence spectrum of D1 and D2 were determined. The singlet oxygen generation capacity of D1 and D2 was measured by using DPBF as singlet oxygen capture agent. Fluorescence assay was used to detect the cellular phagocytosis rate of the compounds in A549 cells, and MTT assay was used to detect their dark toxicity and phototoxicity. A nude mouse model of lung cancer was established to investigate the antitumor activity of the compounds mediated photodynamic action in vivo, and the blood concentration of D2 in nude mice, its distribution in tumor tissue and skin tissue were further detected. Results D1 and D2 had strong absorption at 652 nm with the best excitation wavelength at 429 nm and 427 nm, and the optimal emission wavelength was at about 659 nm. They also had a higher singlet oxygen generation rate than the control drug m-THPC. D1 and D2 had no dark toxicity at concentrations below 10 μmol/L, and could be ingested by A549 cells, basically reaching saturation in 18~24 hours. After laser irradiation at 650 nm wavelength, D1 and D2 showed significant antitumor activity in vivo and in vitro (P<0.01). However, D2 could selectively accumulate in tumor tissues after administration, and the optimal treatment time was less than 30 min after administration. Conclusion D2 had excellent photodynamic antitumor activity and could selectively aggregate in tumor tissues, which had the potential to be a candidate drug for photosensitizer and treatment of lung cancer with independent intellectual property rights, and was worth further research. -
Key words:
- lung cancer /
- chlorin /
- photodynamic therapy /
- pharmacological evaluation
-
表 1 D1、D2和m-THPC的摩尔消光系数
光敏剂 摩尔消光系数(ε) D1 14 400(λ=519 nm) 10 400(λ=549 nm) 5 400(λ=597 nm) 23 200(λ=652 nm) D2 23 800(λ=519 nm) 17 200(λ=549 nm) 9 000(λ=597 nm) 38 200(λ=652 nm) m-THPC 16 800(λ=518 nm) 11 800(λ=546 nm) 6 800(λ=597 nm) 30 000(λ=651 nm) 表 2 D1、D2和m-THPC的单线态氧生成速率
光敏剂 单线态氧生成速率k(min−1) D1 0.160 1 D2 0.206 9 m-THPC 0.086 1 -
[1] SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. doi: 10.3322/caac.21708 [2] YANG T, XIONG Y L, ZENG Y F, et al. Current status of immunotherapy for non-small cell lung cancer[J]. Front Pharmacol, 2022, 13: 989461. doi: 10.3389/fphar.2022.989461 [3] WANG K, YU B X, PATHAK J L. An update in clinical utilization of photodynamic therapy for lung cancer[J]. J Cancer, 2021, 12(4): 1154-1160. doi: 10.7150/jca.51537 [4] EL-HUSSEIN A, MANOTO S L, OMBINDA-LEMBOUMBA S, et al. A review of chemotherapy and photodynamic therapy for lung cancer treatment[J]. Anticancer Agents Med Chem, 2021, 21(2): 149-161. [5] KWIATKOWSKI S, KNAP B, PRZYSTUPSKI D, et al. Photodynamic therapy–mechanisms, photosensitizers and combinations[J]. Biomed Pharmacother, 2018, 106: 1098-1107. doi: 10.1016/j.biopha.2018.07.049 [6] BASKARAN R, LEE J, YANG S G. Clinical development of photodynamic agents and therapeutic applications[J]. Biomater Res, 2018, 22: 25. doi: 10.1186/s40824-018-0140-z [7] AZIZ B, AZIZ I, KHURSHID A, et al. An overview of potential natural photosensitizers in cancer photodynamic therapy[J]. Biomedicines, 2023, 11(1): 224. doi: 10.3390/biomedicines11010224 [8] MATHAI S, SMITH T A, GHIGGINO K P. Singlet oxygen quantum yields of potential porphyrin-based photosensitisers for photodynamic therapy[J]. Photochem Photobiol Sci, 2007, 6(9): 995-1002. doi: 10.1039/b705853e [9] CORREIA J H, RODRIGUES J A, PIMENTA S, et al. Photodynamic therapy review: principles, photosensitizers, applications, and future directions[J]. Pharmaceutics, 2021, 13(9): 1332. doi: 10.3390/pharmaceutics13091332 [10] GUNAYDIN G, GEDIK M E, AYAN S. Photodynamic therapy for the treatment and diagnosis of cancer-a review of the current clinical status[J]. Front Chem, 2021, 9: 686303. doi: 10.3389/fchem.2021.686303 -




 下载:
下载: