-
勃起功能障碍(ED)是指阴茎持续不能达到或维持足够的勃起以完成满意的性生活,病程在3个月以上[1]。ED在世界各地均有着较高发病率,马萨诸塞州男性老龄化研究(MMAS)报道波士顿地区年龄在40~70 岁的男性 ED总体患病率为52%[2]。根据一项我国北京、广州、重庆三个城市的流行病学调查结果显示,ED总患病率为26.1%,其中40岁以上的男性患病率为40.2%[3]。ED发生的机制涉及生理结构、神经内分泌、血管功能和性心理等多个方面,其引起和加重的因素包括年龄增长、血管病变、糖尿病、肥胖、药物等[4]。ED的一线治疗药物是磷酸二酯酶-5抑制剂(PDE5i),其总有效率可达80%[5]。然而随着疾病的进程,ED患者中有11%~44%会出现单独使用PDE5i效果不佳的情况[6]。
ED中医学称为“阳痿”,中医治疗阳痿历史悠久,中医在整体观念和辨证论治的思维下,对于不同症候采取不同的治疗方法。对于阳痿实证,多采用疏肝解郁、活血化瘀、清热利湿之法;虚证阳痿则分阴虚、阳虚,阳虚则温补命门之火,阴虚滋阴,同时兼以脾虚则健脾益气等。对阳痿的治疗有着得天独厚的优势。
健复饮是由上海市名中医周智恒教授创制的治疗ED的协定方,近年来在西医常规治疗的基础上联合使用,取得了理想的效果。健复饮方中,黄芪、人参为君药,起益气强心之效;西红花、毛冬青、三七为臣药,起逐瘀通脉之效;蛇床子、枸杞子、淫羊藿、锁阳补肾益阳为佐药;柴胡、枳实取“四逆”之义,配伍白蒺藜、熟地黄滋阴疏肝理气通阳为使药。全方诸药合用,共奏荣筋起痿之功。临床研究证明,健复饮联用西地那非可改善原单用西地那非的ED患者的临床症状[7]。目前对于健复饮治疗ED的研究缺乏分子生物学层次的揭示,因此本研究通过网络药理学和分子对接技术预测健复饮治疗ED的有效活性成分、作用靶点、关键基因和通路,并结合体外实验验证,以期解释健复饮治疗ED的分子学机制。。
-
在中药系统药理学数据库与分析平台(TCMSP)[8](http://tcmspw.com/tcmsp.php)和中药分子机制的生物信息学分析工具BATMAN-TCM(http://bionet.ncpsb.org.cn/batman-tcm/)中检索人参、毛冬青、柴胡、西红花、锁阳、三七、淫羊藿、生黄芪、枸杞、蛇床子、熟地、枳实、白蒺藜等药物,设定其成分筛选条件为生物口服利用度(OB)≥30,类药性(DL)>0.18[9],筛选出药物成分及作用蛋白信息。所有蛋白名称借助Uniprot数据库(https://www.uniprot.org/)转化为对应的基因名称。
-
在Genecards数据库(https://www.genecards.org/)中搜索ED相关联的人类基因,并使用Excel软件进行汇总和去重后得到ED相关的靶点。
-
通过Excel软件筛选出药物成分靶点与ED靶点的交集,利用R 4.3.2软件绘制药物成分靶点-疾病靶点交集韦恩图。
-
在string数据库(https://cn.string-db.org/)上输入药物分子和疾病的交集靶点,在物种选项中选择人类(Homo sapiens),可信度>0.9,构建PPI(Protein-Protein interaction,PPI)网络,利用Cytoscape软件上NetworkAnalyzer工具对PPI网络进行拓扑分析,以Degree参数为参考标准,调整节点大小及颜色深度,构建具有可视化的PPI网络图。利用Cytoscape软件内置插件MCODE,分析PPI网络,进行核心模块的聚类及筛选,根据Dergee度值和Mcode分值确定核心靶点。
-
将交集靶点导入R语言软件,利用其中的org和clusterProfiler数据包进行GO功能富集分析和KEGG通路富集分析。GO分析中包含生物过程(BP)、细胞成分(CC)、分子功能(MF)3个模块的分析,以P<0.05为筛选标准,根据涉及靶点数目进行排序,选取前10位的条目内容用微生信在线作图软件(http://www.bioinformatics.com.cn/)绘制条形图;KEGG通路富集分析,以P<0.05为筛选标准,根据P值大小进行排序,选取前10位,利用R语言绘制气泡图,将分析结果进行可视化。
-
为检验所筛选核心靶点的精确性,从PDB数据库(https://www.rcsb.org/)查找核心靶点蛋白的三维结构文件;从Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)检索和核心靶点对应的药物活性成分的三维结构文件。应用Autodock软件计算结合能,并使用PyMOL软件将结合力较好的靶点蛋白-药物活性成分预测三维结构进行可视化展示。
-
健复饮购买于上海中医药大学附属龙华医院中药房,其组成成分为:人参、毛冬青、柴胡、西红花、锁阳、三七、淫羊藿、生黄芪、枸杞、蛇床子、熟地、枳实、白蒺藜。采用标准煎煮工艺制备健复饮提取物:取定量饮片置于2 L玻璃容器中,加入1.8 L去离子水浸润6 h后,参照经典提取方案进行两次梯度煎煮(首次30 min,复煎45 min)。收集两次滤液经旋转蒸发仪浓缩成浸膏后,置60 ℃恒温干燥箱中处理至恒重,最终获得灰白色干燥粉末29.79 g,药材转化率为18.8%。精密称取适量粉末,以灭菌蒸馏水配制成5 mg/ml混悬液,经0.22 μm无菌滤膜过滤后分装,于4 ℃冷藏环境保存备用。根据实验需求采用新鲜培养基进行梯度稀释后使用。
-
人脐静脉内皮细胞(HUVEC)来源于上海葵赛生物科技有限公司。将细胞接种于含10%胎牛血清(Newzerum, New Zealand)和1%青霉素链霉素(碧云天)的F12K(源培)的培养基中,置于含有95%空气和5%二氧化碳的37 ℃恒温培养箱中培养。使用小干扰RNA(si-eNOS)沉默HUVEC 细胞eNOS的表达,制备内皮功能障碍模型。si-eNOS的序列为F-UACUUGAUUUAGAGAUUAGAC、R-CUAAUCUCUAAAUCAAGUAUU。
-
Anti-JUN(
24909 -1-AP)购买于武汉三鹰生物技术有限公司,anti-p-JUN(9164S)、anti-MAPK(9108S)、anti-p-MAPK(4695T)购买于Cell Signaling Technology;anti-GAPDH(ab8245)、anti-eNOS(ab317582)购买于Abcam。 -
HUVEC细胞以1×105个/ml的浓度接种于含2 ml培养液的6孔板中,37 ℃培养24 h,然后用低、中、高浓度(0.75 mg/L、2.5 mg/L、5 mg/L)健复饮孵育细胞24 h,用PBS清洗细胞后,Trizol裂解细胞,提取总RNA。然后利用逆转录酶试剂盒(Takara,日本)将RNA转录为cDNA。按照制造商的说明,使用特异性引物(表1)和SYBR Green实时PCR试剂(Takara,日本)进行实时定量逆转录酶PCR分析。
表 1 引物序列
基因名 引物 Human GAPDH F: CTTAGCACCCCTGGCCAAG
R: TGGTCATGAGTCCTTCCACGHuman MAPK1 F: TACACCAACCTCTCGTACATCG
R: CATGTCTGAAGCGCAGTAAGATTHuman MAPK3 F: CTACACGCAGTTGCAGTACAT
R: CAGCAGGATCTGGATCTCCCHuman JUN F: TCCAAGTGCCGAAAAAGGAAG
R: CGAGTTCTGAGCTTTCAAGGTHuman ESR1 F: GGGAAGTATGGCTATGGAATCTG
R: TGGCTGGACACATATAGTCGTTHuman MAPK8 F: TCTGGTATGATCCTTCTGAAGCA
R: TCCTCCAAGTCCATAACTTCCTT -
使用低、中、高浓度(0.75、2.5、5 mg/L)健复饮孵育HUVEC细胞24 h后,用RIPA裂解缓冲液(P0013B)裂解细胞以收集总蛋白。使用BCA蛋白浓度检测试剂盒(P0010)测定蛋白浓度。然后使用SDS-PAGE凝胶电泳分离蛋白,转移至PVDF膜,用5%脱脂奶粉封闭2 h,与特异性一抗4 ℃孵育过夜,然后与HRP标记的二抗孵育2 h。采用Western blot检测系统(Tanon-
5200 )进行成像。 -
在本研究中,数据以
$ \bar x \pm s $ 的形式呈现。统计分析使用的是 GraphPad Prism 8 软件(GraphPad Software Inc., San Diego, California, USA)。所有实验均进行过3次及以上重复。两组比较采用Student’s T test分析,多组比较采用单因素方差分析,随后进行Tukey's检验。P值小于0.05被视为具有统计学显著性(*P<0.05, **P<0.01, ***P<0.001),“ns”表示无显著差异。 -
通过TCMSP与BATMAN-TCM数据库获取到健复饮方中的十三味药共
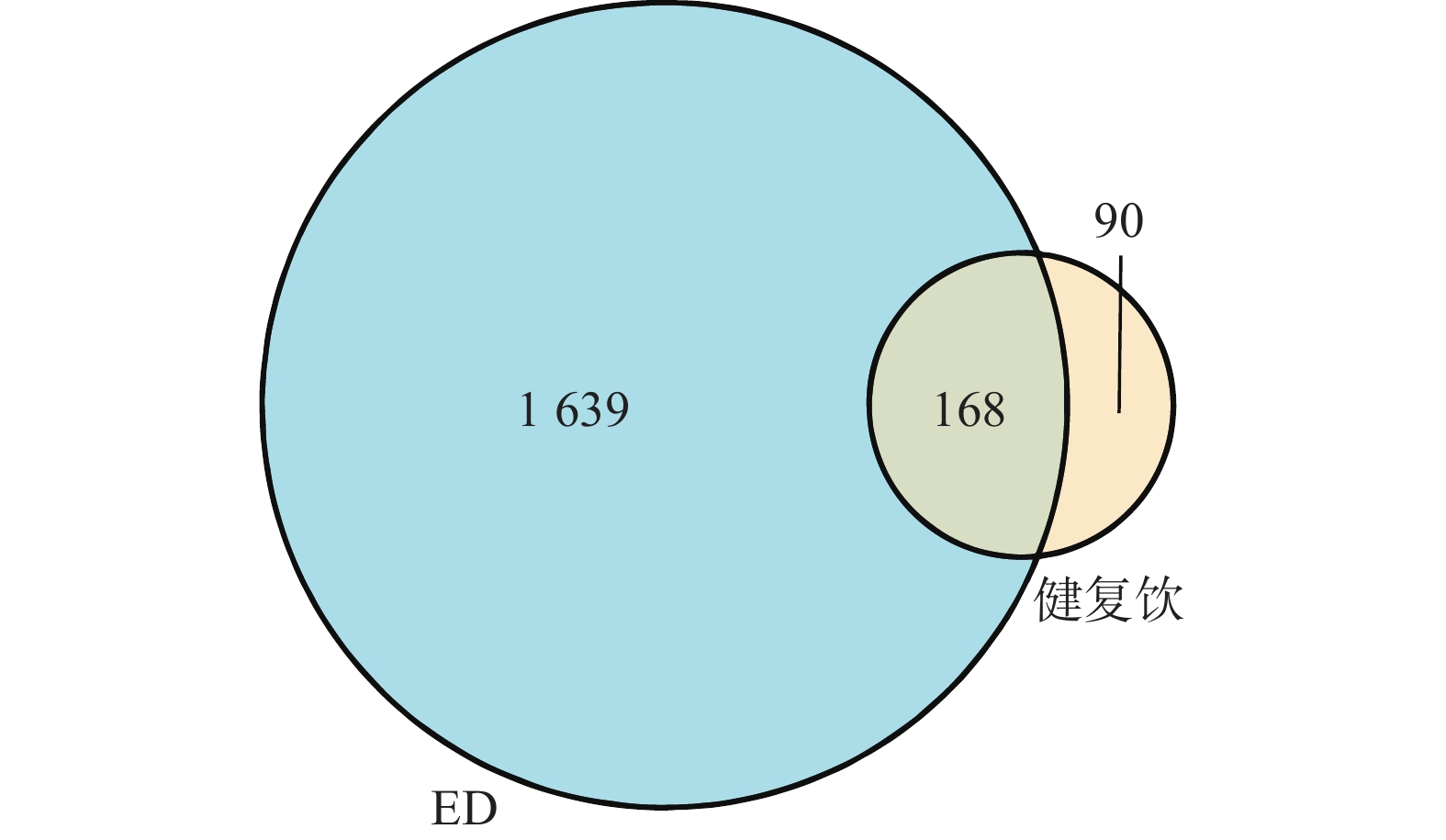
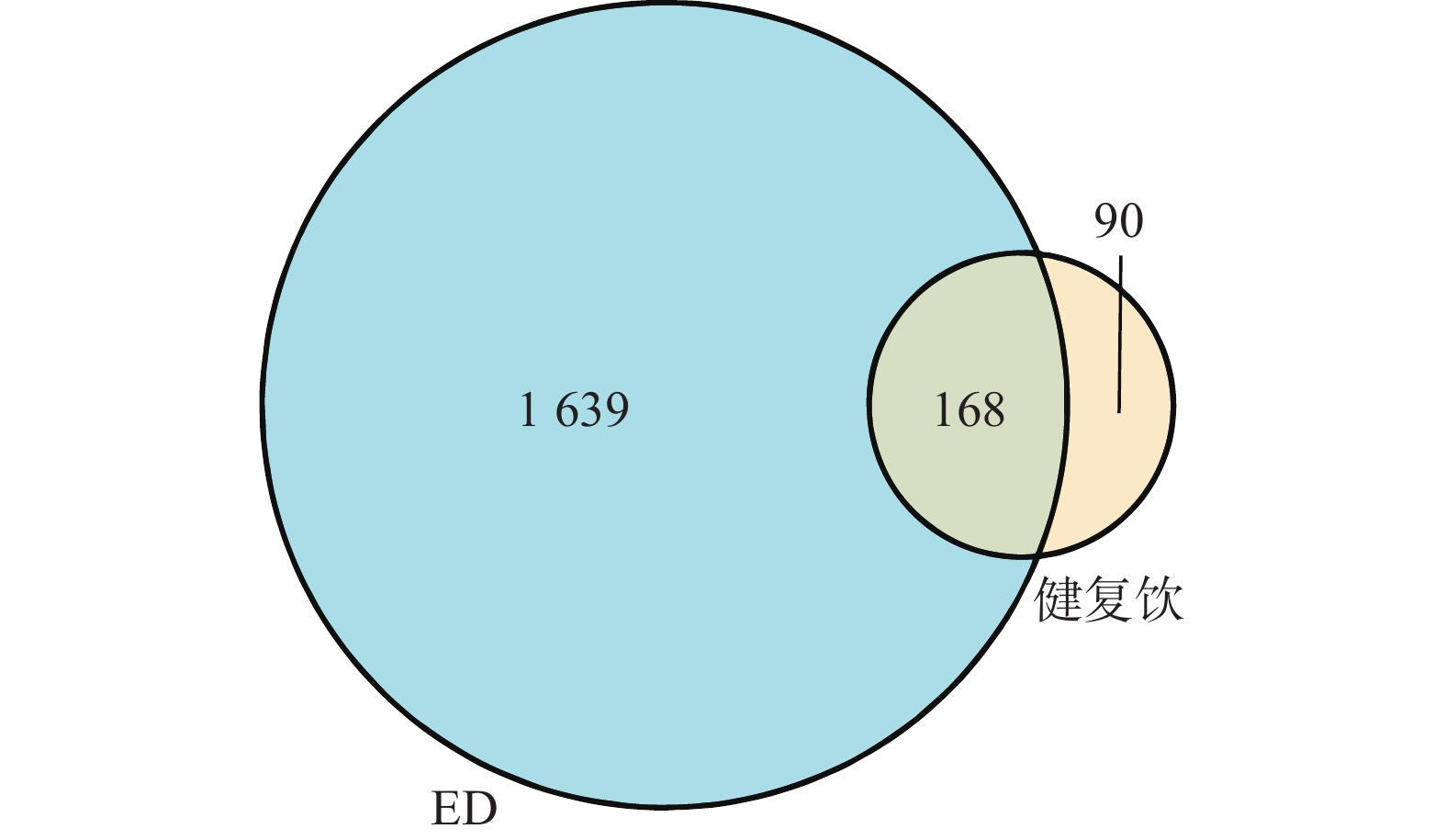
3277 个活性成分。其中淫羊藿499个、黄芪462个、枸杞子364个、柴胡348个、枳实306个、西红花272个、人参256个、三七241个、蛇床子222个、巴戟天145个、蒺藜122个、熟地34个、毛冬青6个。使用Uniprot数据库将药物作用的蛋白名称转化为对应的基因名称,经Excel汇总删重后,得到144个健复饮的药物活性成分,258个有效作用靶点。以“erectile dysfunction”为关键词,在GeneCards数据库检索ED的疾病靶点,经过合并、删重后,最终得到相关靶点1807个。 -
依据“1.3”项下的方法,筛选得到健复饮与ED疾病靶点交集基因共168个,并制作Venn图(图1)。
-
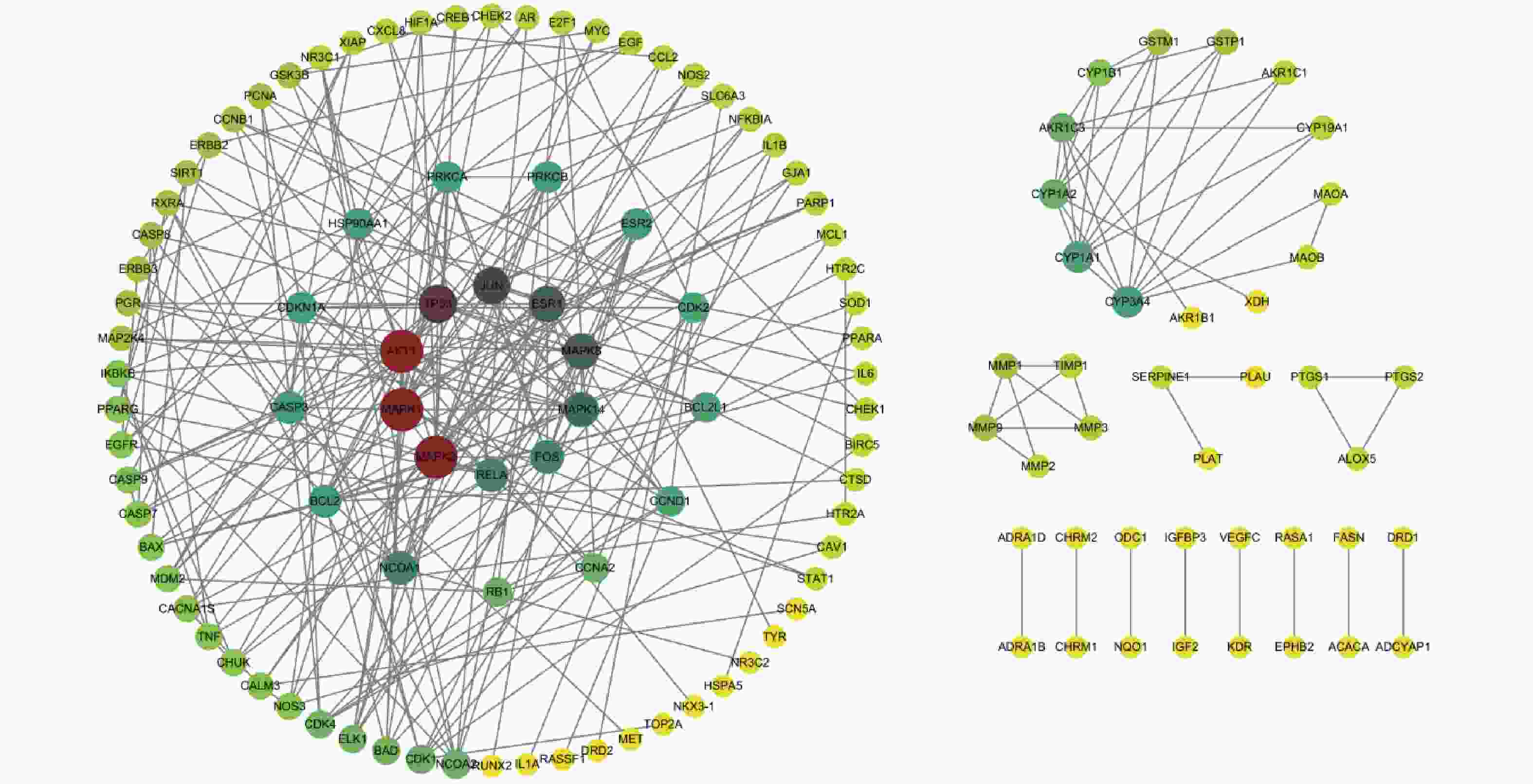
将交集靶点导入至string数据库后,利用“1.4”项下的方法,得到PPI网络。其中有168个节点,287条边,平均度值为3.46,PPI富集P值<1.0e−16。将导出的PPI网络文件导入Cytoscape 3.10.1软件并绘制PPI网络(图2),其中每个节点的颜色越深、节点圆形半径越大代表其度值(degree)越大。
-
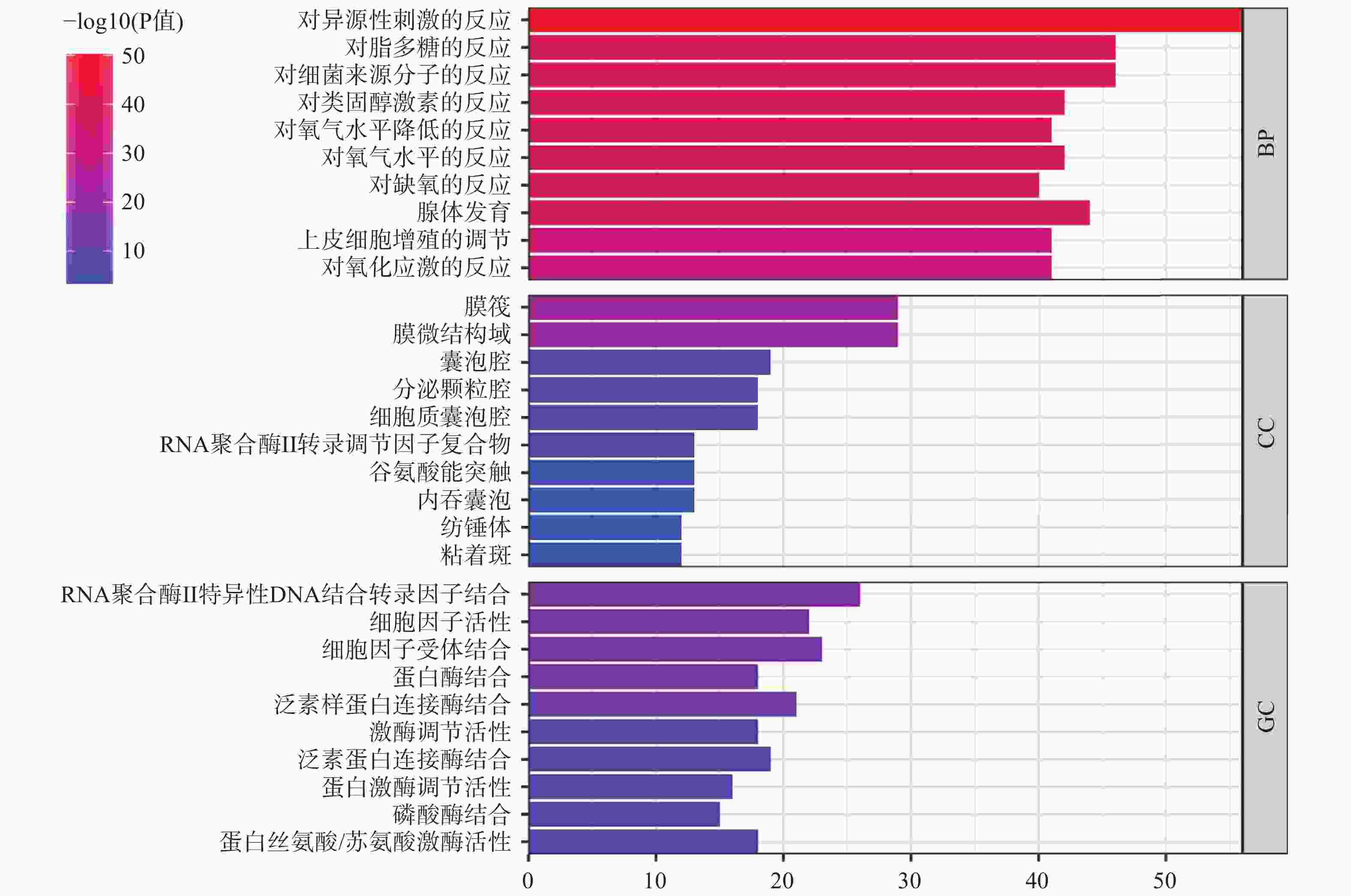
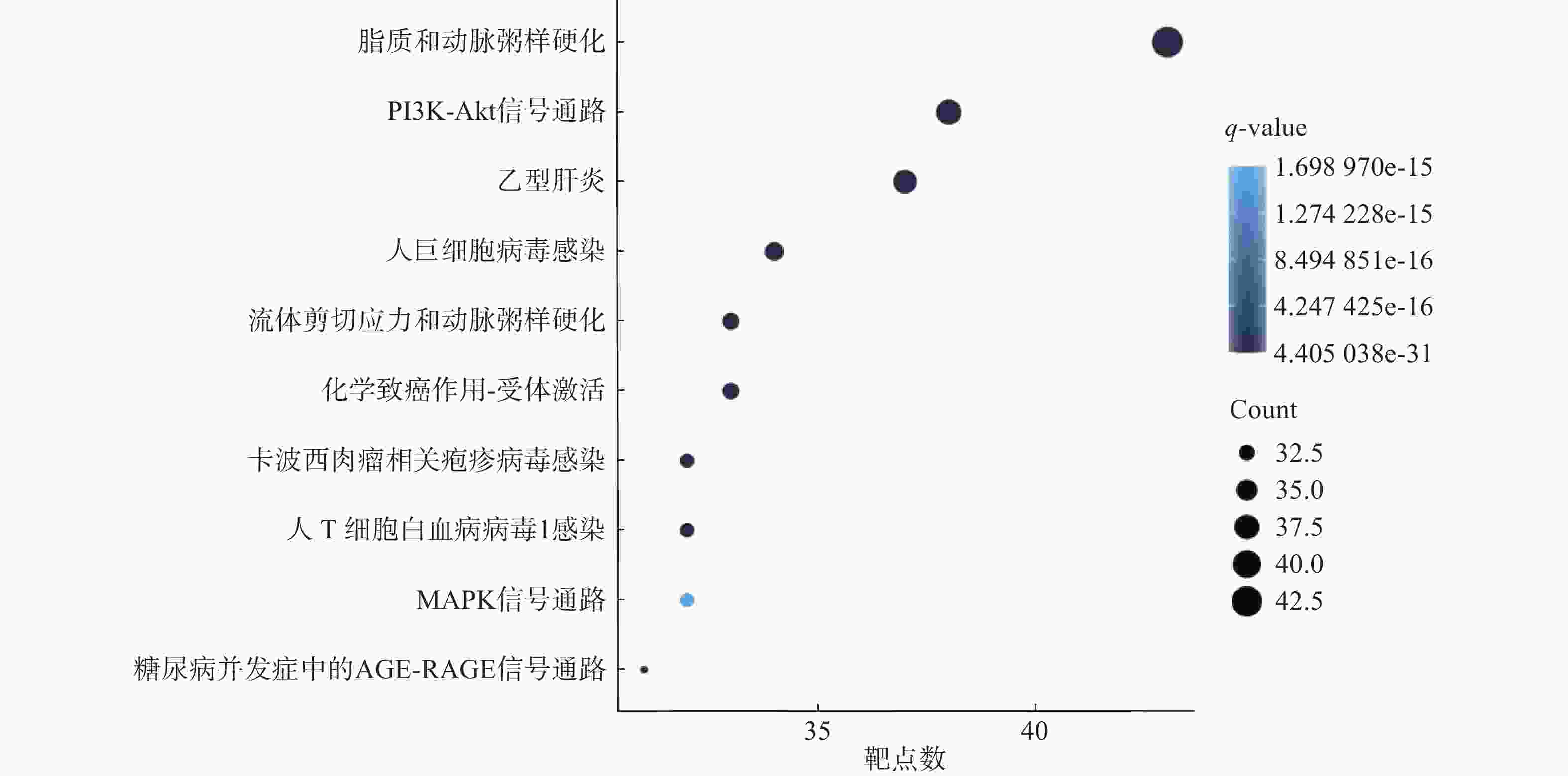
使用R 4.3.2软件,对药物-疾病共有靶点进行GO生物学功能分析,其中有2005个生物过程,151个分子功能,63个细胞组件,根据P<0.05,对所涉及靶点数目进行排序,选出排名前10条目绘制条形图(图3)。对药物-疾病靶点进行KEGG通路分析,共涉及181条通路,根据P<0.05,选出前10的条目绘制气泡图(图4)。
-
运用Cystoscape 3.10.1软件绘制网络图后,筛选出45个度值大于平均度值的基因,使用软件内置插件MCODE,对这45个基因进行模块聚类,得到8组模块(表2)。选取Mcode分值最高的模块中degree值排名5的基因:分别是从高到低依次为:MAPK1、MAPK3、JUN、ESR1、MAPK8。
表 2 Mcode聚类信息
模块 Mcode分值 节点/边 基因 模块1 7.429 8/26 ESR1,MAPK1,MAPK8,MAPK14,FOS,MAPK3,JUN,ESR2 模块2 4 9/16 CDK4,ELK1,PRKCA,CDK2,CDKN1A,CASP3,CCND1,PCNA,PRKCB 模块3 4 4/6 ERBB3,EGF,EGFR,ERBB2 模块4 4 4/6 MMP3,MMP9,MMP1,TIMP1 模块5 3.667 13/22 PARP1,TNF,BCL2,AKT1,RELA,NFKBIA,IKBKB,TP53,CASP9,BAX,CASP7,CHUK,XIAP 模块6 3.333 4/5 GSTP1,CYP1A1,GSTM1,CYP1A2 模块7 3 3/3 MAOA,MAOB,CYP3A4 模块8 3 3/3 PTGS2,ALOX5,PTGS1 -
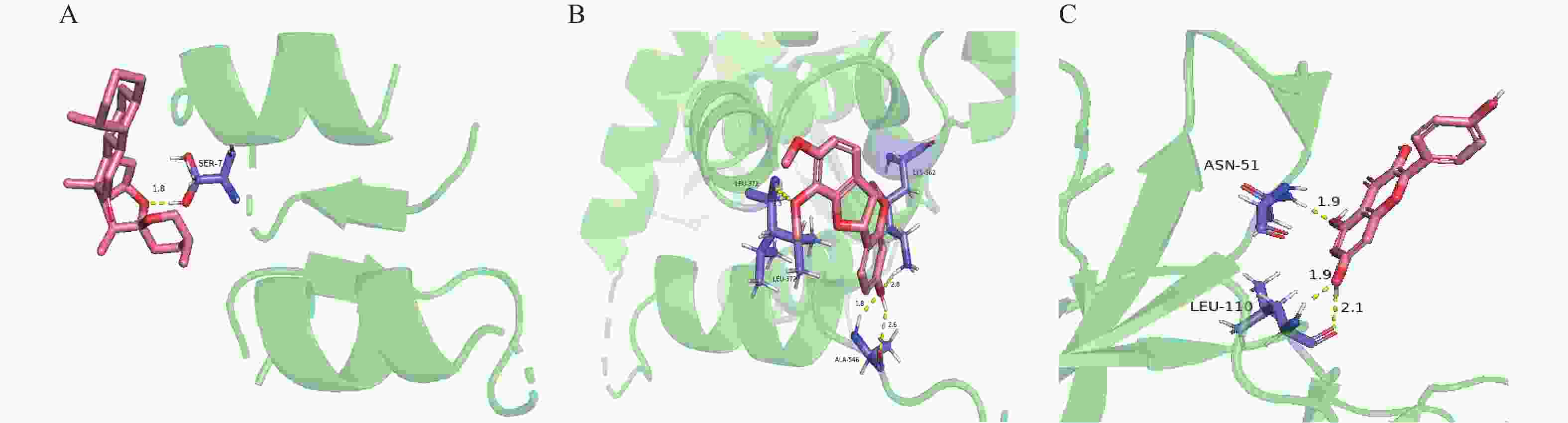
将核心靶点与其对应的药物成分分子进行分子对接,得到18组分子对接结果(表3,按结合能由小到大排列)。其中MAPK1对应2个活性成分、MAPK3对应1个活性成分、MAPK8对应2个活性成分、JUN对应6个活性成分、ESR1对应7个活性成分。一般认为,当结合能<0 kcal/mol时,表明化合物与靶点之间可以自行发生相互结合;当结合能<-5.0 kcal/mol时,说明靶点与化合物之间具有较强的生物结合活性[10]。健复饮治疗ED的预测核心靶点大多数都可以与其对应活性成分分子进行自发结合,其中JUN与β-谷甾醇、ESR1与黄芪紫檀烷苷、MAPK8与山奈酚具有较强的生物结合活性。利用PyMol软件,将结合能最强的三组分子-靶点结合三维结构进行可视化展示(图5)。
表 3 核心靶点-对应活性分子对接结合能
靶点名称 成分名称 结合能(kcal/mol) JUN β-谷甾醇(Beta-sitosterol) −6.75 ESR1 黄芪紫檀烷苷(Astapterocarpan) −5.7 MAPK8 山柰酚(Kaempferol) −5.54 ESR1 刺芒柄花素(Formononetin) −4.86 ESR1 香风草苷(Didymin) −4.85 JUN 刺芒柄花素(Formononetin) −4.76 MAPK1 木犀草素(Luteolin) −4.74 ESR1 淫羊藿新苷A(Yinyanghuo A) −4.67 ESR1 金圣草黄素(Chryseriol) −4.64 ESR1 8-(3-methylbut-2-enyl)-2-phenyl-chromone −4.62 ESR1 苜蓿素(Tricin) −4.5 MAPK1 槲皮素(Quercetin) −4.31 MAPK8 川陈皮素(Nobiletin) −4.16 JUN 山柰酚(Kaempferol) −4.03 JUN 木犀草素(Luteolin) −3.9 JUN 川陈皮素(Nobiletin) −3.82 JUN 槲皮素(Quercetin) −3.65 MAPK3 柚皮素(Naringenin) 2.23 -
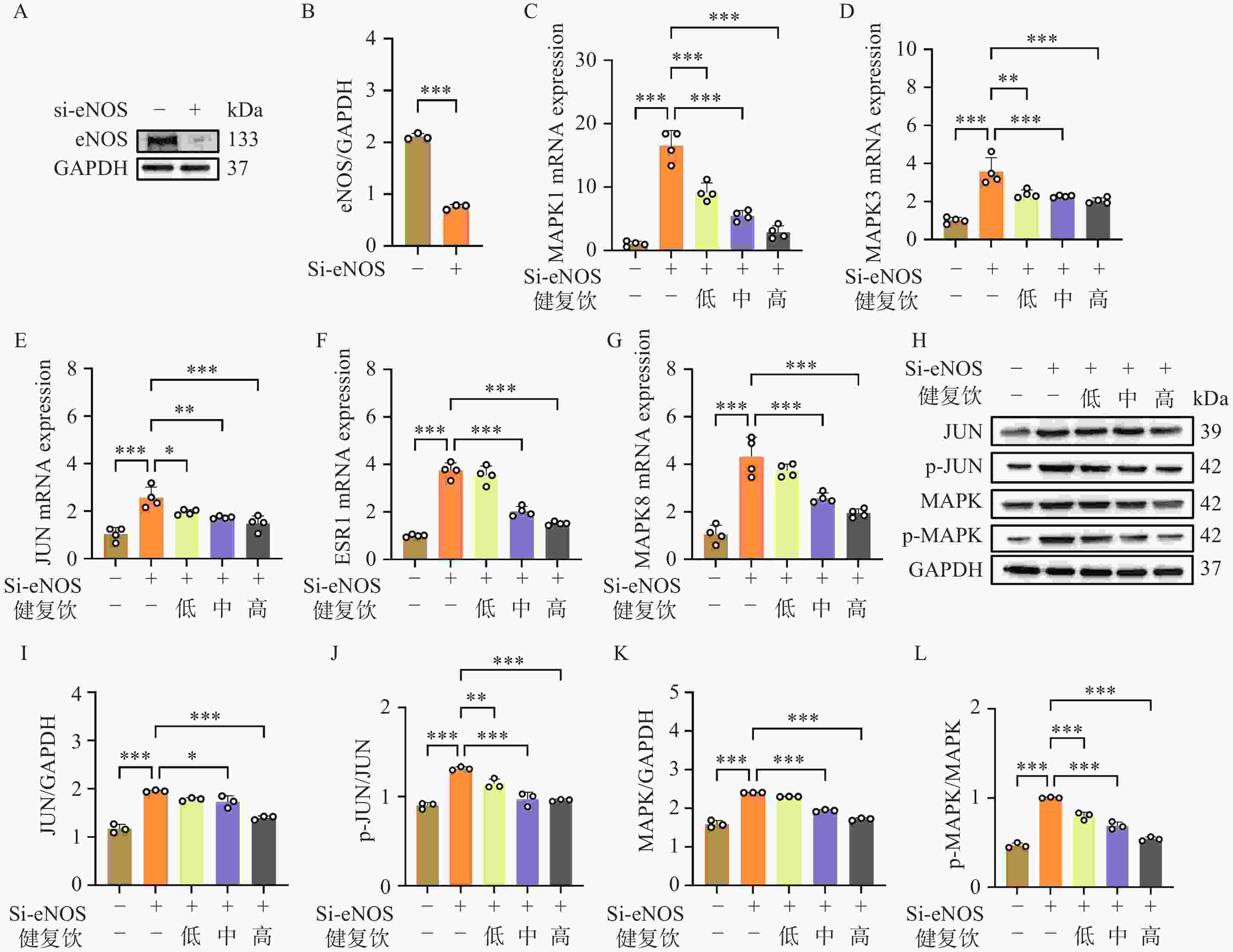
ED的主要表现为内皮功能障碍,因此我们使用小干扰RNA沉默HUVEC的eNOS基因,制备内皮细胞功能障碍模型,以此研究健复饮治疗ED的机制。我们将Si-eNOS RNA转染HUVEC细胞48 h后,提取总蛋白,利用WB检测eNOS蛋白的表达,结果发现eNOS蛋白表达降低,表明内皮功能障碍模型制备成功。接着,我们使用低、中、高三种浓度的健复饮(2.5、10、20 g/L)孵育Si-eNOS RNA转染的HUVEC细胞24 h后提取总RNA,利用QPCR检测发现,健复饮显著抑制内皮功能障碍细胞模型的MAPK1、MAPK3、JUN、ESR1、MAPK8基因表达。同时我们利用WB检测发现内皮功能障碍细胞模型MAPK和JUN蛋白的磷酸化显著增强,健复饮有效抑制MAPK和JUN蛋白的磷酸化(图6)。
-
阴茎勃起是一系列神经血管活动的结果,勃起程度取决于动脉流入血量和静脉流出血量之间的平衡,影响阴茎勃起的神经有交感神经和副交感神经,交感神经兴奋时,动脉平滑肌和海绵体小梁平滑肌收缩,进入阴茎的血量减少,阴茎松弛;相反,副交感神经兴奋时,相应的肌群舒张,流入血量增多,从而达到勃起,上述任一过程受到影响均可导致ED的发生[11]。基于此,ED又可分为器质性ED、心理性ED和混合性ED[12]。PDE5i作为ED的一线用药,其作用机制是通过抑制机体内磷酸二酯酶-5(PDE-5)的活性,从而提高海绵体内环磷酸鸟苷(CGMP)的活性和浓度,引起平滑肌松驰和阴茎勃起。虽然PDE5i已经取得公认较好的疗效,但仍有约20%~30%的患者服用后无效[13]。心理性疾病、糖尿病、动脉粥样硬化性、高血压、性腺功能减退患者往往出现PDE5i无效的情况,对于这类病因复杂的ED而言,PDE5i靶点精准的优势却演变为靶点单一的劣势,而中药复方在治疗时则呈现出整体性、系统化等优势[14]。
-
中医治疗ED具有悠久的历史和经验传承,《马王堆医术·养生方》最早描述阳痿的出土文献,称其为“老不起”。《内经》则称为“阴痿” “阴器不用”和“筋痿”。《诸病源候论》曰:“肾开窍于阴,若劳伤于肾,肾虚不能荣于阴器,故痿弱也”,《景岳全书》云:“凡男子阳痿不起,多由命门火衰,精气虚冷;或以七情劳损伤生阳之气,多致此证”,因此自古中医认为阳痿主要是因为肾精亏虚,故以肾虚为基本病机,治则以补肾固精为主。近现代医家丰富了本病病因病机的内涵,除肾虚还可能伴有肝气郁结、湿热下注、心脾不足、血瘀气滞等其他病机,从而表现为虚实夹杂之证[15-18]。周智恒教授治疗阳痿善于衷中参西,从西地那非最早用于肺动脉高压的治疗中获得灵感,提出了具有创新性的阳痿从“心”论治理论,创制出了以活血化瘀、益气强心为主治疗ED的经验方康凯饮(红花、黄芪等),该研究成果已列入上海市名医创新经验点(N2012070302)。在康凯饮基础上,周师认为现代人多有精神压力大,ED的发病多与精神情志有关,故加用疏肝理气之品,辅以补肾助阳之药,治疗阳痿从肾、心、肝三脏论治[19]。因此由康凯饮基础上增加蛇床子、枸杞子、淫羊藿、锁阳、枳实、柴胡、白蒺藜等药形成如今的健复饮组方。
-
将本研究得到的健复饮有效活性成分与ED疾病靶点交集进行PPI网络构建及Mcode模块聚类后,获得了MAPK1、MAPK3、JUN、ESR1、MAPK8等5个核心靶点。研究发现,MAPK1、MAPK3、MAPK8均是MAPK信号通路的重要组成部分,MAPK信号通路在细胞的分化、增殖及凋亡等过程中起着关键的作用。MAPK信号通路中的ERK蛋白激酶及其所属信号通路与ED的发生发展密切相关[20],ERK抑制剂可改善糖尿病小鼠海绵体舒张功能损伤[21]。JUN基因是1号染色体上的基因,这段基因的编码蛋白可以与特殊的DNA序列结合,能够调控特定基因的表达。研究显示,JUN编码蛋白c-Jun可受细胞外信号蛋白JNK诱导,引起细胞凋亡,在大鼠海绵体神经损伤后每天服用JNKi,2周后观察到c-Jun阳性凋亡细胞减少,从而改善勃起功能[20]。可以推测健复饮可能通过影响阴茎海绵体组织内JNK/c-Jun通路,进而影响到阴茎勃起功能。
-
对ED-健复饮168个交集靶点进行的GO富集分析,可以发现健复饮对于ED疾病过程中氧气水平、缺氧反应等生物过程相关度较高。缺氧性疾病患者人群中的ED的发病率显著提高,如:有研究显示,睡眠呼吸暂停综合症(OSA)的患者ED发病风险更高[22],而缺氧正是OSA患者的主要病理特征。缺氧导致ED的一项可能机制之一是氧分压降低使体内一氧化氮(NO)合成收到影响,而NO已被证实是引起男性勃起的主要神经递质。
-
对ED-健复饮168个交集靶点进行的KEGG结果分析,其中排名前10的通路中主要有:脂质与动脉粥样硬化、pi3k/akt信号通路、流体剪切应力和动脉粥样硬化。有流行病学研究显示,血清高总胆固醇、高低密度脂蛋白与ED密切相关,血脂异常是血管型 ED 的主要致病因素之一[23]。关于pi3k/akt信号通路,有研究证实,糖尿病性ED模型大鼠的阴茎海绵体平滑肌细胞内的磷脂酰肌醇3激酶(PI3K)与蛋白激酶B( AKT)表达水平较正常下降,阴茎海绵体平滑肌凋亡可能与pi3k/akt信号通路有关[24]。同时,多项有关中药单药、复方的研究均证实了其研究的药物与通过这一信号通路参与治疗糖尿病性ED[25-27]。
-
分子对接发现β-谷甾醇、山柰酚与黄芪紫檀烷苷与健复饮的核心靶点有较强的生物结合活性。研究证实,山柰酚可降低心肌酶、环氧化酶-2及血管内皮生长因子的表达以减少生物体内的氧化应激反应,因为阴茎的海绵体主要由血管结缔组织组成,所以推测山柰酚可通过修复血管等方式改善阴茎的勃起功能[28]。β-谷甾醇可以激活2型糖尿病大鼠脂肪组织中的胰岛素受体和葡萄糖转运蛋白4,从而调控大鼠血糖水平,β-谷甾醇亦能增强大鼠的勃起硬度和持续时间[29]。
-
体外实验结果表明,健复饮通过调控MAPK1、MAPK3、JUN、ESR1、MAPK8等核心靶点的基因及蛋白表达,显著改善内皮功能障碍模型细胞的病理状态。首先,通过小干扰RNA(si-eNOS)成功构建HUVEC内皮功能障碍模型,Western blot检测显示eNOS蛋白表达显著降低(图7A-B)。eNOS是合成一氧化氮(NO)的关键酶,NO作为阴茎勃起的重要信号分子,其减少直接导致海绵体平滑肌舒张功能障碍。健复饮处理后,QPCR结果显示MAPK1、MAPK3、JUN、ESR1、MAPK8的mRNA表达水平呈剂量依赖性下调(图7C-G),其中高浓度组(20 g/L)抑制作用最为显著。这表明健复饮可能通过抑制MAPK信号通路中关键激酶的转录活性,阻断下游炎症或凋亡信号的传导。此外,Western blot进一步证实,内皮功能障碍模型中JUN和MAPK蛋白的磷酸化水平显著升高(图7H-L),而健复饮处理后磷酸化水平显著降低,提示其通过抑制JNK/c-Jun和ERK/MAPK信号通路的异常激活,减少细胞凋亡并改善内皮功能。
从机制层面分析,MAPK信号通路在ED发病中扮演重要角色。ERK/MAPK通路的过度激活可诱导氧化应激和血管内皮损伤,而JNK/c-Jun通路的激活则促进细胞凋亡,两者共同导致海绵体血管功能紊乱。健复饮中的活性成分如β-谷甾醇和山柰酚已被证实具有抗氧化和抗炎特性。例如,山柰酚可通过清除自由基抑制NF-κB通路,减轻血管内皮炎症反应;β-谷甾醇则能通过调节胰岛素信号通路改善血管内皮细胞的代谢功能。此外,黄芪紫檀烷苷作为健复饮的关键成分,可能通过增强eNOS活性或稳定其表达,间接促进NO合成,从而改善海绵体血流动力学。这些多靶点作用与中医“活血化瘀、益气强心”的理论高度契合,体现了中药复方整体调节的优势。
值得注意的是,本研究仅基于HUVEC细胞模型,未来需进一步在动物模型(如糖尿病或动脉粥样硬化诱导的ED大鼠)中验证健复饮的疗效,并探索其是否通过相同机制改善海绵体组织结构及勃起功能。此外,健复饮中多种成分的协同作用机制仍需深入解析,例如通过敲除特定靶点基因或使用抑制剂阻断信号通路,明确各成分的主次贡献。体外实验为健复饮治疗ED的分子机制提供了重要证据,但其多成分、多通路、多靶点的特性仍需系统研究,以推动其临床应用与新药开发。
综上,健复饮治疗ED的主要活动表达成分和作用靶点主要涉及修复血管、改善血流动力学水平、改善细胞氧气水平等。有调查研究显示,ED患者中有72%有血管风险因素存在,并伴有血流动力学异常[30]。在中医理论中,《素问》中载有“心者,君主之官也,神明出焉” “主不明则十二官危,使道闭塞而不通,形乃大伤”等内容。王冰有注解曰:“使道,谓神气行使之道也” “心主血脉”作为“藏象”学说的一大思想,有心主血以及心主脉两个方面。心主血,表明心能生血,同时亦能行血;心主脉,说明脉络通畅则血行无阻[31]。
本研究通过体外实验证实,健复饮通过抑制MAPK/JNK等信号通路的异常激活,下调JUN、MAPK等核心靶点的磷酸化水平,减少内皮细胞凋亡并促进NO合成,从而改善海绵体血流灌注。此外,其活性成分如β-谷甾醇、山柰酚等通过多靶点协同作用,在抗氧化、抗炎及调节代谢等方面发挥综合效应,与中医“活血化瘀、益气强心”的治则高度契合。这些发现不仅从分子层面揭示了健复饮的多通路调控优势,也为“从心从肾”论治阳痿的中医理论提供了科学解释,有助于中医理论现代化,同时也为更进一步的动物实验及药物分子实验指明了方向。
Mechanism of Jianfu mixture in the treatment of erectile dysfunction based on network pharmacology analysis, molecular docking and experimental validation
-
摘要:
目的 运用网络药理学及分子对接技术探讨健复饮治疗勃起功能障碍(ED)的分子机制,通过体外实验验证健复饮治疗ED的核心靶点及作用机制。 方法 通过检索TCMSP、Batman-TCM数据库查找健复饮的活性成分、相对应的分子靶点,在GeneCards数据库上查找并下载ED的相关靶点,再对药物靶点与疾病靶点取交集。通过String数据库对交集靶间相互作用情况进行描绘分析,使用Cytoscape软件对分析结果进行可视化,确定核心靶点与对应药物活性单体;对交集靶点进行GO功能富集分析和KEGG通路富集分析;通过Cytoscape软件上的MCODE插件找到交集内的核心靶点并与对应的药物活性成分进行分子对接;构建人脐静脉内皮细胞(HUVEC)内皮功能障碍模型(si-eNOS转染);采用不同浓度健复饮干预模型细胞24 h;通过实时荧光定量PCR(QPCR)检测预测核心靶点(MAPK1、MAPK3、JUN、ESR1、MAPK8)的mRNA表达水平;Western blot分析相关蛋白(eNOS、JUN、p-JUN、MAPK、p-MAPK)表达及磷酸化水平。分析讨论健复饮治疗ED的作用机制。 结果 得到健复饮有效活性成分144个,活性成分-疾病交集靶点168个,GO分析得到2005个生物过程,151个分子功能,63个细胞组件。KEGG分析得到181条通路。筛选出MAPK1、MAPK3、JUN、ESR1、MAPK8等5个核心靶点,β-谷甾醇、山柰酚与黄芪紫檀烷苷等活性成分与核心靶点具有较好的结合力。体外实验显示,si-eNOS转染后,eNOS蛋白表达显著降低,内皮功能障碍模型构建成功;健复饮以剂量依赖性方式显著抑制MAPK1、MAPK3、JUN、ESR1、MAPK8的mRNA表达;健复饮显著降低JUN和MAPK的磷酸化水平,提示其通过抑制JNK/c-Jun和ERK/MAPK信号通路改善内皮功能。 结论 健复饮通过多靶点(MAPK/JUN/ESR1)抑制异常信号通路激活,降低内皮细胞凋亡并促进NO合成,从分子层面验证其“活血化瘀、益气强心”的中医治则。 Abstract:Objective To explore the molecular mechanism of Jianfu mixture in the treatment of erectile dysfunction (ED) by using network pharmacology and molecular docking techniques, and to validate its core targets and mechanisms through in vitro experiments. Methods The active components and corresponding molecular targets of Jianfu mixture were searched by searching TCMSP and Batman-TCM databases, and searching the disease targets of ED by using GeneCards database. Find the intersection of drug ingredient target and disease target. The interaction between intersected targets was described and analyzed by String database, and the analysis results were visualized by Cytoscape software to determine the core target and the corresponding active components. GO functional enrichment analysis and KEGG pathway enrichment analysis were performed for intersection targets; the core target within the intersection were found through MCODE plug-in on Cytoscape software and molecular docking was performed with the corresponding active ingredients. An endothelial dysfunction model was established by transfecting HUVECs with si-eNOS. Intervene with different concentrations of the Jianfu mixture for the model cells for 24 hours. QPCR was used to detect mRNA expression of core targets (MAPK1, MAPK3, JUN, ESR1, MAPK8); Western blot was used to analyze protein expression (eNOS, JUN, p-JUN, MAPK, p-MAPK) and phosphorylation levels. Results 144 effective active components and 168 active components target-disease targe intersection of Jianfu mixture were obtained. GO analysis revealed 2005 biological processes, 151 molecular functions, and 63 cellular components. KEGG analysis yielded 181 pathways. 5 core targets including MAPK1, MAPK3, JUN, ESR1 and MAPK8 were screened out. The active components such as β-sitosterol, kaempferol, astapterocarpan had good binding affinity with the core target. In vitro experiments confirmed successful construction of the endothelial dysfunction model (eNOS expression significantly decreased after si-eNOS transfection). Jianfu mixture dose-dependently inhibited mRNA expression of MAPK1, MAPK3, JUN, ESR1, and MAPK8. Additionally, it reduced phosphorylation levels of JUN and MAPK, indicating inhibition of the JNK/c-Jun and ERK/MAPK signaling pathways to improve endothelial function. Conclusion Jianfu mixture treats ED by suppressing abnormal activation of multi-target signaling pathways (MAPK/JUN/ESR1), reducing endothelial apoptosis, and promoting NO synthesis. This mechanism aligns with the traditional Chinese medicine principle of “activating blood circulation, resolving stasis, tonifying Qi, and strengthening cardiovascular function.” The study provides molecular-level evidence for the therapeutic efficacy of Jianfu mixture in ED management. -
表 1 引物序列
基因名 引物 Human GAPDH F: CTTAGCACCCCTGGCCAAG
R: TGGTCATGAGTCCTTCCACGHuman MAPK1 F: TACACCAACCTCTCGTACATCG
R: CATGTCTGAAGCGCAGTAAGATTHuman MAPK3 F: CTACACGCAGTTGCAGTACAT
R: CAGCAGGATCTGGATCTCCCHuman JUN F: TCCAAGTGCCGAAAAAGGAAG
R: CGAGTTCTGAGCTTTCAAGGTHuman ESR1 F: GGGAAGTATGGCTATGGAATCTG
R: TGGCTGGACACATATAGTCGTTHuman MAPK8 F: TCTGGTATGATCCTTCTGAAGCA
R: TCCTCCAAGTCCATAACTTCCTT表 2 Mcode聚类信息
模块 Mcode分值 节点/边 基因 模块1 7.429 8/26 ESR1,MAPK1,MAPK8,MAPK14,FOS,MAPK3,JUN,ESR2 模块2 4 9/16 CDK4,ELK1,PRKCA,CDK2,CDKN1A,CASP3,CCND1,PCNA,PRKCB 模块3 4 4/6 ERBB3,EGF,EGFR,ERBB2 模块4 4 4/6 MMP3,MMP9,MMP1,TIMP1 模块5 3.667 13/22 PARP1,TNF,BCL2,AKT1,RELA,NFKBIA,IKBKB,TP53,CASP9,BAX,CASP7,CHUK,XIAP 模块6 3.333 4/5 GSTP1,CYP1A1,GSTM1,CYP1A2 模块7 3 3/3 MAOA,MAOB,CYP3A4 模块8 3 3/3 PTGS2,ALOX5,PTGS1 表 3 核心靶点-对应活性分子对接结合能
靶点名称 成分名称 结合能(kcal/mol) JUN β-谷甾醇(Beta-sitosterol) −6.75 ESR1 黄芪紫檀烷苷(Astapterocarpan) −5.7 MAPK8 山柰酚(Kaempferol) −5.54 ESR1 刺芒柄花素(Formononetin) −4.86 ESR1 香风草苷(Didymin) −4.85 JUN 刺芒柄花素(Formononetin) −4.76 MAPK1 木犀草素(Luteolin) −4.74 ESR1 淫羊藿新苷A(Yinyanghuo A) −4.67 ESR1 金圣草黄素(Chryseriol) −4.64 ESR1 8-(3-methylbut-2-enyl)-2-phenyl-chromone −4.62 ESR1 苜蓿素(Tricin) −4.5 MAPK1 槲皮素(Quercetin) −4.31 MAPK8 川陈皮素(Nobiletin) −4.16 JUN 山柰酚(Kaempferol) −4.03 JUN 木犀草素(Luteolin) −3.9 JUN 川陈皮素(Nobiletin) −3.82 JUN 槲皮素(Quercetin) −3.65 MAPK3 柚皮素(Naringenin) 2.23 -
[1] 中国中西医结合学会男科专业委员会. 勃起功能障碍中西医结合诊疗指南(试行版)[J]. 中华男科学杂志, 2016, 22(8):751-757. [2] FELDMAN H A, GOLDSTEIN I, HATZICHRISTOU D G, et al. Impotence and its medical and psychosocial correlates: results of the Massachusetts Male Aging Study[J]. J Urol, 1994, 151(1):54-61. doi: 10.1016/S0022-5347(17)34871-1 [3] 中华医学会男科学分会勃起功能障碍诊断与治疗指南编写组. 勃起功能障碍诊断与治疗指南[J]. 中华男科学杂志, 2022, 28(8):722-755. [4] 王启新, 卢文吉, 孟慧, 等. 男性勃起功能障碍机制及中医药防治进展[J]. 中国中医基础医学杂志, 2020, 26(10):1578-1581. doi: 10.3969/j.issn.1006-3250.2020.10.048 [5] SOMMER F, ENGELMANN U. Future options for combination therapy in the management of erectile dysfunction in older men[J]. Drugs Aging, 2004, 21(9):555-564. doi: 10.2165/00002512-200421090-00001 [6] CARSON C, GIULIANO F, GOLDSTEIN I, et al. The ‘effectiveness’ scale: therapeutic outcome of pharmacologic therapies for ED: an international consensus panel report[J]. Int J Impot Res, 2004, 16(3):207-213. doi: 10.1038/sj.ijir.3901227 [7] 郁超, 曹宏文, 冯懿赓, 等. 健复饮联合西地那非治疗迟发性性腺功能减退症伴难治性勃起功能障碍的临床研究[J]. 上海中医药杂志, 2016, 50(2):42-44,48. [8] RU J L, LI P, WANG J N, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014, 6:13. doi: 10.1186/1758-2946-6-13 [9] LI J S, ZHAO P, LI Y, et al. Systems pharmacology-based dissection of mechanisms of Chinese medicinal formula Bufei Yishen as an effective treatment for chronic obstructive pulmonary disease[J]. Sci Rep, 2015, 5:15290. doi: 10.1038/srep15290 [10] 汤柳, 陈君茹, 张玲莉, 等. 基于网络药理学和分子对接技术探讨蛇床子治疗湿疹的作用机制[J]. 现代药物与临床, 2023, 38(03):540-546. [11] 王华. 血管活性肠多肽与阴茎勃起调控[J]. 国外医学. 泌尿系统分册, 2002(06):343-345. [12] HATZIMOURATIDIS K, AMAR E, EARDLEY I, et al. Guidelines on male sexual dysfunction: erectile dysfunction and premature ejaculation[J]. Eur Urol, 2010, 57(5):804-814. doi: 10.1016/j.eururo.2010.02.020 [13] 孙祥宙, 邓春华. 安特尔联合万艾可治疗对万艾可无效的中老年勃起功能障碍28例[J]. 中国男科学杂志, 2004, 18(3):42-43. doi: 10.3969/j.issn.1008-0848.2004.03.019 [14] 赵凡, 李海松, 张春和, 等. 难治性勃起功能障碍中西医结合防治策略述评[J]. 中华中医药杂志, 2023, 38(09):4013-4021. [15] 李海松, 李曰庆. 勃起功能障碍中医病因病机探析[J]. 中国性科学, 2005(04):13-14+17. doi: 10.3969/j.issn.1672-1993.2005.04.004 [16] 孙自学, 李鹏超. 勃起功能障碍的中医诊疗思路探析[J]. 辽宁中医杂志, 2019, 46(05):970-972. doi: 10.13192/j.issn.1000-1719.2019.05.024 [17] 王琦, 倪平, 吴卫平, 等. 疏肝益阳胶囊治疗勃起功能障碍的作用机理研究[J]. 中国中药杂志, 2005(01):59-64. doi: 10.3321/j.issn:1001-5302.2005.01.018 [18] 赵伟, 孙志兴, 章茂森, 等. 徐福松阳痿分型证候标准量化研究[J]. 中华男科学杂志, 2018, 24(10):911-915. [19] 郁超, 陈磊, 冯懿赓, 等. 周智恒辨治泌尿男科疾病经验举隅[J]. 上海中医药杂志, 2014, 48(7):17-19,43. [20] 陈思翔, 赵凡. MAPK信号通路与勃起功能障碍关系的研究进展[J]. 中华男科学杂志, 2018, 24(5):442-446. [21] NUNES K P, TOQUE H A, CALDWELL R B, et al. Extracellular signal-regulated kinase (ERK) inhibition decreases arginase activity and improves corpora cavernosal relaxation in streptozotocin(STZ)-induced diabetic mice[J]. J Sex Med, 2011, 8(12):3335-3344. doi: 10.1111/j.1743-6109.2011.02499.x [22] 地里亚尔·地里夏提, 陈梓洋, 韩丰阳, 等. 阻塞性睡眠呼吸暂停与勃起功能障碍发病风险的Meta分析[J]. 中国男科学杂志, 2023, 37(6):85-90. doi: 10.3969/j.issn.1008-0848.2023.06.013 [23] 贺占举, 金杰, 张凯. 血脂异常与勃起功能障碍[J]. 中国性科学, 2009, 18(2):6-8,11. doi: 10.3877/j.issn.1672-1993.2009.02.002 [24] 岳增宝, 马文君, 秦茂, 等. 补肾活血方治疗大鼠糖尿病性勃起功能障碍的机理[J]. 北京中医药大学学报, 2015, 38(7):462-466. doi: 10.3969/j.issn.1006-2157.2015.07.008 [25] 冯隽龙, 李海松, 王继升, 等. 基于PI3K/AKT/mTOR信号通路探讨水蛭蜈蚣药对改善糖尿病勃起功能障碍大鼠的作用机制[J]. 北京中医药大学学报, 2021, 44(12):1118-1125. doi: 10.3969/j.issn.1006-2157.2021.12.009 [26] 刘黎明, 王新平, 张爱平, 等. 基于PI3 K/A kt信号通路探讨地龙蛋白改善糖尿病大鼠勃起功能障碍的作用机制[J]. 中国男科学杂志, 2023, 37(3):26-34. doi: 10.3969/j.issn.1008-0848.2023.03.005 [27] 蔚文垚, 曹继刚, 邓超, 等. 基于网络药理学及分子对接技术探讨四逆散治疗勃起功能障碍的作用机制[J]. 河南中医, 2022, 42(10):1492-1500. [28] PONNULAKSHMI R, SHYAMALADEVI B, VIJAYALAKSHMI P, et al. In silico and in vivo analysis to identify the antidiabetic activity of beta sitosterol in adipose tissue of high fat diet and sucrose induced type-2 diabetic experimental rats[J]. Toxicol Mech Methods, 2019, 29(4):276-290. doi: 10.1080/15376516.2018.1545815 [29] WATCHO P, ZELEFACK F, NGOUELA S, et al. Enhancement of erectile function of sexually naïve rats by β–sitosterol and α–β–amyrin acetate isolated from the hexane extract of Mondia whitei[J]. Asian Pac J Trop Biomed, 2012, 2(3):S1266-S1269. doi: 10.1016/S2221-1691(12)60397-9 [30] 张翠红. 192例勃起功能障碍患者动脉粥样硬化危险因子与血流动力学关系调查[C]//中国超声医学工程学会(Chinese Association of Ultrasound in Medicine and Engineering). 中国超声医学工程学会第十二届全国腹部超声医学学术大会论文汇编. 华中科技大学同济医学院附属协和医院超声影像科湖北省分子影像重点实验室;, 2018: 175. [31] 王丽丹, 李文杰. 心主血脉理论考析[J]. 辽宁中医杂志, 2018, 45(6):1173-1176. -




 下载:
下载: