-
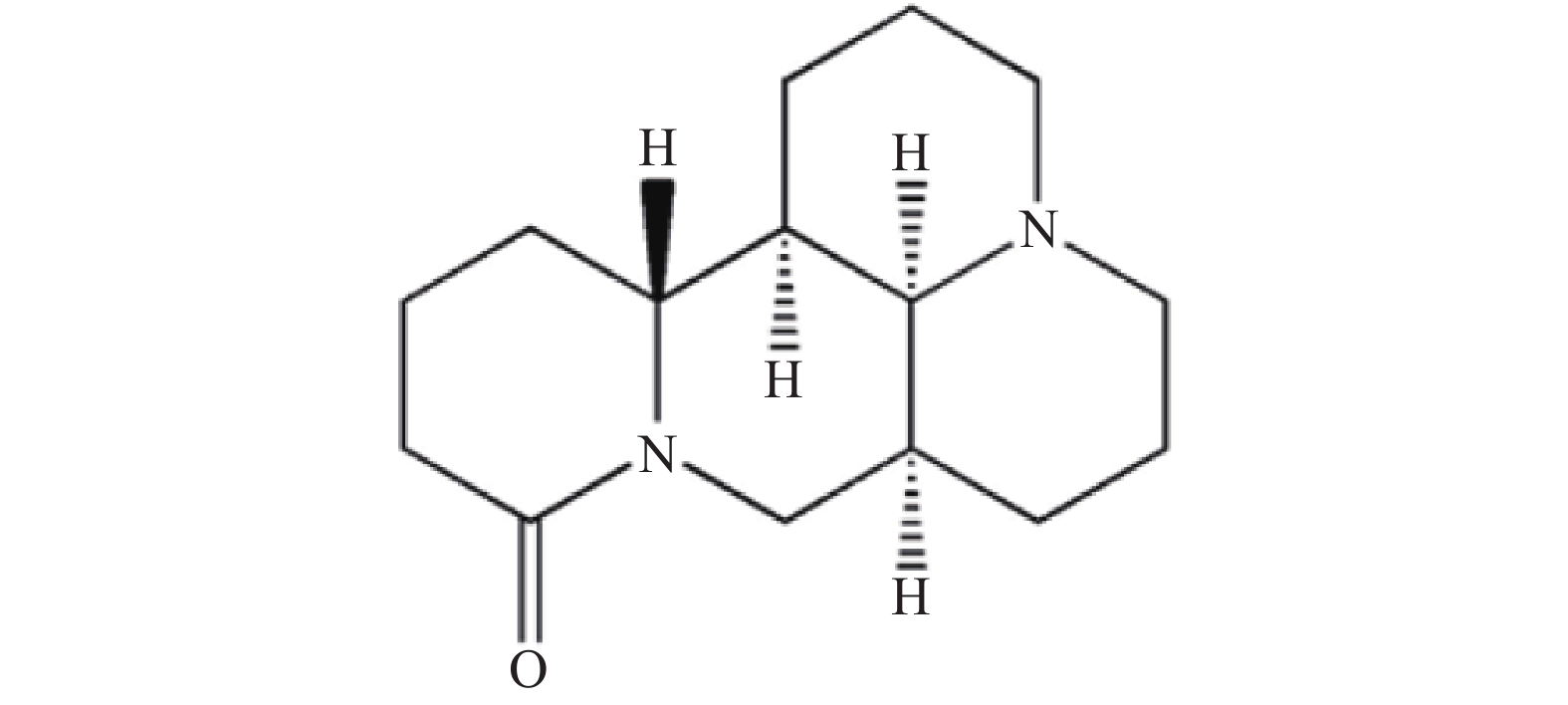
苦参碱(Matrine)是传统中药苦参的主要活性成分[1],是从苦参根中提取的生物碱类化合物,属于喹诺里西啶类生物碱,其化学结构见图1。苦参碱具有广泛的药理活性,包括抗肿瘤、抗病毒、抗纤维化、抗糖尿病、抗心衰、抗血小板和抗动脉粥样硬化等[2-4]。苦参碱存在着生物利用度低、化学稳定性差、生物毒性较高等一系列问题[5-6]。人们通过对苦参碱D环C-13、C-14和C-15位点的修饰,以及使D环的放开或融合等方法[7-9],获得了一系列活性更高、毒性更低的苦参碱衍生物,如硫代苦参碱[10]、13-羟基乙胺苦参碱[11]、13-酰胺基取代苦参碱[12]等。目前,对于苦参碱衍生物的研究多聚焦于抗肿瘤的活性,充分了解并探索其抗炎活性及机制,有助于人们开发苦参碱衍生物在炎症性疾病中的应用。本文将就苦参碱及衍生物的抗炎作用及其机制进行综述,为药物研发及临床应用提供理论支持。
-
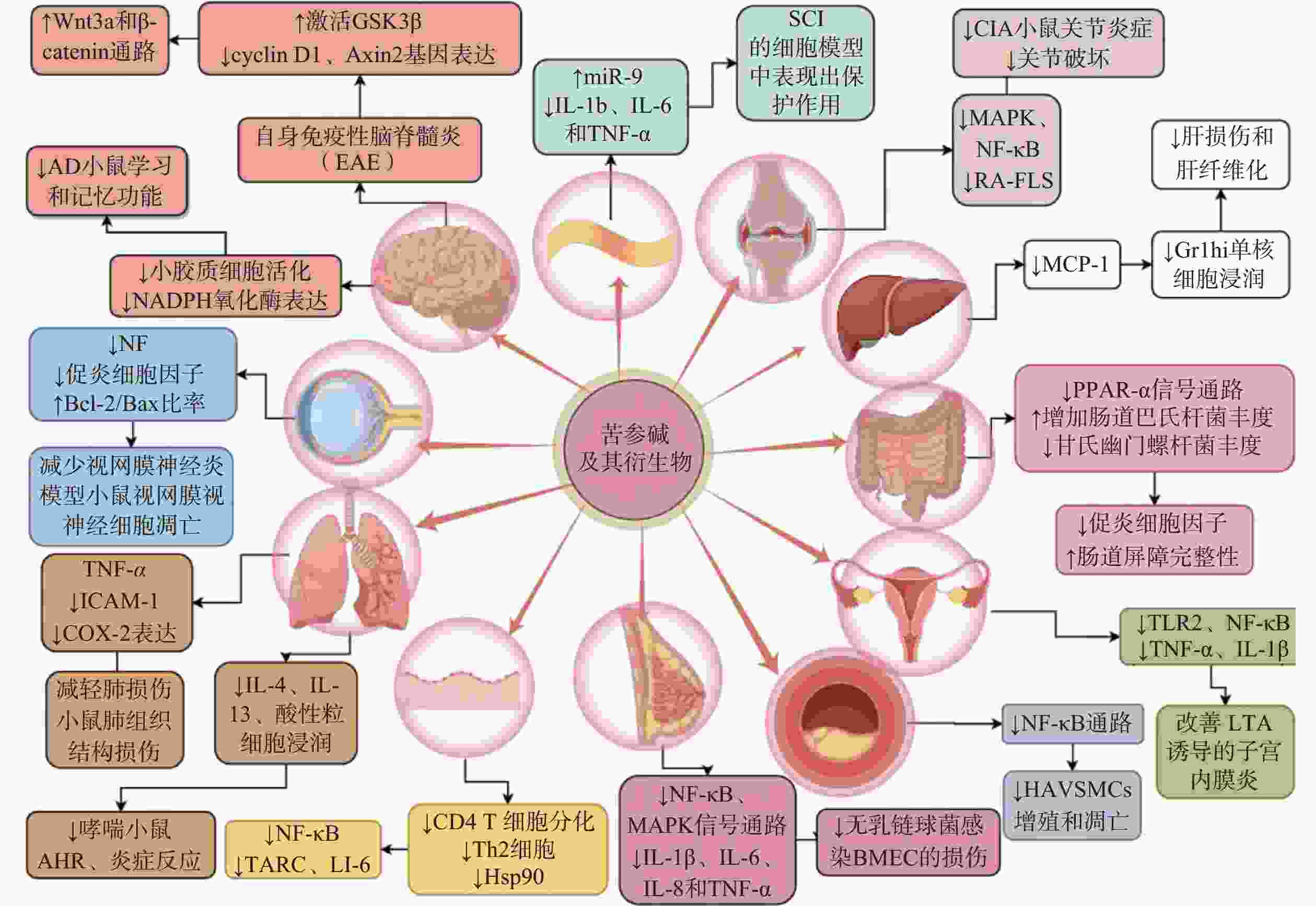
炎症是一种高度受控的过程,它被多种信号通路调控以维持机体的稳态[13]。苦参碱及其衍生物可能通过调节多种细胞信号通路或分子靶标在多系统炎症性疾病中发挥治疗作用(图2)。
-
苦参碱可以通过抑制髓鞘少突胶质细胞糖蛋白MOG35-55诱导的自身免疫性脑脊髓灰质炎(EAE)小鼠中枢神经中Wnt 家族成员 3A(Wnt3a)和β-连环蛋白(β-catenin)活化,激活糖原合成酶激酶-3β(GSK-3β),降低Wnt3a/β-catenin通路中的两个靶基因G1/S-特异性周期蛋白-D1(cyclin-D1)和Axis抑制蛋白2(Axin2)的表达,促进少突胶质细胞(OL)的成熟和髓鞘修复功能,从而改善多发性硬化症(MS)动物模型的神经功能缺损[14]。苦参碱也可以通过抑制Ⅰ型星形胶质细胞的增殖与浸润,有效减轻中枢神经系统炎症促进神经再生,显著改善EAE 的临床评分[15]。
在阿尔茨海默病(AD)小鼠模型中,科研人员发现苦参碱可以降低海马组织中小胶质细胞的活性氧(ROS)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和IL-6水平,显著改善AD模型小鼠的学习和记忆功能[16]。
在脊髓损伤(SCI)的体外实验中,有研究发现苦参碱能够上调miR-9的表达来抑制c-Jun氨基末端激酶(JNK)和核因子κB(NF-κB)通路,并抑制IL-1β、IL-6和TNF-α的释放,保护大鼠肾上腺嗜铬细胞瘤细胞(PC 12)免受脂多糖(LPS)诱导的炎症损伤[17]。
此外,苦参碱还能够通过增加视神经中神经丝蛋白(NFs)的表达,降低Iba1细胞(巨噬细胞/小胶质细胞)数量,上调B淋巴细胞瘤-2(Bcl-2)/BCL2相关X蛋白(Bax)的比率,从而减少炎性浸润、脱髓鞘和视网膜神经节细胞凋亡[18]。
-
有研究表明,苦参碱可以通过抑制急性肺损伤模型中单核细胞趋化蛋白-1(MCP-1)、IL-6和IL-8的表达,改善造模小鼠的肺组织损伤程度[19]。
在卵清蛋白(OVA)诱导的过敏性哮喘小鼠模型中,人们发现苦参碱可以通过抑制嗜酸性粒细胞趋化因子和Th2细胞因子的产生,显著降低哮喘小鼠的嗜酸性粒细胞浸润、减轻气道高反应性和气道炎症[20]。在过敏性哮喘小鼠模型和TNF-α诱导的人气管上皮细胞实验中,苦参碱可以减少IL-4、IL-6、IL-13和粘附分子的表达,抑制模型小鼠上皮细胞中的细胞因子信号传导抑制因子3 (SOCS3)表达,改善OVA诱导引发的气道高反应性、炎症细胞浸润、杯状细胞分化和黏液产生, 减少气管上皮细胞中促炎细胞因子的产生, 达到缓解哮喘症状的效果[21]。
-
苦参碱可以抑制过氧化物酶增殖物激活受体-α(PPAR-α)信号通路,增加肠道巴氏杆菌的丰度,降低甘氏幽门螺杆菌的丰度[22]。在葡聚糖硫酸钠(DSS)诱导的溃疡性结肠炎小鼠模型中,苦参碱可以显著抑制炎性细胞因子水平,改善肠道屏障的完整性。
苦参碱衍生物能通过抑制MCP-1的产生和活性,减少炎症性Gr1hi单核细胞在肝脏中的浸润,从而明显减轻四氯化碳(CCl4)诱导的急性肝损伤和肝纤维化[23]。
-
在胶原诱导的关节炎(CIA)小鼠模型中,人们观察到苦参碱衍生物MASM通过丝裂原活化蛋白激酶(MAPK)和NF-κB通路抑制炎症介质表达,诱导成纤维样滑膜细胞(RA-FLS)的凋亡来减轻CIA小鼠的关节炎严重程度,降低了CIA小鼠的炎症和关节破坏程度[24]。
-
动脉粥样硬化是一种慢性炎症性疾病,与炎症反应以及血管平滑肌细胞不受控制的增殖和过度凋亡有关。研究发现,苦参碱通过抑制NF-κB通路,降低氧化低密度脂蛋白(oxLDL)诱导的动脉粥样硬化模型中人主动脉血管平滑肌细胞的增殖和凋亡,表现出抗炎作用[25]。
在缺氧性肺动脉高压(HPAH)模型中,炎性细胞因子可浸润肺动脉血管,使肺动脉平滑肌细胞异常增殖,导致肺血管重构。人们发现苦参碱可降低大鼠α平滑肌肌动蛋白和肺动脉介质中增殖细胞核抗原(PCNA)的表达,降低TNF-α和IL-1β水平,将细胞周期延缓在S期,并降低p50、p65、PCNA、Bcl-2的表达,逆转缺氧诱导的肺动脉平滑肌细胞(PASMCs)增殖和凋亡的失衡,降低大鼠右心室收缩压和平均肺动脉压,改善缺氧诱导的肺血管重塑(PVR)[26]。
-
苦参碱可以提高小鼠调节性T细胞(Treg)细胞比例,降低CD4+/CD8+比例,减轻移植心脏的炎性细胞浸润,延长心脏移植小鼠的存活时间。更重要的是,苦参碱可以下调NF-κB通路,上调ERK 1/2信号通路,抑制小鼠树突状细胞(DCs)成熟,减少同种异体心脏的氧化损伤和凋亡[27]。
研究发现,在特应性皮炎(AD)小鼠模型和TNF-α/IFN-γ处理的人表皮角质形成细胞(HaCaT)模型中,苦参碱可以减少T淋巴细胞和肥大细胞浸润,抑制CD4+ T细胞分化,调节Th1/Th2炎症反应,抑制Hsp90/NF-κB信号轴来抑制TNF-α/IFN-γ处理的HaCaT细胞炎性因子分泌,从而减轻AD的症状[28]。
无乳链球菌是牛乳腺炎的主要致病菌,在其诱导的乳腺炎体外模型中,可导致牛乳腺上皮细胞 (BMEC)细胞凋亡,研究发现,苦参碱可以抑制NF-κB和MAPK信号通路,显著下调IL-1β、IL-6、IL-8和TNF-α等促炎细胞因子的产生并预防BMEC细胞损伤[29]。
在金黄色葡萄球菌脂磷壁酸(LTA)诱导的小鼠子宫内膜炎模型中,苦参碱可以抑制Toll样受体2(TLR2)的表达及其下游NF-κB的活化,降低TNF-α和IL-1β的表达,发挥对子宫内膜细胞的保护作用[30]。在临床试验中,应用苦参碱治疗慢性盆腔炎,苦参碱组患者的血清TNF-α、IL-1β和IL-6水平显著低于对照组,苦参碱组疗效明显优于对照组[31]。
-
在肽聚糖、脂蛋白等因子的刺激作用下,巨噬细胞发生极化并表现出两种主要表型M1和M2。其中,M1型巨噬细胞产生炎性细胞因子,M2型巨噬细胞则参与炎症的消退和修复[3]。研究表明,苦参碱可以抑制M1巨噬细胞侵袭与浸润,促进M1型巨噬细胞向M2型转化,降低M1/M2的比例,发挥抗炎作用[32]。
中性粒细胞是炎症反应的重要调节剂,它能够表达和产生多种细胞因子参与炎症过程,如IL-1β、IL-6和IL-17等。这些细胞因子在疾病的炎症反应中发挥重要作用。有研究表明,在香烟烟雾暴露诱导的肺炎小鼠模型中,苦参碱能够显著降低其支气管肺泡灌洗液 (BALF) 中嗜中性粒细胞数量,减轻肺部炎症和损伤。进一步研究发现, 苦参碱不是参与抑制中性粒细胞相关的细胞因子及趋化因子, 而是通过诱导中性粒细胞凋亡来起到调节炎症反应的作用[33]。 此外, 苦参碱也可以通过抑制细胞间黏附分子-1(ICAM-1)、 血管细胞粘附分子-1(VCAM-1)来减少中性粒细胞与病变组织的黏附改善炎症反应[34]。
-
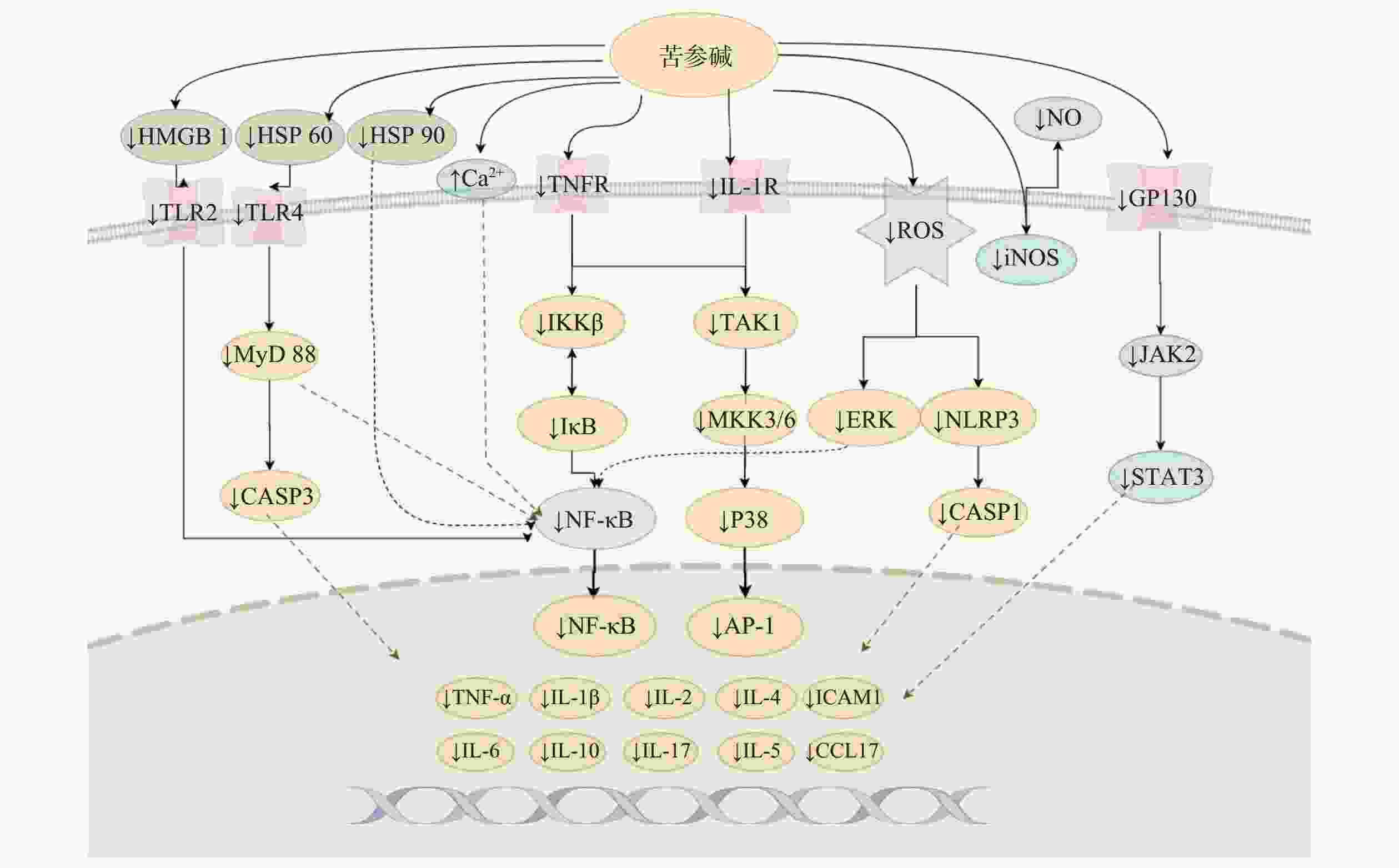
苦参碱及衍生物可以抑制包括NF-κB、JAK2/STAT3、MKK/p38 MAPK信号通路在内的多种炎症信号通路的激活,从而减少炎症因子的分泌,起到抗炎的效果,这也是苦参碱及衍生物发挥抗炎作用的最主要机制。其对各通路的影响汇总并阐述如下(图3)。
-
一氧化氮(NO)是人体内重要的调节分子,诱导型一氧化氮合酶(iNOS)是产生NO的上游调节因子。多种炎症刺激可触发iNOS产生NO,并引发炎症反应。有研究表明,在LPS刺激的RAW 264.7细胞中,氧化苦参碱可以显著抑制iNOS的过表达,从而减少NO水平[35]。
-
NF-κB通路在许多生物过程的调节中起着至关重要的作用,是一种典型的促炎症信号通路,与炎症因子TNF和IL的分泌密切相关[27]。苦参碱可以通过刺激上调钙敏感受体的表达,来抑制NF-κB信号通路的激活,从而保护肠脏器并恢复肠屏障的完整性[36]。
氧化苦参碱能够抑制NF-κB和MAPKs信号通路,显著减轻LPS诱导的乳腺损伤[37];苦参碱可以上调miRNA-9的表达,通过抑制JNK和NF-κB通路,从而改善LPS诱导的PC 12细胞炎症损伤,减轻小鼠脊髓损伤的继发性损伤[17]。苦参碱通过NF-κB通路减弱HAVSMCs中的异常生物反应,减少oxLDL诱导的血管平滑肌细胞异常增殖和过度凋亡,表现出抗炎作用[25]。苦参碱衍生物MASM可显著减轻LPS诱导的小鼠腹腔巨噬细胞和RAW264.7细胞中NF-κB通路的激活,减少了TNF-α、IL-6和NO/iNOS的释放[38]。苦参碱也可以通过抑制NF-κB和MAPK途径的活化,抑制LPS刺激的人肺上皮A549细胞中环氧合酶-2(COX-2)和ICAM-1的转录和表达[19]。
-
JAK2/STAT3通路的异常激活与一些炎性疾病的进展密切相关,包括关节炎、肝炎、肾炎和溃疡性结肠炎等。苦参碱可阻断JAK2/STAT3信号通路,抑制DSS诱导的肠上皮细胞促炎因子水平、髓过氧化物酶(MPO)活性、NO产生和细胞凋亡[39]。苦参碱能够抑制脓毒症诱导的沉默信息调节因子1(SIRT-1)下调和NF-κB p65亚基和p53的去乙酰化,减少肺中M1型巨噬细胞的浸润数量,增加M2型巨噬细胞浸润,减轻脓毒症诱导的肺损伤 [32]。
-
P38 MAPK信号通路在许多细胞类型中诱导炎症反应。p38 MAPK的激活依赖于其上游激酶MKK3和MKK6的磷酸化。研究发现ox-LDL暴露后显著促进MKK3、MKK6和p38的磷酸化,激活p38 MAPK炎症信号通路。而苦参碱能够通过抑制MKKs/p38 MAPK信号通路来减轻ox-LDL诱导的炎症,减少ox-LDL诱导的THP-1细胞ROS产生,发挥抗炎作用[3]。苦参碱能够抑制无乳链球菌诱导的BMEC细胞NF-κB、IκBα、p38和ERK磷酸化水平升高,抑制IL-1β、IL-6、IL-8和TNF-α的mRNA,减少无乳链球菌感染引起的BMEC损伤[29]。
-
TLR4位于多种促炎细胞表面,是炎症反应中的主要受体。LPS激活免疫细胞中的TLR4启动信号级联,触发NF-κB通路的激活,从而导致后续一系列细胞因子和炎症介质的产生。研究发现,氧化苦参碱可以通过抑制TLR4的表达而减少NF-κB的活化,下调TLR4/NF-κB通路,抑制LPS刺激诱导的炎症反应[35]。炎症介质高迁移率族蛋白1(HMGB 1)是一种非组蛋白DNA结合蛋白,具有多种生物学效应,在炎症过程中,HMGB1可以通过结合TLR4,从而激活NF-κB信号通路,促进促炎细胞因子的转录。自身免疫性脑脊髓炎的发生发展便与这一通路的激活密切相关,有研究发现,苦参碱可抑制HMGB1/TLR4/NF-κB信号传导,减少炎症因子的产生,抑制炎性细胞浸润,从而减轻脑脊髓炎模型小鼠的炎性损伤[40]。
-
热休克蛋白60(HSP 60)于细胞外释放结合TLR4,可以刺激神经元细胞加重炎症反应。苦参碱可以通过抑制HSP60/TLR4/MyD88信号传导通路,抑制LPS诱导的小胶质细胞活化,发挥神经保护和抗炎作用[41]。苦参碱可以抑制炎性细胞因子-胸腺活化调节趋化因子TARC/CCL17和IL-6分泌,改善AD小鼠的炎症反应;苦参碱还可以通过抑制 Hsp90/NF-κB 信号轴来调节 Th1/Th2 炎症反应,从而缓解特应性皮炎[28]。
-
苦参碱是从传统中药中提取出来的一种天然成分,具有相当大的药用价值。目前在炎症相关疾病中研究较为深入的苦参碱类生物碱主要包括苦参碱、氧化苦参碱、槐果碱3种。三者之中,苦参碱在多系统多器官的炎症性疾病中都有广泛研究;氧化苦参碱在支气管哮喘[42]、溃疡性结肠炎[43]的动物模型中表现出了一定的治疗效果;槐果碱则主要在类风湿性关节炎[44]、脓毒症[45]的动物模型中表现出了疗效。考虑到成药性,苦参碱的药理活性低、体内药效维持时间短,其临床应用局限很大,仅能偶尔作为辅助药物使用。因此,研究人员对苦参碱进行了结构修饰,提高了其药理活性,改善了其药代动力学特点,苦参碱衍生物在动物实验中表现出了明确的有效性和安全性。例如,苦参碱衍生物MASM已被证实在小鼠关节炎[24]和脓毒症等模型[38]中表现出较好的治疗效果。在实际临床工作中,对于严重感染引发的急危重症脓毒症,患者的致残致死率极高,给临床工作带来极大困难,如果联合应用安全有效的苦参碱衍生物可能会取得很好的疗效,苦参碱衍生物的临床应用前景值得期待。
与此同时,目前对于苦参碱及其衍生物在抗炎机制研究还不够深入,目前大部分研究还是集中在其抑制炎症相关通路(如NO、NF-κB、MAPK等)以及减少炎症因子分泌(IL-1β、IL-6、TNF-α等)的探讨上,缺乏对其特异性靶点的探索。此外,目前合成苦参碱衍生物通常需要经过多步合成反应,制备工艺还相对复杂,且有些合成产物的稳定性差,易被氧化或降解,距离产业化和临床应用还有较长的一段路要走。综上所述,苦参碱及其衍生物在炎症相关疾病中的应用是一个富有前景的研究方向,仍有许多极富价值的课题有待科研人员去探索和解决。
Research progress on anti-inflammatory effect and mechanism of matrine and its derivatives
-
摘要: 苦参碱是从中药植物苦参中分离提取的一种生物碱化合物,具有抗肿瘤、抗炎和抗病毒等作用,由于体内活性低、疗效时间短、毒副作用大等因素,其临床应用受到限制。为解决这一问题,药物专家对苦参碱的结构进行修饰获得其衍生物,以改善其缺点。目前,对苦参碱及衍生物抗肿瘤的研究比较多,在炎症性相关疾病中的研究还有待进一步加强。该文综述了苦参碱及衍生物在改善炎症性疾病中的作用及机制的研究进展,为苦参碱类药物研发提供线索。Abstract: Matrine is an alkaloid compound isolated and extracted from the traditional Chinese medicinal plant Sophora flavescens, which has anti-tumor, anti-inflammatory, and anti-viral effects. However, its clinical application has been limited due to its low in vivo activity, short duration of efficacy, and significant toxic side effects. In response to this challenge, pharmaceutical experts modified the structure of Matrine to obtain derivatives that addressed its limitations. Currently, research on the anti-tumor effects of Matrine and its derivatives is more prevalent, while research in inflammatory-related diseases still needs further strengthening.The progress on the role and mechanism of Matrine and its derivatives in inflammatory diseases were summarized in this paper, which offered valuable insights for the development of therapeutic agents based on Matrine.
-
Key words:
- Matrine /
- derivatives /
- anti-inflammatory action /
- signal pathway
-
[1] Bing B G, Li W, Lin Z L, et al. Beneficial effects of oxymatrine from sophora flavescens on alleviating by improving inflammation and ferroptosis[J]. J Ethnopharmacology, 2024, 332:118385. doi: 10.1016/j.jep.2024.118385 [2] ZHANG H, CHEN L L, SUN X P, et al. Matrine: a promising natural product with various pharmacological activities[J]. Front Pharmacol, 2020, 11:588. doi: 10.3389/fphar.2020.00588 [3] ZHOU J L, MA W X, WANG X C, et al. Matrine suppresses reactive oxygen species(ros)-Mediated MKKs/p38-Induced inflammation in oxidized low-density lipoprotein(ox-LDL)-Stimulated macrophages[J]. Med Sci Monit, 2019, 25:4130-4136. doi: 10.12659/MSM.917151 [4] CHEN F Y, PAN Y X, XU J, et al. Research progress of matrine’s anticancer activity and its molecular mechanism[J]. J Ethnopharmacol, 2022, 286:114914. doi: 10.1016/j.jep.2021.114914 [5] XIONG X Y, YU H J, NAN Y F, et al. A highly sensitive chemiluminescence method and application in rapid pharmacokinetic study of matrine in rat plasma[J]. Curr Pharm Anal, 2017, 13:452-461. [6] GU Y, LU J, SUN W, et al. Oxymatrine and its metabolite matrine contribute to the hepatotoxicity induced by Radix Sophorae Tonkinensis in mice[J]. Exp Ther Med, 2019, 17:2519-2528. [7] LI L, MA L, WANG D, et al. Design and synthesis of matrine derivatives as novel anti-pulmonary fibrotic agents via repression of the TGFβ Smad pathway[J]. Molecules, 2019, 24:1108. doi: 10.3390/molecules24061108 [8] WEI J, LIANG Y, WU L, et al. Design synthesis molecular docking and tumor resistance reversal activity evaluation of matrine derivative with thiophene structure[J]. Molecules, 2021, 26:417. doi: 10.3390/molecules26020417 [9] LAN XU, ZHAO JUN NAN, ZHANG YING. Oxymatrine exerts organ- and tissue-protective effects by regulating inflammation, oxidative stress, apoptosis, and fibrosis: from bench to bedside[J]. Pharmacol Res, 2020, 151: 104541. [10] 刘超.苦参碱衍生物M19的芳香化结构修饰以及骨靶向前药研究[D]. 上海: 中国人民解放军海军军医大学, 2020. [11] 戴航, 孙朋, 杜同同, 等.13-羟乙胺苦参碱衍生物的合成及抗肿瘤药理活性研究[J]. 化学研究与应用, 2019, 31(6): 1006-1012. [12] 付奔, 田云桃, 丁力, 等. 13-酰胺基取代苦参碱衍生物的合成及抗肿瘤活性研究[J]. 药学实践杂志, 2017, 35(1): 12-16. [13] SERHAN C N, GUPTA S K, PERRETTI M, et al. The atlas of inflammation resolution(AIR)[J]. Mol Aspects Med, 2020, 74:100894. doi: 10.1016/j.mam.2020.100894 [14] MA R, CHU Y J, DOU M M, et al. Matrine inhibits the Wnt3a/β-catenin/TCF7L2 signaling pathway in experimental autoimmune encephalomyelitis[J]. J Neuroimmunol, 2022, 367:577876. doi: 10.1016/j.jneuroim.2022.577876 [15] JING Y L, MA R, CHU Y J, et al. Matrine treatment induced an A2 astrocyte phenotype and protected the blood-brain barrier in CNS autoimmunity[J]. J Chem Neuroanat, 2021, 117:102004. doi: 10.1016/j.jchemneu.2021.102004 [16] LI J, CHENG X Y, YANG H, et al. Matrine ameliorates cognitive deficits via inhibition of microglia mediated neuroinflammation in an Alzheimer’s disease mouse model[J]. Pharmazie, 2020, 75(7):344-347. [17] JIANG J S, WANG G J. Matrine protects PC12 cells from lipopolysaccharide-evoked inflammatory injury via upregulation of miR-9[J]. Pharm Biol, 2020, 58(1):314-320. doi: 10.1080/13880209.2020.1719165 [18] KANG J, LIU S Q, SONG Y F, et al. Matrine treatment reduces retinal ganglion cell apoptosis in experimental optic neuritis[J]. Sci Rep, 2021, 11(1):9520. doi: 10.1038/s41598-021-89086-7 [19] LIOU C J, LAI Y R, CHEN Y L, et al. Matrine attenuates COX-2 and ICAM-1 expressions in human lung epithelial cells and prevents acute lung injury in LPS-induced mice[J]. Mediators Inflamm, 2016, 2016:3630485. [20] HUANG W C, CHAN C C, WU S J, et al. Matrine attenuates allergic airway inflammation and eosinophil infiltration by suppressing eotaxin and Th2 cytokine production in asthmatic mice[J]. J Ethnopharmacol, 2014, 151(1):470-477. doi: 10.1016/j.jep.2013.10.065 [21] SUN D Q, WANG J, YANG N D, et al. Matrine suppresses airway inflammation by downregulating SOCS3 expression via inhibition of NF-κB signaling in airway epithelial cells and asthmatic mice[J]. Biochem Biophys Res Commun, 2016, 477(1):83-90. doi: 10.1016/j.bbrc.2016.06.024 [22] YAO H X, SHI Y, YUAN J Q, et al. Matrine protects against DSS-induced murine colitis by improving gut barrier integrity, inhibiting the PPAR-α signaling pathway, and modulating gut microbiota[J]. Int Immunopharmacol, 2021, 100:108091. doi: 10.1016/j.intimp.2021.108091 [23] XU W H, XU J, XIE F Y, et al. The matrine derivate MASM inhibits recruitment of Gr1hi monocyte and alleviates liver injury[J]. Pharmacology, 2019, 104(5-6):235-243. doi: 10.1159/000501384 [24] ZOU Y M, LI Q, LIU D H, et al. Therapeutic effects of matrine derivate MASM in mice with collagen-induced arthritis and on fibroblast-like synoviocytes[J]. Sci Rep, 2017, 7(1):2454. doi: 10.1038/s41598-017-02423-7 [25] WANG G L, JI C Y, WANG C L, et al. Matrine ameliorates the inflammatory response and lipid metabolism in vascular smooth muscle cells through the NF-κB pathway[J]. Exp Ther Med, 2021, 22(5):1309. doi: 10.3892/etm.2021.10744 [26] LI M X, YING M F, GU S L, et al. Matrine alleviates hypoxia-induced inflammation and pulmonary vascular remodelling via RPS5/NF-κB signalling pathway[J]. J Biochem Mol Toxicol, 2024, 38(1):e23583. doi: 10.1002/jbt.23583 [27] ZHENG S H, CHEN Y Y, WANG Z W, et al. Combination of matrine and tacrolimus alleviates acute rejection in murine heart transplantation by inhibiting DCs maturation through ROS/ ERK/NF-κB pathway[J]. Int Immunopharmacol, 2021, 101(Pt B): 108218. [28] HUANG P, HU F, YANG Z B, et al. Matrine regulates Th1/Th2 inflammatory responses by inhibiting the Hsp90/NF-κB signaling axis to alleviate atopic dermatitis[J]. Kaohsiung J Med Sci, 2023, 39(5):501-510. doi: 10.1002/kjm2.12655 [29] LI L X, NIU H, ZHAN J W, et al. Matrine attenuates bovine mammary epithelial cells inflammatory responses induced by Streptococcus agalactiae through inhibiting NF-κB and MAPK signaling pathways[J]. Int Immunopharmacol, 2022, 112:109206. doi: 10.1016/j.intimp.2022.109206 [30] JIANG K F, GUO S, YANG J, et al. Matrine alleviates Staphylococcus aureus lipoteichoic acid-induced endometritis via suppression of TLR2-mediated NF-κB activation[J]. Int Immunopharmacol, 2019, 70:201-207. doi: 10.1016/j.intimp.2019.02.033 [31] 刘晓霞, 胡李涛, 朱少萍, 等.苦参碱阴道膨胀栓治疗慢性盆腔炎的效果研究[J]. 当代医药论丛, 2020, 18(12): 100-102. [32] YANG L, ZHANG Y M, GUO M N, et al. Matrine attenuates lung injury by modulating macrophage polarization and suppressing apoptosis[J]. J Surg Res, 2023, 281:264-274. doi: 10.1016/j.jss.2022.08.003 [33] YU X H, SEOW H J, WANG H, et al. Matrine reduces cigarette smoke-induced airway neutrophilic inflammation by enhancing neutrophil apoptosis[J]. Clin Sci, 2019, 133(4):551-564. doi: 10.1042/CS20180912 [34] LIU J, ZHANG L H, REN Y G, et al. Matrine inhibits the expression of adhesion molecules in activated vascular smooth muscle cells[J]. Mol Med Rep, 2016, 13(3): 2313-2319. [35] ZHANG Y, YAN R H, HU Y E. Oxymatrine inhibits lipopolysaccharide-induced inflammation by down-regulating Toll-like receptor 4/nuclear factor-kappa B in macrophages[J]. Can J Physiol Pharmacol, 2015, 93(4): 253-260. [36] SUN Y N, XU L, CAI Q H, et al. Research progress on the pharmacological effects of matrine[J]. Front Neurosci, 2022, 16:977374. doi: 10.3389/fnins.2022.977374 [37] YANG Z T, YIN R L, CONG Y F, et al. Oxymatrine lightened the inflammatory response of LPS-induced mastitis in mice through affecting NF-κB and MAPKs signaling pathways[J]. Inflammation, 2014, 37(6):2047-2055. doi: 10.1007/s10753-014-9937-7 [38] XU J, WANG K Q, XU W H, et al. The matrine derivate MASM prolongs survival, attenuates inflammation, and reduces organ injury in murine established lethal sepsis[J]. J Infect Dis, 2016, 214(11):1762-1772. doi: 10.1093/infdis/jiw445 [39] CHEN A M, FANG D F, REN Y, et al. Matrine protects colon mucosal epithelial cells against inflammation and apoptosis via the Janus kinase 2/signal transducer and activator of transcription 3 pathway[J]. Bioengineered, 2022, 13(3):6490-6499. doi: 10.1080/21655979.2022.2031676 [40] CHU Y J, JING Y L, ZHAO X Y, et al. Modulation of the HMGB1/TLR4/NF-κB signaling pathway in the CNS by matrine in experimental autoimmune encephalomyelitis[J]. J Neuroimmunol, 2021, 352:577480. doi: 10.1016/j.jneuroim.2021.577480 [41] ZHANG R, LI Y H, HOU X L, et al. Neuroprotective effect of heat shock protein 60 on matrine-suppressed microglial activation[J]. Exp Ther Med, 2017, 14(2):1832-1836. doi: 10.3892/etm.2017.4691 [42] 焦霞, 沈其昀, 王利民, 等. 氧化苦参碱对哮喘小鼠的抗炎作用及对ICAM-1mRNA表达的影响[J]. 首都医科大学学报, 2006, 27(1):28-31. [43] 王帅. 氧化苦参碱抗溃疡性结肠炎焦亡机制探讨[D]. 大连: 大连理工大学, 2022. [44] ZHU L, ZHU L. Sophocarpine suppress inflammatory response in human fibroblast-like synoviocytes and in mice with collagen-induced arthritis[J]. Eur Cytokine Netw, 2017, 28(3):120-126. doi: 10.1684/ecn.2017.0400 [45] JIANG Z, MENG Y, BO L, et al. Sophocarpine attenuates lps-induced liver injury and improves survival of mice through suppressing oxidative stress, tors inflammation, and apoptosis[J]. Mediators Inflamm, 2018, 2018:5871431. -




 下载:
下载: