-
疲劳是指机体由于某一生理变化过程不能维持其运动机能在某一特定水平或者不能维持其运动强度在某一预定水平[1]。疲劳是日常生活中非常普遍的生理现象,通常人们经过一定的体力或是脑力劳动后会感到疲乏无力,疲劳发生时可导致抑郁、焦虑等问题,通常被认为与认知障碍、睡眠质量差、身体功能障碍和能量失衡有关[2-3]。关于疲劳产生的机制有多种解释,主要包括能源衰竭学说、疲劳相关的代谢产物堆积和自由基学说等。其中,运动过程中产生的自由基攻击细胞和线粒体等生物膜,导致氧化与抗氧化作用失衡,被认为是运动性疲劳产生的主要原因之一[4-6]。目前临床上用于缓解疲劳的药物或疗法较少,因此,从疲劳产生机制出发,开发新型抗疲劳药物或潜在物质具有重大意义。
纳米硒(SeNPs)作为一种抗氧化剂,在治疗氧化应激相关疾病中具有潜在的应用前景。然而,SeNPs由于表面能高,通常稳定性较差,容易发生聚沉,形成灰色或黑色的元素硒[7]。功能化SeNPs具有较低的毒性和较高的生物兼容性及反应性,有助于提高疗效和临床应用价值[8]。虎奶菇[Pleurotus tuber-regium (Fr.) Singer]又称菌核侧耳、茯苓侧耳等,为担子菌纲口蘑科侧耳属真菌,性甘温,补气益血,主要分布在热带和亚热带地区,是一种珍贵的药食两用真菌[9],在民间常被用于治疗哮喘、感冒发烧、胃病等疾病[10]。研究表明,多糖是虎奶菇重要的活性成分之一,具有增强小鼠免疫力、提高抗氧化应激能力和抑制肝脏脂质过氧化等多种药理活性[11-12]。
我们前期的试验利用非洲野生虎奶菇菌核多糖作为封端剂,制备出大小可控、高稳定性的新型纳米硒——虎奶菇多糖功能化纳米硒(PTR-SeNPs)[13]。研究表明,PTR-SeNPs具有显著的保肝、抗细菌、抗真菌、抗肿瘤和促进骨形成等多种生物药理活性,表现出巨大的潜在临床应用价值和开发前景[14-18]。本文探究PTR-SeNPs对游泳运动性疲劳的拮抗作用,以期为PTR-SeNPs作为天然补硒剂在抗疲劳保健品或药品的开发和应用提供实验依据。
-
SPF级C57/BL6小鼠48只,雄性,6~8周龄,体质量20 g~25 g,由江苏赛业模式生物研究中心(太仓)有限公司提供,生产许可证号:SCXK(苏)2018-0003。于福建中医药大学动物实验中心SPF级动物房内饲养。
-
PTR-SeNPs(香港理工大学未来食品研究院食品科学及营养学系黄家兴教授制备并提供,初始摩尔浓度为1.30 mmol/L);生理盐水(福州海王福药制药有限公司);血清尿素氮(BUN)、乳酸(LD)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢(CAT)和糖原(Glycogen)测定试剂盒(南京建成生物工程研究所);BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司);动物用异氟烷(深圳市瑞沃德生命科技有限公司)。
5417R低温高速离心机(德国Eppendorf公司);LXJ-IIB低速离心机(上海安亭科学仪器厂);Th900超低温冰箱(美国Thermo公司);DK-S24电热恒温水浴锅(上海精宏实验设备有限公司);AR2310电子天平(奥豪斯仪器有限公司);M-244超纯水机(德国Milipore公司);BCD-216SDN 4℃冰箱(中国Haier集团);Lab dancer S25涡旋仪(IKA公司);M200 Pro多功能酶标仪(瑞士Tecan公司);IMS-300全自动雪花制冰机(常熟市雪科电器有限公司);BioSpec 70/20 USR小动物核磁共振成像仪(瑞士布鲁克公司)。
-
C57/BL6小鼠48只,雄性,6~8周龄,体质量20~25 g,在SPF级实验动物房饲养,室内温度为20℃~26℃,相对湿度40%~70%,噪声<60 dB,光照明暗交替12 h/d,所有小鼠适应性喂养1周,待处理。将C57/BL6小鼠分为4组,每组12只,分别为对照组、游泳训练模型组(EC组)、PTR-SeNPs低剂量组[2.5 μmol/(kg·bw),LPTR-SeNPs组]、PTR-SeNPs高剂量组[10 μmol/(kg·bw),HPTR-SeNPs组]。按所示剂量灌胃21 d,每天给药1次。第1~4天,给药30 min后,适应性游泳训练20 min,连续4 d,第5~7天每天比前1 d增加20 min,连续3 d,第8~20天每天游泳80 min,持续13 d。每日监测食物与水的摄取量,并定期记录小鼠体质量变化情况(第1、5、10、15和20天)。第21天给药30 min后,每组各取3只,游泳80 min后,MRI扫描小鼠后肢肌肉长度和宽度,其余小鼠进行负重力竭游泳训练后,眼球取血并摘取肝脏,进行疲劳相关生化指标检测(图1)。
-
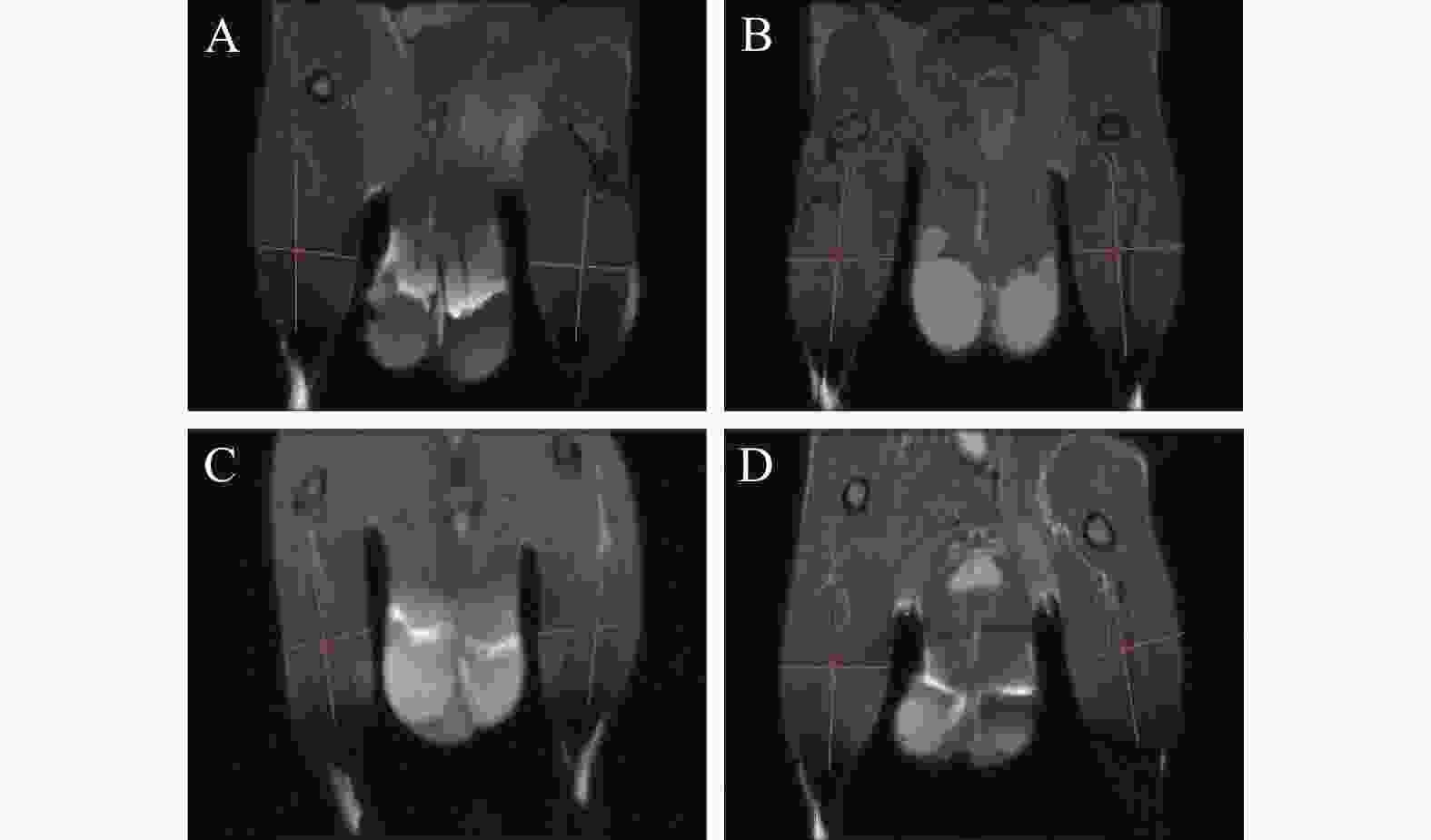
第21天给药30 min后,每组各取3只,异氟烷气体麻醉小鼠,MRI扫描小鼠后肢肌肉,利用ImageJ软件分析各组的肌肉长度和宽度,计算各组与对照组之间的比值,即得各组的肌肉相对长度和宽度。
-
第21天给药30 min后,在尾部绑上重量为小鼠体质量5%的铅丝,将其放入水温为(30±2)℃、50 cm×40 cm×40 cm的水箱中进行负重力竭游泳测试。适当用玻璃棒搅拌水,或拨弄小鼠,使小鼠一直处于运动状态。小鼠的头部沉下水面8 s不能浮出即判断为力竭,记录每只小鼠从开始游泳至力竭的时间[19]。每只小鼠测试过后更换新的超纯水,避免小鼠留在水中的警戒物质对其他小鼠产生干扰。负重力竭游泳结束后立即进行眼球取血,脱颈处死,摘取肝脏,保存于−80℃,待测。
-
小鼠眼球取血,3 500 r/min,4℃离心15 min,取血清,参照试剂盒说明书检测血清中BLA、BUN、ALT、AST和LDH含量。
-
取适量肝组织,用生理盐水漂洗,吸净水分,参照试剂盒说明书检测肝脏中SOD、CAT活性和MDA、HG水平。
-
采用SPSS 23.0软件对实验数据统计分析,以(
$ \bar{x}\pm {s} $ )表示,采用ANOVA单因素方差分析数据,以P<0.05差异有统计学意义。 -
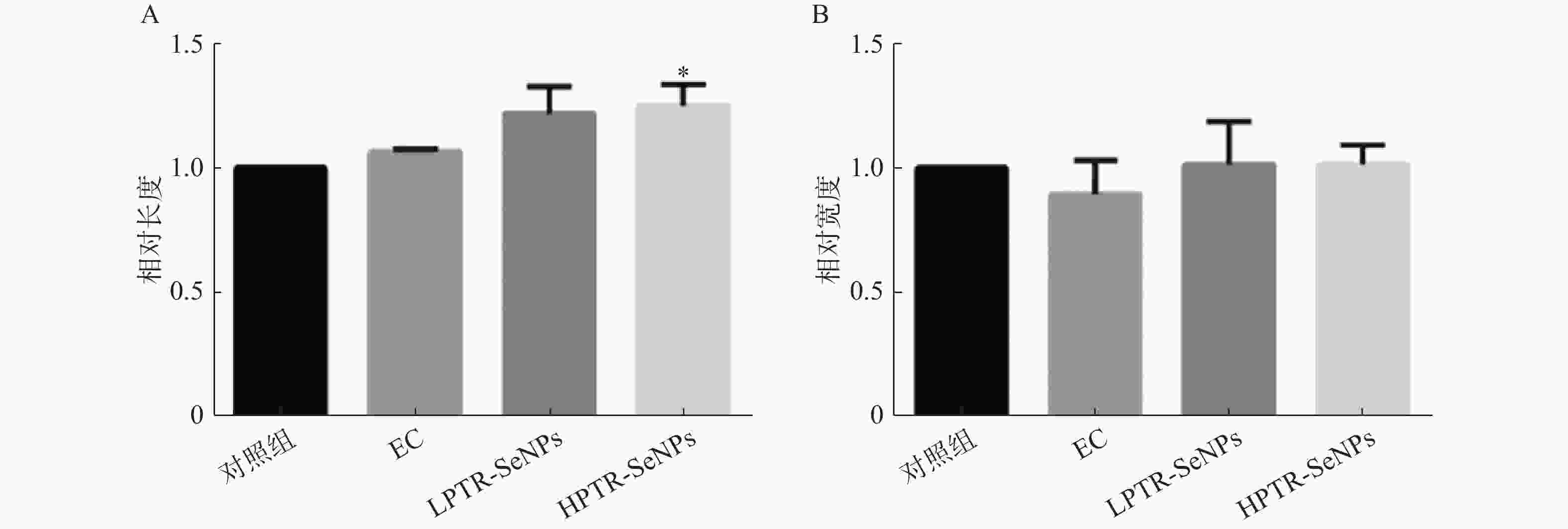
MRI扫描小鼠后肢肌肉(图2),ImageJ软件分析并计算各组小鼠后肢肌肉的相对长度和宽度,结果如图3所示。与对照组比较,HPTR-SeNPs能显著增加后肢肌肉相对长度(P<0.05)。结果表明,PTR-SeNPs可通过增加后肢肌肉长度,改变肌肉结构,可能与提高机体的耐力相关。
-
疲劳是机体复杂的生理变化过程,运动耐力可作为客观直接的判断标准[20]。由图4A-C可知,与对照组比较,给药21 d后,L/HPTR-SeNPs对运动训练小鼠的体质量、摄食和摄水量均无显著影响。小鼠连续灌胃给予PTR-SeNPs 21 d后,通过负重力竭游泳实验考察PTR-SeNPs对小鼠运动性疲劳的影响,结果如图4D所示,与对照组比较,HPTR-SeNPs显著提高小鼠的负重力竭游泳时间(P<0.05);与EC组或LPTR-SeNPs组比较,HPTR-SeNPs能显著提高小鼠的负重力竭游泳时间(P<0.01),说明PTR-SeNPs可以显著提高小鼠运动耐力,明显缓解小鼠疲劳症状。
-
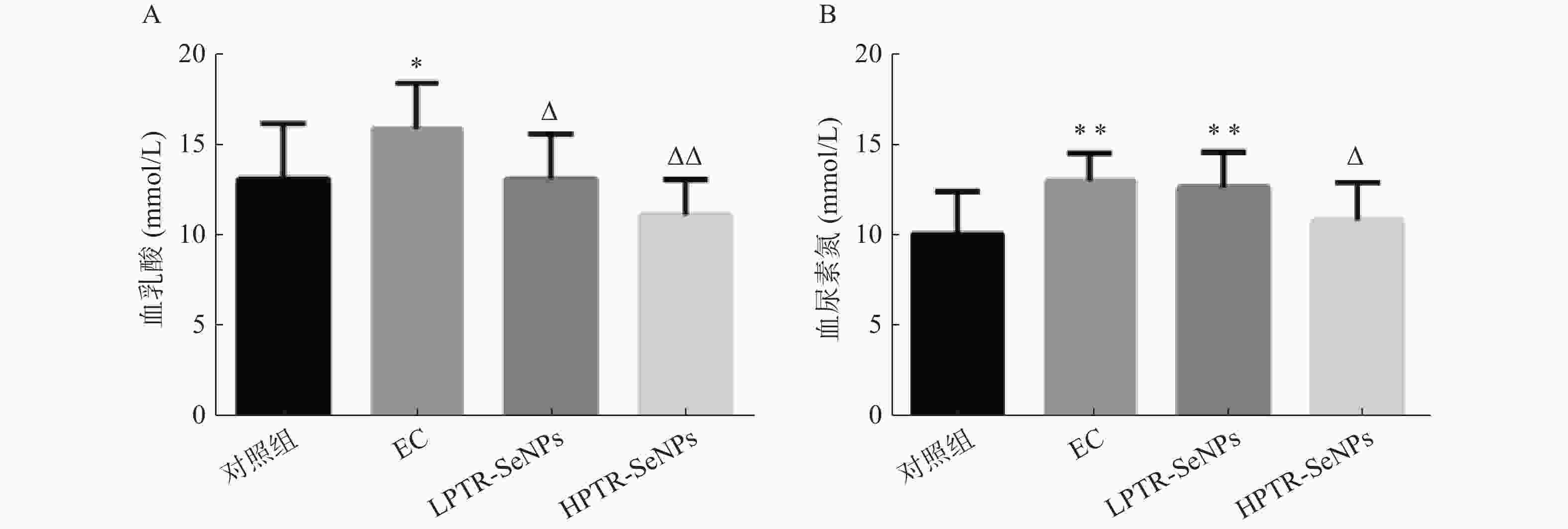
糖原作为机体主要的供能物质,运动产生疲劳时,大量ATP被消耗,此时机体糖酵解过程增强,糖酵解过程最终代谢产物为BLA,BLA在机体内大量堆积,使机体内环境呈酸性,细胞正常的能量转换和物质代谢受到影响,最终导致机体产生疲劳[21-23]。当机体能量消耗达到一定程度,体内的蛋白质开始分解,参与能量代谢,使得血清中BUN含量急剧升高[24]。小鼠血清BLA含量检测结果如图5A所示,与对照组比较,EC组BLA含量显著升高(P<0.05);与EC组比较,LPTR-SeNPs组与HPTR-SeNPs组BLA含量显著下降(P<0.05或P<0.01)。表明PTR-SeNPs可能通过促进葡萄糖更充分氧化分解,减少BLA的生成,或者加快BLA代谢,从而提供更为充足的ATP,减少运动小鼠BLA的蓄积。血清BLA含量检测结果如图5B 所示,与对照组比较,EC组和LPTR-SeNPs组BUN含量显著升高(P<0.01);而HPTR-SeNPs组的BUN含量则无显著性差异。与EC组比较,HPTR-SeNPs组BUN含量显著下降(P<0.05)。提示PTR-SeNPs可能通过提高葡萄糖的利用,减少蛋白质分解,降低疲劳小鼠血清BUN的生成。
-
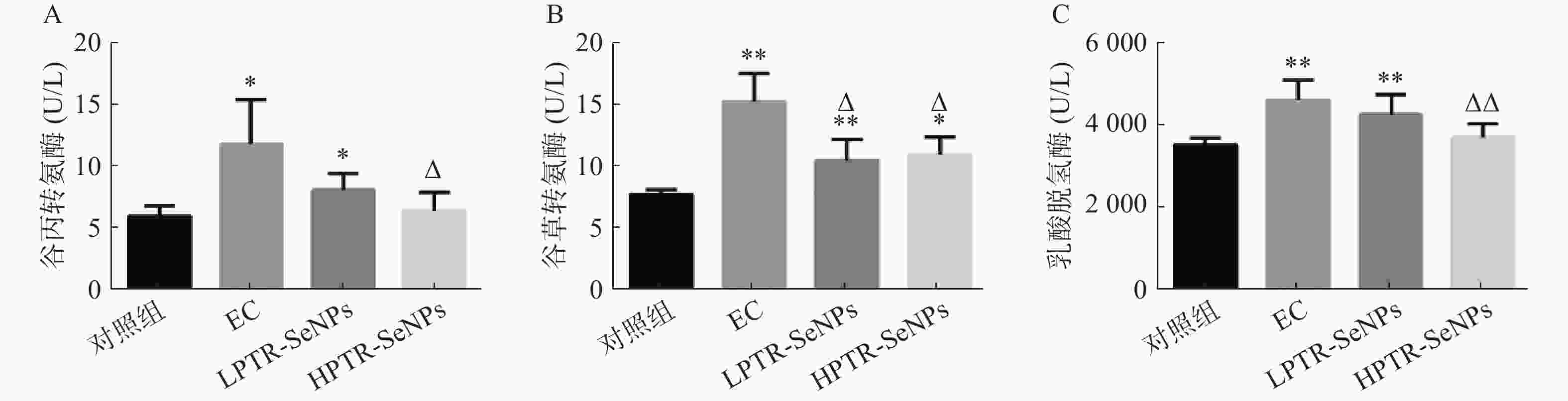
机体在进行剧烈运动时,会生成大量的自由基,使机体产生氧化应激,导致肝脏、心肌和肌肉等组织器官出现受损,血清中ALT、AST和LDH水平亦可作为评价小鼠在游泳应激过程中的敏感指标[25]。由图6可知,与对照组比较,EC组血清中的ALT、AST和LDH含量显著升高。LPTR-SeNPs组的ALT和LDH含量以及L/HPTR-SeNPs组AST含量均显著升高。与EC组比较,HPTR-SeNPs组ALT水平显著降低(P<0.05),见图6A;L/HPTR-SeNPs组的AST水平显著降低(P<0.05),见图6B;HPTR-SeNPs组的LDH活性水平显著降低(P<0.01),见图6C。结果提示PTR-SeNPs改善运动性疲劳过程中的肝脏生理功能。
-
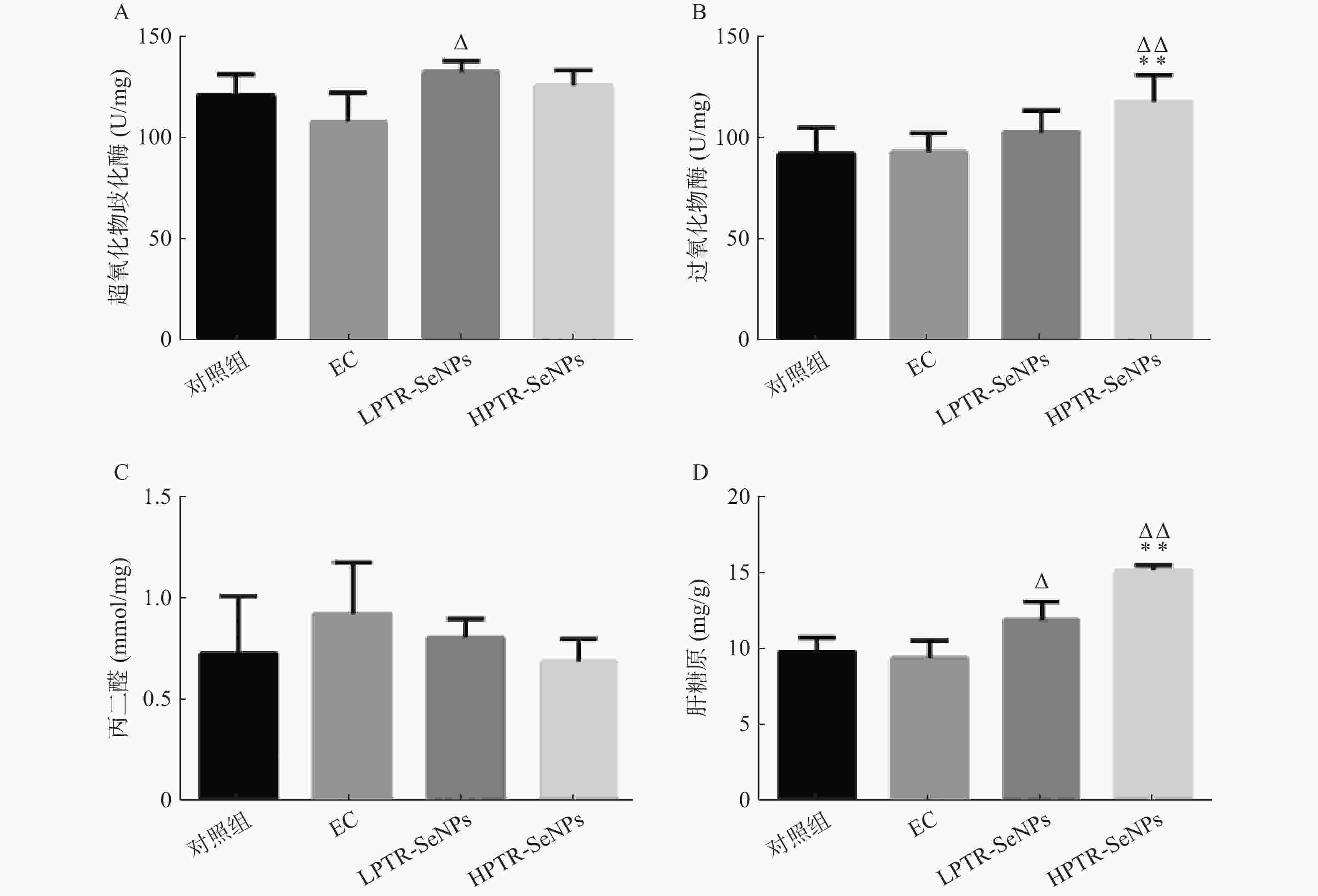
机体内含有的多种抗氧化活性酶,如SOD和CAT,可减少体内活性氧自由基的含量,保护肌细胞。抗氧酶活性的提高能够延缓运动疲劳,MDA水平可作为判断机体内物质氧化程度的指标[26-27]。由图7可知,与对照组比较,HPTR-SeNPs组的CAT活力和HG含量显著升高(P<0.01)。与EC组比较,LPTR-SeNPs组小鼠肝脏中SOD活力和HG含量显著升高(P<0.05),HPTR-SeNPs组小鼠肝脏中CAT活力和HG含量显著升高(P<0.01)。表明PTR-SeNPs可以提高体内SOD、CAT活力,清除体内自由基,减缓小鼠剧烈运动后MDA堆积对肌细胞所造成的损害,同时提高机体HG含量。提示PTR-SeNPs能够显著提高机体的抗氧化应激能力和HG储备能力,从而有效改善运动性疲劳。表明PTR-SeNPs具有增强肝脏生理功能的作用,能有效拮抗游泳训练疲劳的发生。
-
目前,疲劳已严重影响到人们的身心健康和生活质量,受到了国内外专家的关注,并逐渐成为学者研究的热门课题。硒是生物体中必需的微量元素,在预防癌症、心血管疾病和提高免疫力中具有重要作用。近年来,SeNPs作为一种新型补硒药物出现,具有更好的生物利用度以及更小的毒性[2]。然而,SeNPs不稳定、极易聚集的性质,限制了其在临床上的应用。近年来,天然生物大分子作为SeNPs的修饰剂,可提高其稳定性和生物活性,并逐渐成为研究热点[15]。蘑菇多糖具有丰富的羟基,能有效地吸附在SeNPs上,避免其聚积和沉淀[28]。研究表明,蘑菇多糖修饰的SeNPs其稳定性大幅增强,且具有抗肿瘤、抗氧化、保肝和抗疲劳活性等多种生物活性[29]。
本研究结果表明,PTR-SeNPs能显著拮抗小鼠的游泳训练疲劳,其抗疲劳作用可能与改善肝脏生理功能、增加糖原储备、减少代谢物堆积及增强机体抗氧化能力有关。因此,深入探究PTR-SeNPs的抗疲劳活性作用机制,为其在抗疲劳药物及保健品的开发应用提供重要的实验参考依据。
Anti-fatigue activity of selenium nanoparticles functionalized by polysaccharides from Pleurotus tuber-regium sclerotium
-
摘要:
目的 通过检测小鼠后肢肌肉相对长度、负重游泳时间及其血清和肝脏相关指标,探究虎奶菇菌核多糖功能化纳米硒(PTR-SeNPs)的体内抗疲劳功效。 方法 48只雄性C57/BL6小鼠分为4组,每组12只,即对照组、游泳训练组(EC组)、PTR-SeNPs低剂量组(LPTR-SeNPs组)、PTR-SeNPs高剂量组(HPTR-SeNPs组),分别给予生理盐水(对照组与EC组)、LPTR-SeNPs[2.5 μmol/(kg·bw)]和HPTR-SeNPs[10 μmol/(kg·bw)],1次/d,连续灌胃21 d。通过磁共振成像系统分析PTR-SeNPs对小鼠游泳训练后肢肌肉结构的影响,同时测定小鼠的负重游泳时间并检测血清中血乳酸(BLA)、血尿素氮(BUN)、谷丙转氨酶(ALT)、谷草转氨酶(AST)和乳酸脱氢酶(LDH)含量及肝脏中肝糖原(HG)、丙二醛(MDA)水平和过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活力。 结果 与对照组比较,EC组小鼠血清BLA、BUN、ALT、AST及LDH含量显著升高(P<0.05或P<0.01),HPTR-SeNPs组小鼠肝脏中CAT含量显著升高(P<0.01),小鼠后肢肌肉相对长度显著增长(P<0.05),负重力竭游泳时间提高(P<0.05),L/HPTR-SeNPs组MDA水平无明显差异;与EC组比较,HPTR-SeNPs组小鼠负重游泳时间显著延长(P<0.01),BLA及BUN含量均显著降低(P<0.05或P<0.01),L/HPTR-SeNPs组HG含量显著增加(P<0.05或P<0.01),HPTR-SeNPs组血清ALT、AST及LDH水平均显著降低(P<0.05或P<0.01),肝脏CAT活力显著升高(P<0.01),LPTR-SeNPs组血清AST活力显著降低(P<0.05)、肝脏SOD活力显著升高(P<0.05)。 结论 PTR-SeNPs具有改善肝脏生理功能、增加糖原储备、减少代谢物堆积及增强机体抗氧化能力,以及减缓疲劳的作用,具有开发成保健品或药品的潜力。 Abstract:Objective To investigate the anti-fatigue effect of PTR-SeNPs in vivo by measuring the muscle relative length of hindlimb, load-bearing swimming time as well as serum and liver indexes of mice. Methods 48 male C57/BL6 mice were randomly assigned into 4 groups with 12 mice in each group, including vehicle control group (control group), swimming training exercise group (EC group) with vehicle treatment, swimming training exercise with low dose of PTR-SeNPs group (LPTR-SeNPs) and high dose of PTR-SeNPs group (HPTR-SeNPs). The mice were intragastrically administrated with normal saline in both control group and EC group, as well as 2.5 and 10 μmol/(kg·bw) PTR-SeNPs in LHPTR-SeNPs group, respectively, once per day for consecutively 21 days. After swimming training exercise, the muscle structures in the hind limb of mice were examined by magnetic resonance imaging. Furthermore, the burdened swimming time was measured, the serum content of blood lactic acid (BLA), urea nitrogen (BUN), alanine aminotransferase (ALT), glutamic oxalate aminotransferase (AST) and lactate dehydrogenase (LDH), as well as the hepatic level of glycogen (HG), malondialdehyde (MDA) and activity of catalase (CAT) and superoxide dismutase (SOD) were determined. Results Compared with the control group, the serum contents of BLA, BUN, ALT, AST and LDH in EC group (P<0.05 or P<0.01) and hepatic CAT in HPTR-SeNPs group (P<0.01) were significantly increased. The muscle relative length of hind limbs and the burdened swimming time were extended by HPTR-SeNPs markedly (P<0.05). There was no significant difference in MDA level in LHPTR-SeNPs group. Compared with EC group, the burdened swimming time of mice was significantly prolonged (P<0.01), the contents of BLA and BUN were obviously decreased in the HPTR-SeNPs group (P<0.05 or P<0.01), the level of HG was significantly increased in the LHPTR-SeNPs groups (P<0.05 or P<0.01), the serum content of ALT, AST and LDH were markedly decreased in the HPTR-SeNPs group (P<0.05 or P<0.01). Hepatic SOD activity was remarkably increased in LPTR-SeNPs group (P<0.05), the level of CAT was evidently increased (P<0.01) and AST was decreased (P<0.05) in the HPTR-SeNPs group. Conclusion PTR-SeNPs could improve the liver physiological function, increase glycogen storage, reduce the accumulation of metabolites and enhance the body’s antioxidant capacity to ameliorate fatigue significantly, which could present the potential to be developed into health care products or drugs. -
Key words:
- PTR-SeNPs /
- swimming training exercise /
- antioxidant stress /
- anti-fatigue effect
-
-
[1] 代朋乙, 黄昌林. 运动性疲劳研究进展[J]. 解放军医学杂志, 2016, 41(11):955-964. doi: 10.11855/j.issn.0577-7402.2016.11.14 [2] 徐艺园, 王凯, 王佳音, 等. 疲劳产生相关机制研究进展[J]. 科学技术创新, 2019, (23):50-51. doi: 10.3969/j.issn.1673-1328.2019.23.030 [3] LIU G Y, YANG X, ZHANG J X, et al. Synthesis, stability and anti-fatigue activity of selenium nanoparticles stabilized byLycium barbarum polysaccharides[J]. Int J Biol Macromol, 2021, 179:418-428. doi: 10.1016/j.ijbiomac.2021.03.018 [4] WANG X, QU Y D, ZHANG Y F, et al. Antifatigue potential activity of Sarcodon imbricatus in acute excise-treated and chronic fatigue syndrome in mice via regulation of Nrf2-mediated oxidative stress[J]. Oxidative Med Cell Longev, 2018, 2018:9140896. [5] TANG W, JIN L, XIE L, et al. Structural characterization and antifatigue effect in vivo of maca (Lepidium meyenii walp) polysaccharide[J]. J Food Sci, 2017, 82(3):757-764. doi: 10.1111/1750-3841.13619 [6] ZHANG X Y, JING S, LIN H J, et al. Anti-fatigue effect of anwulignan via the NRF2 and PGC-1α signaling pathway in mice[J]. Food Funct, 2019, 10(12):7755-7766. doi: 10.1039/C9FO01182J [7] YAN J K, QIU W Y, WANG Y Y, et al. Fabrication and stabili-zation of biocompatible selenium nanoparticles by carboxylic curdlans with various molecular properties[J]. Carbohydr Polym, 2018, 179:19-27. doi: 10.1016/j.carbpol.2017.09.063 [8] MENON S, SHANMUGAM V K. Chemopreventive mechanism of action by oxidative stress and toxicity induced surface decorated selenium nanoparticles[J]. J Trace Elem Med Biol, 2020, 62:126549. doi: 10.1016/j.jtemb.2020.126549 [9] 徐军军, 李治堃, 黄飞龙, 等. 响应面法优化水溶性虎奶菇多糖提取工艺及其对胃癌细胞的抑制作用[J]. 食品工业科技, 2020, 41(7):185-189,202. doi: 10.13386/j.issn1002-0306.2020.07.031 [10] 王慧宾, 王爽, 翁雅青, 等. 虎奶菇中多糖的提取工艺、结构分析和生物活性研究进展[J]. 江西科学, 2019, 37(6):836-838,850. doi: 10.13990/j.issn1001-3679.2019.06.004 [11] WU G H, HU T, HUANG Z L, et al. Characterization of water and alkali-soluble polysaccharides from Pleurotus tuber-regium Sclerotia[J]. Carbohydr Polym, 2013, 96(1):284-290. doi: 10.1016/j.carbpol.2013.03.036 [12] WONG K H, LAI C K M, CHEUNG P C K. Stimulation of human innate immune cells by medicinal mushroom sclerotial polysaccharides[J]. Int J Med Mushr, 2009, 11(3):215-223. doi: 10.1615/IntJMedMushr.v11.i3.10 [13] CHEN T F, WONG K H, WU H L, et al. Pleurotus tuber-regium polysaccharide functionalized nano-selenium hydrosol with anti-tumor activity and preparation method thereof[P]. USA: US9072669B2, 2013-01-31. [14] YIP J, LIU L, WONG K H, et al. Investigation of antifungal and antibacterial effects of fabric padded with highly stable selenium nanoparticles[J]. J Appl Polym Sci, 2014, 131(17):40728. [15] WU H, LI X, LIU W, et al. Surface decoration of selenium nanoparticles by mushroom polysaccharides–protein complexes to achieve enhanced cellular uptake and antiproliferative activity[J]. J Mater Chem, 2012, 22(19):9602-9610. doi: 10.1039/c2jm16828f [16] ZHANG Z H, DU Y X, LIU T, et al. Systematic acute and subchronic toxicity evaluation of polysaccharide-protein complex-functionalized selenium nanoparticles with anticancer potency[J]. Biomater Sci, 2019, 7(12):5112-5123. doi: 10.1039/C9BM01104H [17] YU S M, LUK K H, CHEUNG S T, et al. Polysaccharide-protein complex-decorated selenium nanosystem as an efficient bone-formation therapeutic[J]. J Mater Chem B, 2018, 6(32):5215-5219. doi: 10.1039/C8TB01084F [18] 吴建国, 马利, 杨彬君, 等. 虎奶菇多糖纳米硒对叔丁基过氧化氢诱导的HepG2细胞氧化损伤的保护作用[J]. 福建中医药, 2017, 48(1):45-46. doi: 10.3969/j.issn.1000-338X.2017.01.021 [19] YUAN T, WU D, SUN K Y, et al. Anti-fatigue activity of aqueous extracts of Sonchus arvensis L. in exercise trained mice[J]. Molecules, 2019, 24(6):1168. doi: 10.3390/molecules24061168 [20] 彭梅, 张振东, 杨娟. 土党参多糖对小鼠的抗疲劳作用[J]. 食品科学, 2011, 32(19):224-226. [21] 闫曙光, 任杰, 潘亚磊, 等. 黄芪建中汤抗疲劳机制研究[J]. 世界科学技术-中医药现代化, 2020, 22(3):799-803. [22] 白海军, 王颖. 发酵法制备芸豆渣可溶性膳食纤维及其抗运动性疲劳作用研究[J]. 食品工业科技, 2022, 43(13):367-372. [23] 姚乐辉. 化橘红多糖抗氧化能力及抗疲劳作用的研究[J]. 粮食与油脂, 2019, 32(4):95-100. doi: 10.3969/j.issn.1008-9578.2019.04.026 [24] 谢飞飞. 远志多糖对力竭运动小鼠体内抗疲劳和体外抗氧化作用研究[J]. 食品工业科技, 2021, 42(6):332-336. doi: 10.13386/j.issn1002-0306.2020050292 [25] 王转丁, 杨晶晶, 李留安, 等. 不同强度游泳应激对小鼠血清ALT、AST和ALP活性的影响[J]. 黑龙江畜牧兽医, 2013, (21):164-166. doi: 10.13881/j.cnki.hljxmsy.2013.21.063 [26] 秦汝兰, 关颖丽, 吕重宁. 山刺玫果多糖抗疲劳及抗氧自由基水平机制研究[J]. 食品工业科技, 2019, 40(22):311-315. doi: 10.13386/j.issn1002-0306.2019.22.054 [27] 龚云, 陈晨. 基于知识图谱的国内运动性疲劳研究进展分析[J]. 西北成人教育学院学报, 2022, (1):67-74. [28] ZHANG Y F, WANG J G, ZHANG L N. Creation of highly stable selenium nanoparticles capped with hyperbranched polysaccharide in water[J]. Langmuir, 2010, 26(22):17617-17623. doi: 10.1021/la1033959 [29] SHI X D, TIAN Y Q, WU J L, et al. Synthesis, characterization, and biological activity of selenium nanoparticles conjugated with polysaccharides[J]. Crit Rev Food Sci Nutr, 2021, 61(13):2225-2236. doi: 10.1080/10408398.2020.1774497 -





 下载:
下载: