-
心脑血管疾病是由于动脉粥样硬化、高血压、高脂血症等导致的心脑及全身组织发生的缺血性或出血性疾病[1-2]。根据最新的《中国心血管健康与疾病报告2023》显示,我国心脑血管病患病率处于持续上升阶段。推算心脑血管病现患病人数3.3亿,其中脑卒中
1300 万,冠心病1139 万。城乡居民疾病死亡构成比中,心脑血管病占首位。2021年,心脑血管病分别占农村、城市死因的48.98%和47.35%。同时,根据美国心脏协会(AHA)发布的美国和全球2024年心脏病和脑卒中统计报告,全球27%的死亡由心脑血管疾病引起,是全球主要死因。2021年,心脑血管疾病导致全球约1991万人死亡,严重地威胁人类健康[1-5]。胆固醇(CHOL)、血压、血糖控制和代谢综合征是调控心脑血管疾病的4个主要健康因素。CHOL是导致动脉粥样硬化和心血管疾病的重要风险因素,其中低密度脂蛋白胆固醇(LDL-C)与心血管疾病风险呈负相关,高甘油三酯(TG)水平与心血管疾病风险增加相关。2019年全球归因于高LDL-C和TG水平的寿命损失年为571万。根据204个国家和地区的数据,2021年,全球有372万人死于LDL-C水平过高[1-2,5]。因此控制高血脂危险因素,对于心血管疾病的防治具有重要临床意义。
目前高血脂治疗方面,根据美国ACC NCDR PINNACLE心脏病学实践登记研究的数据,在2013−2016年
49447 例LDL-C水平过高(LDL-C≥190 mg/dl)的患者中,使用的降脂药主要为:他汀类药物、依折麦布、前蛋白转化酶枯草杆菌蛋白酶/kexin9型(PCSK9)抑制剂、依洛尤单抗等[2,6]。中医药治疗心脑血管疾病疗效肯定。根据中医理论,心脑病证的发生多因阴阳气血亏虚,痰浊、瘀血阻滞,导致血脉运行障碍。治疗上常采用益气活血,通行血脉之法,气血以流,血脉所通。血通胶囊为黄浦区香山中医医院特色院内制剂(沪药制字Z05100436),由上海市名老中医陈敏先主任医师临床使用几十年的经验方化裁而来。血通胶囊处方由水蛭、大黄、制何首乌三味药材组成(每粒0.25 g,口服,一次1 g,一天3次,合计一天用量为3 g)。方中水蛭破血、逐瘀、通络,为君药,大黄泻热通肠、破积行瘀、清热解毒,为臣药,辅以何首乌补肝肾、益精血,为佐药。诸药合用,共奏活血化瘀、降脂通络、泄热通腑、补益肝肾的作用。在临床应用多年,主治高脂血症、高黏滞血症、动脉粥样硬化、中风后遗症及便秘等疾病,疗效确切,安全性好,且价格低廉,服用方便,深受患者欢迎。临床研究表明,血通胶囊具有降低CHOL、TG及血液黏滞度的作用[7-8]。因此,笔者通过高血脂小鼠模型,观察血通胶囊的改善血脂作用和肝脏保护作用,并对其作用机制进行初步研究。
-
ICR小鼠,雄性,SPF级18~20 g,购自上海斯莱克实验动物责任有限公司,许可证号SCK(沪2022-0004),适应性饲养7 d,自由饮食和饮水。血通胶囊(上海市黄浦区香山中医医院特色院内制剂,沪药制字Z05100436);阳性药物阿托伐他汀钙片(北京嘉林药业股份有限公司,批准文号:国药准字H19990258);羧甲基纤维素钠(国药集团化学试剂有限公司);高脂饲料:常州鼠一鼠二生物科技有限公司。油红O和引物购自生工生物工程(上海)股份有限公司。
-
动物按照随机原则分为6组,每组10只:空白对照组(n=10),给予正常对照饲料。高脂模型组(n=10),血通胶囊低、中、高剂量组(剂量分别为0.5、1和2 g/kg,每个剂量组10只小鼠),以及阿托伐他汀组(1.5 mg/kg,n=10)。模型组、血通胶囊3个剂量组以及阳性药物组均给予高脂饲料(货号:SD88137)喂养,持续4周。
第5周,给药组开始灌胃给药,药物羧甲基纤维素钠混悬液(纯净水配成0.5%浓度)溶解,给药体积20 ml/kg。模型组和正常对照组给予同体积溶媒。给药8周后,动物禁食一天(正常饮水),眼眶取血,取血清,测定血脂指标,随后动物使用0.9%氯化钠溶液灌注后,取肝脏、心脏和脾脏,测定重量,计算脏器指数,肝中叶冻存用于分子生物学检测,肝右叶使用4%多聚甲醛固定,用于油红染色等病理检测。
-
以肝脏为例,肝指数=肝脏重量(mg)/体重(g)。
-
油红O染色:油红O取2.5 g,70%乙醇500 ml,混合后间隔摇动多次,待24 h形成饱和液,即可使用,按照说明书将冰冻组织切片进行染色。在光学显微镜下(200×)对每张载玻片的三个区域中的油红O阳性区域进行定量分析,使用Image J统计分析[9-10]。
-
血清CHOL、LDL-C、TG以及高密度脂蛋白胆固醇(HDL-C),血糖,谷丙转氨酶(ALT)以及谷草转氨酶(AST)采用常规血生化分析仪测定(桂林优利特医疗电子有限公司)。
-
用TRIzol提取肝脏RNA,逆转录为cDNA。用定量PCR Mix扩增cDNA。用△CT法评估相对基因表达,并将β-actin用作内部对照。基因特异性引物在引物库中设计,具体如下:
β-actin:F(5’-3’):GGCTGTATTCCCCTCCATCG;R(5’-3’):CCAGTTGGTAACAATGCCATG;
IL-1β:F(5’-3’):GAAATGCCACCTTTTGACAGTG;R(5’-3’):TGGATGCTCTCATCAGGACAG;
TNF-α:F(5’-3’):CCCTCACACTCAGATCATCTTCT;R(5’-3’):GCTACGACGTGGGCTACAG;
IL-6:F(5’-3’):GAGTCCTTCAGAGAGATACAG;R(5’-3’):CTGTGACTCCAGCTTATCTG
-
采用SPSS17.0软件对数据进行分析,结果用GraphPad Prism 8.00软件绘制。数据表示为
$ \bar x \pm s $ 。Shapiro-Wilk检验用于评估数据正态分布。当方差的正态性检验通过时,计量资料以$ \bar x \pm s $ 表示,多组间比较采用单因素方差分析。P<0.05被认为差异有统计学意义。 -
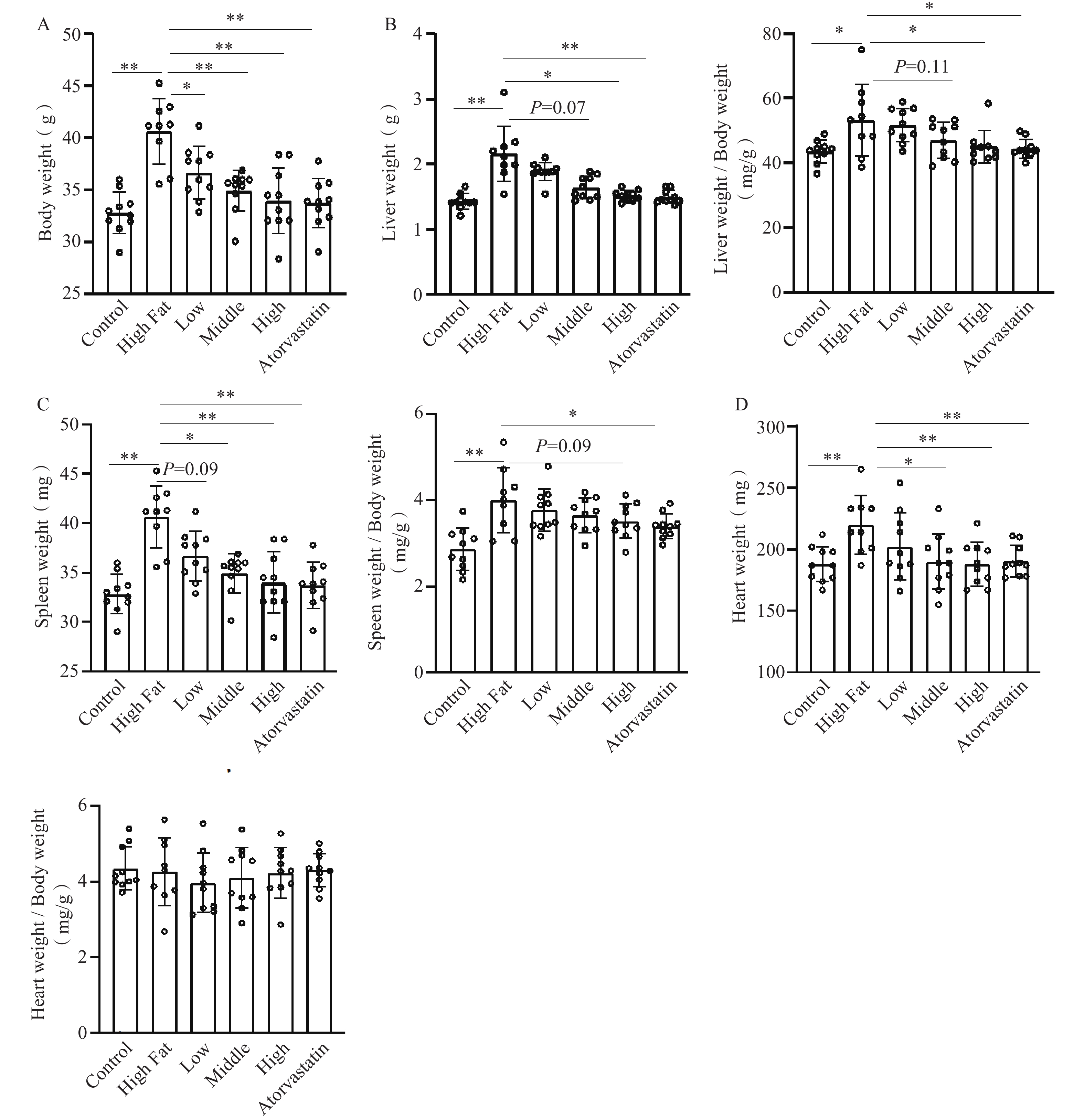
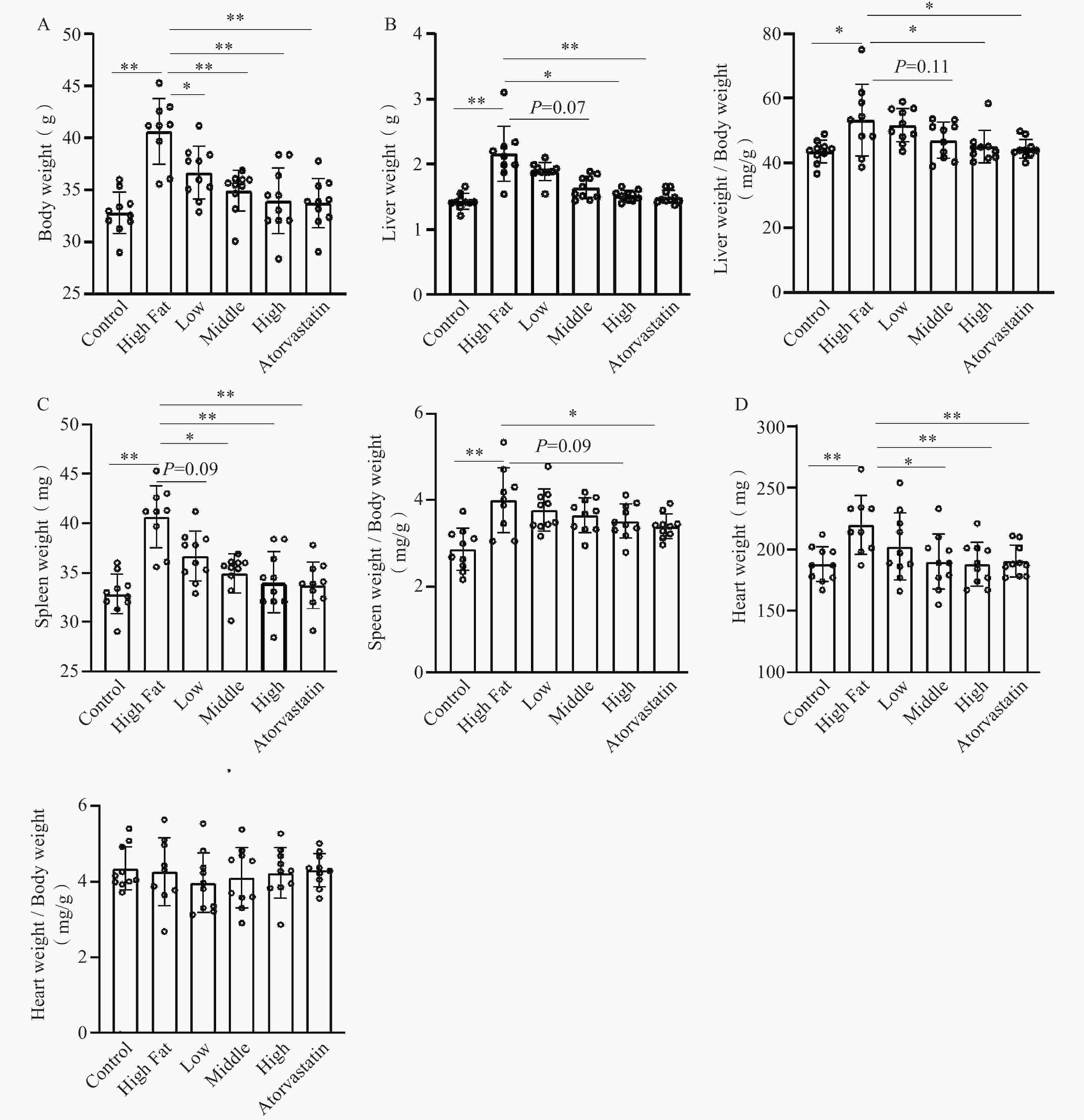
与正常对照组比较,高脂模型组动物体重显著增加(40.7±3.14 g比32.9±2.00 g,P<0.01)。与模型组比较,低、中、高剂量组均显著地降低模型小鼠体重(低剂量组36.7±2.50 g;中剂量组35.0±1.97 g;高剂量组34.0±3.12 g,P<0.01)。阳性药物降低体重作用同样显著(33.8±2.35g比40.7±3.14 g,P<0.01)(图1A)。主要脏器指标:肝脏:与正常对照组比较,高脂模型组动物肝脏重量显著增加(2.16±0.43 g比1.43±0.12 g,P<0.01)。肝脏脏器指数同样差异显著(54.0±11.7mg/g比43.6±3.46mg/g,P<0.05)。与模型组比较,低、中、高剂量组肝脏重量降低,中、高剂量组差异显著(中剂量组1.64±0.17 g;高剂量组1.52±0.08 g,P<0.01)。同时,低、中、高剂量组肝脏脏器指数剂量依赖性地降低,其中高剂量组差异显著(44.7±5.09mg/g比54.0±11.7 mg/g,P<0.05)。阳性药物组肝脏重量和脏器指数与模型组比较,均显著地降低(图1B)。
脾脏:与正常对照组比较,高脂模型组动物脾脏重量显著增加(156±27.5 mg比94.0±17.3 mg,P<0.01)。脾脏脏器指数同样差异显著(3.83±0.60 mg/g比2.86±0.49 mg/g,P<0.01);与模型组比较,低、中、高剂量组脾脏重量降低,中、高剂量组差异显著(中剂量组127±16.2 mg,P<0.05;高剂量组120±17.8 mg,P<0.01)。另外,低、中、高剂量组脾脏脏器指数剂量依赖性地降低,但差异均无统计学意义。阳性药物组脾脏重量和脏器指数与模型组比较,均显著地降低(图1C)。
心脏:与正常对照组比较,高脂模型组动物心脏重量显著增加(224±21.9 mg比188±14.3 mg,P<0.01);与模型组比较,低、中、高剂量组心脏重量均有降低,其中高、中剂量组差异显著(中剂量组190±22.4 mg,P<0.05;高剂量组188±17.5 mg,P<0.01)。阳性药物组心脏重量同样显著降低(191±10.9 mg比224±21.9,P<0.01)。但心脏脏器指数,模型组和给药组均无显著差异(图1D)。
以上结果说明血通胶囊主要对高脂引起的肝脏、脾脏、心脏增大作用显著,其中尤以肝脏最为显著,可明显减轻肝脏绝对重量和脏器指数,减轻高脂引起的肝脏肿大。
-
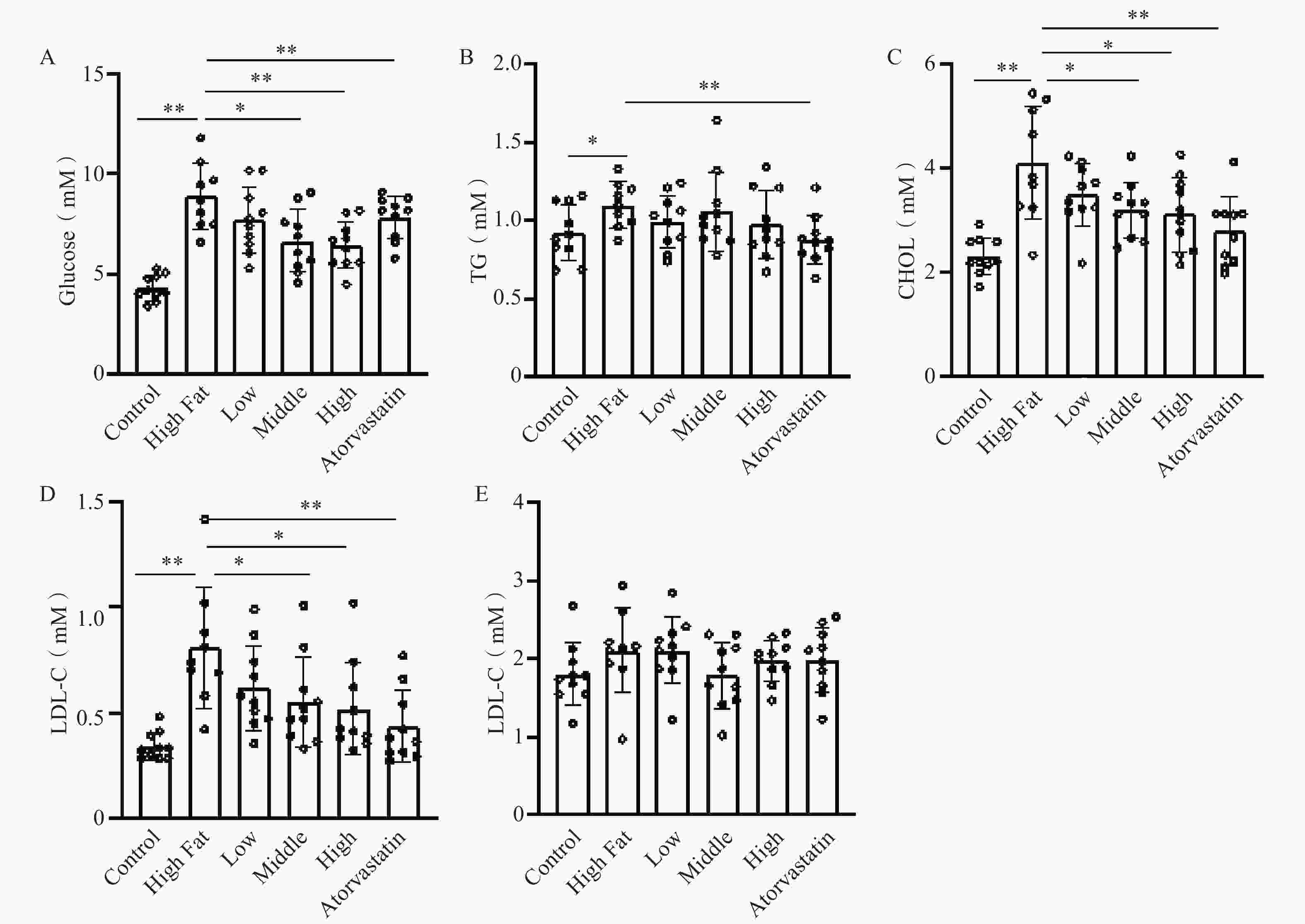
血糖:与正常对照组比较,高脂模型组动物血糖显著增加(8.89±1.66 mM比4.34±0.65 mM,P<0.01);与模型组比较,低、中、高剂量组血糖剂量依赖性地降低,只有中、高剂量组有统计学差异(中剂量组7.73±1.65 mM;高剂量组6.46±1.18 mM,P<0.05)。低剂量组和阳性药物组有下降趋势,但无统计学差异(P>0.05),具体见图2A。
血脂:与正常对照组相比,高脂模型动物组TG显著增加(1.10±0.15比0.92±0.18 mM,P<0.05),并显著地增加CHOL水平(4.10±0.1.09 mM比 2.31±0.36 mM,P<0.01);阳性药物组显著地降低动物TG水平(0.88±0.16 mM 比1.10±0.15 mM,P<0.05),并同样显著降低CHOL水平(2.79±0.66 mM P<0.01)。与模型组相比,低、中、高剂量组TG水平均无显著差异,但低、中、高剂量组剂量依赖性地降低模型小鼠CHOL水平,中、高剂量组有统计学差异(中剂量组3.20±0.54 mM和高剂量组3.12±0.72 mM比模型组4.10±0.1.09 mM,P<0.05)。LDL-C结果类似,中、高剂量组和阳性药物LDL-C水平显著降低(中剂量组0.55±0.21 mM;高剂量组0.52±0.22 mM,P<0.05;阳性药物组0.43±0.17 mM比模型组0.81±0.29 mM,P<0.01)。与正常对照组比较,高脂造模组与各给药组HDL-C水平无显著差异,具体结果见图2B~2E。
-
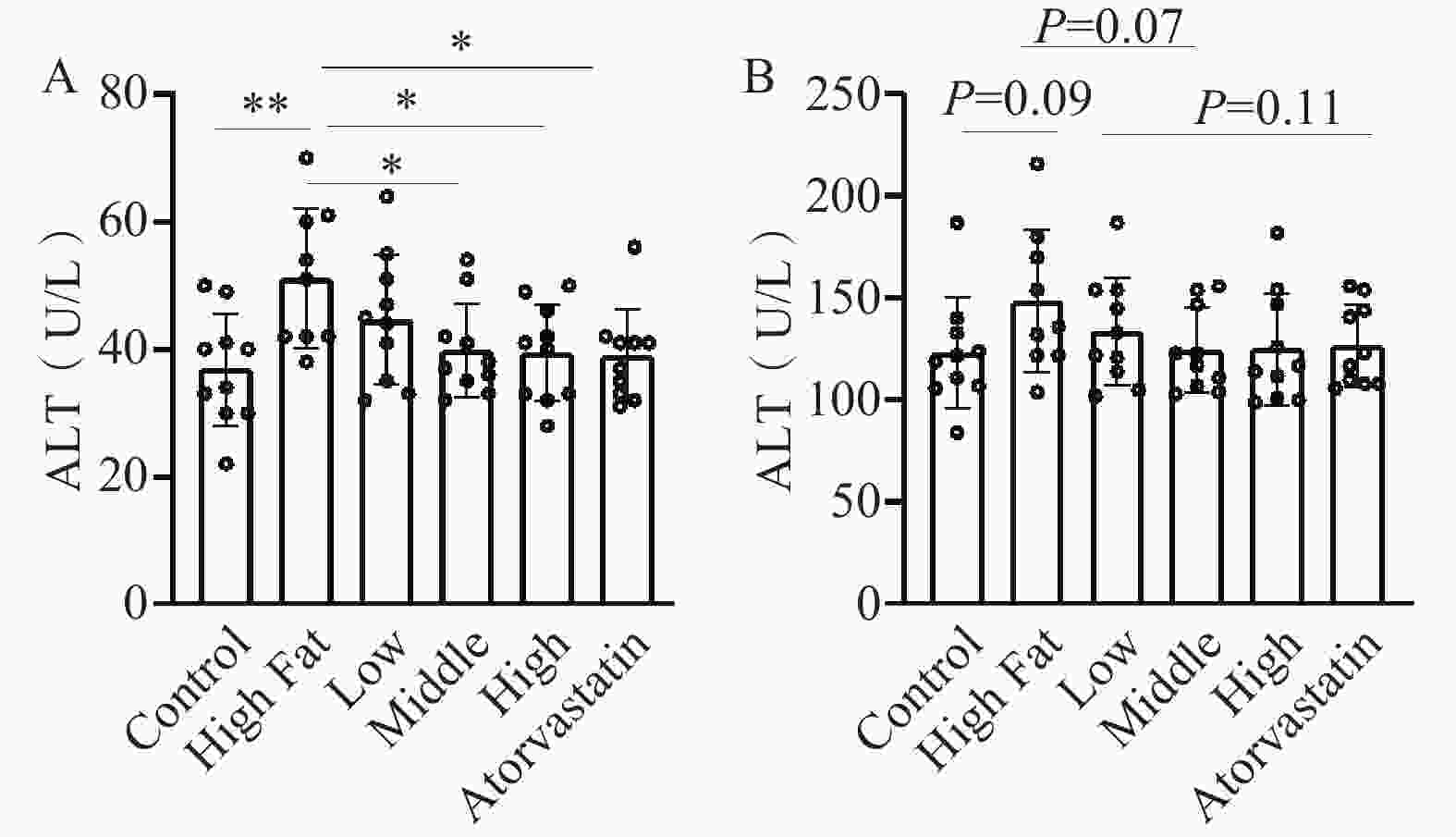
肝功能指标。ALT:与正常对照组比较,高脂模型组动物ALT显著增加(51.1±11.0 U/L比36.9±8.79U/L,P<0.01)。与模型组比较,低、中、高剂量组ALT剂量依赖性地降低,中、高剂量组差异显著(中剂量组39.9±7.37U/L;高剂量组39.4±7.63U/L,P<0.05)。阳性药物组ALT水平显著降低(38.9±7.29 U/L,P<0.05)(图3A)。AST:高脂模型组AST水平增加,但无统计学差异(148±35.1比123±27.3 U/L,P>0.05)。与模型组比较,低、中、高剂量组AST水平降低,但无统计学差异(P>0.05);阳性药物组AST水平降低,与模型组比较无统计学差异(图3B)。
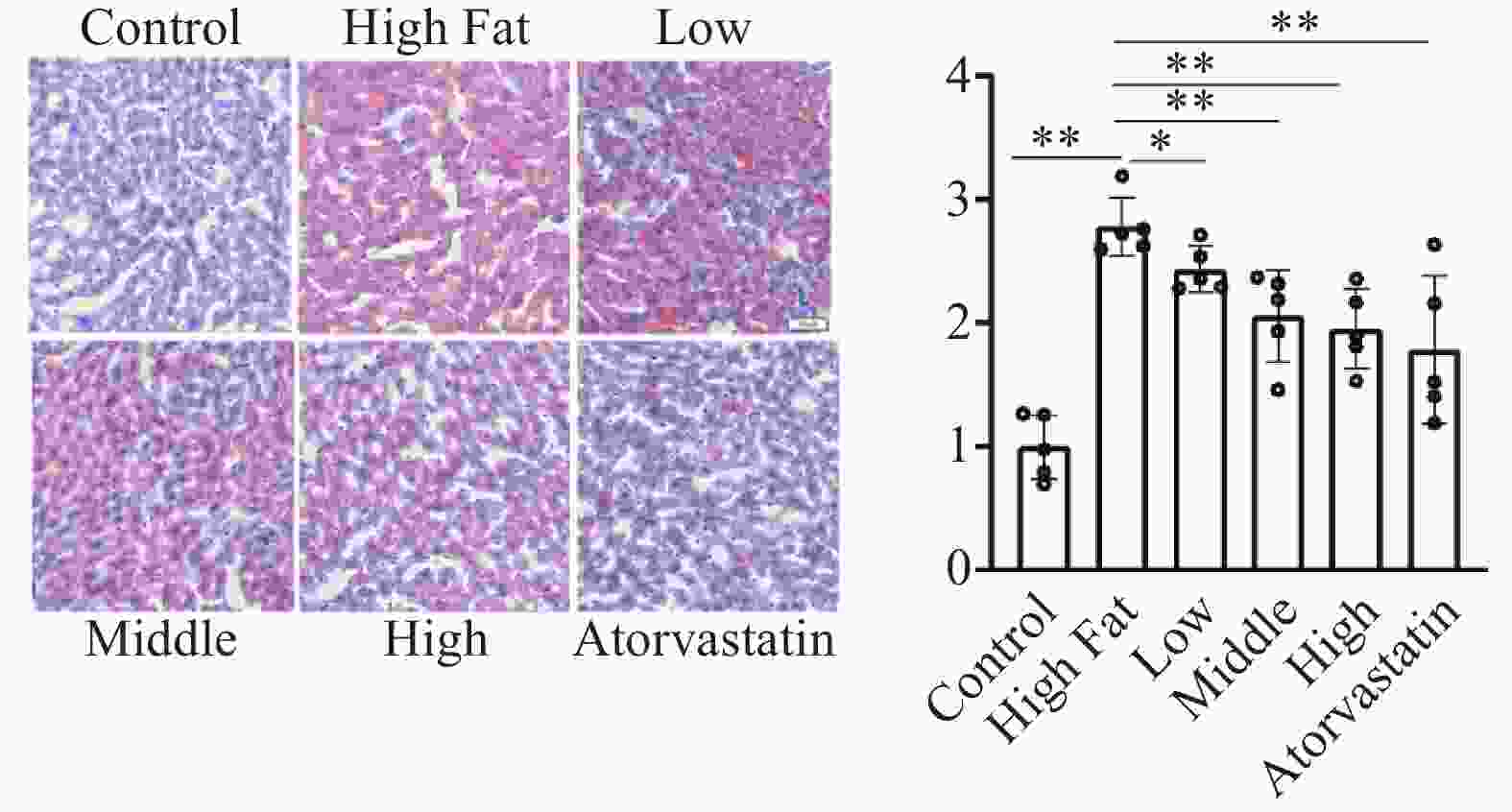
油红O染色:与正常对照组比较,高脂模型组动物肝脏脂滴染色显著增加(2.78±0.24比1.00±0.26,P<0.01)。与模型组比较,低、中、高剂量组油红染色程度剂量依赖性显著降低(低剂量组2.44±0.19,P<0.05;中剂量组2.05±0.37,P<0.01;高剂量组1.95±0.32,P<0.01);阳性药物组也显著降低染色程度(P<0.01)(图4)。以上结果说明血通胶囊可以显著地减轻肝脏脂肪沉积,减轻肝脏损伤。
-
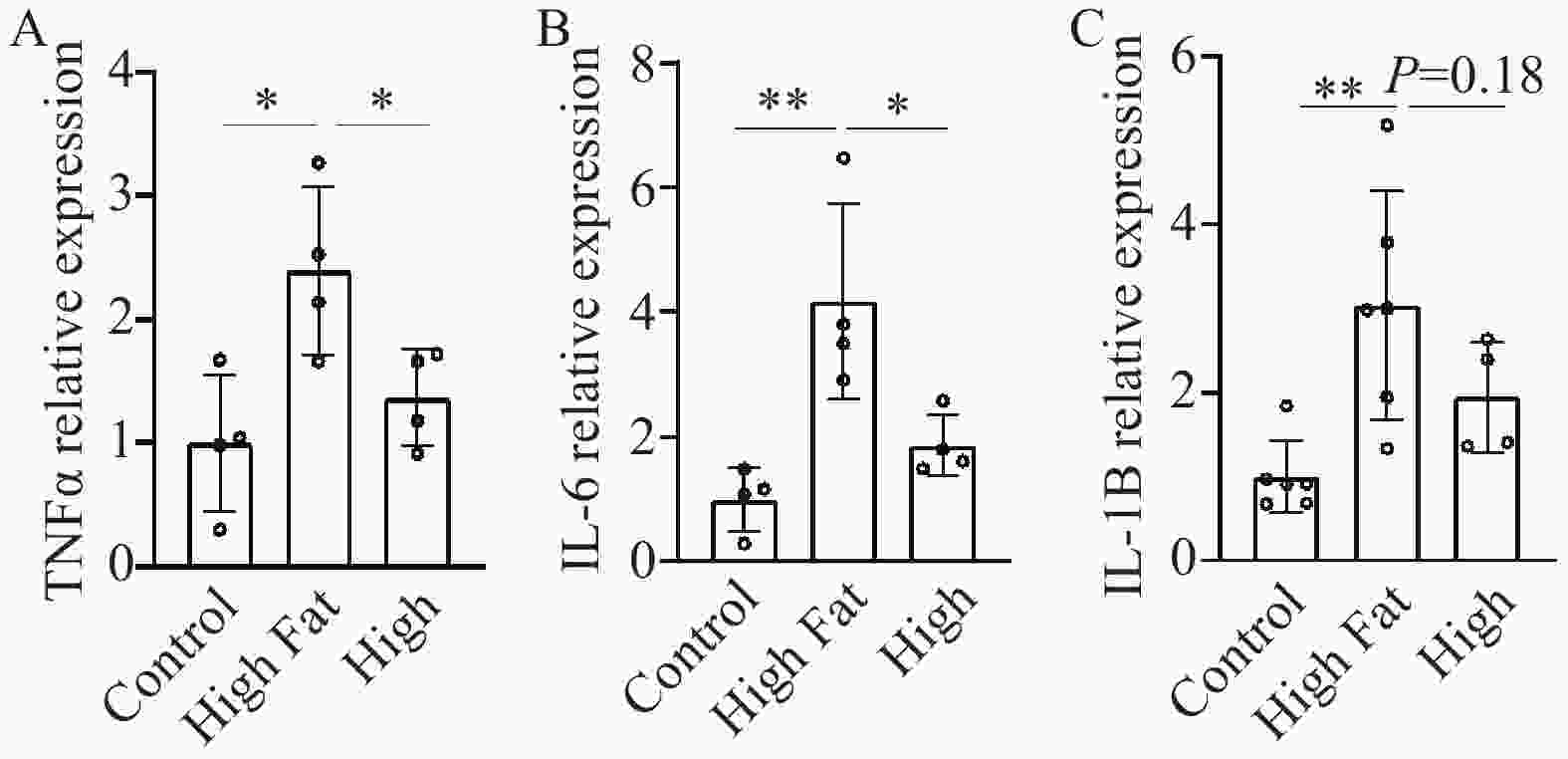
为探讨血通胶囊降低血脂、减轻肝脏损伤的机制,我们选择TNF-α、IL-6和IL-1β三个炎性因子,利用PCR技术,检测其变化情况,治疗组选择疗效最为显著的高剂量组。与正常对照组比较,高脂模型组动物TNF-α、IL-6和IL-1β表达均显著增加(TNF-α:2.40±0.68 比1.00±0.56,P<0.05;IL-6:4.17±1.58 比1.00±0.51,P<0.01;IL-1β:3.04±1.36比1.00±0.43,P<0.01)。与模型组比较,高剂量组TNF-α和IL-6表达显著降低(TNF-α:1.37±0.38比2.40±0.68,P<0.05;IL-6:1.87±0.49 比4.17±1.58,P<0.05)(图5A-C)。高剂量组IL-1β水平降低,但统计学无显著性差异(1.95±0.66比3.04±1.36,P=0.18)(图5C)。以上结果说明,血通胶囊可以显著地降低肝脏组织炎性因子表达。
-
血通胶囊在临床上主要用于老年高脂血症治疗[7-8]。前期血通胶囊降血脂作用为临床真实世界研究,也缺乏相应的机制探讨,因此需要开展进一步的疗效评价以及机制研究。本研究结果显示,血通胶囊可以显著地降低高血脂小鼠血脂,降低CHOL和LDL-C水平,减轻肝脏脂肪沉积和炎性损伤。
现代医学研究支持血通胶囊的中药单药在改善血脂方面可能具有较好作用。研究证实:水蛭具有抗血小板聚集,降血脂,抗动脉粥样硬化等作用。水蛭的主要成分是蛋白质和肽大分子。根据其药理作用,它们可分为两类。一组由直接靶向凝血系统的活性成分组成,如水蛭素、肝素和组胺。另一组包括蛋白酶抑制剂成分,如decorsin和hementin。其中,水蛭唾液腺分泌的水蛭素是最有效的凝血酶抑制剂,在发现肝素之前,它是预防凝血的唯一药物。另一类为其他蛋白酶抑制剂组分,如水蛭透明质酸酶、destabilase、decorsin、eglin等,具有较强的抗凝作用,能抑制血小板聚集,降血脂,消退动脉粥样硬化等作用[11]。另有研究通过筛选出水蛭的34种活性成分开展深入机制探讨,发现水蛭的活性成分通过与炎症反应、氧化应激和脂质代谢相关的多组分、多靶点和多通道作用机制在预防动脉粥样硬化中发挥重要作用[12]。
大黄是一种具有降脂、抗炎和抗氧化特性的传统中药,其活性成分主要为含蒽醌类化合物[13]。脂质代谢紊乱是高脂血症引起组织损伤的基础,在高脂血症的发展中起着关键作用。研究发现,大黄提取物,包括大黄素、大黄酸和大黄酚,通过C/EBPα、3T3-L1、PPARα和AMPK等信号通路调节总CHOL、TG、TNF-α和IL-1β水平,从而改善高脂血症[14]。
何首乌化学成分已经报道分离出100多种化合物,主要成分包括二苯乙烯、醌、黄酮等,如2,3,5,4'-四羟基二苯乙烯-2-O-β-d-吡喃葡萄糖苷和大黄素等。何首乌的粗提取物和纯化合物有抗衰老、抗高脂血症、抗癌和抗炎作用,以及促进免疫调节、神经保护等作用。在阿尔茨海默病、帕金森病、高脂血症、炎症和癌症等疾病中的治疗潜力已得到证实[15-16]。
基于我们前期临床发现和中药单药研究,我们重点围绕血通胶囊的抗高血脂作用,对其降脂作用以及减轻肝脏损伤作用开展了系统研究。结果明确了血通胶囊具有显著地降低血脂作用,同时可显著降低肝脏油脂含量。肝脏是血脂调节的主要器官,我们的研究也证实,血通胶囊具有明确的肝脏保护作用,显著地降低高脂引起的肝脏增大,并降低高脂引起的转氨酶异常增高。基于以上研究,我们推测,血通胶囊可能是通过保护肝脏,改善肝脏功能发挥降血脂作用。
炎症在高血脂的发生发展,以及动脉粥样硬化形成中发挥重要作用。近期,美国一项研究共纳入了
6117 名美国成年人,多元线性回归分析发现,全身免疫炎症指数(SII)与高脂血症之间存在显著的正相关关系,而年龄、性别、体重指数、吸烟状况、高血压和糖尿病与这种正相关没有显著相关性。这一结果明确SII水平与高脂血症之间存在显著关联[17]。炎症会进一步导致冠状动脉疾病和动脉粥样硬化[18]。脂蛋白的进入、滞留和氧化修饰会导致内皮损伤,引发先天性和适应性免疫反应。进一步发展为早期动脉粥样硬化病变,最终通过各种炎症级联促发心脑血管疾病[19]。高血脂对肝脏的损伤包括两次打击:“第一次打击”包括肝脏中的脂质积聚,随后是“第二次打击”,主要是炎性因子等诱导炎症、肝细胞损伤和纤维化,诱发非酒精性脂肪肝,并进一步加重高血脂。因此减轻炎性损伤,对于肝脏保护和改善血脂均具有重要的临床价值。我们的结果显示,高血脂可引起肝脏增大,肝脏脂肪堆积增加,同时,炎性因子TNF-α、IL-6以及IL-1β含量显著增加,加重肝脏炎症损伤。血通胶囊可以显著地减轻肝脏损伤,降低肝脏脏器指数,减少肝脏脂肪堆积,这一作用可能与降低TNF-α、IL-6表达水平有密切关联。
The hypolipidemic function and hepatic protective effects of Xuetong capsules
-
摘要:
目的 观察血通胶囊对高血脂模型动物的血脂、肝脏损伤的保护作用。 方法 ICR小鼠60只,随机分为6组,一组给于正常饲料,其余各组利用高脂饲料制备高血脂模型,造模4周后,3组灌胃给予低、中、高剂量血通胶囊(0.5、1.0和2.0 g/kg),阳性药物阿托伐他汀钙灌胃给药(剂量为1.5 mg/kg),模型组给予溶媒(0.5%羧甲基纤维素钠)。连续治疗8周,随后测定动物体重、脏器指数、血脂、血糖、肝功能指标,肝脏油红染色测定脂滴含量,利用定量PCR检测炎性因子TNF-α、IL-6和IL-1β表达水平。 结果 高脂造模显著增加小鼠体重,增加肝脏、脾脏绝对重量和脏器指数,加重肝脏油红染色程度,血清血糖以及甘油三酯(TG)、胆固醇(CHOL)、低密度脂蛋白胆固醇(LDL-C)水平显著增加。与模型组比较,低、中、高剂量组TG水平与模型组均无显著差异。3个组剂量依赖性地降低模型小鼠CHOL,中、高剂量组有统计学差异。LDL-C结果类似,中、高剂量组LDL-C水平显著降低(中剂量组0.55±0.21 mM;高剂量组0.52±0.22 mM 与模型组0.81±0.29 mM,P<0.01)。与正常对照比较,高脂造模与各给药组HDL-C水平无显著差异。肝脏功能显示,血通胶囊显著地降低肝脏油红染色程度,降低高脂引起的谷丙转氨酶(ALT)升高。阿托伐他汀钙显著降低高脂模型动物体重,减轻肝脏和脾脏绝对重量和脏器指数,同时降低血清CHOL、LDL-C以及TG,减少ALT水平,减轻肝脏油红染色程度。进一步的研究显示,血通胶囊高剂量可显著降低高脂引起的TNF-α和IL-6表达(P<0.05),一定程度降低IL-1β水平,但统计学无显著性差异(P>0.05)。 结论 血通胶囊显著降低高脂动物体重,减轻肝脏增大、脂肪沉积和炎性损伤,显著地降低血脂CHOL、LDL-C水平,减少转氨酶升高。以上作用可能与血通胶囊减少肝脏TNF-α、IL-6等炎性因子表达有关。 Abstract:Objective To investigate the effects of Xuetong capsule on blood lipids and liver lesion in hyperlipidemic model animals. Method Sixty ICR mice were randomly divided into six groups. The normal control group was fed with normal diet, the other groups were fed with high-fat diet to induce hyperlipidemia. After four weeks feeding, the three groups were given low, middle, and high doses of Xuetong capsules (0.5, 1.0, and 2.0 g/kg ) by Gavage, and the positive control drug atorvastatin calcium (1.5 mg/kg). The model group was given solvent (0.5% carboxymethyl cellulose sodium). After treatment for 8 weeks, the body weight, organ index, blood lipids, blood glucose and liver function index were measured. The liver oil red staining was used to determine the lipid droplet content, and quantitative PCR was used to detect the expression of inflammatory factors TNF-α, IL-6, and IL-1β. Result The body weight, the weight of liver and spleen were significantly increased by high-fat diet. High-fat diet increased the organ indexes of the liver and spleen, the degree of liver oil red staining, and also significantly increased the levels of glucose, triglyceride (TG), cholesterol (CHOL), and low-density lipoprotein cholesterol (LDL-C) in serum. Compared with the model group, the level of TG has no significant change in low, middle and high doses groups. The level of CHOL in serum was reduced by Xuetong capsule with a dose dependent manner. There were significant difference between the model group and middle, high doses groups. The results of LDL-C were similar, the level of LDL-C was significantly reduced by middle and high doses groups (middle dose 0.55±0.21 mM, high dose 0.52±0.22 mM v.s. 0.81±0.29 mM in model group P<0.01). Compared with the normal control, there was no significant difference in HDL-C levels between the high-fat model and each drug-treated group. Liver function showed that Xuetong capsules significantly reduced the degree of liver oil red staining and decreased the level of alanine aminotransferase (ALT) induced by high-fat diet. The body weight, the weight and organ indexes of liver and spleen were significantly reduced by atorvastatin calcium. The levels of CHOL, LDL-C, and TG, and the degree of liver oil red staining were also significantly reduced in atorvastatin calcium group. Further studies have shown that high dose of Xuetong capsules significantly reduced the expression of TNF-α and IL-6 induced by high-fat diet (P<0.05), while the reduction of IL-1β was not so significant (P>0.05). Conclusion Xuetong capsules significantly reduces the body weight of animals with high fat, reduce liver size, fat deposition, inflammatory damage and also significantly reduces blood lipid CHOL and LDL-C levels and reduce transaminase elevation. The above effects may be related to Xuetong capsules reducing the expression of inflammatory factors such as TNF-α and IL-6 in the liver. -
Key words:
- Xuetong capsule /
- hyperlipidemia /
- liver injury /
- inflammatory factors
-
-
[1] 国家心血管病中心. 中国心血管健康与疾病报告2023[R]. 2024. [2] MARTINSS, ADAYAW, ALMARZOOQZI, et al. 2024 heart disease and stroke statistics: areport of US and global data from the American heart association[J]. Circulation, 2024, 149(8):e347-e913. [3] LIK C, HUANGL P, TIANM Y, et al. Cost-effectiveness of a household salt substitution intervention: findings from 20 995 participants of the salt substitute and stroke study[J]. Circulation, 2022, 145(20):1534-1541. doi: 10.1161/CIRCULATIONAHA.122.059573 [4] QUAN J C, PANG D, LIT K, et al. Risk prediction scores for mortality, cerebrovascular, and heart disease among Chinese people with type 2 diabetes[J]. 2019, 104(12): 5823-5830. [5] ALLOUBANI A, NIMER R, SAMARA R. Relationship between hyperlipidemia, cardiovascular disease and stroke: asystematic review[J]. Curr Cardiol Rev, 2021, 17(6):e051121189015. doi: 10.2174/1573403X16999201210200342 [6] REAMYB V, FORD B, GOODMAN C. Novel pharmacotherapies for hyperlipidemia[J]. Prim Care, 2024, 51(1):27-40. doi: 10.1016/j.pop.2023.08.002 [7] 陈敏先, 姚克裘, 周曾绮, 等. “血通胶囊”治疗高脂血症、高粘滞血症的临床观察[J]. 江苏中医, 1997, 29(10):13-14. [8] 姚克裘, 周曾绮, 陈敏先. 血通胶囊对老年高脂血症影响的临床研究[J]. 上海中医药杂志, 1995, 29(1):37-38. [9] MAO T H, ZHANG C X, YANG S, et al. Semaglutide alters gut microbiota and improves NAFLD in db/db mice[J]. BiochemBiophys Res Commun, 2024, 710:149882. doi: 10.1016/j.bbrc.2024.149882 [10] DING J, XU M, DU W, et al. Myeloid-specific blockade of Notch signaling ameliorates nonalcoholic fatty liver disease in mice[J]. Int J Biol Sci, 2023, 19(6):1941-1954. doi: 10.7150/ijbs.80122 [11] WU S H, ZHOU YY, WANG Y, et al. Therapeutic potentials of medicinal leech in Chinese medicine[J]. 2024, 52(4): 1027-1051. [12] LV Q, LI M Y, WEN Z Y, et al. Efficacy and potential mechanism of atherosclerosis prevention by the active components of leech based on network pharmacology combined with animal experiments[J]. Heliyon, 2024, 10(6):e27461. doi: 10.1016/j.heliyon.2024.e27461 [13] YAO M, LI J M, HE M Z, et al. Investigation and identification of the multiple components of Rheum officinaleBaill. using ultra-high-performance liquid chromatography coupled with quadrupole-time-of-flight tandem mass spectrometry and data mining strategy[J]. J Sep Sci, 2021, 44(3):681-690. doi: 10.1002/jssc.202000735 [14] WU L J, WANG X J, JIANG J H, et al. Mechanism of rhubarb in the treatment of hyperlipidemia: a recent review[J]. Open Med, 2023, 18(1):20230812. doi: 10.1515/med-2023-0812 [15] LIN L F, NI B R, LIN H M, et al. Traditional usages, botany, phytochemistry, pharmacology and toxicology of Polygonum multiflorum Thunb. : a review[J]. J Ethnopharmacol, 2015, 159:158-183. doi: 10.1016/j.jep.2014.11.009 [16] TEKA T, WANG L M, GAO J, et al. Polygonum multiflorum: Recent updates on newly isolated compounds, potential hepatotoxic compounds and their mechanisms[J]. J Ethnopharmacol, 2021, 271:113864. doi: 10.1016/j.jep.2021.113864 [17] MAHEMUTI N, JING X Y, ZHANG N J, et al. Association between systemic immunity-inflammation index and hyperlipidemia: apopulation-based study from the NHANES(2015-2020)[J]. Nutrients, 2023, 15(5):1177. doi: 10.3390/nu15051177 [18] ATTIQ A, AFZAL S, AHMAD W, et al. Hegemony of inflammation in atherosclerosis and coronary artery disease[J]. Eur J Pharmacol, 2024, 966:176338. doi: 10.1016/j.ejphar.2024.176338 [19] AUGUET T, BERLANGA A, GUIU-JURADO E, et al. Molecular pathways in non-alcoholic fatty liver disease[J]. Clin Exp Gastroenterol, 2014: 221. -




 下载:
下载: