-

-
肝癌(HCC)是全球常见且致命的恶性肿瘤,尤其在东亚、东南亚和撒哈拉以南非洲等地区发病率较高。据2020年全球癌症统计,全球每年约有90.57万例肝癌新发病例,使其成为全球第六大常见癌症,占癌症总数的4.7%;同年,肝癌相关死亡人数达83.02万,位列癌症致死原因的第三位[1]。肝癌类型主要分为肝细胞癌(Hepatocellular Carcinoma, HCC)、肝内胆管癌(Intrahepatic Cholangiocarcinoma, ICC)和混合型肝癌(Mixed Hepatocellular-Cholangiocarcinoma, cHCC-CCA)。不同类型肝癌的临床表现和病理特征差异显著,尤其是肝内胆管癌侵袭性更强、诊断更为困难[2]。
目前,肝癌的诊断依赖多种影像学技术,包括计算机断层扫描(Computed Tomography, CT)、磁共振成像(Magnetic Resonance Imaging, MRI)、正电子发射断层扫描(Positron Emission Tomography, PET)和超声成像(Ultrasonography, US)。CT对肝脏结构显像清晰,但无法提供分子信息[3];MRI在软组织分辨率上优于CT,但成本高且检查时间较长[4];PET能追踪放射性标记物的代谢活动,但灵敏度较低,尤其对早期肝癌检测不理想[5];超声因操作简便、无创,广泛用于筛查,但早期肝癌的检测效果有限[6]。总体而言,这些传统技术在捕捉肝癌早期分子变化和分型上存在显著局限,导致诊断延迟,错过最佳治疗时机。此外,肝癌具有高度异质性,五年内复发率高达70%至80%,亟需开发新的药物及监测其代谢机制[7-9]。
质谱成像(Mass Spectrometry Imaging, MSI)是一种新兴技术,能够将组织的空间分辨率和分子信息相结合,不仅提供组织解剖信息,还揭示分子特征和代谢途径[10]。相比传统影像技术,MSI能更全面地展示肝癌组织的分子异质性、分型及代谢变化。如果将MSI应用于肝癌的早期诊断和分子机制研究,将有助于提高早期发现率,并为个性化治疗提供有力支持。本文综述了MSI在肝癌的早期诊断、分型、分子机制研究及药物疗效评价中的最新进展。
-
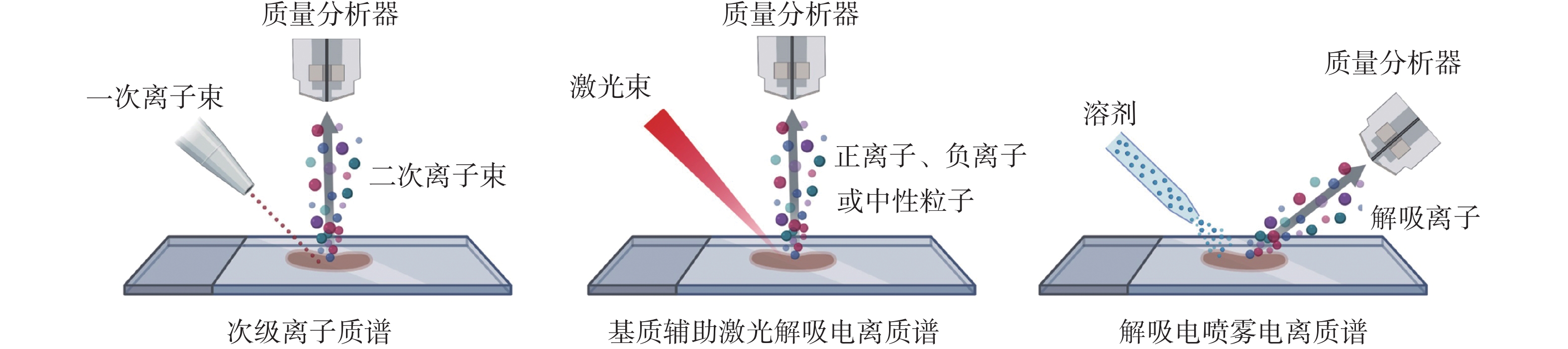
质谱成像(Mass Spectrometry Imaging, MSI)是一种结合分子量信息和空间分辨率的分子成像技术,能够直接分析生物样本中的化学成分,并以成像形式展示这些成分在样本中的空间分布。MSI的工作原理基于将生物样本表面的分子电离,并通过质谱仪对这些电离的分子进行质量分析,最终生成分子分布图谱[1]。根据不同的离子化方式,MSI可分为几种主要技术类型,包括次级离子质谱(SIMS)、基质辅助激光解吸电离质谱(MALDI-MS)和解吸电喷雾电离质谱(DESI-MS),这些技术各自的电离方式不同(图1)[11],具备不同的优势,适用于多样化的研究场景,表1比较了SIMS、MALDI和DESI离子化技术。
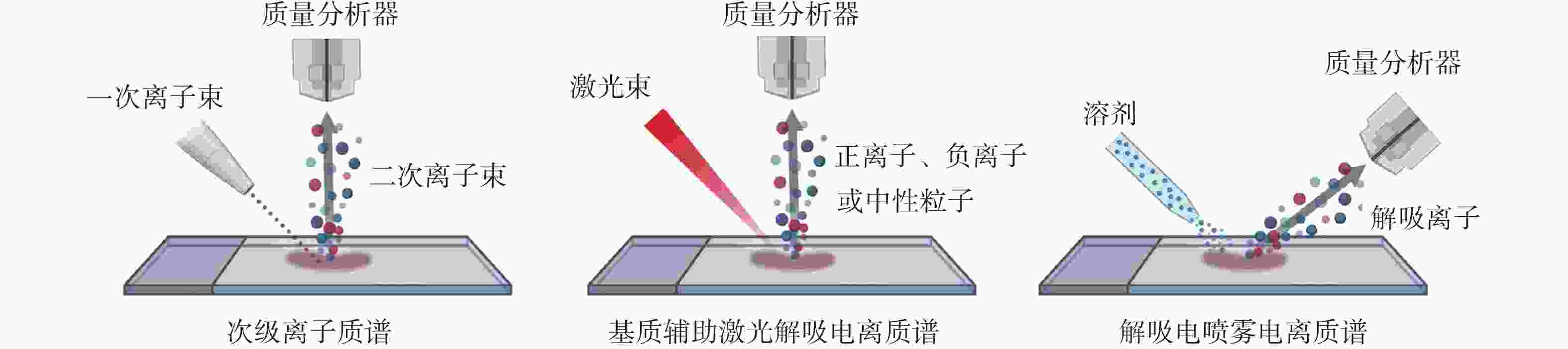
图 1 MSI技术的3种电离方式[11]
表 1 MSI技术的3种电离方式的比较
质谱成像技术 次级离子质谱 基质辅助激光解吸电离质谱 解吸电喷雾电离质谱 环境条件 真空 真空 常温常压 空间分辨率 一般1 ~ 100 μm 一般10 ~ 100 μm 一般40 ~ 200 μm 样品处理 冷冻切片 冷冻切片,需借助基质离子化 冷冻切片 检测对象 分子量小于1 000的疏水性化合物 不受样本与分子量限制 分子量小于2 000的化合物 优势 高空间分辨率、高灵敏、
免标记、多组分分析高空间分辨率、高质量分辨率 高通量、最小样本量、高效率 局限性 无法进行实时原位分析、
测试易产生碎片离子上机前处理时间长、
激光器维护费用高空间分辨率有待提高、难对大分子量的
化合物进行分析SIMS适用于小分子和元素分布检测。通过高能离子束轰击样品表面,诱发次级离子的产生。SIMS的空间分辨率极高,可达到纳米级别,适合分析细胞内的分子分布,但对大分子的检测灵敏度较低[12]。
MALDI-MS是目前应用最为广泛的MSI技术,尤其适合分析大分子如蛋白质、多肽以及某些大分子代谢物[13]。MALDI-MS适合大分子物质(如蛋白质和多肽)的分析,其原理是通过激光照射基质使样本电离,能高效检测大分子,且对样本破坏小,已广泛用于疾病标志物发现和肿瘤分析[12]。
DESI-MS是一种非侵入性的大气压下MSI技术,其原理是通过带电微滴喷射样品表面,引发表面分子解吸并电离进入质谱仪进行分析[14]。这一技术能够在不破坏样品的前提下进行分析,且样品准备简单,特别适合用于组织切片的实时分析[13]。DESI-MS在肿瘤研究中显示出广泛的应用潜力,尤其在代谢物和脂质的分析方面。
MSI技术的核心优势在于其结合了空间分辨率和分子信息的获取能力。特别是在肝癌研究中,MSI通过无标记检测,揭示肿瘤微环境中的代谢物、脂质和蛋白质分布,为分子分型和亚型区分提供重要依据。MSI还能揭示肿瘤中的脂质代谢和糖代谢异常,为早期诊断和个性化治疗提供关键分子信息[15]。
-
肝癌通常在晚期才被发现,且容易与其他肝脏病变混淆[16]。传统的影像学技术如CT和MRI能够提供肿瘤的解剖结构信息,但对于分子水平上的病变识别仍存在局限性[17]。肿瘤标志物如甲胎蛋白(AFP)和癌胚抗原(CEA)虽然可以为肝癌的诊断提供一定的帮助,但灵敏度和特异性仍不足,尤其是在ICC和cHCC-CCA的早期诊断中效果有限[18]。因此,准确的早期诊断和肿瘤分型对于提高肝癌的治疗效果具有重要意义。MSI作为一种高分辨率分子成像工具,通过对代谢物、脂质、蛋白质等分子信息进行直接检测,并展示其在肿瘤组织中的空间分布,为肝癌的精准分型和早期检测提供了新的方法并为研究肝癌的分子机制提供了新的视角[19],在肝癌分型和早期诊断中展现了显著的优势。
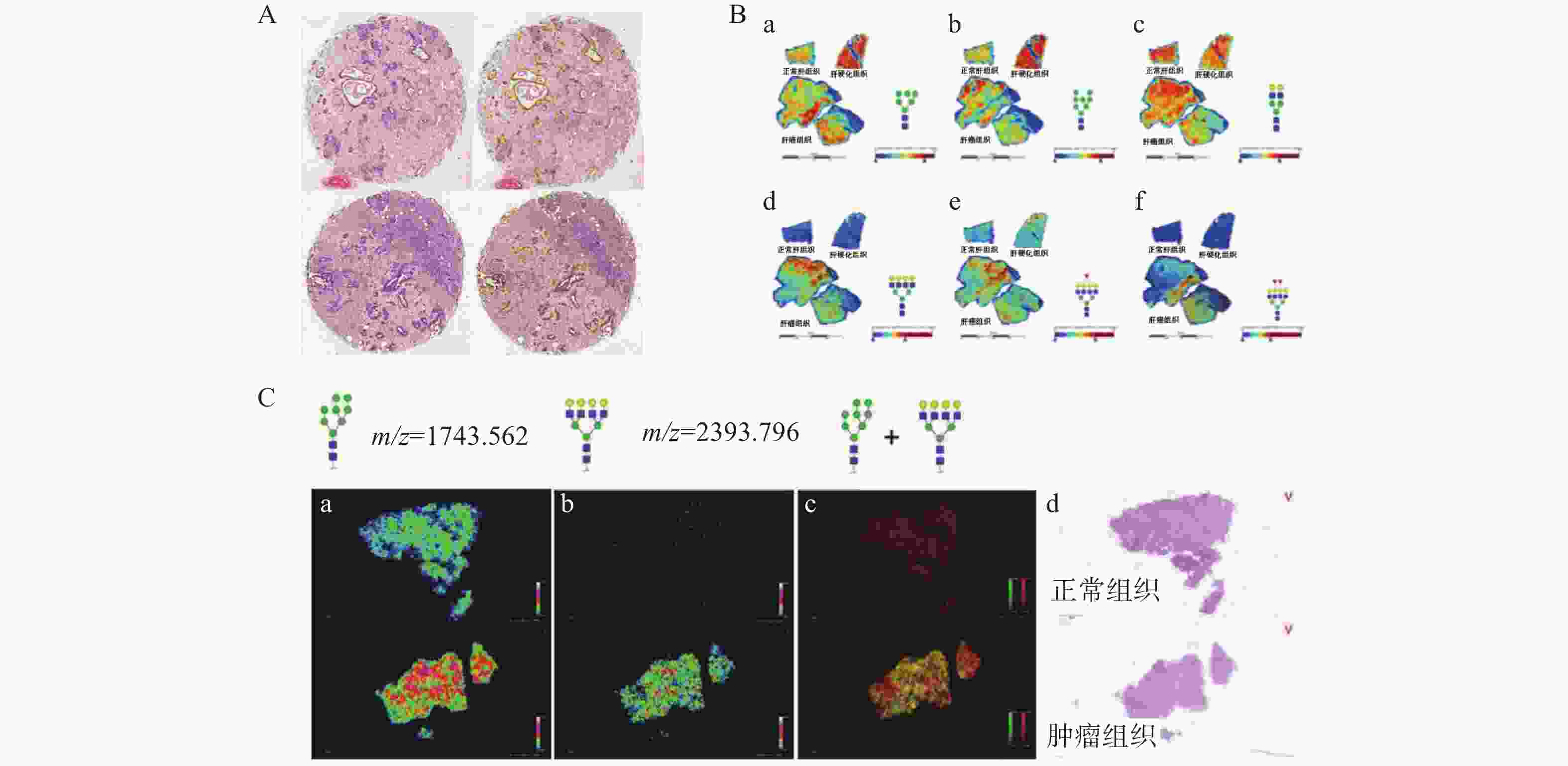
在肝内胆管癌的研究中,MSI已被广泛应用于早期检测与分型。Bollwein等[20]通过MALDI-MS成像技术对41例胰管腺癌和41例胆管癌进行分析癌症组织中的蛋白质和代谢物分布,发现了用于区分不同癌症亚型的生物标志物,成功区分了胰腺癌和胆管癌,揭示了这些癌症之间的代谢差异。为现有的诊断工具(如免疫组织化学)提供了一种有希望的补充或替代方法,为不同类型肿瘤的分型提供了新的思路(图2A)。
West等[21]基于MSI技术开发了一种基于原位组织的N-聚糖成像方法分析了138个HCC组织样本,并将癌组织中的N-聚糖与邻近未转化的或来自肝硬化但无癌患者的组织进行了比较。与肝硬化或邻近组织相比,HCC组织中有10种聚糖显著升高。这项工作支持了HCC血清中的N-聚糖水平增加是直接从癌组织产生的假设,显示其在HCC早期诊断和治疗中的潜在价值(图2B)。
Powers等[22]利用基质辅助激光解吸电离成像质谱法(MALDI-IMS)对n-糖苷酶F在冷冻或福尔马林固定组织中释放的多种N-聚糖的位置和分布进行了空间分析,对多种福尔马林固定的人肝细胞癌组织进行了评估,结果检测到30多个n-聚糖。证明了该方法在使用不同的肝癌FFPE组织切片分析多种N -聚糖方面的实用性。具有识别全身性疾病标志物和阐明疾病病因的潜力(图2,C)。
MSI技术能够揭示不同肝癌类型的分子特征,为肝癌的分型和早期诊断提供了强大的支持,能够揭示不同肝癌类型的分子特征,特别是在肝内胆管癌和混合型肝癌的早期发现和分型上具有独特的优势。MSI不仅在肝癌的分型和早期诊断中起到了关键作用,还在预后监测和复发预测中展示了广阔的应用前景。
-
肝癌的发生和发展是一个复杂的多因素过程,涉及代谢异常、蛋白质修饰、信号传导通路改变及肿瘤微环境的变化[7]。MSI技术作为一种高分辨率分子成像工具,能够揭示肿瘤组织中代谢物、脂质和蛋白质的空间分布,为理解肝癌的分子机制提供了全新的视角[23]。
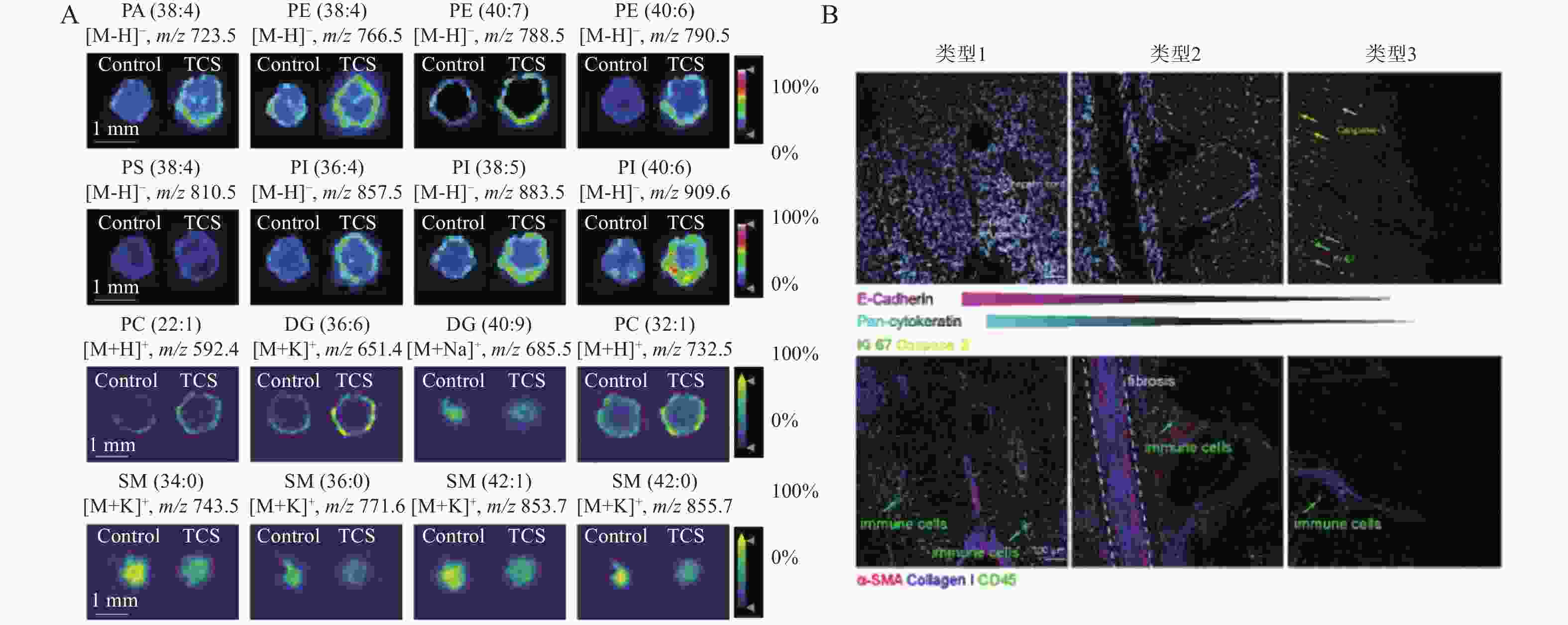
陈静等[24]研究三氯生(TCS)暴露对肝癌肿瘤细胞球生长的影响,基于MALDI-MS技术拟建立肝癌肿瘤细胞球模型,分析并比较了脂质小分子在肿瘤细胞球内丰度和分布的差异,发现TCS暴露可以显著促进肝癌肿瘤细胞球的增长,并引起脂质代谢的变化(图3,A)。
肿瘤微环境(Tumor Microenvironment, TME)是影响肝癌发展的关键因素,Sheng等[7]通过利用成像质谱流式技术(IMC)解析了肝癌肿瘤微环境中细胞邻近关系的拓扑结构,发现了不同谱系的巨噬细胞对肿瘤发展的反向调节作用。揭示了三种主要类型TME和瘤内区域,表现出肝细胞去分化,间质细胞和免疫细胞的区域特异性分布,为理解免疫细胞在肝癌发展中的作用提供了新的视角。(图3,B)。
孙菲等[25]串联质谱成像技术(MALDI-TOF-MS)被应用于肝细胞肝癌组织的空间脂质组学分析,通过对磷脂中C=C位置异构体的精细结构质谱成像,揭示了肝脏癌变区域及癌旁区域的显著性差异,为癌症和癌旁边界的鉴定提供了新的视角。
陈兵等[26]应用MALDI-TOF-MS检测原发性肝癌骨转移患者血清的多肽差异谱,筛选得到的血清多肽可能成为潜在的诊断HCC骨转移的肿瘤标志物,为今后通过此技术手段找到更多的早期分子标志物,建立有效的预测模型,预测HCC骨转移高危患者打下了基础。
质谱成像技术帮助我们更深入地了解肿瘤微环境以及相关的代谢物的变化,这不仅帮助我们更好地理解肝癌的分子病理机制,还为肝癌的靶向治疗提供了重要的线索。此外,该技术为解析肝癌的分子机制提供了前所未有的机会。这些发现不仅推动了肝癌基础研究的发展,还为临床诊断和个性化治疗提供了潜在的应用价值。
-
尽管MSI技术在肝癌及其他疾病的诊断、治疗和研究中展现出巨大潜力,但它的广泛应用仍面临着诸多技术挑战。当前,MSI的主要瓶颈包括高昂的成本、复杂的样品制备流程以及海量数据的处理和分析[10]。然而,随着人工智能(AI)和大数据分析技术的发展,MSI技术有望在未来克服这些限制,并在医学领域发挥更大的作用。
-
尽管MSI技术在医学研究和临床应用中展现出巨大的潜力,但其技术瓶颈限制了在更大范围内的推广。MSI技术的高成本是制约其广泛应用的首要障碍。MSI设备的采购和维护费用昂贵,且操作需要专业技能和培训,进一步增加了其使用门槛。例如,MALDI-MS和SIMS等技术都依赖昂贵的高精度仪器,这些仪器在小型研究机构和资源有限的临床环境中难以普及。除此之外,MSI的样品制备也需要特殊的化学试剂和耗材,加剧了其应用成本[27]。
不同的MSI技术对样品处理有不同的要求。以MALDI-MS为例,它需要将样品均匀覆盖一层基质,而基质的选择和涂覆方式会直接影响成像的质量和准确性。样品制备过程复杂,且对技术操作有很高要求[27]。
此外,对质谱采集的高通量数据快速分析仍存在一定的技术局限[28]。MSI技术产生的多维数据量巨大,包括空间分布信息、分子质量、信号强度等多维数据。处理和分析这些数据需要高度复杂的计算能力。传统的分析方法难以快速有效地处理这些海量数据,特别是当面对复杂的生物样本时,现有的算法和工具常常难以提取出关键的生物标志物[10]。这使得MSI在临床诊断中的实时应用变得困难。随着MSI数据量的增加,如何利用先进的算法和人工智能技术更好地解析数据,成为亟待解决的课题。
总之,MSI技术在成本、样品制备及数据分析方面仍然面临许多技术瓶颈。未来的研究应聚焦于如何通过降低成本、简化样品制备流程以及开发更高效的算法来提升MSI技术的临床应用性和普及度。
-
尽管MSI技术目前面临诸多挑战,随着人工智能(AI)和大数据分析技术的发展,未来MSI的应用前景逐渐清晰。AI和机器学习的引入将极大提升MSI数据处理的效率和准确性,通过大数据技术的帮助,MSI能够从海量数据中迅速识别与疾病相关的特征和生物标志物。
Zhang[29]等人的研究结合了AI与MSI数据,通过模式识别从肝癌质谱数据中提取代谢物和蛋白质特征,通过大数据分析提高了对药物代谢路径的解析能力。此外,机器学习算法通过大规模数据训练,提高了MSI在癌症分子标志物识别中的诊断能力。这种结合将进一步提升药物代谢监测的准确性,为药物开发和临床优化提供更加精确的数据支持。
赵敏[28]指出,随着硬件技术的进步,MSI设备成本将大幅降低,这将推动该技术在更多医疗机构中的应用。特别是在精准医学领域,MSI能够通过分子成像数据为医生提供个性化的治疗方案支持。
随着纳米技术的发展,研究人员能够更加精细地追踪药物在纳米级别的分布,尤其是在肝癌等异质性较高的肿瘤中,MSI的空间分辨率和灵敏度将得到提升。李欣昕[27]等人通过MALDI-MS和SIMS技术研究药物在肝癌模型中的分布,揭示了药物在肿瘤组织中的时间依赖性累积情况,并识别了与疗效相关的关键代谢物。指出新型MSI设备可提供更高精度的分子和代谢物分布信息,有助于细胞和亚细胞水平的动态研究。
AI和大数据技术的成熟,MSI有望从“实验室工具”逐步转变为“常规临床手段”。通过AI算法的深度学习和模式识别,MSI生成的数据将能够为医生提供实时的诊断信息,这为更准确的个性化治疗提供了重要支持,其在肝癌精准医学中的应用将进一步得到拓展[30]。未来,随着MSI技术与人工智能和大数据分析的结合,MSI有望在肝癌等复杂疾病的治疗中,帮助预测疗效、监控药物代谢,并提高整体治疗效果。
-
MSI技术在肝癌研究中展现出显著的应用潜力,通过高空间分辨率和分子信息结合,弥补了传统影像技术在分子层面上的不足,精准检测肿瘤中的代谢物和蛋白质分布,为肝癌的分子机制研究、分型及诊断分析分析提供了全新视角。
在早期诊断方面,MSI通过分析代谢物和脂质的空间分布,帮助发现肝癌的分子标志物,提高了早期检测率,减少患者死亡率,并为个性化治疗提供了有力支持。此外,MSI技术在肝癌分型中能够精准区分肝细胞癌、肝内胆管癌及混合型肝癌,帮助医生制定更具针对性的治疗策略。在治疗方面,MSI技术通过追踪药物在体内的分布和代谢路径,评估药物在肿瘤中的作用效果,优化治疗方案,助力个性化治疗。
随着人工智能(AI)和大数据分析技术的发展,MSI将进一步加速质谱数据的处理,提升其在个性化治疗中的应用效率。并且设备成本的降低和数据处理技术的进步,MSI有望成为常规的临床诊断工具,不仅在肝癌的早期诊断和治疗中发挥重要作用,还将在其他复杂疾病的研究中带来革命性突破,推动精准医学的进一步发展。
Application of mass spectrometry imaging in the diagnosis and molecular mechanism of liver cancer
-
摘要: 质谱成像(MSI)是一种新兴的分子成像技术,兼具高空间分辨率和分子信息获取能力。该技术能够直接获取肿瘤组织内代谢物、蛋白质、脂质等分子的空间分布图谱,揭示肝癌发生发展过程中的分子异常变化,弥补了传统影像学(如CT、MRI)在分子层面信息的不足。在肝癌研究中,MSI在早期诊断与筛查、精确分型、肿瘤异质性分析及分子机制探索中展现出独特优势和应用潜力。本文综述了MSI技术的原理特点及其在肝癌早期诊断、分型、分子机制研究中的最新进展,并探讨了当前面临的挑战及未来发展方向。旨在为深入理解肝癌病理机制及推动其精准诊疗提供新的视角和理论依据。Abstract: Mass spectrometry imaging (MSI) is an emerging molecular imaging technique that combines high spatial resolution and the ability to acquire molecular information. This technology can directly obtain spatial distribution maps of metabolites, proteins, lipids and other molecules in tumor tissues, reveal the abnormal molecular changes during the occurrence and development of liver cancer, and make up for the deficiency of information at the molecular level in traditional imaging (such as CT, MRI). In liver cancer research, MSI has demonstrated unique advantages and application potential in early diagnosis and screening, precise classification, tumor heterogeneity analysis, and exploration of molecular mechanisms. The principle characteristics of MSI technology and its latest progress in the early diagnosis, classification and molecular mechanism research of liver cancer were reviewed, and the current challenges and future development directions were discussed, which aims to provide a new perspective and theoretical basis for an in-depth understanding of the pathological mechanism of liver cancer and promote its precise diagnosis and treatment.
-
Key words:
- mass spectrometry imaging /
- liver cancer /
- early diagnosis /
- precision medicine
-
图 1 MSI技术的3种电离方式[11]
表 1 MSI技术的3种电离方式的比较
质谱成像技术 次级离子质谱 基质辅助激光解吸电离质谱 解吸电喷雾电离质谱 环境条件 真空 真空 常温常压 空间分辨率 一般1 ~ 100 μm 一般10 ~ 100 μm 一般40 ~ 200 μm 样品处理 冷冻切片 冷冻切片,需借助基质离子化 冷冻切片 检测对象 分子量小于1 000的疏水性化合物 不受样本与分子量限制 分子量小于2 000的化合物 优势 高空间分辨率、高灵敏、
免标记、多组分分析高空间分辨率、高质量分辨率 高通量、最小样本量、高效率 局限性 无法进行实时原位分析、
测试易产生碎片离子上机前处理时间长、
激光器维护费用高空间分辨率有待提高、难对大分子量的
化合物进行分析 -
[1] RUMGAY H, ARNOLD M, FERLAY J, et al. Global burden of primary liver cancer in 2020 and predictions to 2040[J]. J Hepatol, 2022, 77(6):1598-1606. doi: 10.1016/j.jhep.2022.08.021 [2] GUO D Z, HUANG A, WANG Y C, et al. Early detection and prognosis evaluation for hepatocellular carcinoma by circulating tumour DNA methylation: a multicentre cohort study[J]. Clin Transl Med, 2024, 14(5):e1652. doi: 10.1002/ctm2.1652 [3] SCHWAMBORN K, KRIEGSMANN M, WEICHERT W. MALDI imaging mass spectrometry: From bench to bedside[J]. Biochim Biophys Acta BBA Proteins Proteom, 2017, 1865(7):776-783. doi: 10.1016/j.bbapap.2016.10.014 [4] LIU C J, ZHANG L, SUN Y, et al. Application of CT and MRI images based on an artificial intelligence algorithm for predicting lymph node metastasis in breast cancer patients: a meta-analysis[J]. BMC Cancer, 2023, 23(1):1134. doi: 10.1186/s12885-023-11638-z [5] OLTHOF E P, BERGINK-VOORTHUIS B J, WENZEL H H B, et al. Diagnostic accuracy of MRI, CT, and [18F] FDG-PET-CT in detecting lymph node metastases in clinically early-stage cervical cancer - a nationwide Dutch cohort study[J]. Insights Imaging, 2024, 15(1):36. doi: 10.1186/s13244-023-01589-1 [6] 高婧媛. 《影像学》: 医学影像学近现代发展历史及当代发展[J]. 磁共振成像, 2024, 15(8):236. [7] SHENG J P, ZHANG J L, WANG L, et al. Topological analysis of hepatocellular carcinoma tumour microenvironment based on imaging mass cytometry reveals cellular neighbourhood regulated reversely by macrophages with different ontogeny[J]. Gut, 2022, 71(6):1176-1191. doi: 10.1136/gutjnl-2021-324339 [8] LIU Y L, WANG B, MO X, et al. A deep learning workflow for mass-forming intrahepatic cholangiocarcinoma and hepatocellular carcinoma classification based on MRI[J]. Curr Oncol, 2022, 30(1):529-544. doi: 10.3390/curroncol30010042 [9] FAN H S, WANG B, SHI L H, et al. Monitoring minimal residual disease in patients with multiple myeloma by targeted tracking serum M-protein using mass spectrometry(EasyM)[J]. Clin Cancer Res, 2024, 30(6):1131-1142. doi: 10.1158/1078-0432.CCR-23-2767 [10] 冯鲍盛, 白玉, 刘虎威. 常压敞开式质谱成像技术及其应用[J]. 大学化学, 2013, 28(4):1-8. doi: 10.3969/j.issn.1000-8438.2013.04.001 [11] PANG H H, HU Z P. Metabolomics in drug research and development: The recent advances in technologies and applications[J]. Acta Pharm Sin B, 2023, 13(8):3238-3251. doi: 10.1016/j.apsb.2023.05.021 [12] 张莹, 陈岗, 陆豪杰, 等. MALDI质谱成像技术在非小细胞肺癌中的应用研究[J]. 质谱学报, 2007, 28(4):209-213. [13] 蔡乐斯, 夏梦婵, 李展平, 等. 二次离子质谱生物成像[J]. 化学进展, 2021, 33(1):97-110. [14] 罗志刚. 免标记、便捷的新型常压敞开式质谱分子成像技术与方法研究[D]. 北京: 北京协和医学院, 2012. [15] YANG S, QIAN L, LI Z X, et al. Integrated multi-omics landscape of liver metastases[J]. Gastroenterology, 2023, 164(3): 407-423. e17. [16] SALEH M, VIRARKAR M, BURA V, et al. Intrahepatic cholangiocarcinoma: pathogenesis, current staging, and radiological findings[J]. Abdom Radiol, 2020, 45(11):3662-3680. doi: 10.1007/s00261-020-02559-7 [17] 卞直鹏, 孙富海, 余霞客. 新形势下医学影像技术专业面临的挑战与对策[J]. 影像技术, 2015, 27(5):3-4. doi: 10.3969/j.issn.1001-0270.2015.05.01 [18] SUN D W, XU Z G, CAO S Y, et al. Imaging features based on CT and MRI for predicting prognosis of patients with intrahepatic cholangiocarcinoma: a single-center study and meta-analysis[J]. Cancer Imaging, 2023, 23(1):56. doi: 10.1186/s40644-023-00576-5 [19] 李志豪, 王蔚昕, 石高军, 等. 解吸电喷雾电离质谱成像技术及其在文件/文物检验中的应用[J]. 刑事技术, 2022, 47(4):342-346. [20] BOLLWEIN C, GON\U04ABALVES J P L, UTPATEL K, et al. MALDI mass spectrometry imaging for the distinction of adenocarcinomas of the pancreas and biliary tree[J]. Molecules, 2022, 27(11):3464. doi: 10.3390/molecules27113464 [21] WEST C A, WANG M J, HERRERA H, et al. N-linked glycan branching and fucosylation are increased directly in hcc tissue As determined through in situ glycan imaging[J]. J Proteome Res, 2018, 17(10):3454-3462. doi: 10.1021/acs.jproteome.8b00323 [22] POWERS T W, HOLST S, WUHRER M, et al. Two-dimensional N-glycan distribution mapping of hepatocellular carcinoma tissues by MALDI-imaging mass spectrometry[J]. Biomolecules, 2015, 5(4):2554-2572. doi: 10.3390/biom5042554 [23] 盛奕琪. 股骨头坏死的质谱成像研究[D]. 北京: 中国石油大学(北京), 2023. [24] 陈静, 谢佩斯, 蔡宗苇. 脂质质谱成像揭示三氯生促进三维肝癌肿瘤细胞球增长的相关机理[J]. 质谱学报, 2023, 44(2):213-222. doi: 10.7538/zpxb.2022.0181 [25] 孙菲, 王刚, 张金仿, 等. MALDI-TOF-MS在HBV相关肝癌蛋白质组学中的应用价值[J]. 中华实验和临床病毒学杂志, 2019, 33(1):95-98. doi: 10.3760/cma.j.issn.1003-9279.2019.01.021 [26] 陈兵, 何健, 曾昭冲, 等. 应用MALDI-TOF-MS检测原发性肝癌骨转移患者血清的多肽差异谱[J]. 肿瘤, 2012, 32(8):643-649. [27] 李欣昕, 吴欢, 王晨, 等. 质谱成像技术及其在药学领域的应用[J]. 中国药科大学学报, 2014, 45(1):17-25. [28] BUCHBERGER A R, DELANEY K, JOHNSON J, et al. Mass spectrometry imaging: a review of emerging advancements and future insights[J]. Anal Chem, 2018, 90(1):240-265. doi: 10.1021/acs.analchem.7b04733 [29] ZHANG H R, ZHANG J Y, YUAN C X, et al. Recent advances in mass spectrometry imaging combined with artificial intelligence for spatially clarifying molecular profiles: Toward biomedical applications[J]. Trac Trends Anal Chem, 2024, 178:117834. doi: 10.1016/j.trac.2024.117834 [30] 王子璇. 脑卒中功能代谢特征的识别、空间定位和注释新方法研究及其在候选药物CZ-7体内分析中的应用[D]. 北京: 北京协和医学院, 2021. -




 下载:
下载: