-
缺血性脑卒中(IS)是常见的一种中风,是导致人类死亡和残疾的最常见因素之一[1]。目前溶栓是IS的首选治疗方法,其中药物溶栓最为有效,但往往具有黄金治疗时间窗,可能约3%~8%的患者才有资格使用药物溶栓治疗[2-3]。因此,需要针对IS开发新的药物以提高溶栓治疗的疗效。咪达唑仑是一种有效的短效苯二氮䓬类药物,具有抗焦虑、镇静和催眠作用[4]。Yu等[5]研究表明咪达唑仑通过抗凋亡机制减少细胞毒性和凋亡,从而保护缺血环境下的神经元,具有治疗中风的潜在能力,但其具体机制仍需探索。线粒体是细胞的能量来源,在决定细胞死亡中起着关键作用,PTEN诱导假定激酶1(PINK1)/E3泛素连接酶(PARKIN)信号通路在线粒体吞噬和线粒体运动中起关键作用,已有研究显示PINK1/PARKIN介导的线粒体自噬在中风后的神经元和组织损伤中起主要作用,能够防止IS后神经元凋亡[6-7]。动脉阻塞法建立IS动物模型是最接近模拟人类IS的模型之一[8-10]。本研究通过动脉阻塞法建立IS大鼠,探讨咪达唑仑是否通过调节PINK1/PARKIN信号通路影响IS大鼠神经元损伤,从而为咪达唑仑治疗脑中风提供理论依据。
-
健康无特定病原体级成年雄性SD大鼠[许可证号:SCXK(豫)2022-0001,郑州大学实验动物中心],6周龄,体质量200~230 g,在室温和光照/黑暗(12 h/12 h)交替循环的条件下喂养,并自由获得食物和水。本研究实验符合《中华人民共和国实验动物指南》规定,并获得动物伦理委员会批准。
-
咪达唑仑注射液(批号: TMZ23E02,国药准字:H10980025,江苏恩华药业股份有限公司)。
-
自噬抑制剂(3-MA,美国Selleck Chemicals公司);ECL化学发光试剂盒(上海天能科技有限公司);PINK1、ARKIN、微管相关蛋白1轻链3(LC3)、P62一抗(Abcam公司);线粒体提取试剂盒、TUNEL试剂盒(上海生物工程有限公司);苏木精-伊红(HE)染色液(北京Solarbio公司);二辛可宁酸(BCA)蛋白定量试剂盒(美国Bioteke公司)。
-
凝胶电泳、转移装置(美国Bio-Rad公司);透射电子显微镜(1400PLUS型,日本JEOL电子公司)。
-
大鼠适应性喂养1周后,通过中动脉阻塞法建立IS大鼠模型[11]:将麻醉的大鼠置于立体定位框架中,颈部正中央做一切口,手术分离右侧颈总动脉、颈内动脉和颈外动脉,结扎颈外动脉,然后将线栓穿过颈外动脉残端插入颈内动脉,在离插入点约18~22 mm处闭塞大脑中动脉,固定2 h后,抽出线栓并缝合伤口。当大鼠出现自主向左旋转的行为,记为IS大鼠造模成功,术后死亡大鼠给予相应补充。将造模成功的大鼠随机分为IS组、药物低、中、高剂量(药物-L、M、H,30、60、90 mg/kg咪达唑仑)组、药物-H+自噬抑制剂-3-MA组(90 mg/kg咪达唑仑+30 mg/kg 3-MA),并以仅分离血管的大鼠为假手术组,其中药物-L组、药物-M组、药物-H组根据参考文献[12]和前期预实验结果分别以30、60、90 mg/kg咪达唑仑进行腹腔注射给药干预,同时给予生理盐水干预;药物-H+3-MA组在给予90 mg/kg咪达唑仑腹腔注射给药的同时,以30 mg/kg 3-MA灌胃给药干预[13];其余各组分别以等体积的生理盐水腹腔注射、灌胃干预,1次/d,连续2周。
-
以有经验的测试者根据Longa方法采用双盲设计评估神经功能缺损评分,神经功能缺损评分中无神经功能缺损症状,活动正常,记为0分;大鼠左前肢不能完全伸直,记为1分;大鼠爬行时转向对侧,记为2分;自发的向左转圈或行走,记为3分;大鼠无法行走,失去知觉,记为4分。
-
神经功能评分结束后,随机取5只大鼠麻醉,用0.9%生理盐水经心脏灌注,然后用4%多聚甲醛灌注,直到四肢僵硬,立即取出大脑,并在4 ℃下经固定剂固定部分脑组织24 h。将脑组织包埋在石蜡中,并切成连续的冠状切片,然后将切片脱蜡、再水合并用苏木精伊红染色,于显微镜下观察并拍照。
-
取1.2.3中脑组织石蜡片,脱蜡后按照试剂盒要求检测TUNEL阳性细胞,并计算凋亡率,其中棕黄色或棕褐色颗粒为阳性细胞。
-
取部分脑组织皮质区,并以戊二醛、四氧化锇固定,经浸透、包埋、聚合后制备超薄切片,透射电镜下观察皮质区自噬小体的变化。
-
利用线粒体分离试剂盒提取剩余8只大鼠脑组织线粒体,在含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA缓冲液中,在玻璃匀浆器中将脑组织匀浆并定量,将蛋白质经过常规十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离、电转移、抗体反应(PINK1、PARKIN、LC3及P62一抗)后,利用增强化学发光(ECL)试剂盒进行可视化,用荧光成像仪拍摄图像,随后用Image J软件定量分析。
-
采用SPSS 27.0软件分析数据,计量资料以均数
$ \pm $ 标准差($ \bar{x} \pm s $ )表示,P<0.05时,差异有统计学意义。单因素方差分析用于多组间比较,以snk-q检验进一步两两比较。 -
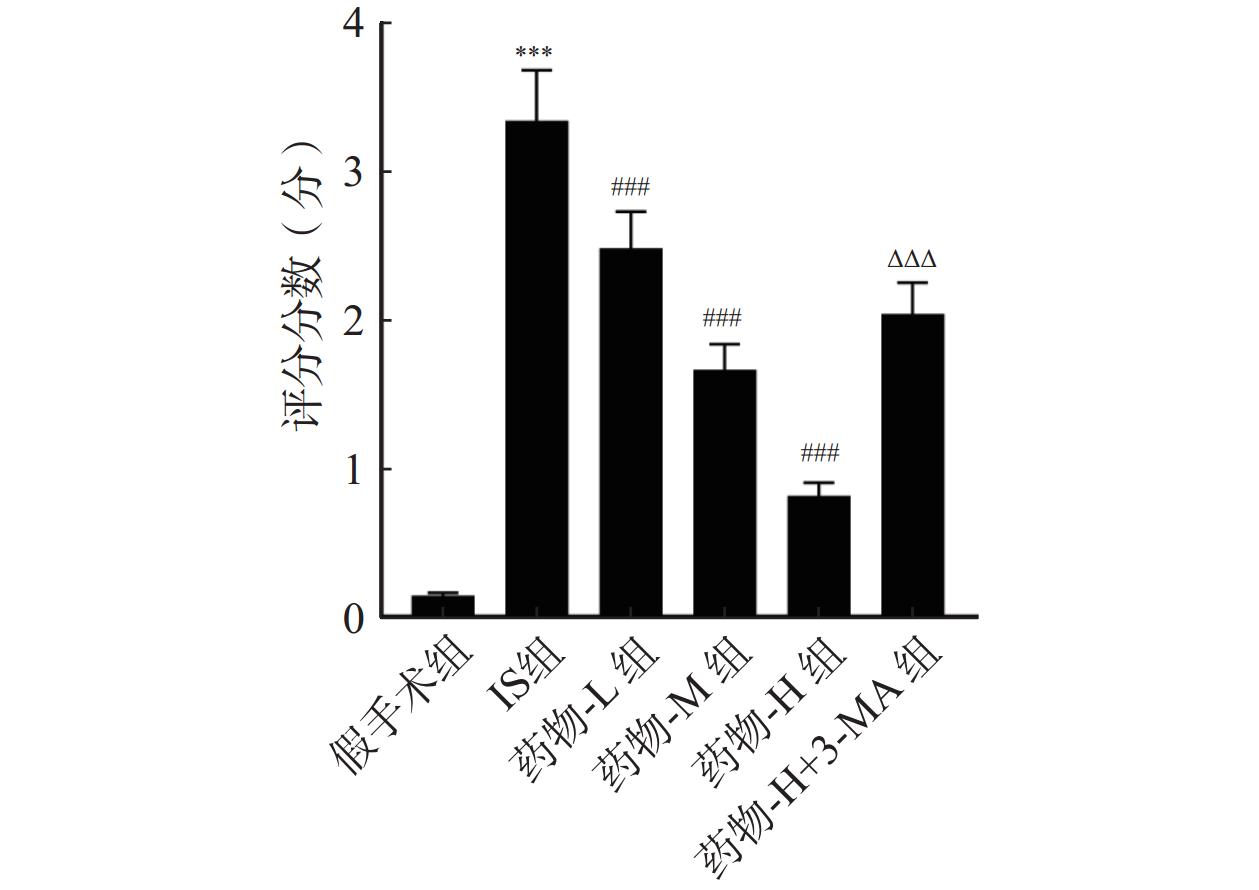
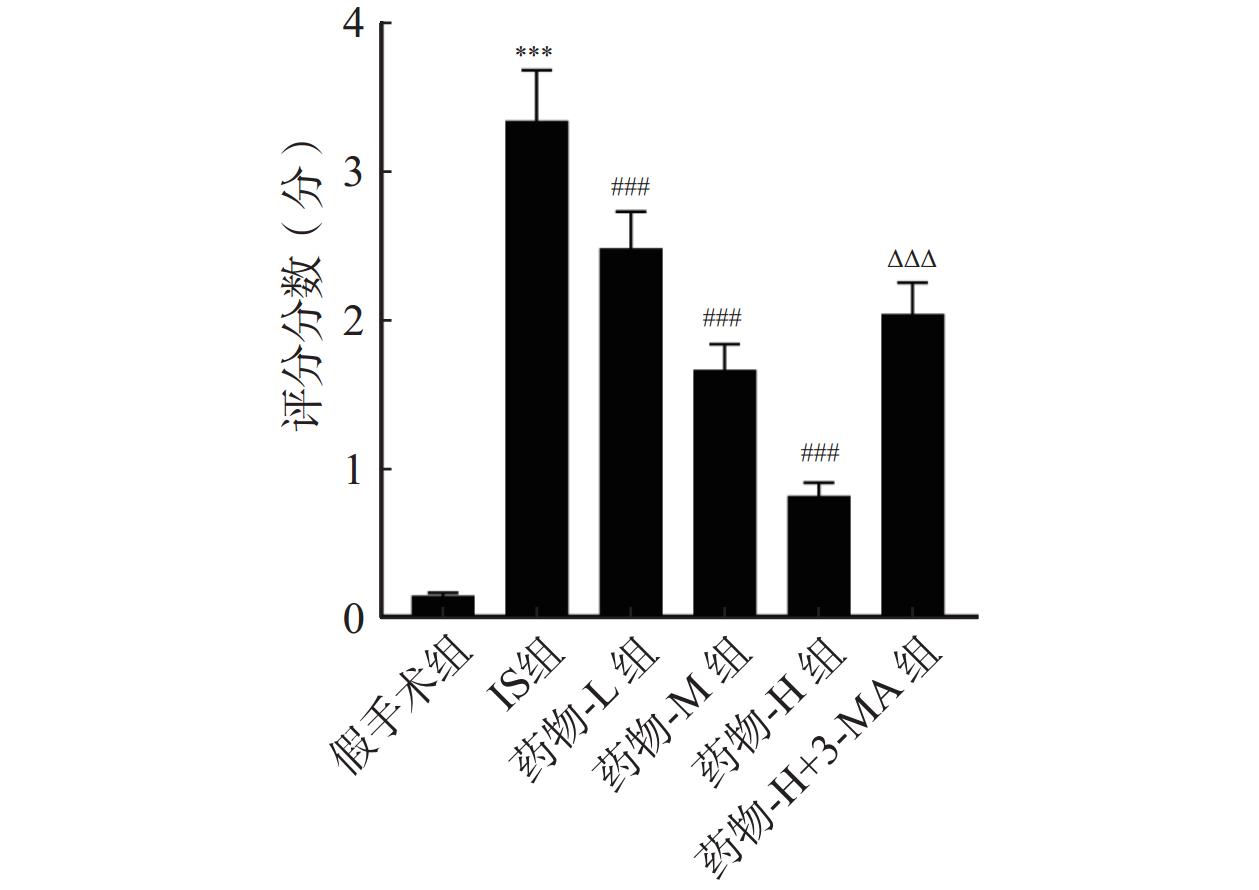
与假手术组比较,IS组神经功能评分显著增加(P<0.001);但经药物-L组、药物-M组、药物-H组干预后,神经功能评分逐渐降低,呈剂量依赖性(P<0.001);与药物-H组比较,药物-H+3-MA组神经功能评分显著增加(P<0.001),见图1。
-
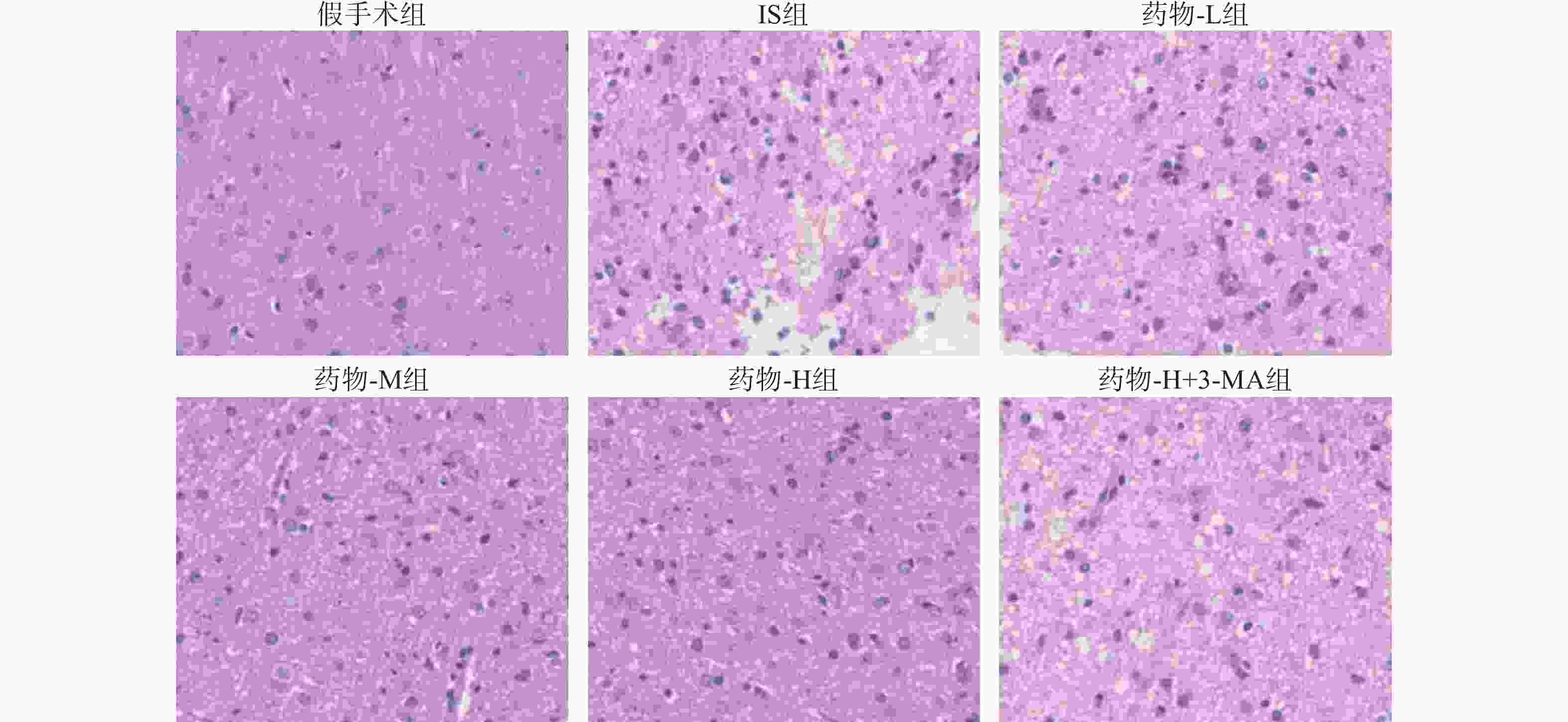
假手术组脑组织皮质区结构完整,未见细胞变性,神经元形态饱满,数量较多;而IS组皮质区结构间隙较大,结构疏松,神经元数量明显减少;药物-L组、药物-M组、药物-H组病理状况有所改善,神经元形态逐渐改善,数量逐渐增加;但药物-H+3-MA组较药物-H组皮质区结构呈筛网状,神经元存在坏死现象,见图2。
-
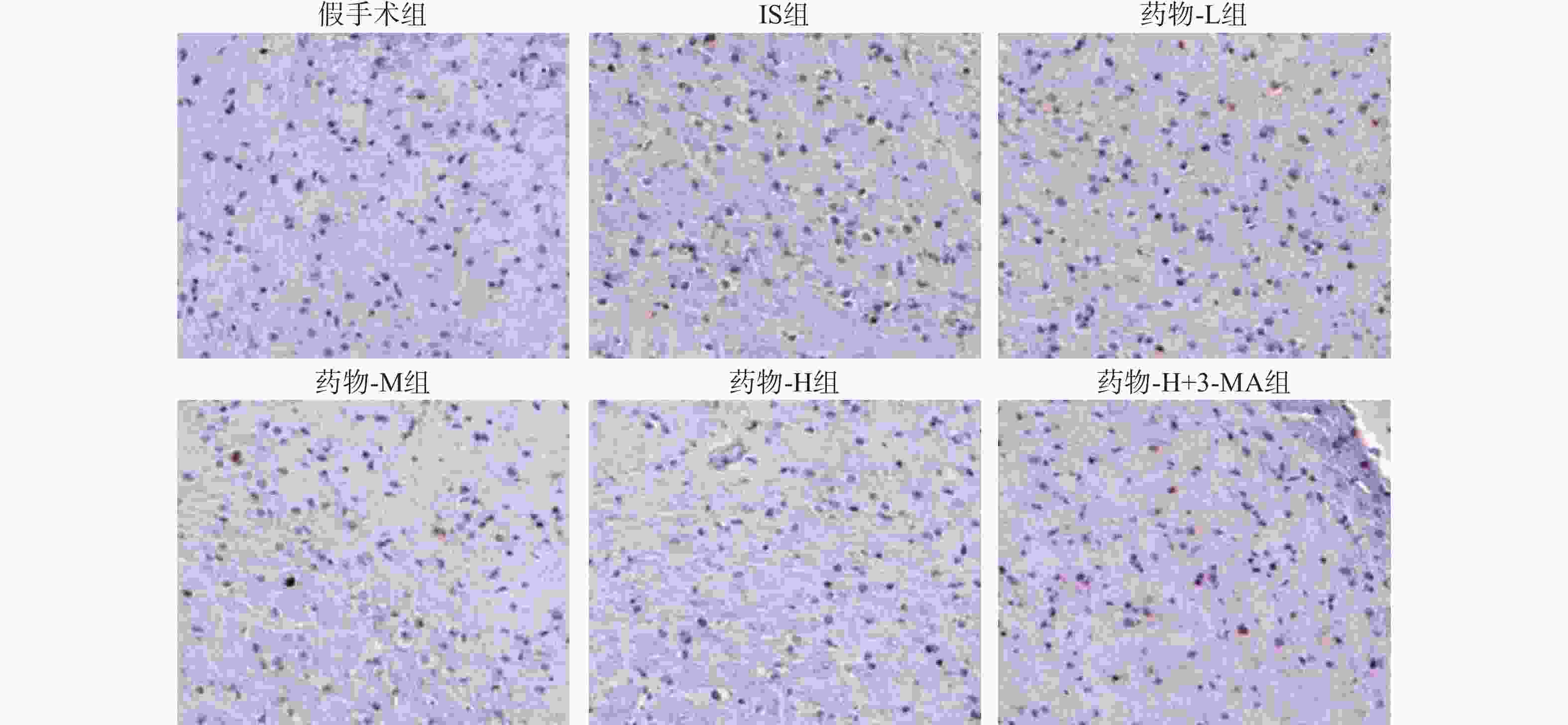
与假手术组比较,IS组神经元凋亡率显著增加(P<0.001);但经药物-L组、药物-M组、药物-H组干预后,神经元凋亡率逐渐降低,呈剂量依赖性(P<0.001);与药物-H组比较,药物-H+3-MA组神经元凋亡率显著增加(P<0.001),见图3、表1。
表 1 各组大鼠细胞凋亡变化比较(
$ \bar{x} \pm s $ ,n=5)组别 凋亡率(%) 假手术组 6.22±0.63 IS组 21.28±2.13*** 药物-L组 16.11±1.63### 药物-M组 11.32±1.14### 药物-H组 8.02±0.81### 药物-H+3-MA组 17.11±1.72△△△ ***P<0.001,与假手术组比较; ###P<0.001,与IS组比较;△△△P<0.001,与药物-H组比较。 -
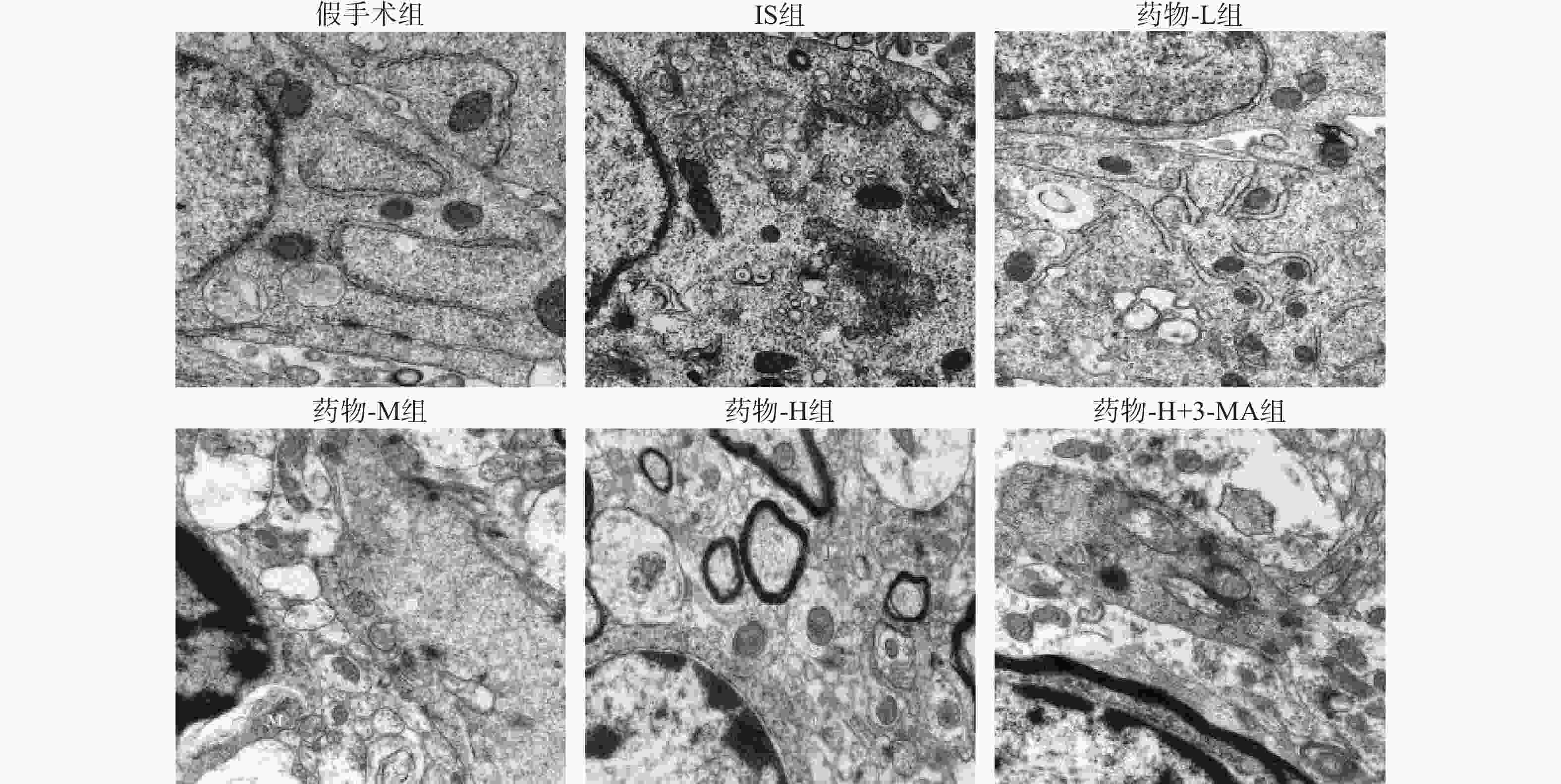
与假手术组比较,IS组脑组织皮质区自噬小体的数目增加;经药物-L组、药物-M组、药物-H组干预后,皮质区自噬小体的数目也呈现增加趋势,以药物-H组最为显著;但药物-H+3-MA组较药物-H组自噬小体的数目逐渐减少,见图4。
-
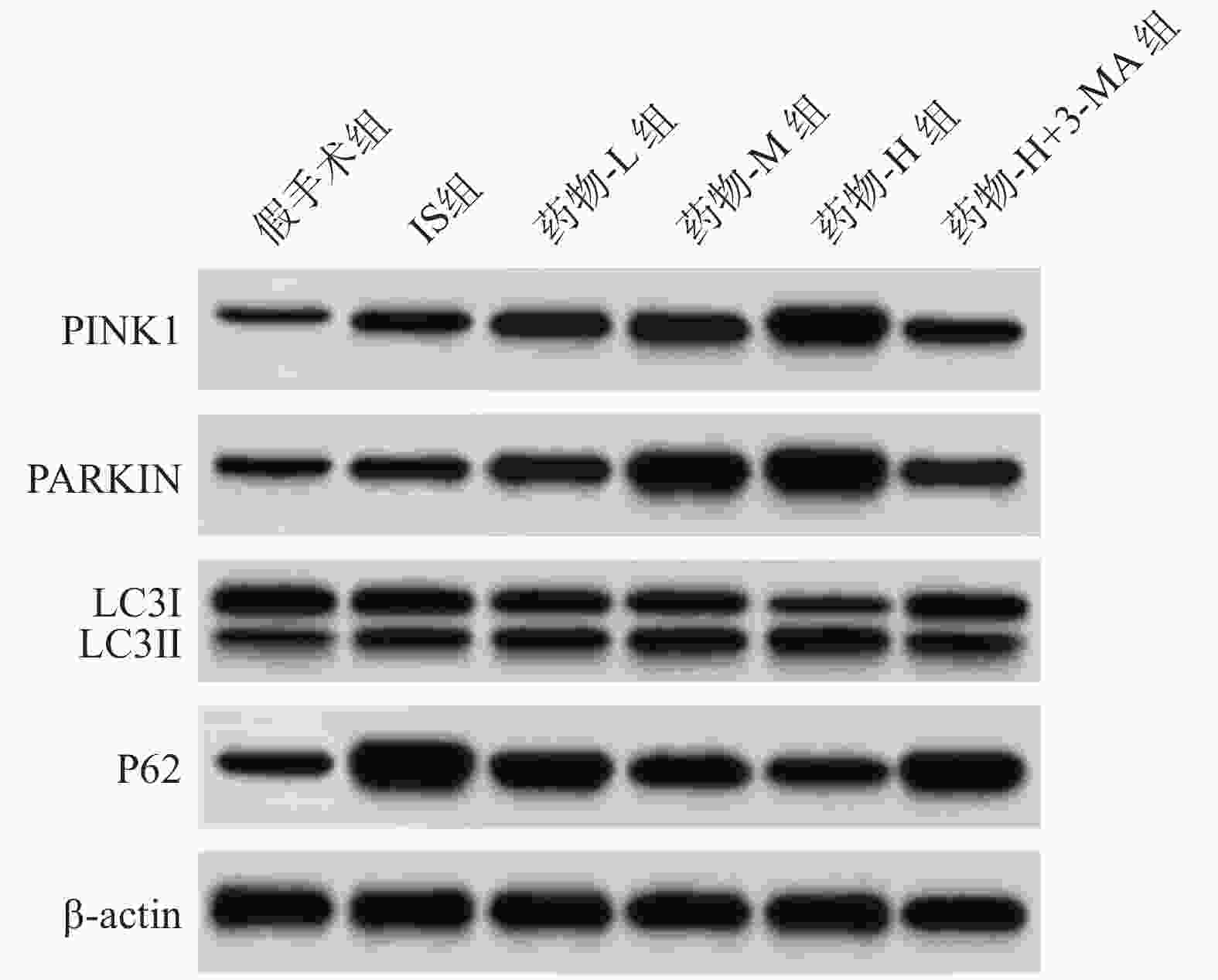
与假手术组比较,IS组脑组织线粒体PINK1、ARKIN、LC3及P62蛋白显著增加(P<0.001);与IS组比较,药物-L组、药物-M组、药物-H组PINK1、PARKIN、LC3蛋白表达增加,P62蛋白显著降低,呈剂量依赖性(P<0.01或P<0.001);与药物-H组比较,药物-H+3-MA组PINK1、PARKIN、LC3蛋白表达降低,P62蛋白显著增加(P<0.001),见图5、表2。
表 2 脑组织线粒体中PINK1、PARKIN、LC3及P62表达比较(
$ \bar{x} \pm s $ ,n=8)组别 PINK1/β-actin PARKIN/β-actin LC3/β-actin P62/β-actin 假手术组 0.29±0.03 0.41±0.05 0.38±0.04 0.64±0.07 IS组 0.55±0.06*** 0.69±0.07*** 0.62±0.07*** 1.85±0.19*** 药物-L组 0.72±0.08## 0.96±0.10### 0.83±0.09## 1.34±0.14### 药物-M组 0.92±0.10### 1.39±0.14### 1.24±0.13### 1.06±0.11### 药物-H组 1.34±0.15### 1.67±0.17### 1.67±0.17### 0.72±0.08### 药物-H+3-MA组 0.66±0.07△△△ 0.88±0.09△△△ 0.75±0.08△△△ 1.42±0.15△△△ ***P<0.001,与假手术组比较; ##P<0.01,###P<0.001,与IS组比较;△△△P<0.001,与药物-H组比较。 -
咪达唑仑是一种γ-氨基丁酸A苯二氮䓬类受体激动剂,是诱导镇静的常用麻醉剂,咪达唑仑处理可维持树突结构,并且不影响麻醉期间的神经元发育,研究表明咪达唑仑可以保护大脑中动脉闭塞诱导的神经元变性和神经细胞凋亡[14]。本研究发现IS大鼠神经功能评分、神经元凋亡率显著增加,HE结果显示皮质区病理损伤严重,皮质区结构疏松、间隙较大,提示IS大鼠的构建伴随着严重的神经元损伤,与杨秋怡等[15]结果相吻合。但经不同剂量的咪达唑仑治疗后,病理损伤得到改善,神经功能评分、神经元凋亡率显著降低,呈剂量依赖性,提示咪达唑仑尤其是高剂量咪达唑仑可保护IS大鼠神经元损伤,但其机制仍未阐明。
自噬是一种基因程序化的过程,选择性自噬最典型的类型是线粒体自噬,即针对受损的线粒体进行降解,促进线粒体的更新,防止功能障碍的细胞器积累[16-17]。在自噬过程中,LC3羧基端经剪切后形成LC3I,LC3I泛素化后形成LC3II,在自噬体膜表面附着,LC3II与LC3I比值是判断自噬体形成的标志。LC3与P62结合形成自噬小体,P62会随溶酶体的降解而降解,P62与自噬强弱呈反比[10]。PINK1-PARKIN介导的线粒体自噬在线粒体质量控制中起关键作用,并与多种疾病相关,包括神经退行性疾病、心血管疾病以及脑缺血损伤[18-19]。本研究结果发现IS大鼠自噬小体较多,线粒体中PINK1、PARKIN、LC3及P62蛋白显著增加,提示IS大鼠脑组织中自噬体增加,但并未得到及时降解;经咪达唑仑干预后,IS大鼠自噬小体逐渐增多,线粒体中PINK1、PARKIN、LC3蛋白显著增加,P62蛋白表达降低,提示咪达唑仑可通过激活PINK1/PARKIN信号通路激活线粒体自噬,并加快自噬体降解,减轻IS大鼠神经元损伤。为进一步验证实验结论,以自噬抑制剂3-MA进行回复验证,结果发现3-MA逆转了咪达唑仑对IS大鼠神经元损伤的保护作用,表明咪达唑仑改善IS大鼠神经元损伤,与激活PINK1/PARKIN信号通路有关。
综上所述,咪达唑仑通过激活PINK1/PARKIN信号通路诱导IS大鼠线粒体自噬,降低神经元凋亡,改善IS大鼠神经元损伤,为咪达唑仑治疗脑中风提供理论依据。
Effect of midazolam on neuronal damage in ischemic stroke rats by regulating the PINK1/PARKIN signaling pathway
-
摘要:
目的 探讨咪达唑仑对缺血性脑卒中(IS)大鼠神经元损伤的影响及其与PTEN诱导假定激酶1(PINK1)/E3泛素连接酶(PARKIN)信号通路的调节作用。 方法 通过动脉阻塞法建立IS大鼠模型,将造模成功的大鼠随机分为IS组、药物低、中、高剂量(药物-L、M、H,30、60、90 mg/kg咪达唑仑)组、药物-H+自噬抑制剂-3-MA组(90 mg/kg咪达唑仑+30 mg/kg 3-MA),并以仅分离血管的大鼠为假手术组,各组均进行相应剂量药物或生理盐水干预,随后进行神经功能评分、脑组织病理学、神经元凋亡、超微结构以及线粒体中PINK1、PARKIN、微管相关蛋白1轻链3(LC3)及P62蛋白表达检测。 结果 与IS组比较,药物-L组、药物-M组、药物-H组病理损伤得到改善,自噬小体呈现增加趋势,PINK1、PARKIN、LC3蛋白表达增加,神经功能评分、神经元凋亡率、P62蛋白显著降低,呈剂量依赖性(P<0.01或P<0.001);与药物-H组比较,药物-H+3-MA组病理损伤加重,自噬小体减少,PINK1、PARKIN、LC3蛋白表达降低,神经功能评分、神经元凋亡率、P62蛋白显著增加(P<0.001)。 结论 咪达唑仑通过激活PINK1/PARKIN信号通路诱导IS大鼠线粒体自噬,降低神经元凋亡,改善IS大鼠神经元损伤。 Abstract:Objective To investigate the effect of midazolam on neuronal damage in ischemic stroke (IS) rats and its regulatory effect on PTEN-induced putative kinase 1 (PINK1)/E3 ubiquitin ligase (PARKIN) signaling pathway. Methods An IS rat model was established using arterial occlusion method. The rats with successful model were randomly divided into IS group, drug-low, medium, high-dose (drug-L, M, H, 30, 60, 90 mg/kg midazolam) groups, drug-H+autophagy inhibitor 3-MA group (90 mg/kg midazolam+30 mg/kg 3-MA), and rats with only isolated blood vessels were used as sham surgery groups. Each group received corresponding doses of drugs or physiological saline intervention, and the neurological function scoring, brain histopathology, neuronal apoptosis, ultrastructure, and expression of PINK1, PARKIN, microtubule-associated protein 1 light chain 3 (LC3), and P62 protein in mitochondria were detected. Results Compared with the IS group, the pathological damage of the drug-L group, drug-M group, and drug-H group was improved, and autophagosomes showed an increasing trend, the expression of PINK1, PARKIN, and LC3 proteins increased, the neurological function score, neuronal apoptosis rate, and P62 protein obviously decreased in a dose-dependent manner (P<0.01 or P<0.001); compared with the drug-H group, the pathological damage in the drug-H+3-MA group increased and autophagosomes decreased, the expression of PINK1, PARKIN, and LC3 proteins decreased, the neurological function score, neuronal apoptosis rate, and P62 protein obviously increased (P<0.001). Conclusion Midazolam induced mitochondrial autophagy in IS rats by activating the PINK1/PARKIN signaling pathway, neuronal apoptosis was reduced and neuronal damage were improved in IS rats. -
Key words:
- midazolam /
- PINK1/PARKIN signaling pathway /
- ischemic stroke /
- neuron /
- autophagy /
- apoptosis
-
表 1 各组大鼠细胞凋亡变化比较(
$ \bar{x} \pm s $ ,n=5)组别 凋亡率(%) 假手术组 6.22±0.63 IS组 21.28±2.13*** 药物-L组 16.11±1.63### 药物-M组 11.32±1.14### 药物-H组 8.02±0.81### 药物-H+3-MA组 17.11±1.72△△△ ***P<0.001,与假手术组比较; ###P<0.001,与IS组比较;△△△P<0.001,与药物-H组比较。 表 2 脑组织线粒体中PINK1、PARKIN、LC3及P62表达比较(
$ \bar{x} \pm s $ ,n=8)组别 PINK1/β-actin PARKIN/β-actin LC3/β-actin P62/β-actin 假手术组 0.29±0.03 0.41±0.05 0.38±0.04 0.64±0.07 IS组 0.55±0.06*** 0.69±0.07*** 0.62±0.07*** 1.85±0.19*** 药物-L组 0.72±0.08## 0.96±0.10### 0.83±0.09## 1.34±0.14### 药物-M组 0.92±0.10### 1.39±0.14### 1.24±0.13### 1.06±0.11### 药物-H组 1.34±0.15### 1.67±0.17### 1.67±0.17### 0.72±0.08### 药物-H+3-MA组 0.66±0.07△△△ 0.88±0.09△△△ 0.75±0.08△△△ 1.42±0.15△△△ ***P<0.001,与假手术组比较; ##P<0.01,###P<0.001,与IS组比较;△△△P<0.001,与药物-H组比较。 -
[1] ZHAO B, YUAN Q, HOU J B, et al. Inhibition of HDAC3 ameliorates cerebral ischemia reperfusion injury in diabetic mice in vivo and in vitro[J]. J Diabetes Res, 2019, 2019:8520856. [2] XIAO L, DAI Z W, TANG W J, et al. Astragaloside IV alleviates cerebral ischemia-reperfusion injury through NLRP3 inflammasome-mediated pyroptosis inhibition via activating Nrf2[J]. Oxid Med Cell Longev, 2021, 2021(1):9925561. [3] SO P W, EKONOMOU A, GALLEY K, et al. Intraperitoneal delivery of acetate-encapsulated liposomal nanoparticles for neuroprotection of the penumbra in a rat model of ischemic stroke[J]. Int J Nanomedicine, 2019, 14:1979-1991. doi: 10.2147/IJN.S193965 [4] MANSO M A, GUITTET C, VANDENHENDE F, et al. Efficacy of oral midazolam for minimal and moderate sedation in pediatric patients: a systematic review[J]. Paediatr Anaesth, 2019, 29(11):1094-1106. doi: 10.1111/pan.13747 [5] YU H, WANG X Z, KANG F X, et al. Neuroprotective effects of midazolam on focal cerebral ischemia in rats through anti-apoptotic mechanisms[J]. Int J Mol Med, 2019, 43(1):443-451. [6] GUAN R Q, ZOU W, DAI X H, et al. Mitophagy, a potential therapeutic target for stroke[J]. J Biomed Sci, 2018, 25(1):87. doi: 10.1186/s12929-018-0487-4 [7] SUN E, ZHANG J, DENG Y, et al. Docosahexaenoic acid alleviates brain damage by promoting mitophagy in mice with ischaemic stroke[J]. Oxid Med Cell Longev, 2022, 2022:3119649. [8] GUO P P, JIN Z, WU H S, et al. Effects of irisin on the dysfunction of blood-brain barrier in rats after focal cerebral ischemia/reperfusion[J]. Brain Behav, 2019, 9(10):e01425. [9] 杨涛, 刘勇, 曹兴华, 等. 三七总皂苷对短暂性前脑缺血大鼠海马区神经元的修复作用实验研究[J]. 陕西医学杂志, 2023, 52(7):803-808. doi: 10.3969/j.issn.1000-7377.2023.07.006 [10] 周丽娜, 辛欢, 杨敏, 等. 丹参酚酸A对脑缺血大鼠神经功能及热休克蛋白基因表达的影响[J]. 陕西中医, 2022, 8(11):1521-1526. [11] 李亚琴, 任维, 罗钢, 等. 蛭龙活血通瘀胶囊对缺血性脑卒中模型大鼠的作用及对脑皮层神经元线粒体的影响[J]. 中药药理与临床, 2021, 37(5):119-124. [12] 刘建, 叶玉军, 刘树民, 等. 基于p38MAPK信号通路分析咪达唑仑对腰椎间盘突出症模型大鼠疼痛的影响[J]. 中国骨伤, 2023, 9(1):55-60. [13] 陆晓华, 金桂芳, 余河汉, 等. 基于PINK1/Parkin信号通路研究细叶远志皂苷对AD模型小鼠脑组织线粒体自噬的影响[J]. 中国药房, 2021, 7(22):2748-2754. doi: 10.6039/j.issn.1001-0408.2021.22.11 [14] LIU J Y, GUO F, WU H L, et al. Midazolam anesthesia protects neuronal cells from oxidative stress-induced death via activation of the JNK-ERK pathway[J]. Mol Med Rep, 2017, 15(1):169-179. doi: 10.3892/mmr.2016.6031 [15] 杨秋怡, 王琪, 马博. 柔肝通络汤上调血管内皮生长因子及其受体表达对缺血性脑卒中大鼠脑皮质血管再生、神经元损伤的影响[J]. 广州中医药大学学报, 2022, 39(12):2870-2876. [16] PALIKARAS K, LIONAKI E, TAVERNARAKIS N. Mechanisms of mitophagy in cellular homeostasis, physiology and pathology[J]. Nat Cell Biol, 2018, 20(9):1013-1022. doi: 10.1038/s41556-018-0176-2 [17] 王谢, 谢道俊, 杜世超, 等. 肝豆灵片对肝豆状核变性认知障碍模型小鼠海马神经元自噬的作用机制[J]. 陕西中医, 2023, 44(7):833-838. doi: 10.3969/j.issn.1000-7369.2023.07.002 [18] WEN H X, LI L X, ZHAN L X, et al. Hypoxic postconditioning promotes mitophagy against transient global cerebral ischemia via PINK1/Parkin-induced mitochondrial ubiquitination in adult rats[J]. Cell Death Dis, 2021, 12(7):630. doi: 10.1038/s41419-021-03900-8 [19] WU M, LU G, LAO Y Z, et al. Garciesculenxanthone B induces PINK1-Parkin-mediated mitophagy and prevents ischemia-reperfusion brain injury in mice[J]. Acta Pharmacol Sin, 2021, 42(2):199-208. doi: 10.1038/s41401-020-0480-9 -





 下载:
下载: