-
人粒细胞刺激因子(human granulocyte colony-stimulating factor,G-CSF)是调节骨髓粒系造血细胞增殖和分化的主要细胞因子之一,能诱导造血干细胞从骨髓向外周血动员,促进中性粒细胞生成和释放。G-CSF注射液是一种通过基因重组技术生产的生物制剂,主要成分为重组人粒细胞刺激因子(recombinant human G-CSF,rhG-CSF),临床用于各种原因导致的中性粒细胞减少。近年来,外周造血干细胞移植供者移植前常应用G-CSF注射液,动员干细胞从骨髓转移到外周血,增加造血细胞数量,提高移植的安全性[1]。随着G-CSF制剂的广泛应用,不良反应在临床中越发多见,常见的不良反应有肌肉酸痛、骨痛、食欲不振、发热、乏力、皮疹等,较严重的不良反应为间质性肺炎、成人呼吸窘迫综合征、幼稚细胞增加等,极少数出现弥漫性肺泡出血(diffuse alveolar hemorrhage,DAH)[2]。DAH可由多种因素诱发,临床进展迅速,重症患者病死率高。药物相关性肺泡出血往往被忽视,G-CSF作为导致DAH的少见病因,其发病机制与其他疾病不同,起病急、病情危重,临床医师和药师应提高警惕,对于临床上出现咯血、低氧血症、进行性贫血的患者应详细询问病史及用药史,早期诊断并及时治疗[3]。笔者通过分析1例健康供者移植前应用G-CSF注射液导致DAH的病例,以期提高临床对应用G-CSF注射液诱发DAH的风险意识,同时为该类患者的临床治疗和监护提供依据。
-
患者39岁,男,身高170 cm,体重65 kg,身体质量指数22.5 kg/m2。既往体健,因其子患血液病,拟行造血干细胞移植,与其子HLA配型为亲缘单倍体相合,排除禁忌症。于2024年8月31日为捐献造血干细胞收入空军特色医学中心,否认肝炎、结核等传染病病史,否认高血压等慢性病史,否认药物、食物过敏史。
-
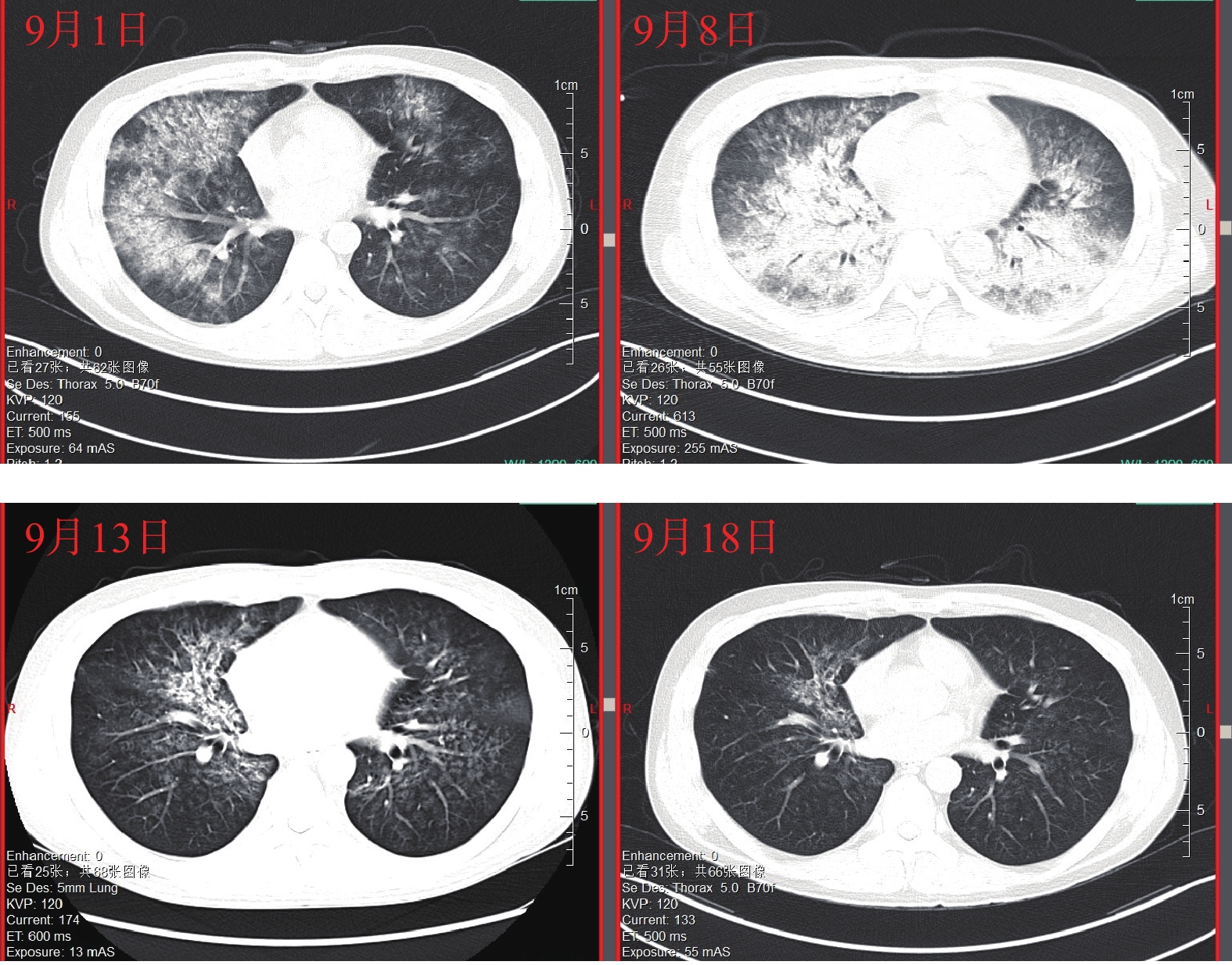
患者入院前在门诊完成各项检查,血常规、尿常规、便常规、手术感染八项、凝血功能及肝肾功能正常,胸片无异常。8月31日9:00入院,血压、心率、体温正常,10:00和18:00给予G-CSF注射液300 μg皮下注射各1次,无其他合并用药。9月1日6:00给予G-CSF注射液300 μg皮下注射1次,患者诉咽部不适,有血丝咳出,7:47急查凝血六项,未见异常。9:30查体,血压100/65 mmHg,血氧饱和度94%,双肺呼吸音清,10:37急查胸部CT,两肺见弥漫分布片状密度增高影及磨玻璃影(图1),提示两肺渗出,排除呼吸道感染,咽喉鼻腔出血和肺栓塞,12:00综合患者咯血及肺部影像学表现,考虑有DAH,病情较重,停G-CSF注射液,停三级护理改一级护理,给予心电、血压、血氧饱和度监测,持续低流量吸氧,根据血氧饱和度调整,给予注射用甲泼尼龙80 mg q12 h,注射用奥美拉唑40 mg q12 h,维生素K1注射液10 mg q12 h。9月2日8:00,患者血氧饱和度低,在90%~94%之间波动,心率110次/min,血压正常,呼吸颦促(约40次/min),改为高流量吸氧;9:16急查床旁胸片,提示肺部炎症较昨日明显加重,给予注射用甲泼尼龙500 mg q12 h、静注人免疫球蛋白25 g冲击治疗,同时给予重组人凝血因子Ⅶa止血,给予注射用艾司奥美拉唑40 mg q12h预防应激性溃疡,更换常压高流量氧疗仪,后血氧饱和度维持在97%~98%,呼吸频率降至25次/min左右。9月3日9:00患者仍间断咯血,血红蛋白下降至98 g/L,血氧饱和度94%,床旁胸片提示左肺病灶较昨日略加重,继续500 mg甲泼尼龙冲击,加用矛头蝮蛇血凝酶加强止血,高流量给氧条件下加用面罩吸氧;20:00血压下降至87/50 mmHg,紧急输注红细胞后血压升至97/59 mmHg,21:00咯血加重,每间断约10 min就要吐出约20 ml鲜红色血液,继续输注红细胞、血浆400 ml;23:45给予全麻下床旁气管插管,呼吸机辅助呼吸,同时置入胃管,持续胃肠减压、吸痰治疗。胃管引流出鲜红色液体约50 ml,行床旁气管镜检查,镜下见左右主支气管内大量鲜红色血性液体涌出,给予镜下吸引并局部使用去甲肾上腺素稀释液止血,继续输血、止血治疗。9月4日,患者镇痛镇静持续俯卧位通气状态,经口气管插管持续呼吸机辅助呼吸,监护显示体温36 ℃,心率98次/min,血压111/75 mmHg,血氧饱和度91%,输注悬浮红细胞2 U、普通冰冻血浆400 ml,将激素减量至注射用甲泼尼龙120 mg q12 h,考虑血浆置换治疗。9月5日和9月6日给予床旁血浆置换。9月6日患者镇痛镇静持续俯卧位通气状态,经口气管插管持续呼吸机辅助呼吸,监护提示心率89次/min,血压146/60 mmHg,血氧饱和度96%,血浆置换后气道出血减少,血氧饱和度改善,病情好转,将激素减量至注射用甲泼尼龙80 mg q12 h,并限液利尿。9月7日行气管检查见左右主气管及各级支气管开口通畅,可见陈旧性血性分泌物及血栓附着,各分段支气管开口通畅,无新鲜出血。9月8日患者血氧饱和度明显改善,肺泡出血减少,充分评估后脱机拔管;复查胸部CT,两肺见弥漫分布片状密度增高影及磨玻璃高密度影(图1),提示双肺弥漫性肺出血。9月9日患者神志清楚,经鼻高流量氧疗,监护提示体温36 ℃,心率67次/min,血压124/82 mmHg,血氧饱和度97%,激素调整为注射用甲泼尼龙每天早80 mg、晚40 mg,继续吸氧、雾化、抗感染、辅助排痰等治疗。9月11日患者病情平稳,经鼻高流量氧疗,血氧饱和度99%,复查肺部CT继续好转,注射用甲泼尼龙减量为40 mg q12 h。9月13日复查胸部CT,两肺见片状密度增高影及磨玻璃密度影较前减少(图1),提示双肺出血较前减轻。9月14日患者不吸氧状态下血氧饱和度98%,未再诉咽颈部疼痛,注射用甲泼尼龙减量为20 mg q12 h。9月18日复查胸部CT,两肺渗出阴影较前明显减少(图1),提示双肺出血较前明显好转,停用静脉激素,予以醋酸泼尼松片25 mg qd序贯口服治疗。9月20日患者情况稳定出院。
-
DAH是由不同原因导致肺泡微血管损伤,肺微血管的血液进入肺泡,引起咯血、呼吸困难和贫血,影像表现双肺弥漫性浸润影,并可导致呼吸衰竭的致命性临床综合征[4]。患者8月31日入院后给予G-CSF注射液皮下注射,无合并用药,9月1日早晨发现咽部不适,咳血症状,血氧饱和度下降,9月1日胸部CT结果显示两肺渗出,排除咽喉鼻腔问题所致出血,考虑DAH,停用G-CSF注射液,给予对症治疗。患者既往无基础疾病,入院前血常规、肝肾功能等各项基础检查均正常,DAH发生于使用G-CSF注射液之后,G-CSF共使用3剂,每剂300 μg,累计剂量14 μg/kg,第一次给药20 h后患者出现症状,且在此期间未使用其他药物。因此,患者G-CSF的使用时间与DAH出现的时间存在时间先后关系。急查抗核抗体及抗核抗体谱、类风湿因子、补体C3及C4、抗中性粒细胞胞浆抗体、抗磷脂抗体、抗髓过氧化物酶等自身免疫相关指标,均未发现异常,可排除其他疾病引起DAH的可能性。查阅药品说明书和文献,G-CSF可引起肺毒性[5],国内亦有G-CSF导致DHA的相关报道[6]。按照国家药品不良反应(ADR)关联性评价判定原则[7],G-CSF的结果为“很可能”。另外,根据Naranjo评估量表[8]得分如下:该 ADR 先前有结论性报告(1分),该ADR 是在使用G-CSF后发生(2分),停药后ADR减轻(1分),排除引起该反应的其他原因(2分),存在ADR的客观证据(1分),总得分7分,故患者DAH与G-CSF“很可能相关”。
-
DAH的病因可分为自身免疫相关性和非自身免疫相关性两类,自身免疫系统性疾病包括抗中性粒细胞胞浆抗体(ANCA)相关性血管炎、抗肾小球基底膜病、IgA血管炎、系统性红斑狼疮、白塞病、混合性结缔组织病等,非自身免疫相关性原因包括感染、中毒、药物、化学物质、肺部放射治疗等[9]。尽管病因各异,但病理生理机制相似,即在疾病的发展过程中,由于多种因素刺激造成的免疫功能紊乱,炎症介质级联反应,氧化应激反应持续刺激肺血管内皮,导致肺泡毛细血管基底膜发生广泛损伤,终末细支气管远端的肺腺泡内广泛出血,充满了含铁血黄素的巨噬细胞在肺泡及肺间质内堆积[10]。
本例患者出现DAH后急查抗核抗体等自身免疫相关指标均无异常,可排除自身免疫性疾病,药物引起的可能性大。近年来,随着药物种类的增加,多种药物出现药源性DAH报道,如生物制剂度伐利尤单抗注射液[11]、靶向药物奥希替尼[12]、抗肺纤维化药物吡非尼酮[13]等。自身免疫反应和细胞因子风暴是引起药源性DAH的主要原因[14]。患者应用G-CSF注射液后中性粒细胞持续升高,9月2日炎症因子检验结果提示白介素(IL)-2、IL-6及IL-12p70均升高,G-CSF所致DAH的原因可能为粒细胞短时间内显著增多,肺泡里中性粒细胞大量聚集,巨噬细胞激活,释放的炎性物质抑制粒细胞正常凋亡,产生炎症风暴,导致肺毛细血管内皮损伤,通透性增加,肺泡毛细血管膜损伤。
-
DAH临床进展迅速,重症患者病死率高,缺少特异性诊断特征,对于临床上出现咯血、低氧血症、进行性贫血的患者应详细询问病史和用药史,尽早诊断,对症治疗[15]。一旦发生药源性DAH,首先要判断可疑药品并立即予以停用,然后评估临床症状、脏器受累情况,通过吸氧或机械通气等措施,尽可能维持呼吸状况稳定,在支持治疗基础上决定是否使用糖皮质激素、免疫抑制剂、血浆置换或生物制剂等治疗[16]。
糖皮质激素治疗是DAH治疗的重要手段,重症患者建议使用糖皮质激素冲击治疗,然而对激素用量及用药时间目前尚无定论。文献报道高剂量甲泼尼龙能改善 DAH患者的预后,经验性使用甲泼尼龙30 mg/(kg·d),连用3 d,控制急性出血,当肺泡出血缓解后再逐渐减量[17]。也有研究认为1 mg/(kg·d)可有效治疗 DAH,并减少激素相关性不良反应[18]。本例患者应用G-CSF注射液后即出现咯血及进行性加重的呼吸困难,开始给予糖皮质激素甲泼尼龙80 mg q12 h治疗,病情进展,血氧饱和度和血红蛋白继续下降,调整为甲泼尼龙500 mg q12 h冲击治疗,病情好转后,将激素减量至甲泼尼龙80 mg q12 h。因此,糖皮质激素用量需结合患者具体情况:急性DAH,症状快速进展,常应用大剂量激素冲击;慢性DAH,可应用1 mg/(kg·d)治疗。同时,需监测血红蛋白和血氧饱和度情况,评估治疗效果,及时调整激素用量。
血浆置换也是治疗急性DAH的有效措施[19]。药源性DAH的原因可能为药物导致免疫或过敏反应,血浆置换可短期内改善免疫状态,减少免疫相关肺损伤,按照治疗方案,急性期的血浆置换推荐每天或间隔1~2 d进行[20]。本例G-CSF注射液引起的DAH与粒细胞刺激因子活化粒细胞导致损伤内皮细胞、肺通透性损伤相关,患者炎症因子指标高,在对症治疗基础上行2次床旁血浆置换,去除过度活化的炎性细胞和细胞因子,患者病情改善明显。
-
大剂量糖皮质激素治疗可能引发短期或长期副作用,包括消化道损伤、免疫抑制、代谢紊乱等,需做好用药监护,减少激素相关不良反应的发生[21]。该患者给予G-CSF注射液后出现DAH,病情危重,血氧饱和度持续下降,应用甲泼尼龙500 mg冲击治疗,临床药师建议给予艾司奥美拉唑40 mg静脉泵入,预防消化道出血。甲泼尼龙冲击治疗后,患者仍频繁咯血,需监测血红蛋白,检测便潜血,警惕肺泡出血合并消化道出血。患者因咯血量较大,血红蛋白持续下降,最低时67 g/L,给予重组人凝血因子Ⅶa促进止血。临床药师提示重组人凝血因子输注需严格评估风险与收益,避免过度输注导致血栓等并发症,治疗过程中密切监测凝血指标和生命体征,根据病情调整治疗方案。
高剂量甲泼尼龙应用2 d后,及时降低甲泼尼龙剂量至120 mg,患者症状改善后,将激素减量至甲泼尼龙80 mg q12 h,并根据患者床旁胸片和肺部CT检查结果,逐步降低激素剂量,9月18日停用静脉激素,改为泼尼松片25 mg qd序贯口服治疗,降低激素所致的不良反应。
另外,患者病情危重,免疫力低,易合并肺部感染,在治疗期间需密切监测血常规、C反应蛋白、降钙素原等感染相关指标,如出现感染指标升高,应及时给予经验性抗感染治疗。
-
DAH是G-CSF罕见的严重不良反应,一般起病急、诊断困难、病情凶险,重症患者病死率高,早期诊断并给予积极治疗尤为重要。临床药师在日常工作中熟悉药物的不良反应和相互作用等信息,可协助医师尽快识别药物不良反应,及时对症治疗。在治疗过程中,临床药师密切关注患者用药情况,开展药学监护,可协助医师调整优化给药方案,为患者的合理安全用药保驾护航。
Participation of clinical pharmacists in patient of diffuse alveolar hemorrhage induced by human granulocyte colony-stimulating factor
doi: 10.12206/j.issn.2097-2024.202506021
- Received Date: 2025-06-19
- Accepted Date: 2025-10-14
- Rev Recd Date: 2025-10-11
- Available Online: 2025-11-19
- Publish Date: 2025-11-25
-
Key words:
- human granulocyte colony-stimulating factor /
- diffuse alveolar hemorrhage /
- adverse drug reaction
Abstract:
| Citation: | YANG Zhihui, CAI Huadan, XU Fangchu, LIU Yuan, YUAN Hailong. Participation of clinical pharmacists in patient of diffuse alveolar hemorrhage induced by human granulocyte colony-stimulating factor[J]. Journal of Pharmaceutical Practice and Service, 2025, 43(11): 567-571. doi: 10.12206/j.issn.2097-2024.202506021 |







 DownLoad:
DownLoad: