-
据世界卫生组织(WHO)估计,2015年全世界有7 100万人存在慢性丙型肝炎病毒(HCV)感染,并且有399 000人死于HCV感染引起的肝硬化或肝细胞癌[1]。我国人口基数大,HCV感染者众多,且呈递增趋势,目前HCV感染者居世界首位[2]。慢性丙型肝炎因其高隐匿性,早期不易被发现,诊断率低、反复发作、治疗难度大等特点,若早期没及时处理和干预,会逐渐发展为肝纤维化、肝硬化甚至肝癌[3-4]。索磷布韦(sofosbuvir)是一种NS5B多聚酶核苷抑制剂,临床上显示出较好的效果[5-6]。但是索磷布韦也存在着一些副作用,如接受索非布韦和胺碘酮治疗的患者发生严重心动过缓的风险增加[7-9],因此,仍有必要寻找和发现新型抗HCV药物。
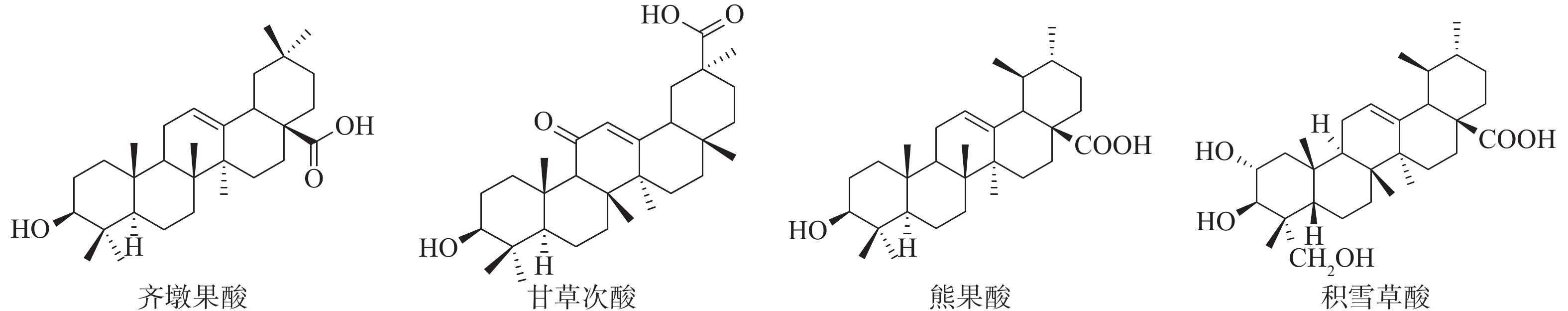
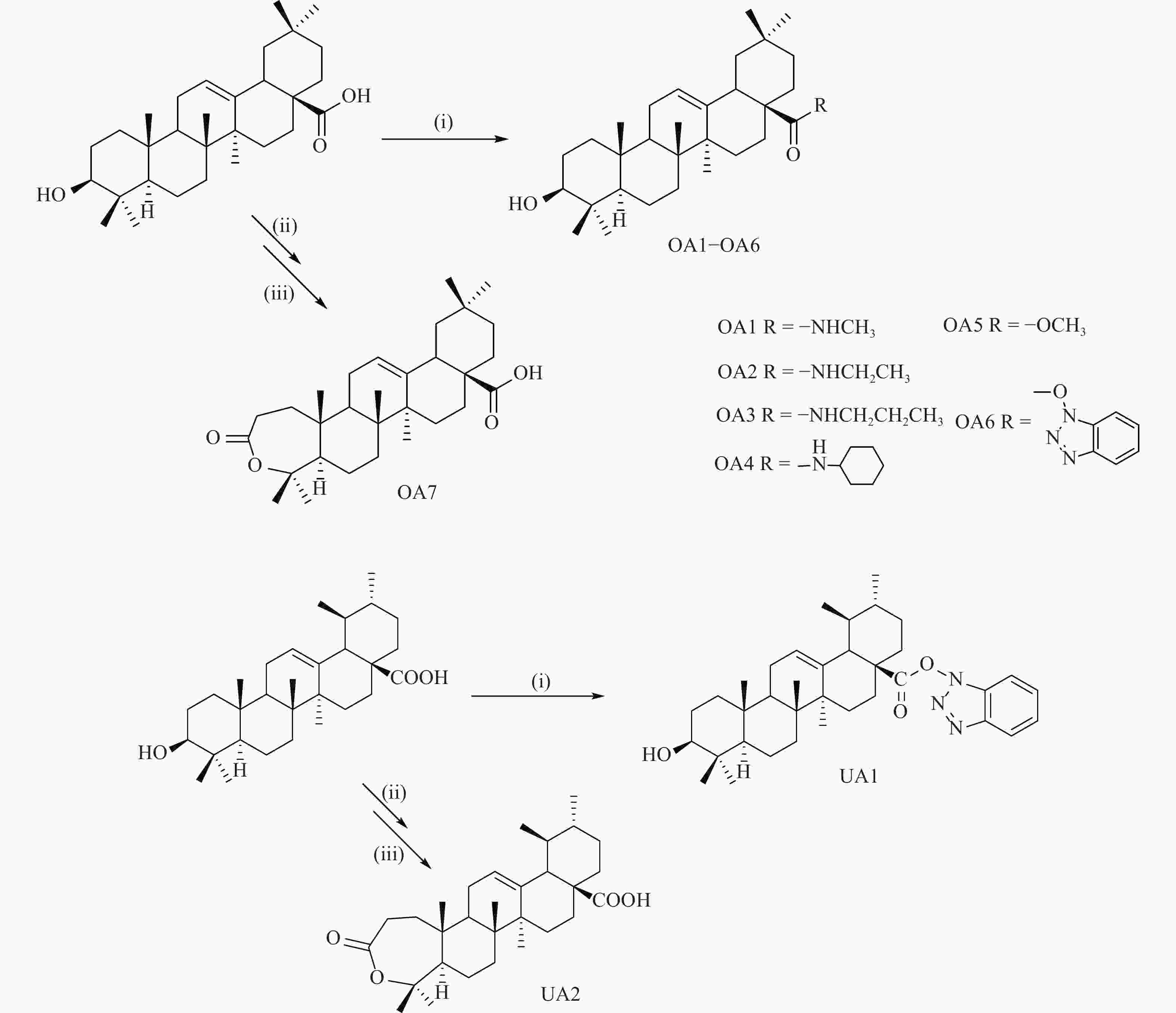
五环三萜类化合物是一类重要的天然产物,自然界中多以苷或游离苷元形式存在;其苷及苷元具有抗肿瘤、保肝、抗炎、抗病毒等多种药理活性[10]。其中,齐墩果酸(OA)、甘草次酸(GA)、熊果酸(UA)和积雪草酸(AA)等均有报道具有保肝作用[11-13],见图1。前期研究中我们发现GA及其衍生物显示出较好的抗HCV活性[11],因此,我们又进一步测试了OA、UA和AA这些天然的五环三萜酸的抗HCV活性,并最终选择原料较易获得的OA和UA进行了初步的结构修饰和抗HCV活性测试,以期获得更高活性化合物并初步探索构效关系,为进一步研究天然产物来源的抗HCV药物研究提供基础和依据。
-
Broker Spectrospin AC-300P型核磁共振仪(德国布鲁克公司);Aglilent LC/MS-
6210 液相质谱联用仪(安捷伦科技有限公司);Synergy 2多功能酶标仪(美国BioTek公司);CO2 细胞培养箱(美国Thermo scientific 公司);CKX31 倒置相差显微镜(日本Olympus 公司)。 -
齐墩果酸、甘草次酸、熊果酸、积雪草酸白桦酸[购于萨恩化学技术(上海)有限公司];合成与纯化所用试剂均为市售化学纯或分析纯试剂。DMEM培养基10%胎牛血清等试剂均购自 GIBCO-Invitrogen或Sigma-Aldrich;人肝癌Huh7细胞(购自中国科学院上海细胞所);细胞活性检测(CCK-8)试剂盒[购自同仁化学研究所(Dojindo)]。
-
首先采用CCK-8方法确定对细胞活力不产生影响的药物的合适浓度范围。将药物用DMSO溶解,配制成合适浓度母液,再稀释为合适浓度的候选工作液。然后在96 孔板中接种细胞悬液(100 μl,5×104个/孔),将培养板放在培养箱预培养(37℃,5% CO2),待细胞融合度达到80% 时,用不同浓度的药物进行处理,后置于培养箱中孵育,24 h 后各孔换上新鲜培养基,每孔加入10 μl的CCK-8 溶液,将培养板放在培养箱内孵育。2 h后用酶标仪测定450 nm 吸光度值。
取处于对数生长期的Huh7细胞, 调整细胞浓度为1×105个/ml,将Huh7细胞隔夜种于96孔板中(1×104个/孔),次日每孔加一定体积的HCVcc病毒颗粒液,再加入不同浓度的药物,37℃孵育6 h后更换新鲜含有10%胎牛血清的DMEM全培养基,继续37℃培养48 h,在荧光显微镜下计算每个孔中的表达绿色荧光蛋白的阳性克隆数。
-
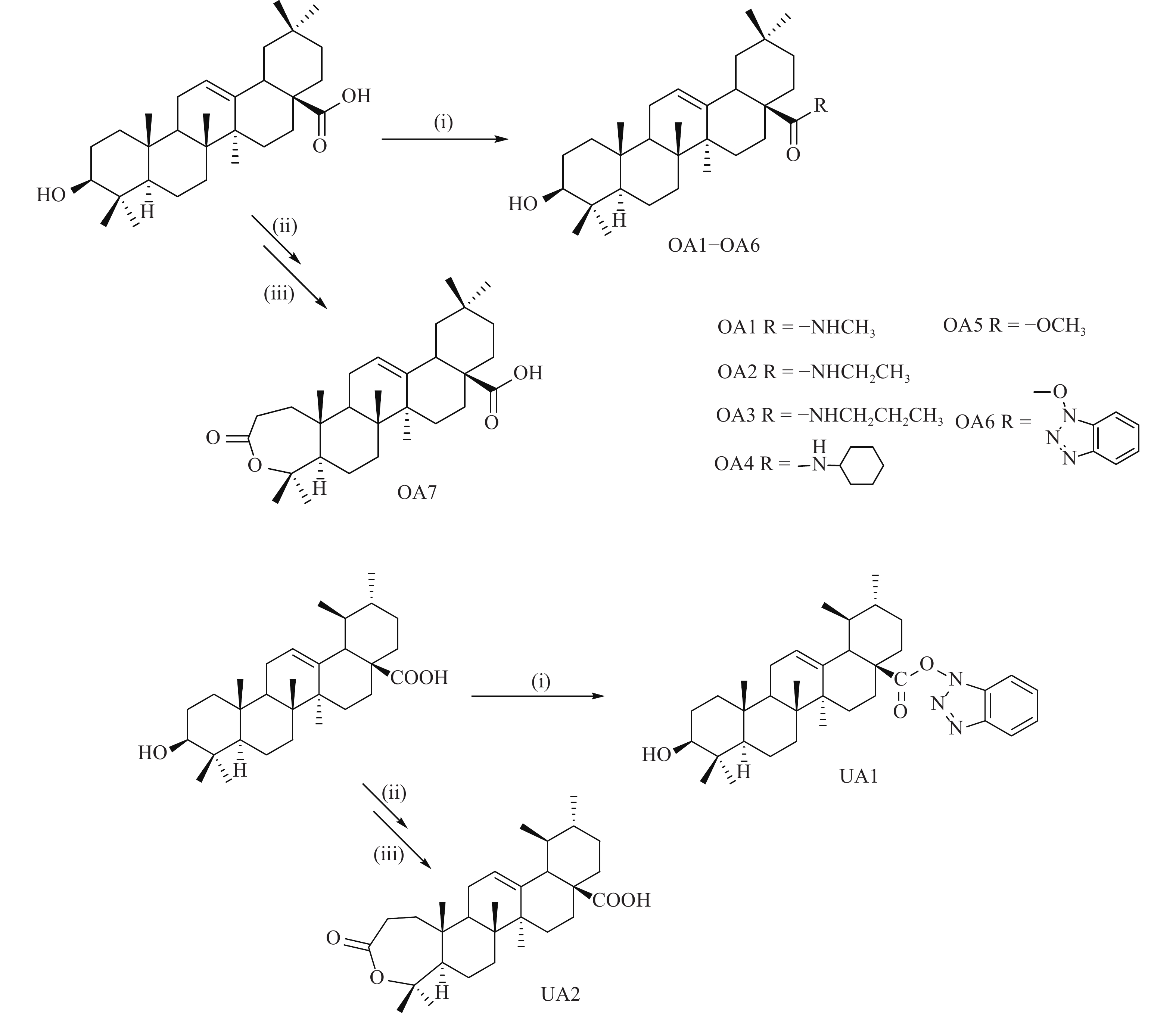
化合物OA1-OA6和UA1采用PyBOP作为缩合剂,在DIEA存在下直接与相应的胺反应制备而得。OA7和UA2通过PCC 将3位羟基氧化为羰基后,再通过m-CPBA 氧化发生Baeyer-Villiger反应而制得(图2)。
-
OA(200 mg, 0.43 mmol),PyBOP(244.6 mg, 1.47 mmol),2 ml DIEA溶解,再加入甲胺盐酸盐100 mg,然后室温下搅拌反应6 h。将反应液倒入到100 ml冰水,析出白色固体,抽滤,然后用10 ml 95% 乙醇重结晶得粗品,再用硅胶柱层析纯化分离得到目标化合物101 mg,产率47%。1H NMR(300 MHz, CDCl3)δ 5.88(d, J = 4.2 Hz, 1H), 5.31(m, 1H), 3.16(d, J = 9.6 Hz, 1H), 2.67(d, J = 4.7 Hz, 3H), 2.40(m, 1H), 1.09(s, 3H), 0.92(s, 3H), 0.83(s, 9H), 0.72(s, 3H), 0.67(s, 3H). 13C NMR(CDCl3, 75 MHz): δ 179.1, 145.4, 123.0, 79.9, 55.5, 48.7, 47.0, 46.9, 43.3, 43.0, 39.9, 39.8, 39.4, 37.9, 34.5, 33.9, 33.1, 32.9, 31.3, 30.4, 29.2, 28.1, 28.2, 27.2, 24.9, 24.6, 24.5, 18.2, 17.9, 16.6, 16.4; LC-MS, [M+H]+ = 470.8。
-
采用乙胺盐酸盐为原料,合成方法与OA1基本相同。产率43%。1H NMR(300 MHz, CDCl3)δ 5.87(s,1H ), 5.38(m, 1H), 3.35(m, 1H), 3.23(m, 1H), 3.11(m, 1H), 2.50(m, 1H), 1.16(s, 3H), 1.10(s, 3H), 0.99(s, 3H), 0.91(m, 9H), 0.78(m, 6H); 13C NMR(CDCl3, 75 MHz): δ 176.8, 144.3, 123.0, 78.7, 54.9, 48.3, 46.7, 45.6, 43.5, 42.8, 39.6, 39.0, 38.6, 37.1, 35.0, 34.1, 33.0, 32.8, 32.0, 31.2, 30.8, 28.5, 28.0, 26.6, 24.1, 23.4, 23.0, 17.5, 16.9, 16.0, 15.3. LC-MS, [M+H]+ = 484.7。
-
采用正丙胺为原料,合成方法与OA1基本相同。产率51%。1H NMR(300 MHz, CDCl3)δ 5.93(s,1H), 5.38(m, 1H), 3.35(m, 1H), 3.20(s, 1H), 2.95(m, 1H), 2.50(m, 1H), 1.16(s, 3H), 0.99(s, 3H), 0.91(m, 12H), 0.78(s, 3H), 0.77(s, 3H). 13C NMR(CDCl3, 75 MHz): δ 176.8, 144.3, 123.0, 78.7, 54.9, 48.3, 46.7, 45.6, 43.5, 42.8, 39.6, 39.0, 38.6, 37.14, 35.0, 34.1, 33.0, 32.8, 32.0, 31.2, 30.8, 28.5, 28.0, 26.6, 24.1, 23.4, 23.0, 17.5, 16.9, 16.0, 15.3. LC-MS, [M+H]+ = 498.9。
-
采用环己胺为原料,合成方法与OA1基本相同。产率45%。1H NMR(300 MHz, CDCl3)δ 5.63(d, J = 7.4 Hz, 1H), 5.27(m, 1H), 3.65(m, 1H), 3.15(m, 1H), 2.46(m, 1H), 1.09(s, 3H), 0.92(s, 3H), 0.85(s, 3H), 0.83(m, 6H), 0.74(s, 3H), 0.71(s, 3H). LC-MS, [M+H]+ = 539.0。
-
采用无水甲醇为原料,合成方法与OA1基本相同。产率52%。1H NMR(300 MHz, CDCl3)δ 5.26(s, 1H,), 3.62(m, 1H), 3.17(s, 3H), 2.46(m, 1H), 1.10(s, 3H), 0.94(s, 3H), 0.88(s, 9H), 0.75(s, 3H), 0.69(s,1H); 13C NMR(CDCl3, 75 MHz): δ 178.3, 143.7, 122.4, 79.2, 55.2, 51.6, 47.6, 46.7, 45.6, 41.7, 41.2, 39.3, 38.8, 38.4, 37.1, 33.9, 33.2, 32.6, 32.5, 31.0, 28.2, 27.3, 27.2, 26.0, 23.6, 23.4, 23.1, 18.4, 16.8, 15.6, 15.3. LC-MS, [M+H]+ =471.7。
-
采用1-羟基苯并三氮唑为原料,合成方法与OA1基本相同。产率41%。1H NMR(300 MHz, CDCl3)δ 8.07(d, J = 8.4 Hz, 1H), 7.54(t, J = 7.5 Hz, 1H), 7.40(m, 2H), 5.40(s, 1H), 3.64(s, 1H), 3.24(m, 1H), 3.00(m, 1H), 1.24(s, 3H), 1.02(s, 6H), 0.99(s, 3H), 0.93(s, 3H), 0.87(s, 3H), 0.81(s, 3H); 13C NMR(300 MHz, CDCl3)δ 173.7, 143.6, 142.1, 128.8, 128.5, 124.6, 123.9, 120.5, 108.2, 79.0, 55.3, 47.6, 47.6, 45.5, 41.9, 41.6, 39.5, 38.8, 38.5, 37.0, 33.7, 32.9, 32.9, 32.5, 30.7, 28.1, 27.2, 25.8, 23.5, 23.5, 23.2, 18.3, 17.3, 15.6, 15.4. LC-MS, [M+H]+=574.8。
-
OA(200 mg, 0.43 mmol),NaHCO3(85.69 mg, 1.02 mmol),m-CPBA (264.03 mg, 1.53 mmol),4 ml无水二氯甲烷溶解,室温搅拌反应15 min后减压蒸除溶剂,继续放置过反应,柱层析(石油醚∶乙酸乙酯=2∶1),得151 mg白色固体,产率45%。1H NMR(300 MHz, CDCl3)δ 5.28(s, 1H), 2.79(m, 1H), 2.55(m, 1H), 1.49(s, 3H), 1.46(s, 3H), 1.11(m, 6H), 1.09(s, 3H), 0.65(s, 3H), 0.63(s,3H) ppm. 13C NMR(300 MHz, CDCl3)δ 178.9, 177.6, 140.4, 122.6, 79.9, 73.3, 57.7, 50.9, 47.2, 43.6, 42.5, 41.6, 40.3, 37.6, 34.9, 33.4, 32.1, 31.1, 29.9, 30.4, 30.0, 29.9, 27.4, 25.2, 22.8, 22.0, 20.9, 15.6, 15.0。
-
以熊果酸为原料,参考齐墩OA6的合成方法制备。1H NMR(300 MHz, CDCl3): δ 8.12(m, 1H), 7.62(m, 1H), 7.41(m, 1H), 7.35(m, 1H), 5.45(m, 1H), 3.56(m, 1H), 2.31(m, 2H), 2.10(m, 6 H), 1.02(m,9H), 0.92(m,9H). 13C NMR(75 MHz, CDCl3)δ 172.5, 142.4, 141.0, 127.7, 127.3, 123.5, 122.8, 119.4, 107.0, 77.9, 76.3, 76.1, 75.9, 75.4, 54.1, 46.5, 46.5, 44.4, 40.8, 40.5, 38.4, 37.6, 37.4, 35.9, 32.6, 31.8, 31.7, 31.3, 29.5, 27.0, 26.9, 26.1, 24.6, 22.4, 22.3, 22.0, 17.2, 16.2, 14.4, 14.2. [M+H]+ = 574.5。
-
以熊果酸为原料,参考齐墩OA7的合成方法制备。1H NMR(300 MHz, CDCl3)δ 5.28(s, 1H), 2.62(m, 1H), 1.48(s, 3H), 1.42(s, 3H), 1.15(s, 3H), 1.09(s, 3H), 0.96(d, J = 5.7 Hz, 3H), 0.85(m, 5H), 0.80(s, 1H). [M+H]+ = 471.5, [M-H]− = 469.7。
-
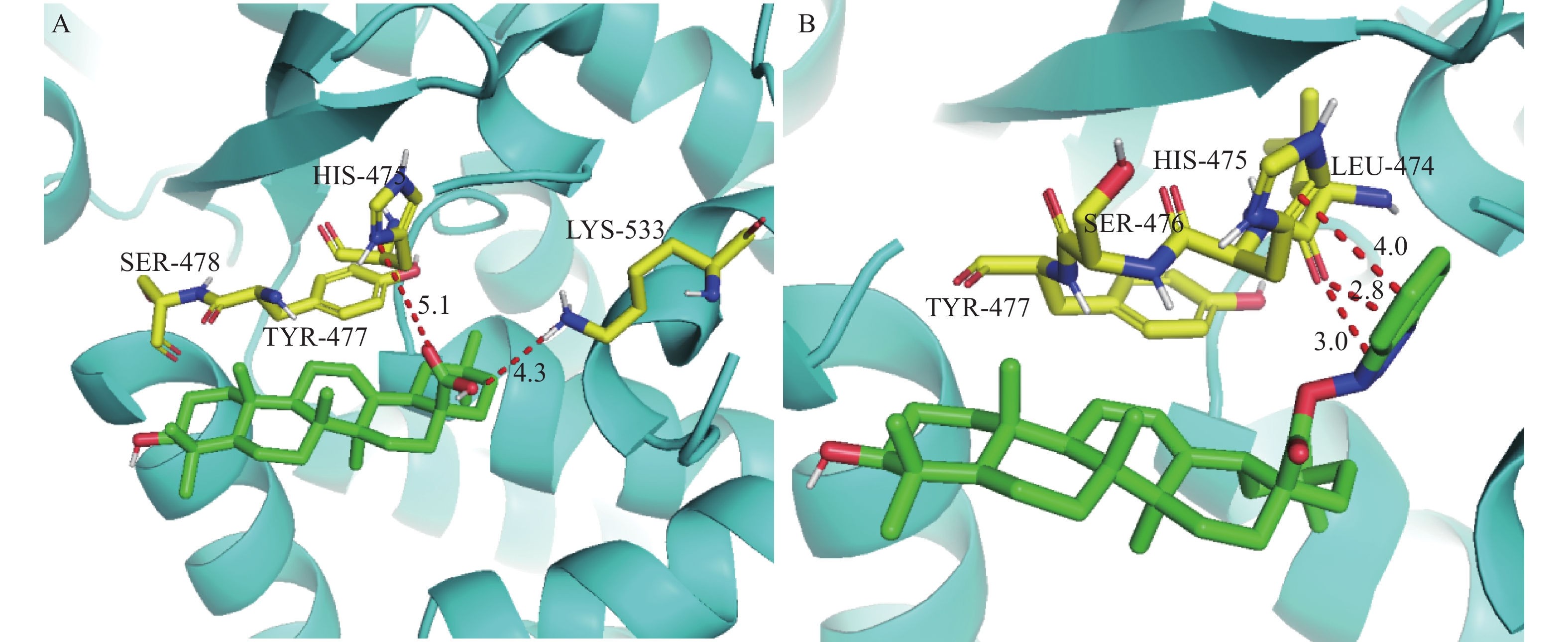
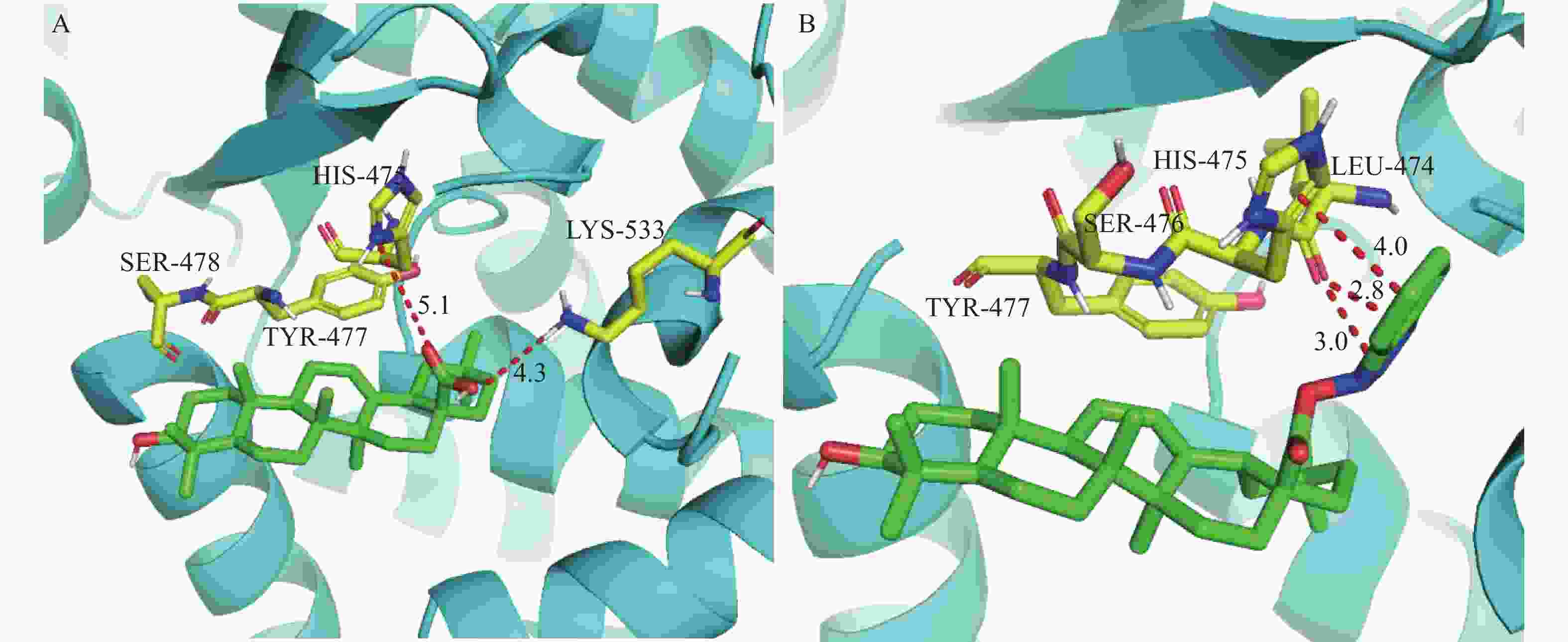
首先利用Chem3D软件对化合物OA和OA6结构进行能量最小化并保存(mol2格式)。然后通过RCSB PDB数据库获取HCV的NS5B(PDB ID:3PHE),PyMOL3.1软件中输入命令(“RemoveSolvent”“RemoveOrganic”)去除水分子及配体并保存(PDB格式)。采用Autodock1.5.7进行分子对接(选择精确的“遗传参数算法”,其余参数均默认),以关键氨基酸残基476位丝氨酸和477位酪氨酸为活性口袋[14]。比较结合能大小及氢键个数,以预测活性成分与核心靶蛋白的亲和力。最后,选择最低结合能及构象最佳的对接结果并利用PyMOL软件将大分子-配体复合体进行可视化处理。
-
共合成OA衍生物7个,UA衍生物2个。测试了五环三萜酸OA、GA、UA和AA的抗HCV作用。结果表明它们都具有一定的抗HCV作用。在合成的衍生物中多数也显示了比母体化合物更好抗HCV活性。首先选择28位羧基进行结构修饰,考察对活性的影响。合成了齐墩果酸-28-甲酯(OA5),抗HCV活性测试结果表明,其抗HCV活性没有提高(表1)。因此,又设计合成了酰胺类化合物(OA1-OA4),它们都显示出了强于OA的作用,其中,OA3的作用最强,提示酰胺化可能有利于提高活性,引入适当长短的烷烃取代的氨基可能提高活性。对与三萜酸的A环,采用Baeyer-Villiger氧化得到內酯类化合物OA7,也显示出较好的抗HCV活性。此外,合成过程中发现,活化酯中间体OA6具有较强的稳定性,不易发生下一步反应,因此将其分离出来,并测定了抗HCV的活性,发现它在OA衍生物中具有最好的活性。这提示28位羧基引入一个体积较大基团后可能有利于提高活性。在此基础上,进一步以UA为原料,合成了UA的內酯和活性酯衍生物,结果发现它们也具有强于母体化合物的更高的活性。这些结果表明,三萜的A环氧化为內酯结构,或者28引入较大体积结构都有利于提高活性。
化合物 IC50
(μmol/L)化合物 IC50
(μmol/L)化合物 IC50
(μmol/L)OA 198.6 GA 159.4 UA 142.6 AA 146.8 OA1 >200 OA2 192.3 OA3 178.2 OA4 185.2 OA5 >200 OA6 136.3 OA7 144.2 UA 1 121.2 UA2 134.3 NS5B是一种RNA依赖性RNA聚合酶(RdRp),是HCV RNA复制的中心酶,因此是抗病毒药物研发的有吸引力的靶标[15]。文献[16]报道了齐墩果酸可以通过抑制HCV的NS5B而发挥抗HCV的作用。因此,采用分子对接的方法,将OA及活性最高的化合物OA6与HCV的NS5B进行了对接。结果如图3所示:OA6(结合能–10.05 kJ/mol)作为配体时与蛋白的结合能小于OA(结合能–8.01 kJ/mol),表明OA6与蛋白形成的复合物结构更稳定。由图3可知,OA可以与475位组氨酸以及533位赖氨酸形成分子间氢键,但由于键长较长所以配体与蛋白之间的结合作用较弱,复合物稳定性较差。而OA6除了与474位亮氨酸形成短距离氢键外,其三氮唑结构还能与475位组氨酸的咪唑环形成π-π堆积进一步稳定复合物的整体结构,进而表现出复合物较高的稳定性。这一结果与体外抗HCV活性结果一致。
综上所述,本研究测试了4种常见的五环三萜酸OA、GA、UA和AA的抗HCV活性,并对OA和UA进行了衍生物设计与合成。多数OA和UA衍生物都显示出更强的抗HCV活性,其中,以引入活性酯的OA6和UA1活性最强。进一步的分子对接结果表明,活性分子可能是通过抑制NS5B发挥抗HCV作用。因此,这些五环三萜酸以及它们的衍生物值得进一步的研究,为寻找和发现新型的天然来源的抗HCV药物提供依据。
Synthesis and in vitro antiviral effects against hepatitis C virus of oleanolic acid and ursolic acid derivatives
doi: 10.12206/j.issn.2097-2024.202502045
- Received Date: 2025-02-28
- Rev Recd Date: 2025-04-17
- Available Online: 2025-10-21
- Publish Date: 2025-10-25
-
Key words:
- pentacyclic triterpenoid acid /
- derivatives /
- antiviral effect against hepatitis C virus /
- NS5B
Abstract:
| Citation: | XIAO Shuwen, ZHOU Heyang, JIN Yongsheng, QIAO Liming, ZHENG Wei. Synthesis and in vitro antiviral effects against hepatitis C virus of oleanolic acid and ursolic acid derivatives[J]. Journal of Pharmaceutical Practice and Service, 2025, 43(10): 503-508. doi: 10.12206/j.issn.2097-2024.202502045 |







 DownLoad:
DownLoad: