-
脑卒中是当前国内首位致死致残疾病,其中缺血性脑卒中占所有卒中的70%[1],严重危害人民身体健康。缺血性脑卒中发生后尽可能快的实现缺血半暗带再灌注是治疗的关键[2],但再灌注会使缺血半暗带区域形成强烈的免疫激活和炎症损伤[3],可能导致缺血性脑卒中急性损伤期的二次伤害并在远期预后上增加功能恢复难度[4]。日本学者研究显示,血管内治疗后仅有约1/7患者有较好的90 d预后[5],在我国接受再灌注治疗的患者仍有约1/3会留有终身残疾[6],因此,对脑卒中后神经保护药物的研究显得越来越重要[7]。大量研究表明,神经保护药可通过多种途径抑制致病级联反应,达到急性期治疗效果,如尼莫地平、依达拉奉等[8];也可以在长期治疗和功能恢复中发挥重要作用,包括一些“老药”新用,如右美托咪定、半胱氨酰白三烯受体拮抗剂等[9],特别是一些活血化瘀功效中药组方及成分,如灯盏生脉胶囊、白果内酯等的研究都取得了一定的进展[10]。课题组前期研究发现:中药红花(Carthami Flos)中的黄酮类化合物菸花苷能够通过促进自噬、抗氧化等对脑缺血再灌注损伤动物发挥急性期治疗效果[11, 12],同时菸花苷长期给药可改善CIRI大鼠生存状态[13],但到目前为止,菸花苷发挥长期保护作用的机制尚不明确。作为延续性工作,本实验重点研究了菸花苷长期给药对CIRI大鼠神经功能的影响,并运用转录组测序等方法对其作用机制进行了初步探索,旨在为将菸花苷应用于促进CIRI大鼠神经功能恢复提供更多实验支撑,也为从传统活血化瘀中药中开发神经保护药物提供借鉴。
-
成年雄性Wistar大鼠,体重(240±10)g,购自上海市计划生育科学研究所实验动物经营部,许可证号为SCXK(沪)2018-0006。大鼠购入后于海军军医大学药学系SPF级动物房内饲养,自由食水,人工照明模拟昼夜变化。实验操作严格遵守动物福利和伦理原则。
-
菸花苷注射液和菸花苷空白对照制剂由苏中药业集团股份有限公司生产加工(批号:20200331),菸花苷含量10 mg/ml。Caspase-1多克隆抗体(22915-1-AP)、GSDMD多克隆抗体(20770-1-AP)、NLRP3单克隆抗体(68102-1-Ig)、ASC多克隆抗体(10500-1-AP)均购自武汉三鹰生物科技有限公司,重组Anti-Caspase-11抗体(EPR18628)购自Abcam公司,IL-18多克隆抗体(AF5207)购自碧云天生物科技有限公司。
-
直钳、齿镊、线剪等手术器材(上海医疗器械有限公司);MCAO线栓(250~280 g,北京西浓科技有限公司);平衡木装置(江苏赛昂斯生物科技有限公司);Morris水迷宫泳池及站台(上海玉研科学仪器有限公司);高速冷冻离心机(3H16RI,湖南赫西仪器装备有限公司);扫膜仪(Tanon-
5200 ,上海天能科技有限公司)。 -
大鼠饲养至体重(270±15)g,采用随机数字表法将大鼠随机分为3组:模型组(M)和菸花苷组(Y)大鼠进行CIRI模型的建立,而假手术组(S)大鼠则无脑部损伤。造模后1 h,菸花苷组腹腔注射菸花苷注射液1 ml/kg[14],模型组与假手术组腹腔注射菸花苷注射液空白对照制剂1 ml/kg,造模后常规饲养并在固定时间给药,第1周1次/d,1周后1次/2 d持续至实验周期结束。
-
采用MCAO/R法进行模型制备,参考文献并进行一定改进[15],具体方法如下:术前4 h禁食水,用1%戊巴比妥钠(4 ml/kg,生理盐水配制)腹腔注射麻醉。手术部位常规备皮消毒,仰卧位,将大鼠四肢与前牙用皮筋固定于手术台板。沿颈部正中线作2 cm纵行切口,从气管偏右侧(大鼠的左侧)沿肌纤维走行向下分离,至颜色深红且明显搏动的左颈总动脉,沿该血管向上至颈总动脉分叉,近气管侧为颈外动脉,另一侧即为线栓需要进入的颈内动脉。在距分叉1.5 cm处结扎左颈总动脉近心端,用动脉夹锁闭颈内动脉及颈外动脉近心端。用眼科剪在颈总动脉近心端距分叉口1 cm处剪一斜行小口,将线栓插入左颈总动脉,用缝合线略微固定于颈总动脉,撤掉颈内动脉近心端动脉夹,将线栓缓慢深入颈内动脉直至明显阻力时停止深入(18~20 mm),撤掉颈外动脉近心端动脉夹并将固定线栓的缝合线牢固打结,逐层缝合结缔组织和皮肤。术后将大鼠放于保温垫上,保持其体温至苏醒,放入笼中,术后1 h根据分组腹腔注射给药,待大鼠完全苏醒后观察大鼠右前肢无法完全伸展,且大鼠行走时向右侧倾倒或前进时向右侧转圈,此即标志造模成功。术后2 h使用初次剂量1/3的1%戊巴比妥钠进行二次麻醉,将线栓向外抽出1.5 cm形成大脑缺血再灌注损伤。假手术组仅分离血管,不插入线栓。
-
在第2、4、8周进行3轮悬尾偏转实验[16]。将大鼠尾中段处固定在距地面垂直高度30 cm的实验架上,分别记录大鼠头部及躯干向左、右两侧偏转的次数,偏离中轴线10°以上计为偏转1次,每轮实验记录10次。正常大鼠会随机向左侧或者右侧进行偏转并试图攀爬,而CIRI大鼠由于一侧肢体的偏瘫及肌力减弱,向另一侧进行偏转的几率会大大提高。
-
在第2、4、8周进行3轮平衡木实验[17]。取长2 m、宽2.5 cm、距地面高度50 cm的木条为平衡木,一端为大鼠躲避处放置黑色方盒,另一端为大鼠起步处。每轮实验测试前每只大鼠训练3次,每次间隔2 h,训练完毕后观察大鼠从起步处经过平衡木进入躲避处的过程,记录大鼠通过平衡木的情况并按以下标准进行打分(表1)。
大鼠平衡木实验得分 平衡木评分标准 得分 通过平衡木,无踩空、无跌倒 0分 通过平衡木,踩空、跌倒机会小于50% 1分 通过平衡木,踩空、跌倒机会大于50% 2分 通过平衡木,对侧后肢出现拖行 3分 不能通过平衡木,但能保持平衡不摔落 4分 不能在平衡木上保持平衡,伴有摔落 5分 -
由同一名操作人员在第2、4、8周进行3轮水迷宫实验[18]。本实验使用直径1.8 m的圆形水池,水温(25±2)℃,站台为高0.4 m、直径12 cm的圆形板,水深约0.43 m,即水位高度超过站台平面约3 cm,并在池壁4个方位上方1 m高处悬挂显著的远距离视觉参照物。每轮前5 d站台放于池中固定位置,大鼠入水后找寻并记忆站台位置,第6天撤掉站台进行空间探索实验,测试大鼠的空间记忆能力,记录大鼠在90 s内穿过之前站台位置的次数。
-
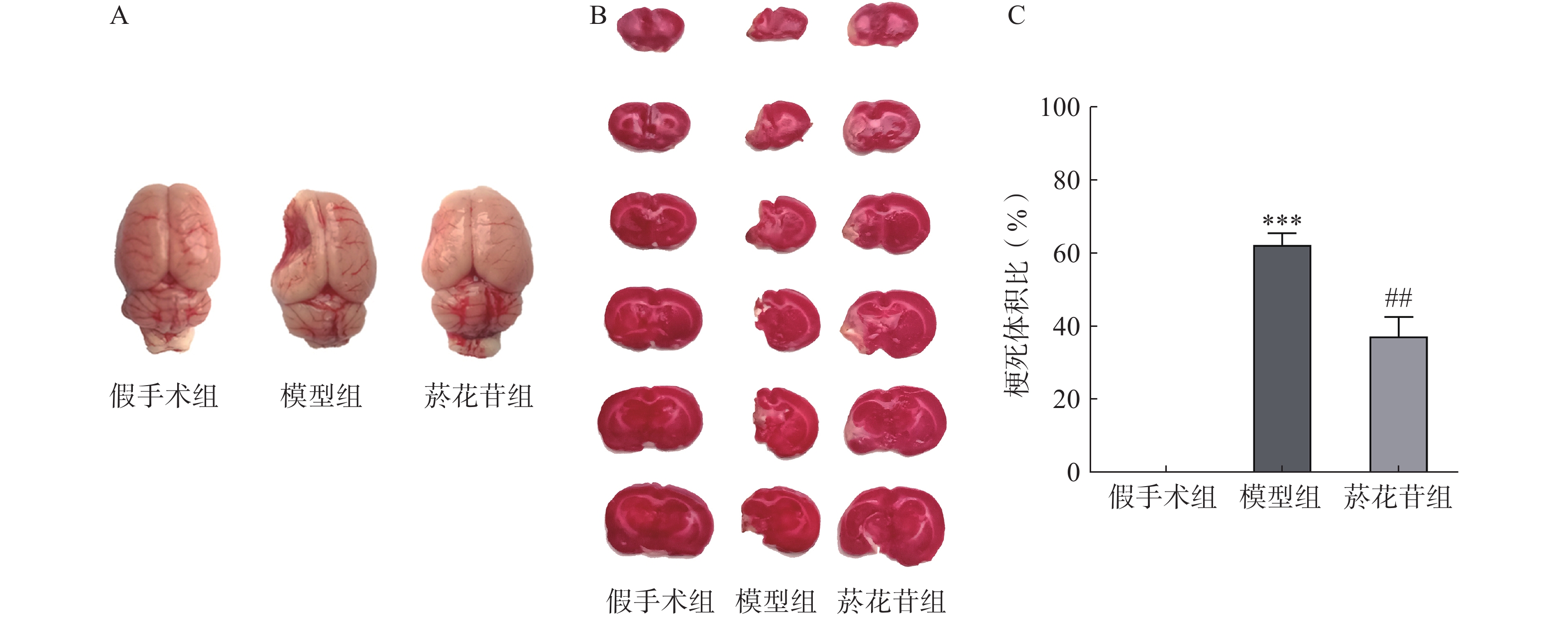
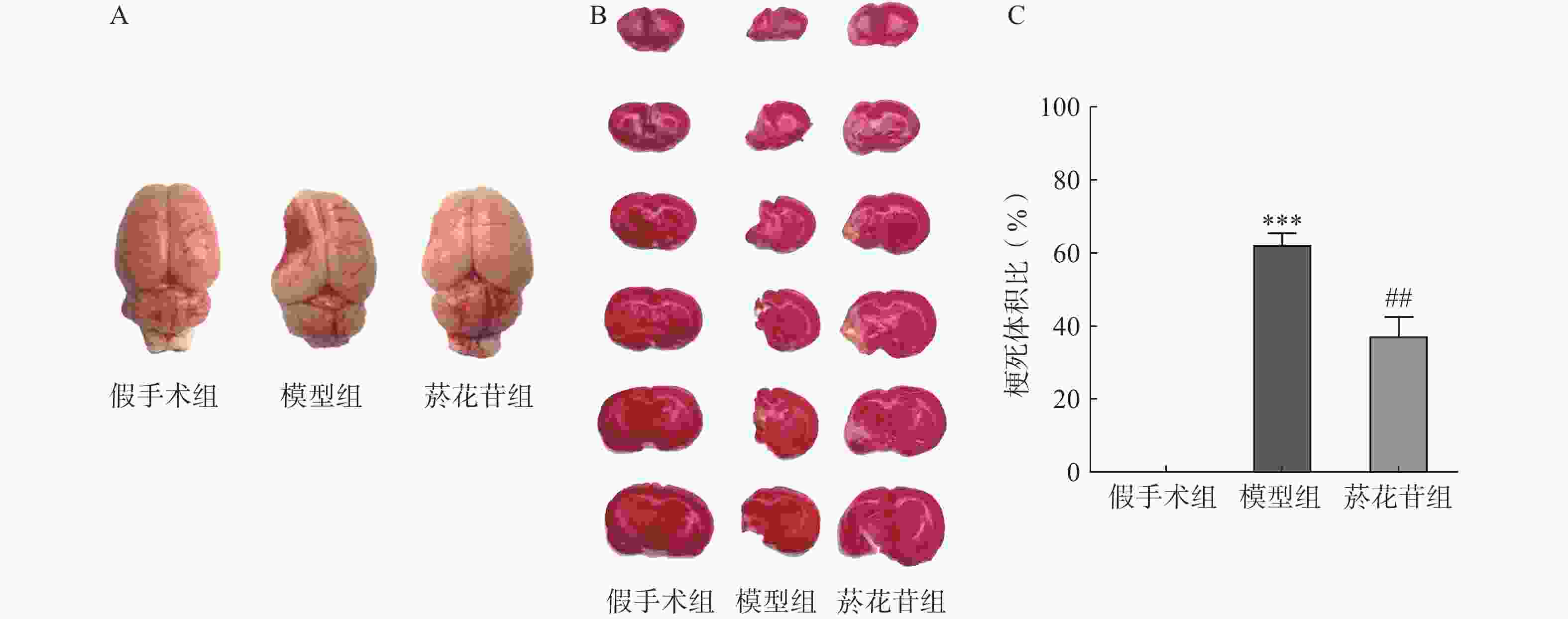
8周后脱颈处死大鼠,断头取脑,吸除表面水分后将脑组织冷冻硬化,切除嗅球、脑干、小脑等部位,将大脑切成厚度均等的6片,放入2% TTC染液37 ℃水浴染色10 min,4%多聚甲醛溶液固定5 min后拍照,白色或缺如则计为梗死萎缩区,正常组织显示为红色部分。利用Image J软件进行图像处理,按公式计算梗死萎缩区体积百分比=[(患侧梗死体积+萎缩体积)/健侧半脑体积]×100%,其中,萎缩体积=健侧半脑体积−患侧半脑体积。
-
造模8周后,提取总RNA,在RNA总量超过1 μg的基础上,以浓度超过35 ng/μl的标准,进行库的建立,并确保OD 260/280≥1.8,OD 260/230≥1.0。分离所需的mRNA后加入碎片缓冲液,使mRNA随机分裂为300 bp的小片段。反转录合成cDNA,利用PCR技术扩增15 cycles,2%琼脂糖胶回收目的条带并进行精确定量,借助cBot系统通过大规模分子簇的方式达到荧光信号检测强度,Illumina Novaseq 6000平台测序,读长控制在2×150 bp。对所得数据库数据进行筛选过滤,基因差异表达分析。
-
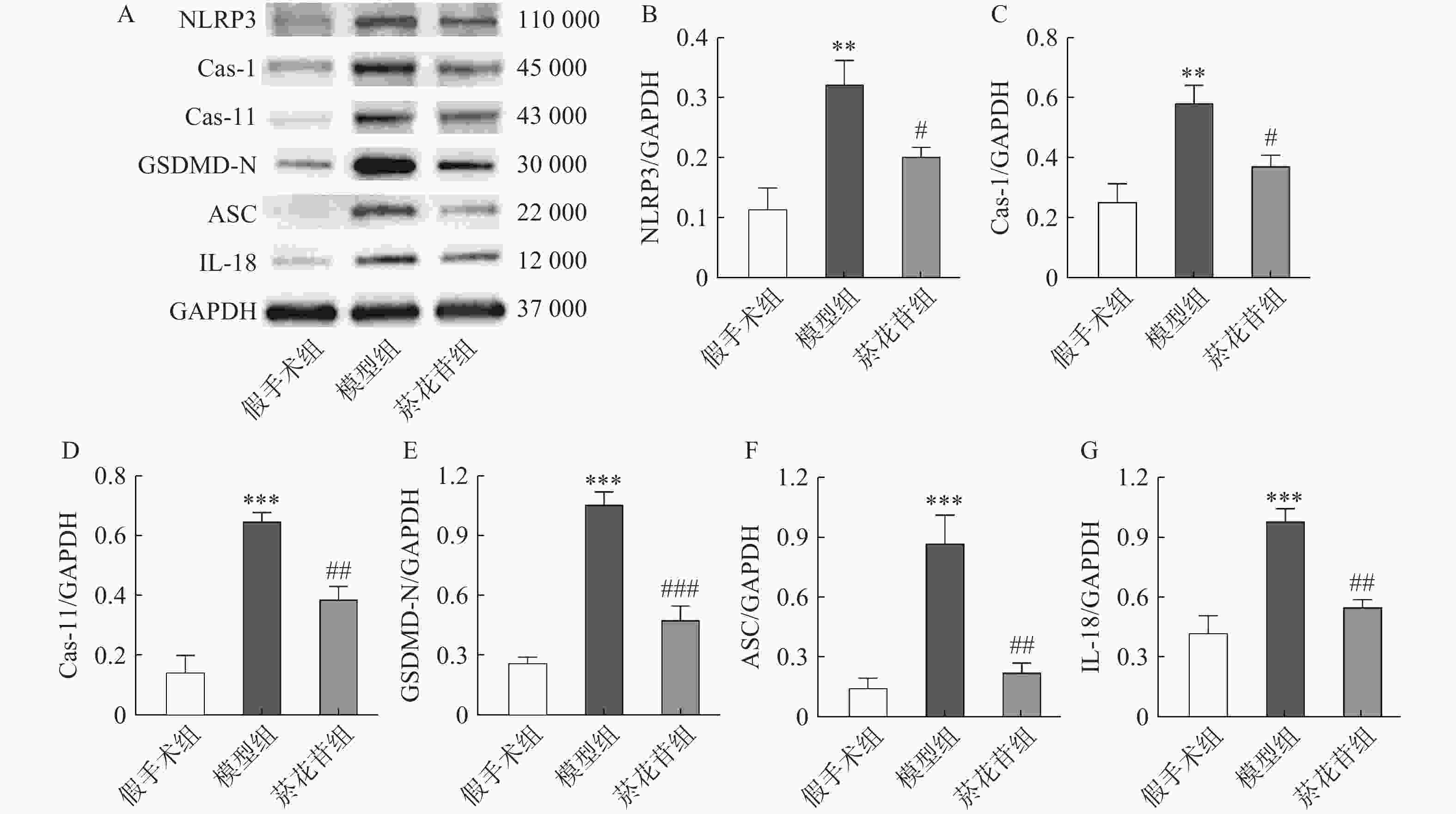
采用Western-blot法检测各组大鼠脑组织缺血半暗带中Caspase-1、Caspase-11、GSDMD-N、NLRP3、ASC、IL-18蛋白表达。参考相关文献取缺血半暗带区域作为样品[19],取适量样品加入RIPA裂解液进行研磨裂解,12 000 r/min、4 ℃离心取上清液,BCA法定量蛋白浓度,浓度均一化后进行蛋白变性作为待测样品。经电泳、转膜、漂洗、封闭、漂洗,一抗(Caspase-1,1∶10 000、Caspase-11,1∶4 000、GSDMD,1∶800、NLRP3,1∶800、ASC,1∶10 000、IL-18,1∶1 000、GAPDH,1∶15 000)4 ℃孵育16 h,漂洗后二抗(1∶15 000)25 ℃孵育1 h,再次漂洗后放入配置好的ECL发光液,浸泡后使用扫膜仪进行成像并拍照记录。
-
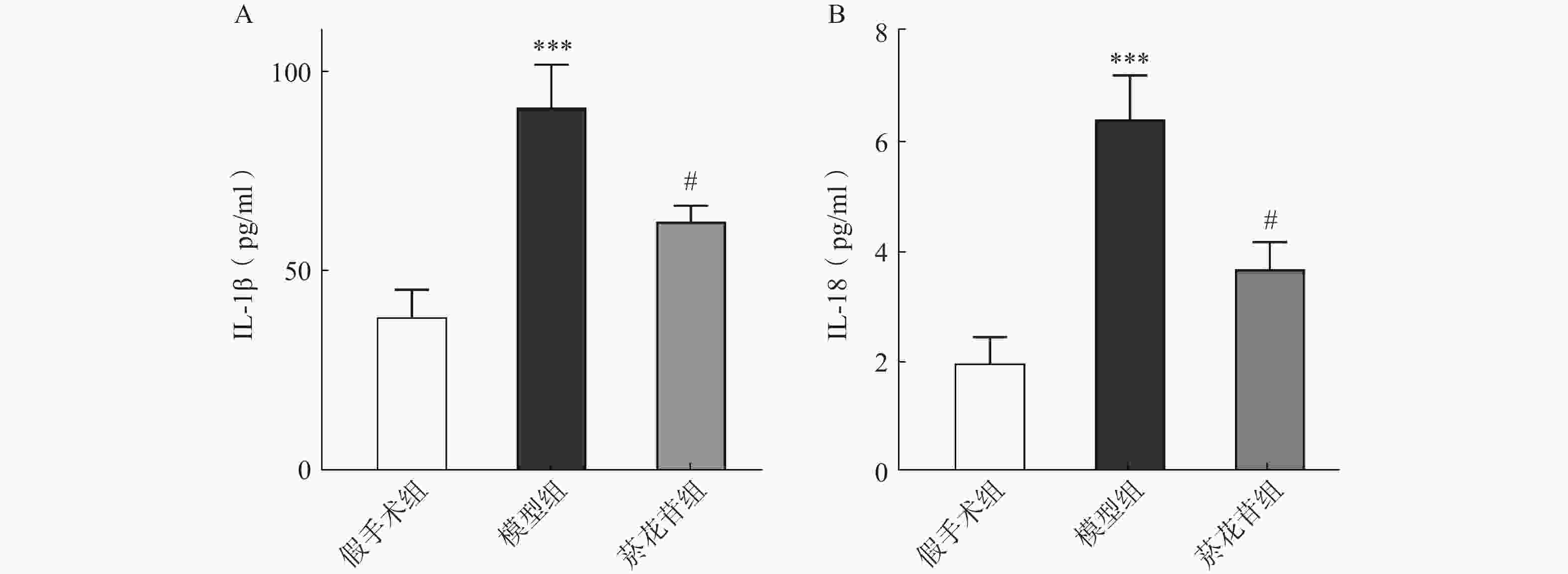
取大鼠脑组织10 mg加入适量PBS溶液,研磨后低温离心取上清液,按照Elisa试剂盒说明书配置梯度浓度标准品溶液,按顺序滴加样品及各反应液,显色反应终止后,使用酶标仪测定450 nm处A值,根据标准曲线计算各样品IL-1β、IL-18浓度。
-
应用Image J软件对脑组织TTC切片的照片、Western-blot图片进行图像处理,统计学分析及数据处理使用GraphPad Prism 8.0.1进行。实验数据采用(
$\bar {x} $ ±SE)表示,大鼠神经行为学数据使用双因素方差分析,TTC切片及Western-blot数据应用单因素方差分析方法, P<0.05表示差异有统计学意义。 -
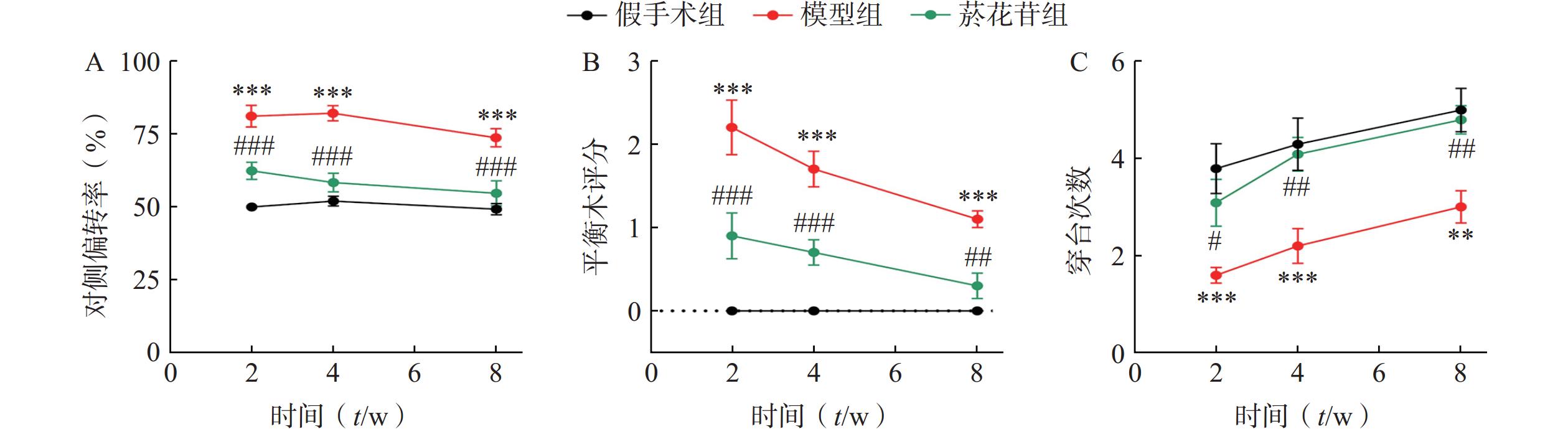
在第2、4、 8周对大鼠的神经功能进行多角度评价。悬尾偏转实验中,模型组大鼠的对侧偏转率明显高于菸花苷组(P<0.001,图1A);平衡木实验中,模型组大鼠的评分始终高于菸花苷组(P<0.05,图1B);水迷宫实验中,模型组大鼠90 s时间内穿台次数明显少于菸花苷组(P<0.05,图1C)。以上实验结果显示,菸花苷长期给药能够一定程度上改善CIRI大鼠的偏瘫及肌力减弱情况,提高实验大鼠的肢体平衡性,改善其空间学习能力和记忆能力。
-
TTC染色显示模型组大鼠脑组织明显变小且左侧萎缩缺如体积超60%(P<0.01);菸花苷组大鼠脑梗死萎缩体积同模型组相比减少约25%(P<0.01,图2A、图2B、图2C)。提示CIRI长期发展会导致大鼠脑组织梗死萎缩,菸花苷长期给药能减轻大鼠脑组织梗死萎缩状况。
-
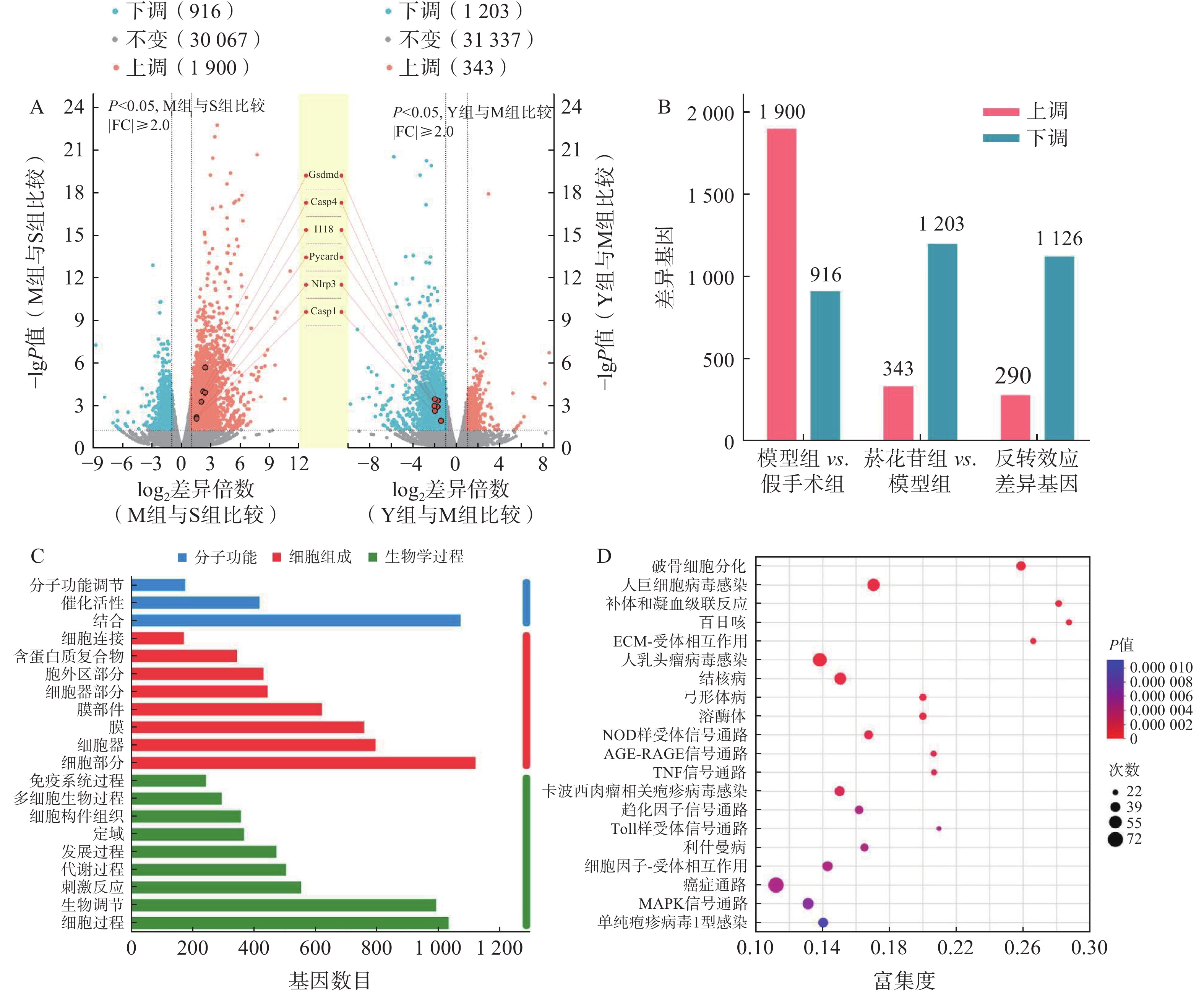
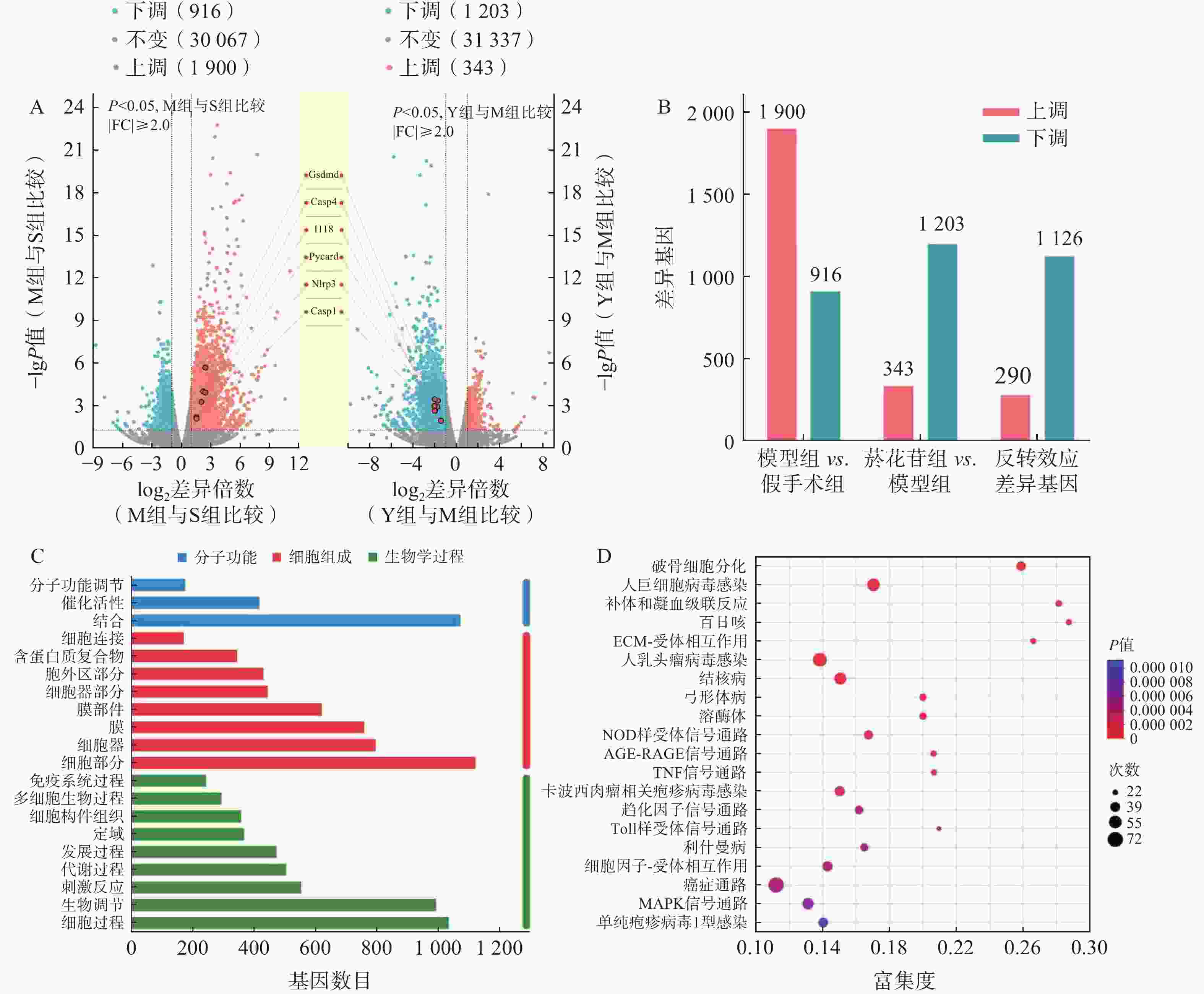
以总表达量为基础,利用TPM进行数据分析,以 |log2fc|>1, P<0.05为差异有统计学意义,统计分析组间的差异基因(DEGs)。模型组对假手术组DEGs
2 816 个,其中,上调1 900个,下调916个;菸花苷组对模型组DEGs 1 546个,其中,上调343个,下调1 203个;具有反转效应的DEGs 1 416个,其中,上调290个,下调1 126个(图3A、图3B)。分析1 416个反转效应DEGs,基因数在前20位的GO注释分析条目与生物学过程(BP)和细胞组成(CC)相关的基因较多,主要参与生物调节、细胞过程、细胞组分(图3C)。通过KEGG功能富集分析,发现1 416个DEGs主要富集在NOD样受体信号通路、肿瘤坏死因子(TNF)信号通路、Toll样受体信号通路、丝裂原活化蛋白激酶(MAPK)信号通路等通路中(图3D),其中,NOD样受体信号通路是显著性最高的信号通路,是参与细胞炎症、细胞死亡过程的重要通路之一。
如表2所示, NOD样受体信号通路中GSDMD、IL-18、NLRP3等基因富集度较高,而这些基因在细胞焦亡过程中均有参与,结合图3A中所标注的焦亡相关基因表达情况,推测脑缺血再灌注损伤可能与细胞焦亡有关,且菸花苷可能对细胞焦亡过程产生一定的抑制作用。
通路名称 通路显著性(P值) 富集基因 NOD样受体信号通路 6.05×10−7 NF-κB、IL-18、Caspase8、
NLRP3、GSDMD、Caspase4肿瘤坏死因子受体信号通路 1.12×10−6 NF-κB、p38、Bcl3、TNFR1、
TNFR2、Ccl2、、Caspase8Toll样受体信号通路 3.66×10−6 NF-κB、p38、Caspase8、
TLR3、TLR4、TLR7丝裂原活化蛋白激酶信号通路 5.73×10−6 NF-κB 、P38、TNFR、IL-1R -
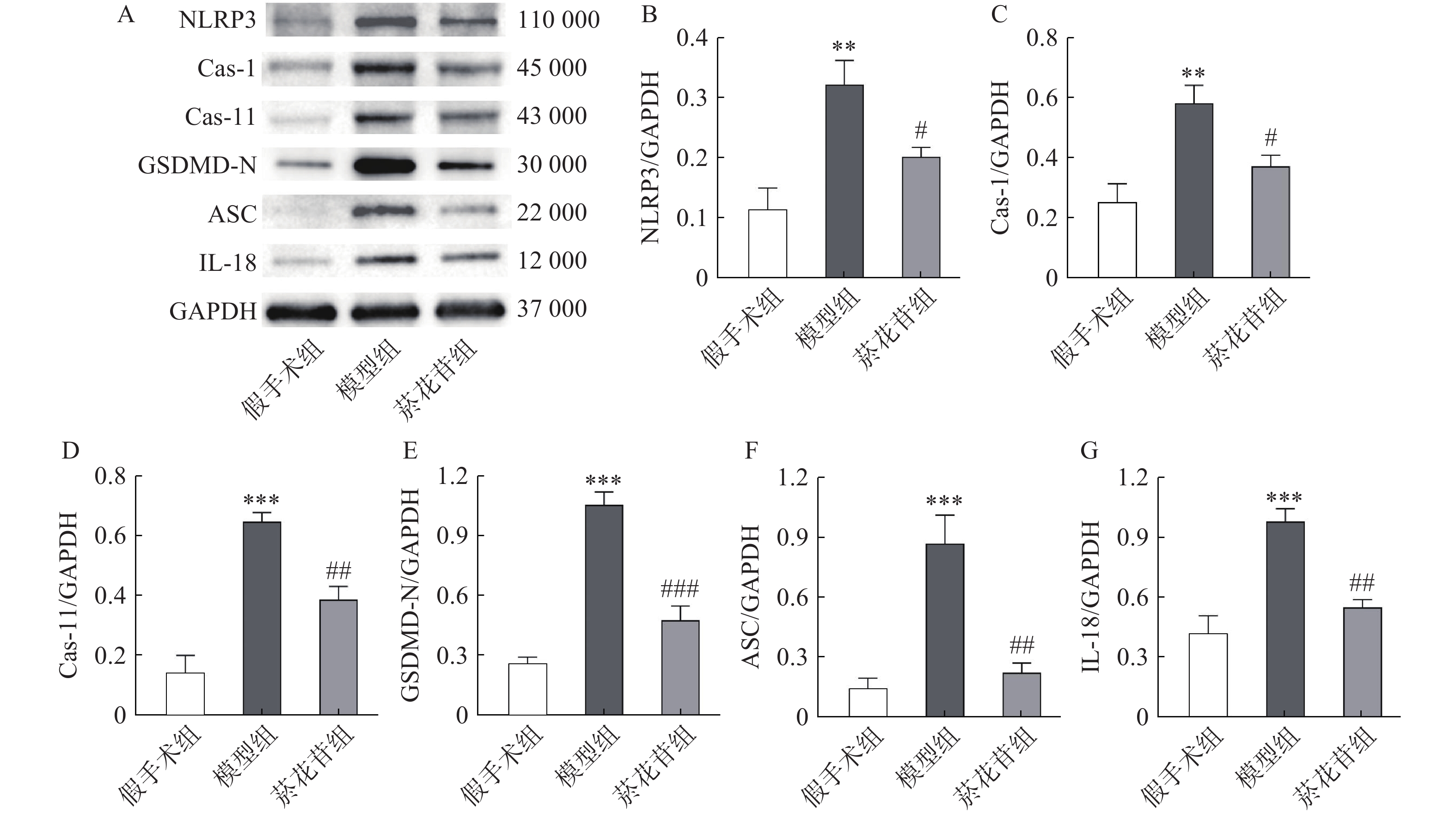
根据转录组数据结果,采用Western-blot方法检测脑缺血半暗带中Caspase-1、Caspase-11、GSDMD-N、NLRP3、ASC、IL-18蛋白的表达情况(ASC的基因型为PYCARD,Caspase-11与Caspase-4同源)。结果显示模型组表达水平显著高于假手术组(P<0.01),菸花苷组显著低于模型组(P<0.05,图4)。提示菸花苷长期给药能够降低CIRI大鼠细胞焦亡相关蛋白的表达量。
-
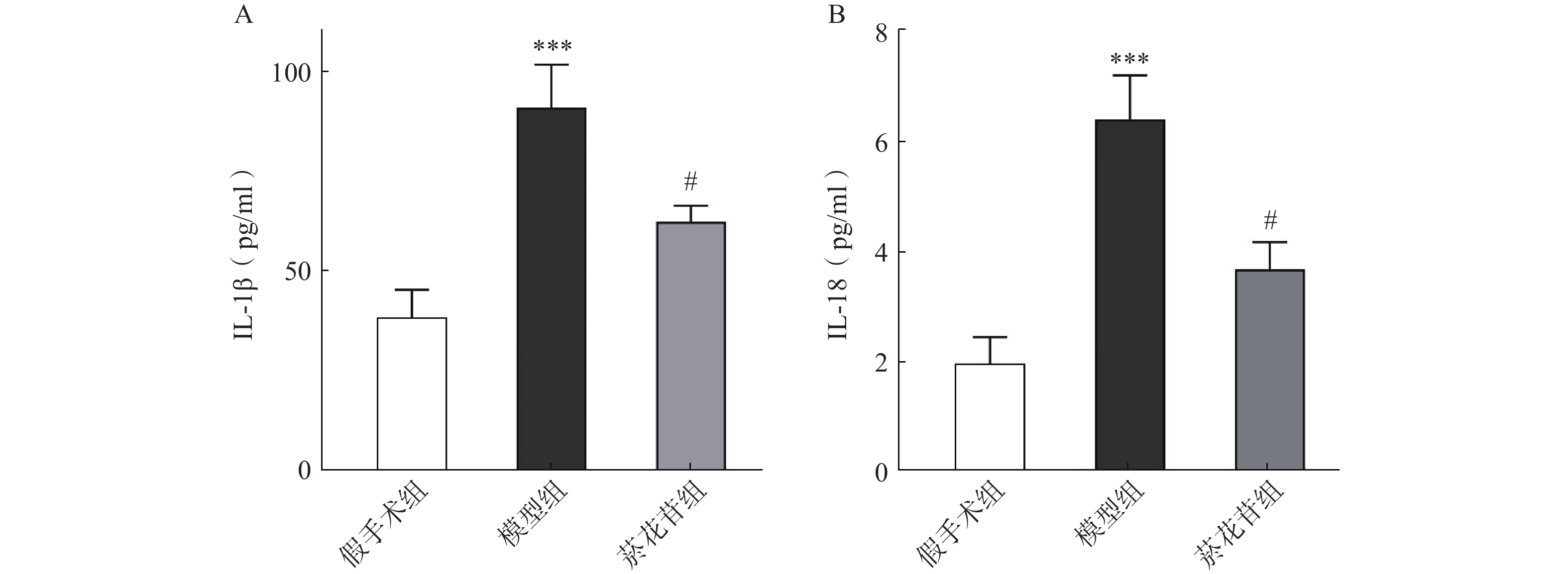
利用ELISA法对炎症因子IL-1β、IL-18进行了测定,结果显示模型组IL-1β、IL-18释放量相较于假手术组明显增加(P<0.001),菸花苷组IL-1β、IL-18释放量比模型组明显降低(P<0.05),见图5。表明菸花苷能够抑制因CIRI导致的脑组织炎症因子IL-1β、IL-18释放量升高。
-
目前神经保护药物的实验研究更多集中于缺血性脑卒中的急性损伤期治疗,对缺血性脑卒中长期治疗和慢性恢复的研究相对较少[20]。本实验以菸花苷对CIRI大鼠的长期治疗和功能恢复研究为重点,对CIRI大鼠神经运动能力及脑组织外观形态进行了观察分析,结果表明,菸花苷能显著改善CIRI大鼠的神经运动功能,提高长期治疗和功能恢复效果,明显减少脑梗死萎缩体积,抑制脑缺血后梗死区域进一步扩大并改善梗死区域坏死萎缩的状况。
缺血性脑卒中涉及到细胞凋亡、铁死亡和细胞焦亡等多种病理机制[21],其中,细胞焦亡是一种依赖Caspase的炎症性细胞死亡形式,在缺血性脑卒中神经损伤中扮演了重要角色[22]。细胞焦亡过程中,GSDMD蛋白被活化Caspase剪切为具有活性的GSDMD-N, GSDMD-N聚合并在细胞膜上形成孔道导致细胞膜破裂伴随细胞内IL-1β、IL-18等炎症因子释放增加[23],进一步促进炎症反应的发生和神经细胞的死亡。有研究表明,通过抑制细胞焦亡可以有效促进CIRI后的神经功能恢复[24, 25]。本实验首次将菸花苷促进缺血性脑卒中的长期恢复与其抑制细胞焦亡联系起来,利用转录组测序及蛋白免疫印记等方法对细胞焦亡相关基因和蛋白的表达水平进行了测定,数据显示菸花苷能够降低NOD样受体信号通路中细胞焦亡关键基因的表达量,并使焦亡相关蛋白的表达水平以及炎症因子的释放量明显下降,表明菸花苷能够抑制细胞焦亡及其引起的炎症反应。
综上,菸花苷能减轻大鼠脑缺血再灌注损伤,显著促进CIRI大鼠的长期功能恢复,该作用可能与抑制大鼠脑组织细胞焦亡有关。随着对菸花苷治疗缺血性脑卒中研究的不断深入,其对缺血性脑卒中缺血再灌注损伤的长期保护作用及机制将被进一步阐释。
Effects of long-term administration of nicotiflorin on neurological function in rats with cerebral ischemia-reperfusion injury
doi: 10.12206/j.issn.2097-2024.202407038
- Received Date: 2024-07-18
- Rev Recd Date: 2024-11-14
- Available Online: 2025-05-20
- Publish Date: 2025-05-25
-
Key words:
- nicotiflorin /
- cerebral ischemia-reperfusion /
- transcriptomics /
- pyroptosis /
- long-term functional recovery
Abstract:
| Citation: | FENG Yifan, YAN Xiaodong, ZHANG Wenbin, LI Bingfeng, GUO Meili. Effects of long-term administration of nicotiflorin on neurological function in rats with cerebral ischemia-reperfusion injury[J]. Journal of Pharmaceutical Practice and Service, 2025, 43(5): 228-234. doi: 10.12206/j.issn.2097-2024.202407038 |








 DownLoad:
DownLoad: