-
路路通为金缕梅科植物枫香树(Liquidambar formosana Hance)的干燥成熟果序,始载于《本草纲目拾遗》,是临床常用中药,2020版《中国药典》记载其味苦,性平,归肝、肾经,具有祛风活络、利水通经的功效,可用于关节痹病、麻木拘挛、水肿胀满、乳少、经闭的治疗[1]。路路通主要成分包括桦木酮酸、没食子酸、路路通酮A及其他萜类、脂肪族、芳香族等[2-3]。现代药理学研究表明,路路通提取物具有抗炎消肿、抑制病原微生物、保护神经、抗氧化、抗肿瘤等作用。有研究发现,路路通中的桦木酮酸对肝癌、前列腺癌、乳腺癌、宫颈癌等肿瘤细胞的增殖有一定的抑制作用,能诱导实体瘤内源性凋亡,临床可用于癌症的治疗[4-8]。目前,路路通抗肿瘤的研究局限于某一成分的作用,缺乏从整体角度阐述路路通抗肿瘤作用机制的研究。
网路药理学是从药物活性成分、靶点与疾病间相互作用的整体性和系统性出发,运用网络方法分析药物与疾病和靶点之间“多成分、多靶点、多途径”协同作用关系,揭示药物活性成分与疾病之间发生发展相关通路的潜在机制[9-10]。分子对接是预测蛋白与配体亲和能力和结合模式的强有力工具,对于给定的蛋白质和配体(蛋白质、DNA/RNA、小分子),可通过预测它们的结合模式及结合自由能,进而对成分与靶点的相互作用及机制进一步验证[11-12]。本研究通过网络药理学和分子对接技术,以公开的文献报道为基础,系统地分析路路通的有效活性成分和潜在的作用靶点,探讨其发挥抗肿瘤作用可能的作用机制,为路路通抗肿瘤药效物质基础及分子机制的研究提供科学依据。
-
基于中药系统药理学技术平台(TCMSP,https://old.tcmsp-e.com/),以“OB≥30%和DL≥0.18”[14]作为筛选条件,对路路通成分进行筛选,口服生物利用度(OB)描述口服给药后,成分从胃肠道和肝脏吸收和分布到体循环的速度和程度。类药性参数(DL)评估化合物作为药物的潜力,同时查阅相关文献进行补充,最终确定路路通的主要活性成分。通过PubChem(https://pubchem.ncbi.nlm.nih.gov/)获取活性成分sdf分子结构,并在SwissTargetPrediction平台(http://swisstargetprediction.ch/)预测其潜在靶点。
-
利用“tumor”、“cancer”为关键词,在GeneCards数据库(https://www.genecards.org/)、OMIM数据库(https://omim.org/)、TTD数据库(http://db.idrblab.net/ttd/)、DrugBank(https://www.drugbank.com/)数据库等疾病基因数据库进行检索与筛选,将得到的靶点汇总去除重复值,再根据文献报道补充未预测到的有效成分的已知靶点,利用UniProt数据库(https://www.uniprot.org/)将所得靶点标准化。
-
将路路通活性成分与肿瘤相关靶点取交集,并在“微生信”在线绘制韦恩图,得到路路通抗肿瘤的潜在靶点。将获得的共同靶点提交至String11.0数据库(https://string-db.org),将生物种类设定为“Homosapiens”,最小互相作用阈值设定为“mediumconfidence”(>0.4),其余设置均为默认设置,利用Cytoscape3.7.1软件[24]构建蛋白质-蛋白质相互作用(PPI)网络,并进行网络拓扑学数据分析,根据各节点度值和介度中心性的比较筛选出核心靶点,其中,节点度值与介度中心性越大,表示该靶点越重要。
-
将路路通与肿瘤共同的靶点输入Metascape数据库(https://metascape.org/gp/index.html#/main/step1),设置物种为人,分别勾选基因本体(GO) 分析中的生物过程(BP)、细胞成分(CC)、分子功能(MF),以及Pathway中的京都基因与基因组百科全书(KEGG)进行富集分析。对各个分析结果按照P值从小到大排序,且以P≤0.01为筛选条件,利用“微生信”在线作图,选取符合条件的前10位GO富集分析结果做柱状图,前20位的KEGG通路构建气泡图。选取路路通活性成分、相关靶点以及信号通路导入Cytoscape3.7.1软件,构建活性成分-靶点-通路网络图。
-
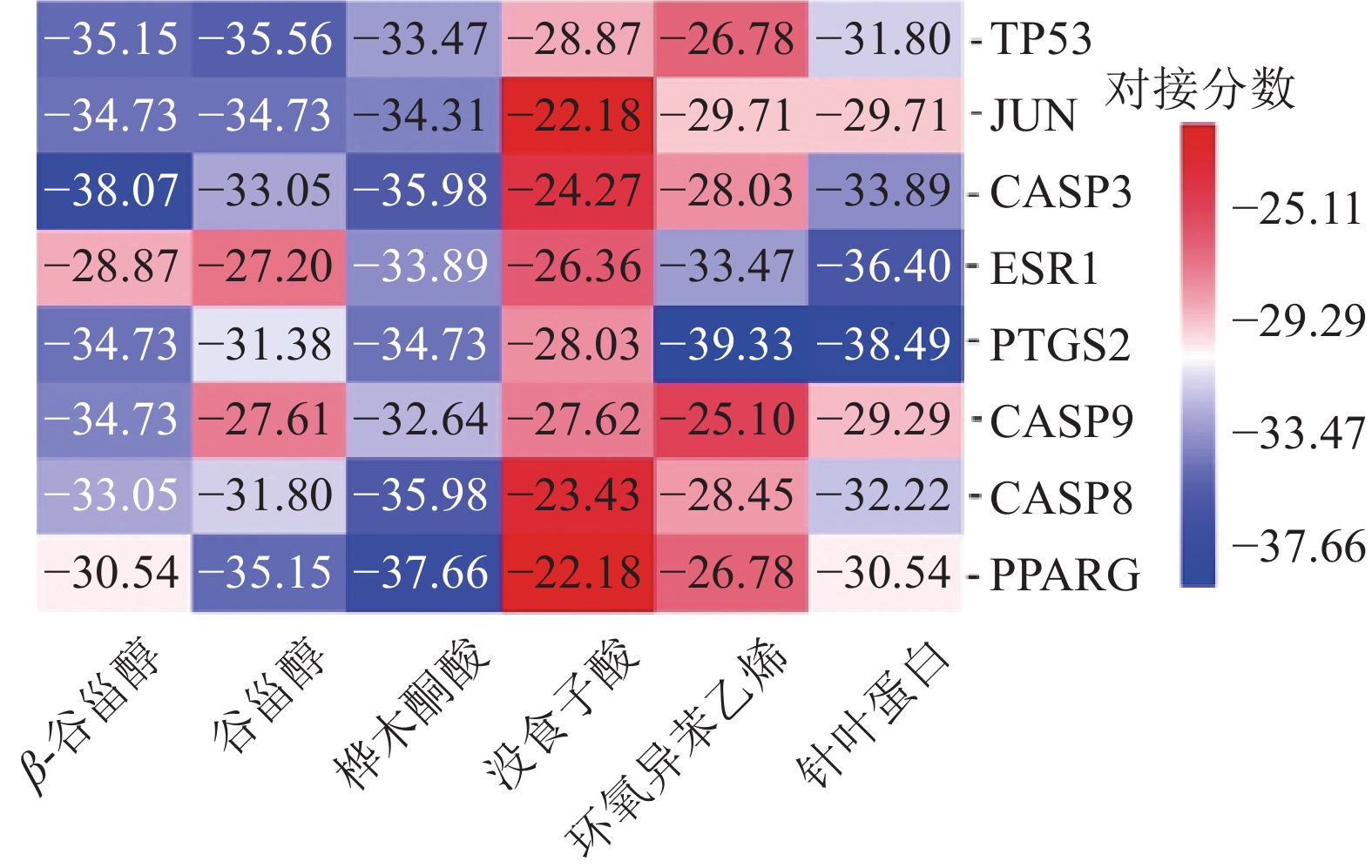
在RCSB PDB数据库(https://www.rcsb.org/)中下载“1.3”项下筛选的核心靶点对应的蛋白晶体结构,保存为pdb格式。在Pubchem中下载路路通活性成分的3D结构图,保存为sdf格式。然后利用AutoDock Vina软件[15],将核心靶点分别与活性成分一一进行对接,其对接分数(kJ/mol)值即代表两者的结合能力,数值越低,活性成分与靶点结合越稳定,结合可能性越大,对接分数<−17.78 kJ/mol可认为配体与靶点之间具有结合活性,对接分数<−20.92 kJ/mol 表明结合活性较佳,对接分数小于−29.29 kJ/mol说明两者之间有强烈的对接活性[16],并将对接结果在“微生信”中绘制热图。
-
从TCMSP数据库筛选获取4个活性成分,并搜集文献资料[6-7,17],增加了具有抗肿瘤作用的活性成分桦木桐酸和没食子酸,共获得6个主要活性成分(表1)和67个靶点。
分子编号 化合物名称 OB(%) DL 靶点数 MOL000358 β-谷甾醇(beta-sitosterol) 36.91 0.75 36 MOL000359 谷甾醇(sitosterol) 36.91 0.75 3 MOL001996 桦木桐酸(betulonic acid) 16.83 0.78 9 MOL000513 没食子酸
(3,4,5-trihydroxybenzoic acid)31.69 0.04 12 MOL000517 环氧异苯乙烯
(isostyracin epoxide)92.53 0.22 16 MOL000519 针叶蛋白(coniferin) 31.11 0.32 20 -
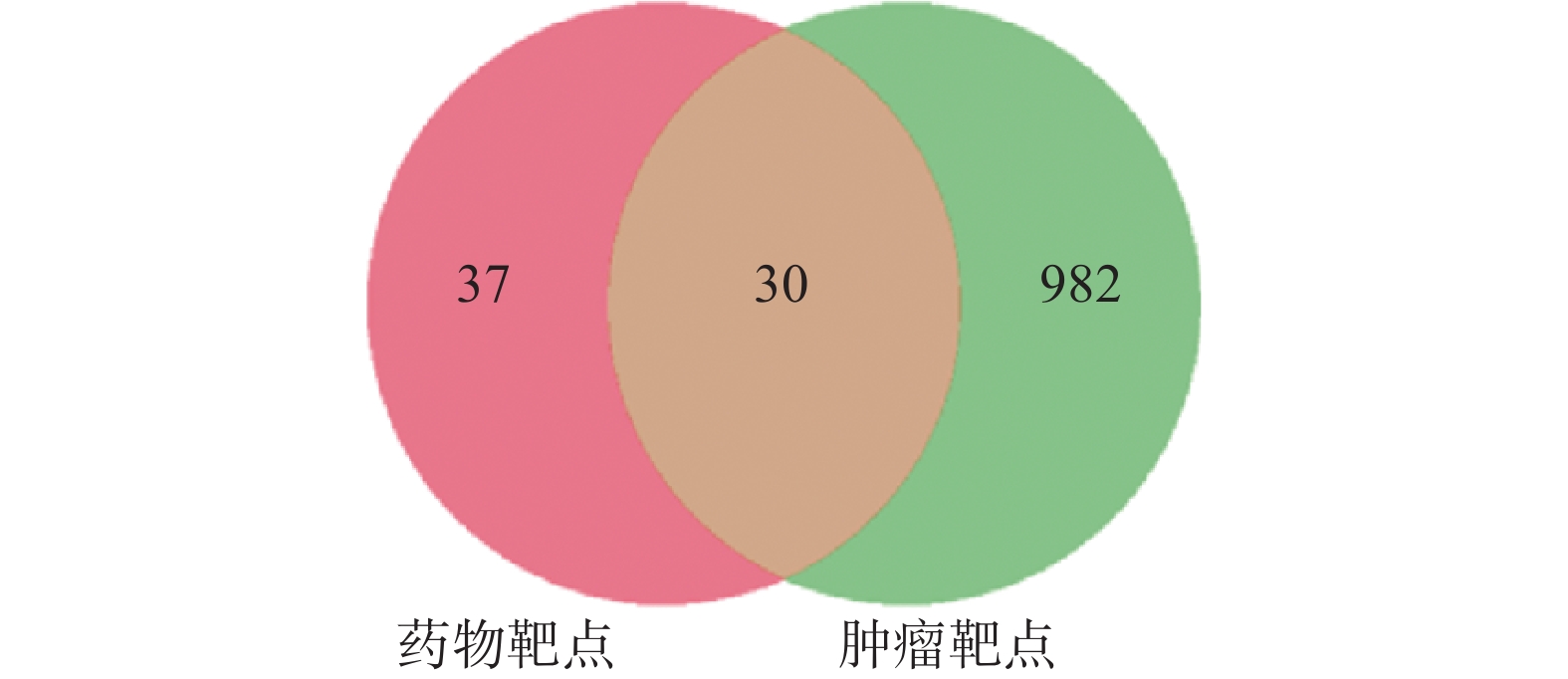
检索Gencards、OMIM、TTD和DrugBank4个疾病数据库,去重后共获得1 012个疾病靶点。将活性成分靶点与肿瘤相关靶点取交集得到路路通抗肿瘤的潜在作用靶点30个,并在“微生信”在线绘制韦恩图,见图1。
-
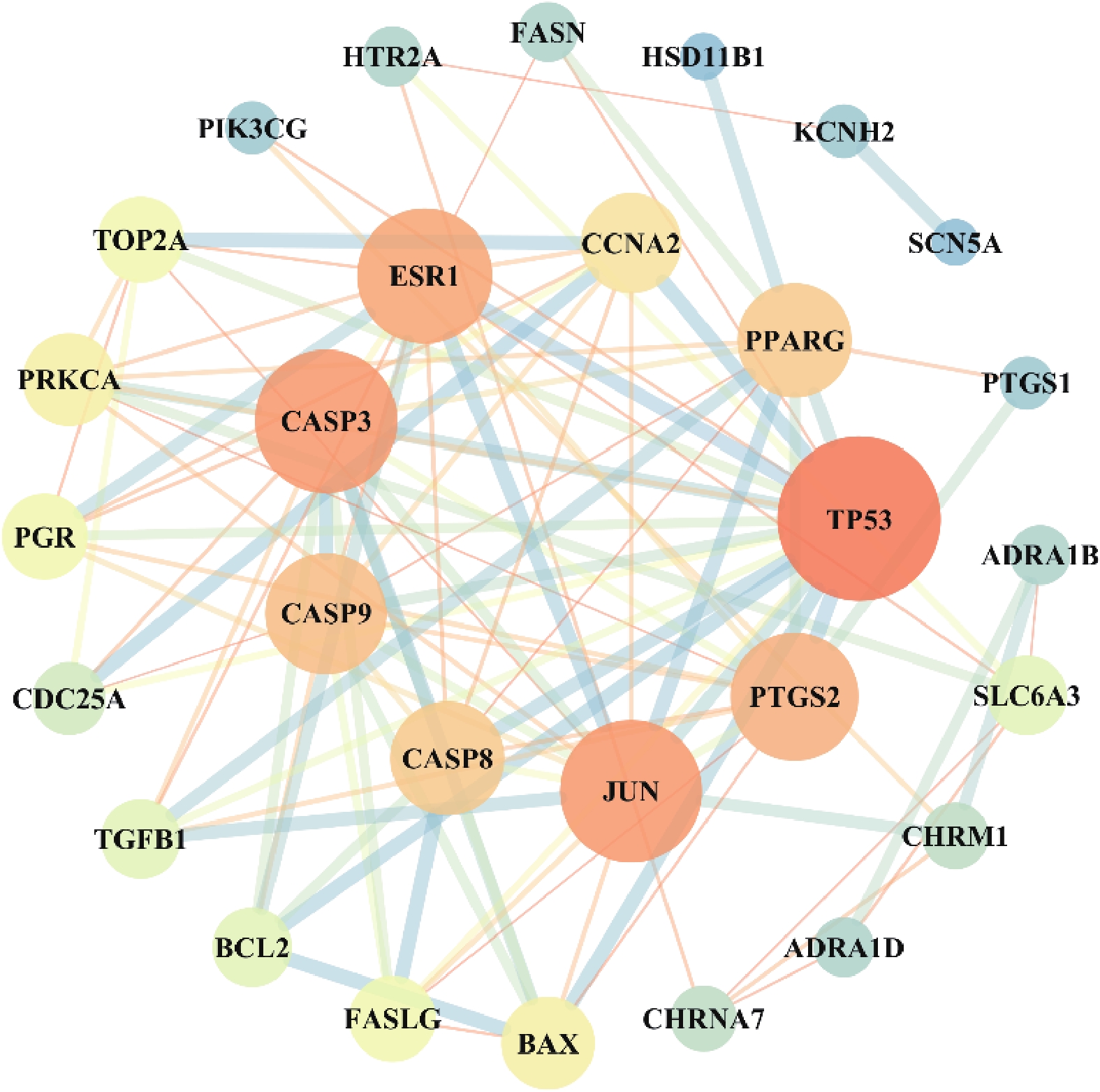
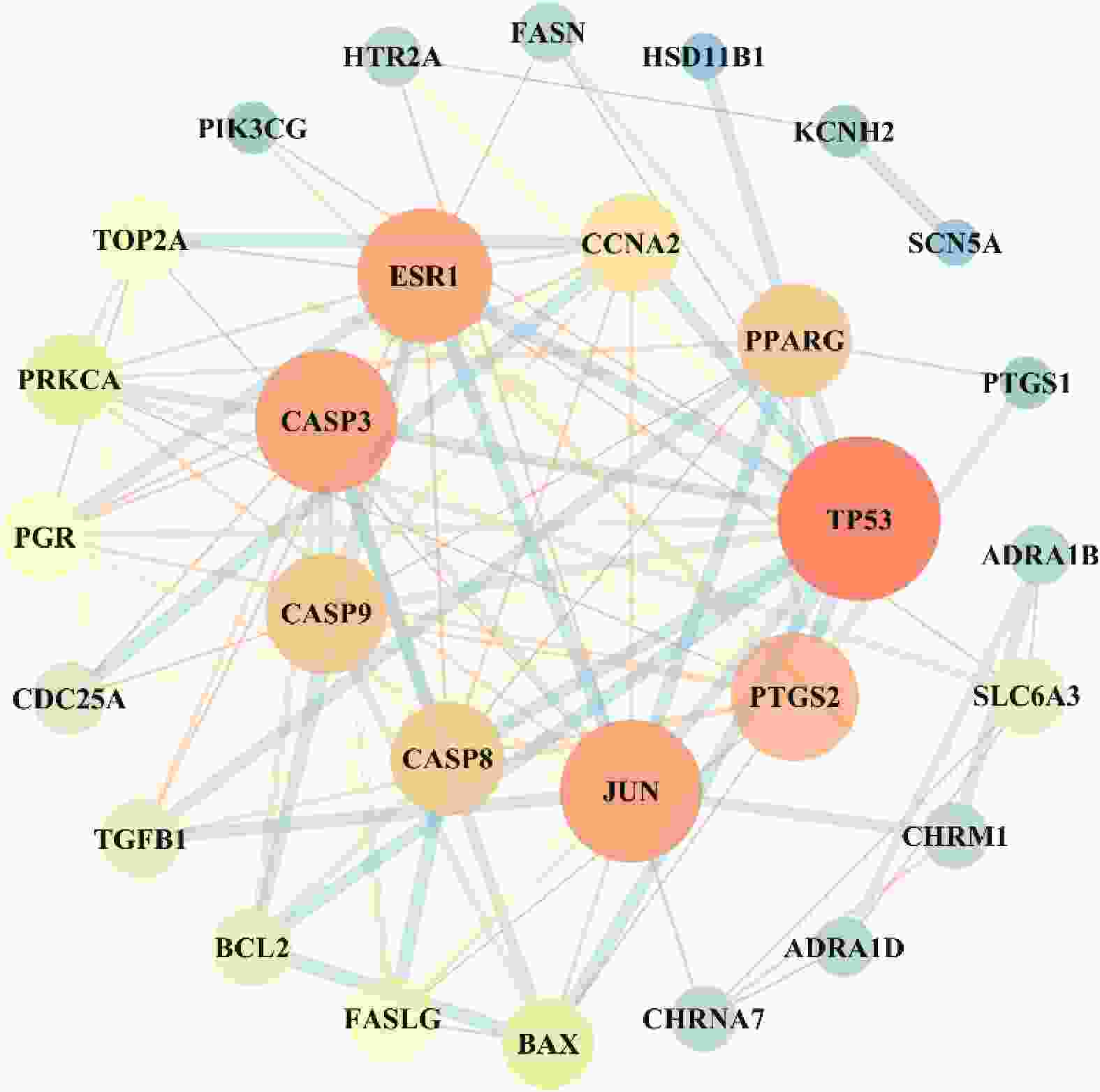
利用Cytoscape3.7.1构建靶蛋白PPI网络,将游离一个节点去除,得到29个节点和103条边,见图2。对网络节点进行拓扑分析,节点的大小是依据网络中的度值设定,即节点越大对应的靶点的度值越大,说明该靶点越重要,见表2。根据靶点度值可知,路路通抗肿瘤的核心靶点有TP53、JUN、CASP3、ESR1、PTGS2、CASP9、CASP8和PPARG。
靶点 蛋白名称 度值 介数中心性 TP53 肿瘤蛋白P53 18 0.13 JUN 转录因子AP-1 15 0.12 CASP3 半胱天冬酶3 15 0.04 ESR1 雌激素受体α 14 0.21 PTGS2 前列腺素G/H合酶2 13 0.06 CASP9 半胱天冬酶9 12 0.02 CASP8 半胱天冬酶8 11 0.01 PPARG 过氧化酶体增生激活受体γ 11 0.11 CCNA2 细胞周期蛋白A2 9 0.01 BAX Bcl-2相关的X蛋白 8 0 PRKCA 蛋白激酶C 8 0.10 FASLG Fas配体 7 0 PGR 孕激素受体 7 0 TOP2A 拓扑异构酶Ⅱα 7 0.01 SLC6A3 溶质载体家族6成员3 6 0.28 BCL2 BCL2细胞凋亡调节因子 6 0 TGFB1 转化生长因子β1 6 0 CDC25A 细胞周期蛋白25A 5 0 CHRM1 毒蕈碱型胆碱受体M1 4 0.07 CHRNA7 α7烟碱乙酰胆碱受体 4 0.03 ADRA1B α1B-肾上腺素受体 3 0.01 ADRA1D α1D-肾上腺素能受体 3 0 HTR2A 羟色胺2A受体 3 0.14 FASN 脂肪酸合成酶 3 0 PIK3CG 磷脂酰肌醇4,5-二磷酸
3-激酶催化亚基 γ2 0 KCNH2 钾电压门控通道亚家族H成员2 2 0.07 PTGS1 前列腺素G/H合酶1 2 0 HSD11B1 11β-羟基类固醇脱氢酶1 1 0 SCN5A 钠电压门控通道α亚基5 1 0 -
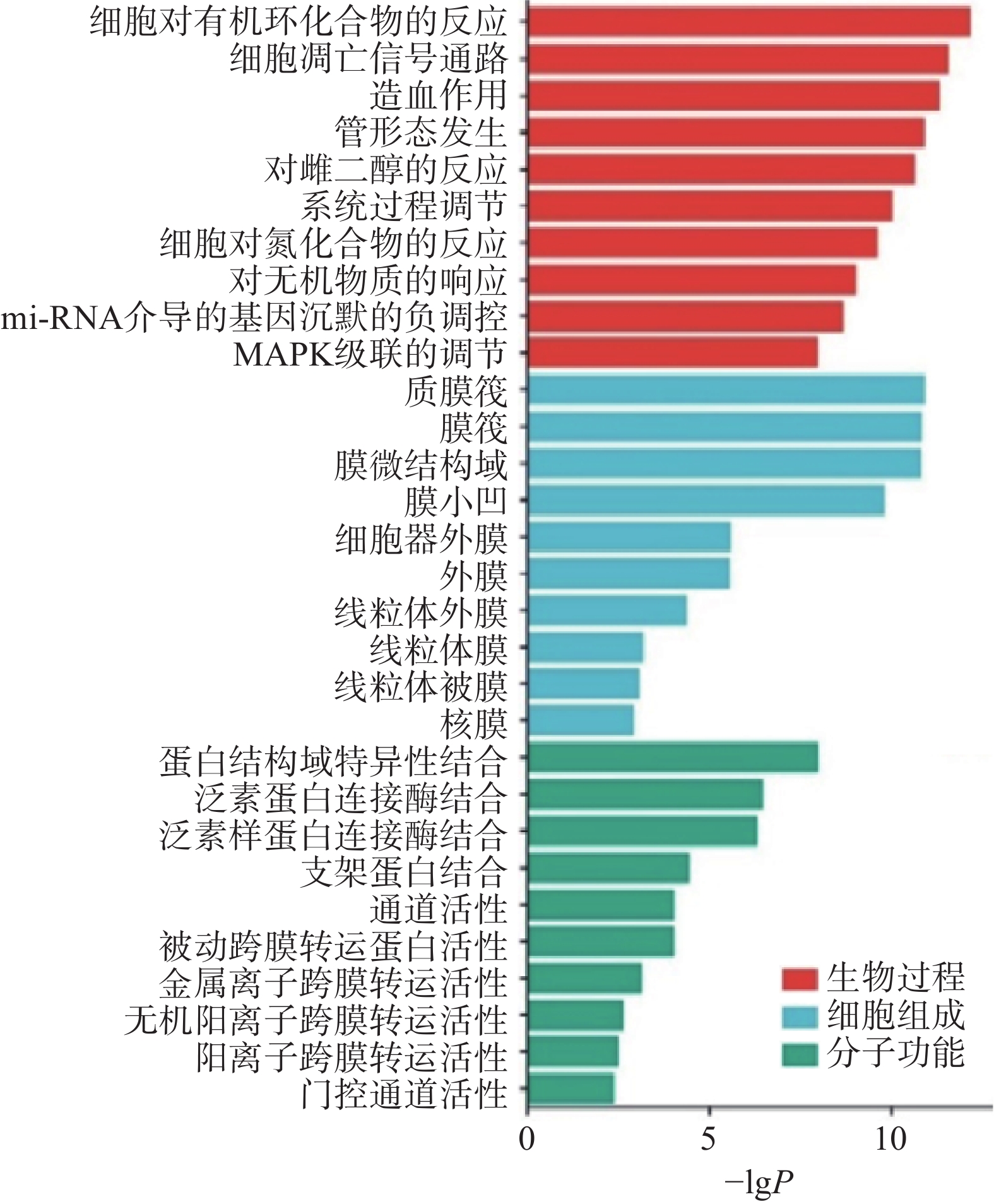
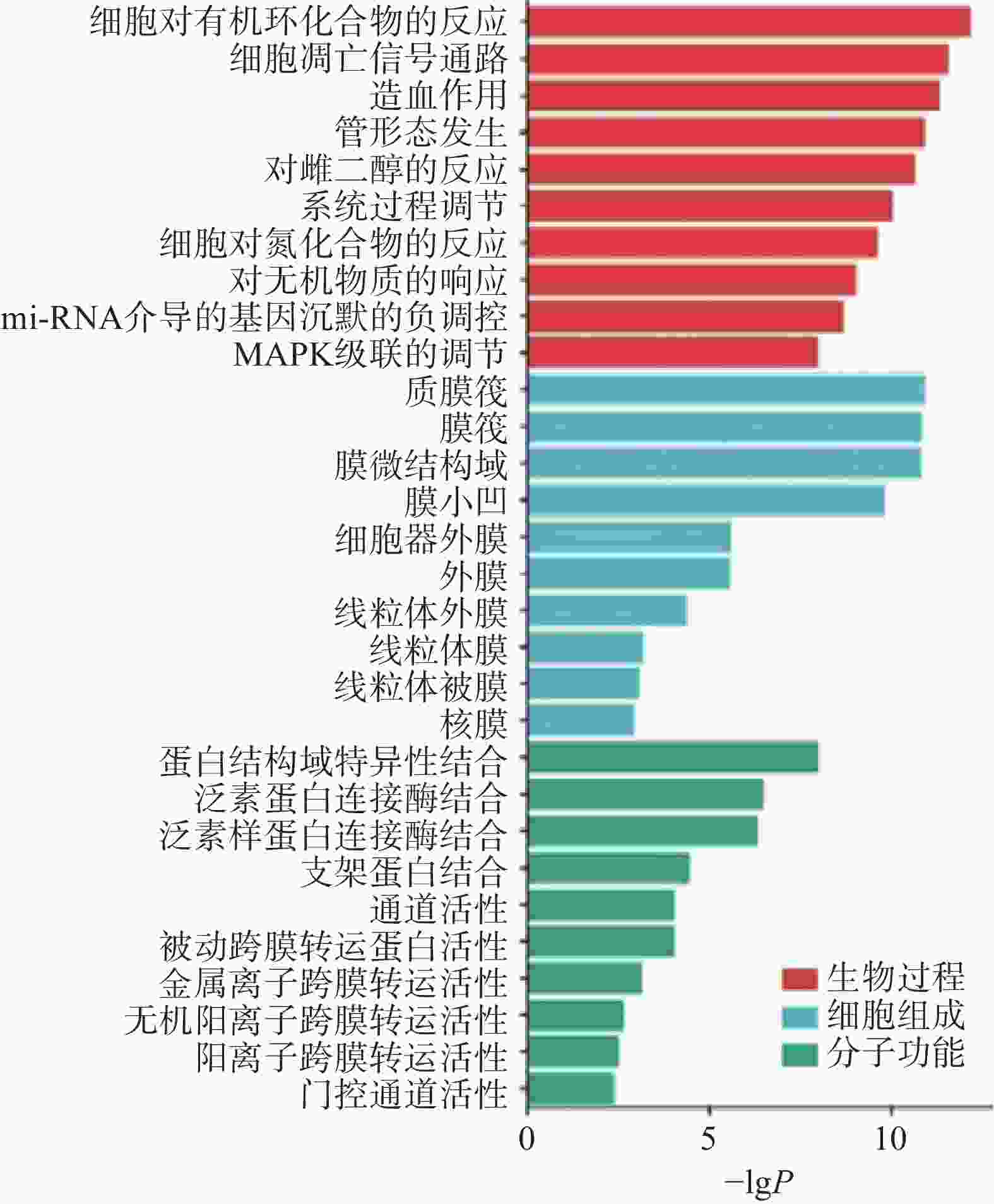
将上述29个关键靶点导入Metascape平台进行GO和KEGG通路富集分析,用“微生信”在线平台分别对GO富集每类前10个条目进行可视化分析。结果显示,路路通抗肿瘤靶点的生物过程主要涉及细胞对有机环状物的反应、细胞凋亡信号通路、造血作用、管形态发生和对雌二醇的反应等。细胞组成有脂膜筏、脂膜和膜微区等;分子功能涉及蛋白质结构域特异性结合、泛素蛋白连接酶结合、泛素样连接酶结合、支架蛋白结合、通道活性等(图3)。通过比较发现,细胞生物过程富集的基因数较多,说明路路通可能主要通过调节生物过程发挥抗肿瘤作用。
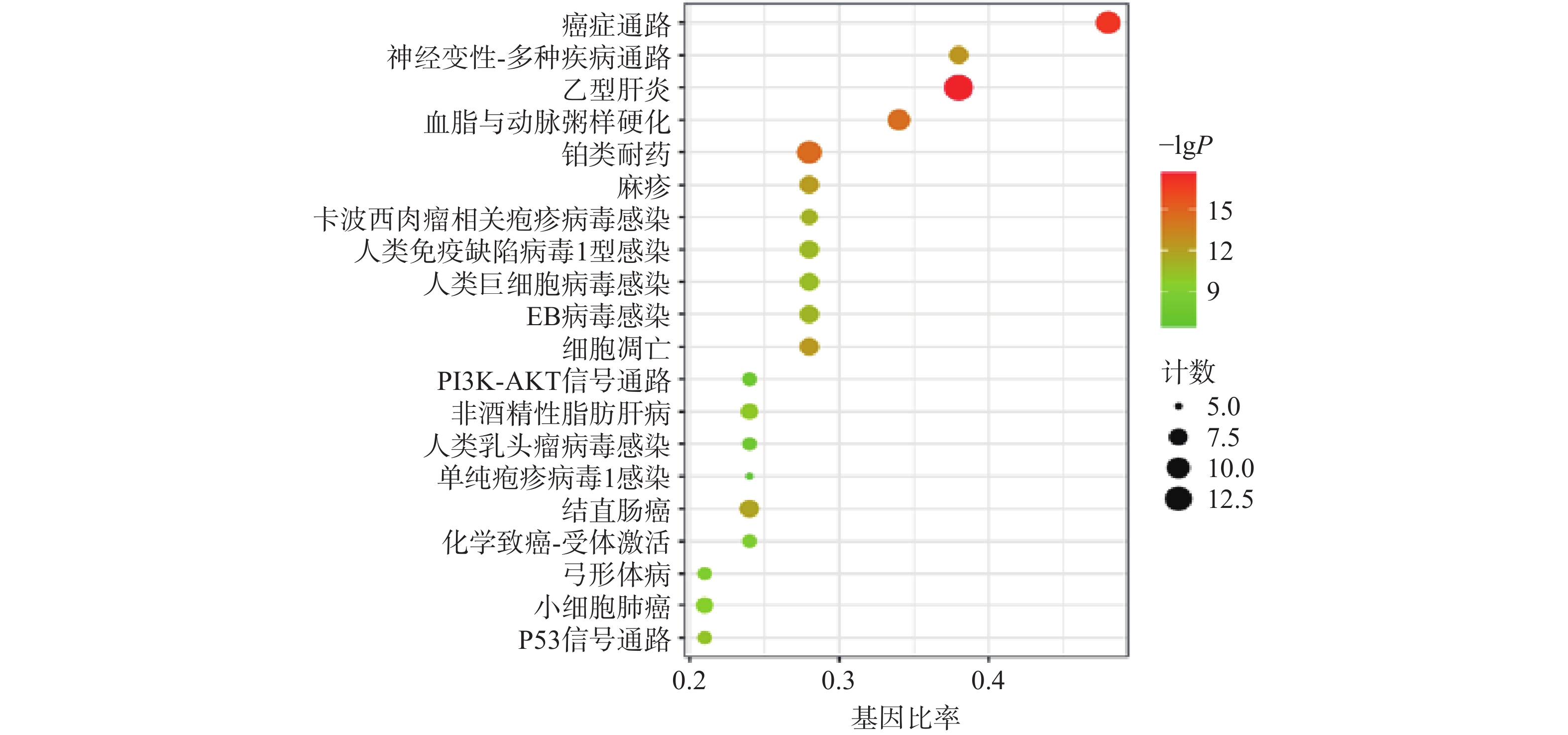
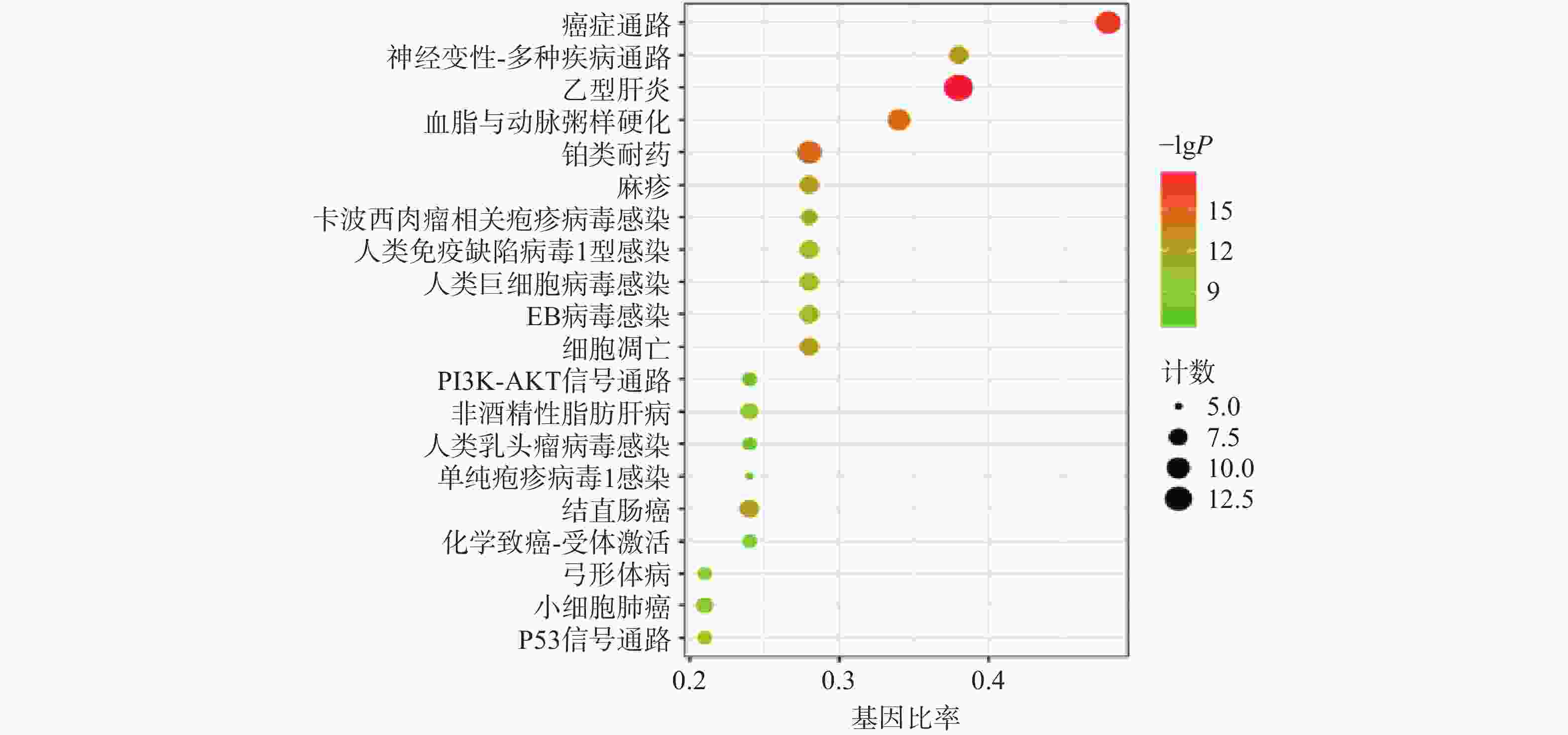
利用“微生信”在线平台对路路通抗肿瘤靶点的KEGG信号通路富集分析,前20条可视化分析结果如图4所示:按照P值从小到大富集的通路主要有癌症通路、乙型肝炎通路、铂类耐药性通路、细胞凋亡通路、PI3K-Akt信号通路、结直肠癌通路、小细胞肺癌通路和P53信号通路。
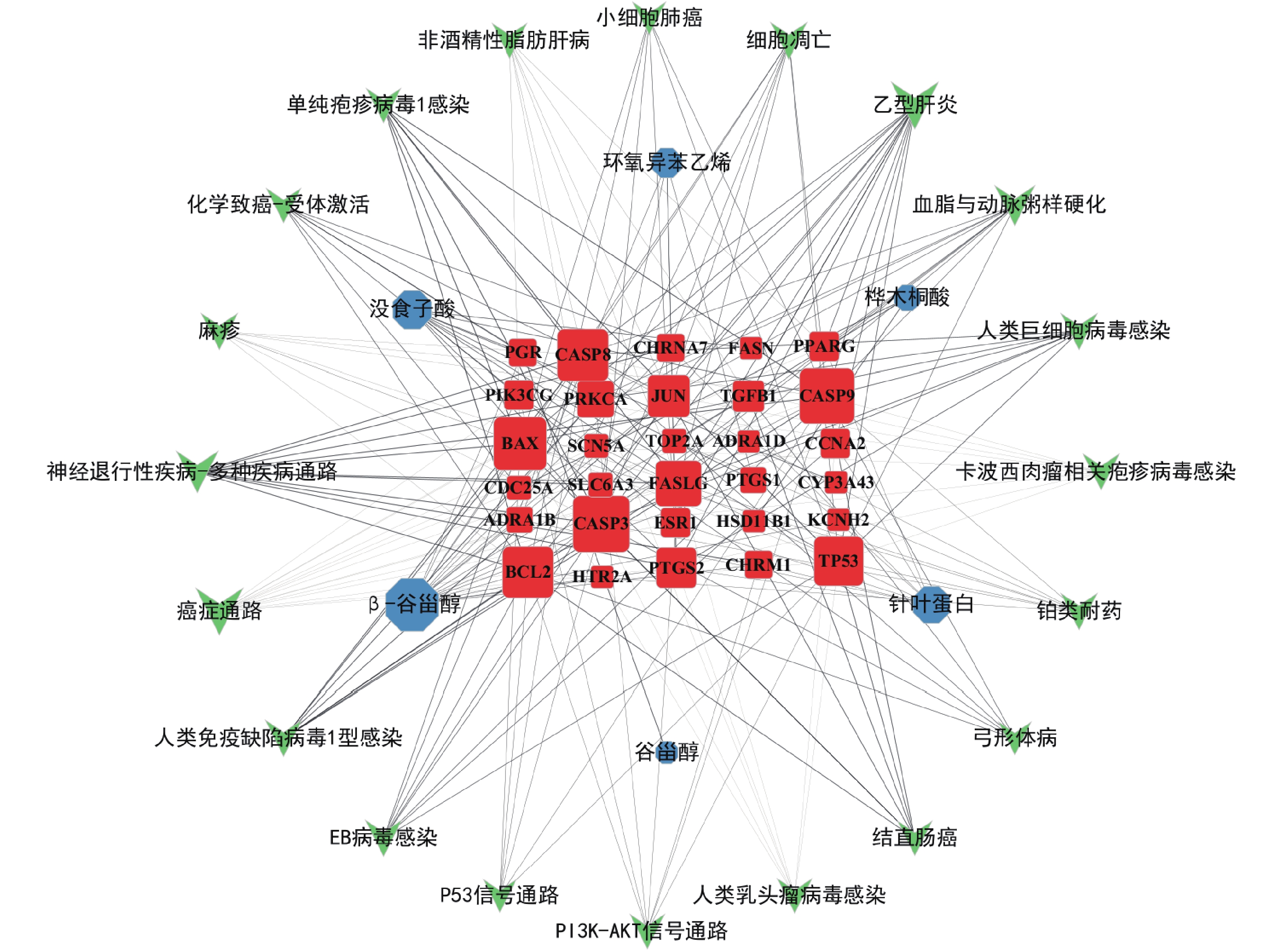
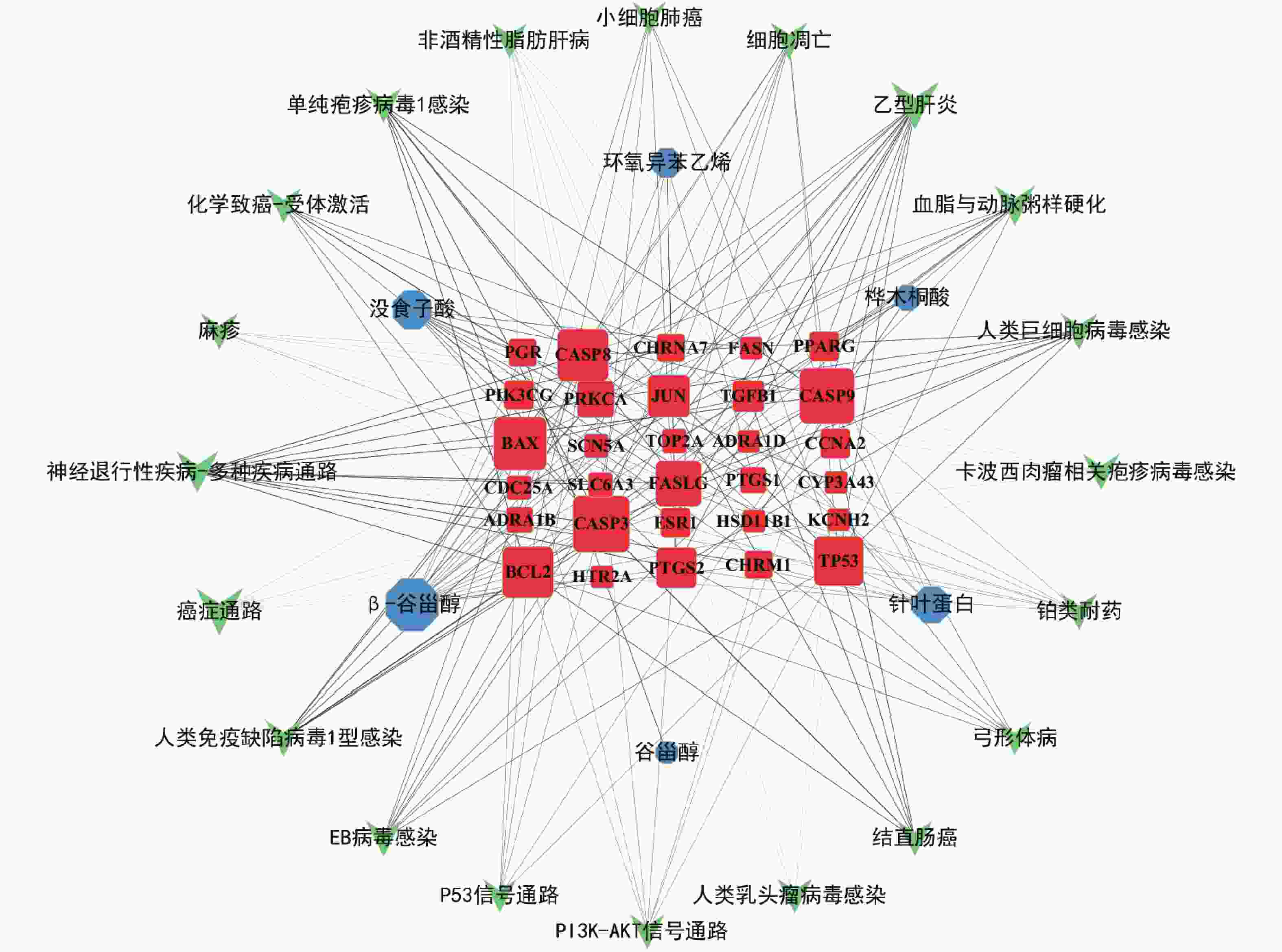
采用Cytoscape3.7.1软件构建活性成分-靶点-通路网络,见图5。红色节点代表29个治疗肿瘤的核心靶点,蓝色节点代表路路通的6个活性成分,绿色节点代表20条排名靠前的信号通路,连线代表三者之间的相互作用,节点的大小与度值呈正相关,表示节点在网络中重要性越高。从网络分析中可见,路路通抗肿瘤的主要活性成分是β-谷甾醇、没食子酸、针叶蛋白和桦木酮酸;核心靶点是CASP3、CASP9、BAX、BCL2、TP53、CASP8;核心通路是癌症通路、细胞凋亡通路、小细胞肺癌、结直肠癌、PI3K-AKT信号通路和P53信号通路。
-
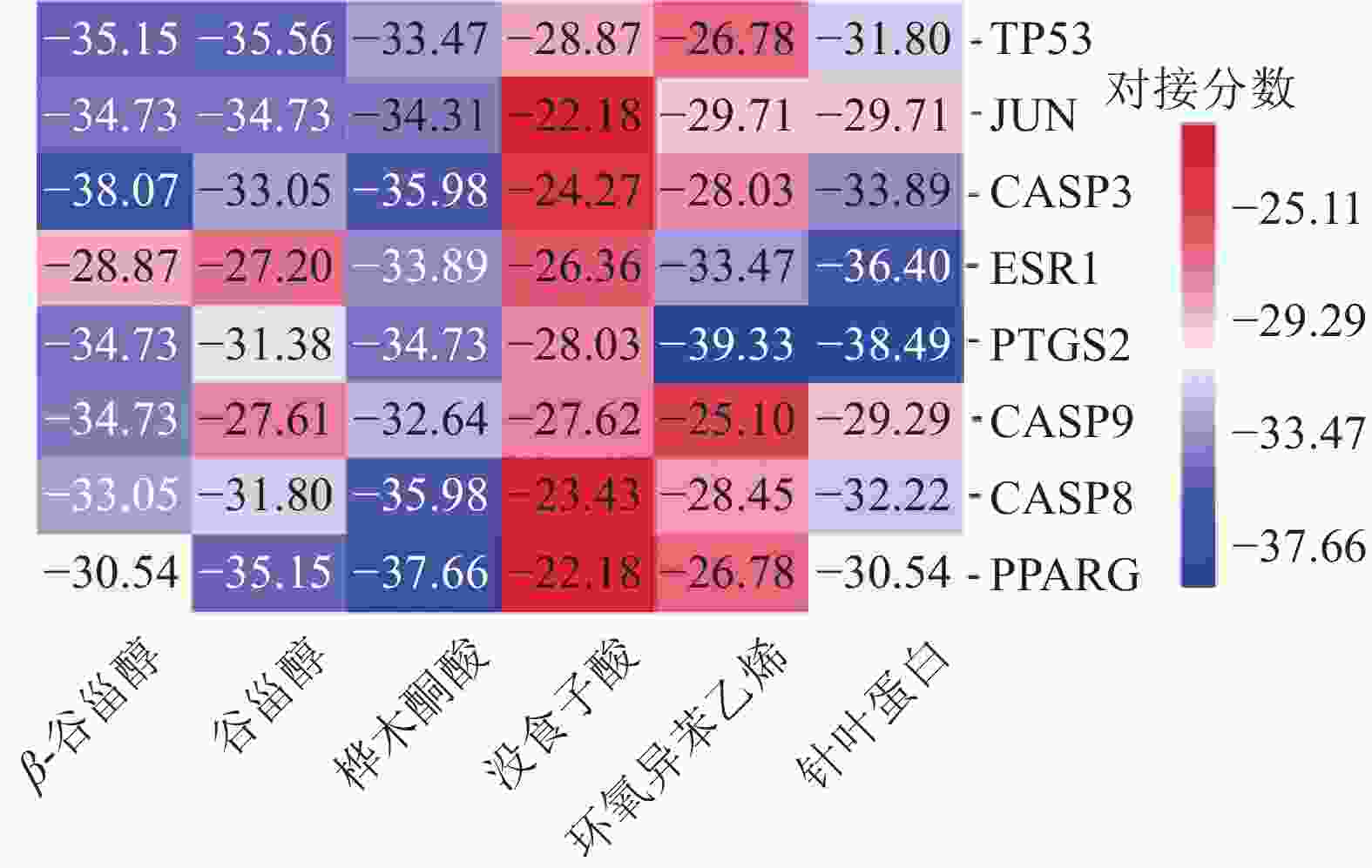
按照表2度值排序前8位的核心靶点为TP53、JUN、CASP3、ESR1、PTGS2、CASP9、CASP8和PPARG,对应的PDB ID分别为4RG2、5DEW、1NMS、5KD9、5F19、3D9T、4PS1和5Z6S。再分别与路路通的6个活性成分进行分子对接,最终得到48组受体-配体对接结果,用“微生信”在线绘制热图(图6),48组受体-配体结果的对接分数均< −20.92 kJ/mol,说明筛选的活性成分与核心靶点对接活性良好;对接分数 < −29.29 kJ/mol的有32组,可知大部分活性成分和靶点具有较好的结合活性,其中,结合最好的是PTGS2-环氧异苯乙烯,其次有PTGS2-针叶蛋白、CASP3-β-谷甾醇、PPARG-桦木桐酸、ESR1-针叶蛋白等。
-
中医药治疗肿瘤历史悠久,《黄帝内经》认为肿瘤是长期经络气血积聚、瘀滞导致邪阻络脉导致的结果,经络系统与肿瘤病证发生发展及病证治疗有着极为密切的联系[18-19]。现代医学认为肿瘤的发生和发展是多基因、多步骤的结果,中药多成分、多靶点的特点使其在肿瘤治疗方面有独特的优势。路路通果体多孔,归肝、肾经,有通行十二经之功效,为通经活络的常用中药,主要用于炎症、关节痛、脑血管病、肿瘤等的治疗。网络药理学最大的优势在于可以运用系统生物学方法,为中药多成分、多靶点、多通路的机制研究提供有力的技术支撑,其分析理念和技术路径与中医药治疗疾病的整体观相符合。
本研究通过TCMSP数据库筛选路路通活性成分,根据文献报道桦木桐酸和没食子酸体外有抑制肿瘤细胞增殖、诱导凋亡的作用,最终获得路路通的6个活性成分,再根据PPI网路拓扑属性分析筛选出核心靶点TP53、JUN、CASP3、ESR1、PTGS2、CASP9、CASP8和PPARG等,推测这些可能是路路通抗肿瘤的潜在作用靶点。CASP3是细胞凋亡的主要执行者,诸多抗肿瘤疗法包括细胞毒性药物、放疗或免疫治疗,都能够通过激活CASP3导致肿瘤细胞死亡,因此,CASP3的激活也被用作肿瘤治疗疗效的替代标志物[20]。文献报道[8]桦木桐酸激活p53蛋白,上调CASP3活性,触发线粒体凋亡通路引起胃癌MGC-803细胞凋亡,从而抑制肿瘤细胞增殖。桦木酮酸体外实验证实,抑制肝癌H22细胞的进展是通过提高CASP3、CASP9的活性,促进肝癌细胞凋亡。PPARG是过氧化酶体增殖物激活受体家族的一个亚型,研究发现其在多种肿瘤上高表达,包括脂肪肉瘤、前列腺癌及乳腺癌等[21]被证实通过多种机制参与多种肿瘤的增殖、转移、血管生成、凋亡及免疫调节,文献报道桦木酮酸在体外细胞培养中具有高度特异的抗前列腺癌活性,推测可能和PPARG有关[8]。ESR1是编码雌激素受体α(ERα)的基因,ERα主要表达的组织有子宫、垂体、肝脏、下丘脑、骨骼、乳腺、子宫颈和阴道,该受体可通过多种途径与其他信号分子相互作用,如PI3K/Akt或MAPK信号通路;ESR1突变最早报道于乳腺癌,是激素受体阳性晚期乳腺癌对芳香化酶抑制剂治疗后继发耐药的主要机制[22],此外在胃癌中,ESR1突变与细胞增殖、转移和侵袭有关[23];结合文献报道[5]桦木桐酸能抑制乳腺癌MCF-7细胞和宫颈癌C-33A细胞的增殖,推测可能与ESR1相关。
根据生物功能富集通路结果,构建了活性成分-靶点-通路网络,推测β-谷甾醇、没食子酸、针叶蛋白和桦木酮酸为路路通抗肿瘤核心活性成分,可能通过PI3K-Akt信号通路、TP53信号通路发挥抗肿瘤作用,可能对小细胞肺癌、结直肠癌等有治疗作用。PI3K-Akt信号通路是促进细胞存活、增殖、抗凋亡、促血管生成、化疗耐药的重要途径,与肿瘤发生发展及侵袭转移相关,一直是肿瘤治疗及抗肿瘤药物研发的重要靶点[24-25]。P53在人类所有肿瘤中半数以上都有错义突变,最早研究发现它是一种原癌基因,后来的研究证明野生型P53是一种有效的抑癌因子,P53信号通路也是抗肿瘤药物开发中较为关键的途径[26]。
根据分子对接验证了路路通抗肿瘤活性成分与核心靶蛋白之间能够较好结合,对接最好的是PTGS2-环氧异苯乙烯,其次有PTGS2-针叶蛋白、PPARG-桦木桐酸、ESR1-针叶蛋白。PTGS2是前列腺素生物合成过程中的一种关键酶,在肿瘤细胞中有明显的过表达[27],其在早期和晚期结直肠癌组织中过度表达,预示着预后不良,抑制PTGS2过表达有利于减少结直肠癌风险,提示该靶点可能在结直肠发生、发展、转移中发挥作用[28]。PPARG的激活介导多个通路抑制血管生成,其激动剂15d- PGJ12可减少基质金属蛋白酶-7(MMP-7)的合成,导致结肠癌细胞发生有丝分裂G1期停止[29]。ESR1通过以激素依赖性方式与NF-κB相互作用来抑制IL-6基因表达,而IL-6在早期结肠炎相关癌发生过程中是一个关键的肿瘤启动子。PPARG可通过抑制NF-κB介导的促炎反应充当肠道稳态的关键调节剂[30]。推测路路通治疗结直肠癌的物质基础是环氧异苯乙烯和针叶蛋白,可能通过调控结直肠癌细胞的增殖及凋亡、抑制炎症反应和维持肠道稳态来抑制结直肠癌的发展。
综上所述,该研究基于网络药理学、分子对接的研究方法,对路路通治疗肿瘤的活性成分和作用机制进行分析,提示路路通主要活性成分β-甾谷醇、甾谷醇、桦木桐酸、没食子酸、环氧异苯乙烯和针叶蛋白,可能通过PTGS2、CASP3、PPARG和ESR1等靶点,作用于PI3K-Akt、P53、细胞凋亡等癌症信号通路干预肿瘤,并预测了对结直肠癌作用物质基础和可能的机制,后续可以通过完整的实验来验证。
The antitumor mechanism of Fructus liquidambaris based on network pharmacology and molecular docking
doi: 10.12206/j.issn.2097-2024.202404067
- Received Date: 2024-04-18
- Rev Recd Date: 2024-10-21
- Available Online: 2026-01-22
- Publish Date: 2026-01-25
-
Key words:
- Fructus liquidambaris /
- anti-tutmor /
- network pharmacology /
- molecular docking
Abstract:
| Citation: | ZHANG Juan, WANG Chunmin. The antitumor mechanism of Fructus liquidambaris based on network pharmacology and molecular docking[J]. Journal of Pharmaceutical Practice and Service, 2026, 44(1): 32-38. doi: 10.12206/j.issn.2097-2024.202404067 |







 DownLoad:
DownLoad: