-
酒精性肝病(alcoholic liver disease, ALD)包括广泛的肝病变,从脂肪变性到脂肪性肝炎、纤维化、肝硬化和肝癌[1-4],目前仍然是肝脏疾病发病和死亡的主要原因。据统计,ALD的患病率在全球范围内持续增长,ALD严重影响着人类健康和生活质量。
在酒精性肝损伤中,丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)明显上升,血脂代谢异常,血清总胆固醇(TC)和甘油三酯(TG)上调,肝细胞损伤严重,肝脏脂质严重堆积,出现大量空泡[5-6]。ALD的早期阶段为酒精性脂肪肝,由脂质异常积累引起[7-8]。乙醇通过固醇调节元件结合蛋白1(SREBP1)来刺激脂肪生成[9];乙醇还能通过抑制过氧化物酶体增殖物激活受体α(PPARα)的转录活性和DNA结合能力来抑制脂肪酸氧化[10],降低脂质的分解,影响肝脏的脂质代谢[11]。
ALD的临床治疗主要包括抗氧化剂和抗炎药物,如水飞蓟素和甘草酸制剂[12];然而,这些药物的疗效和治疗范围有限,且缺少有效的治疗方式或药物来预先保护肝脏和减缓ALD的进程。草药及其活性单体因其低毒性、多靶点作用和其他作用而越来越受到关注。金线莲 (Anoectochilus roxburghii, AR)是一种被用作治疗肝病、糖尿病、高血压、癌症、手足口病和骨关节炎的传统中药[13],其具有抗炎、抗血脂、护肝的作用[14];金线莲含有多种活性成分,包括糖苷、生物碱、多糖、黄酮等[15]。目前金线莲肝脏保护作用的有效成分尚不清楚,而其主要成分金线莲苷是否作为金线莲发挥护肝作用的主要有效成分需要进一步研究,近年来研究发现金线莲苷(Kinsenoside, KD)具有减轻肝脏纤维化,抑制炎症反应,减轻氧化应激的作用[16],可能是金线莲发挥保肝护肝的有效成分。因此,本文旨在探究金线莲中的主要活性成分KD对于小鼠酒精性肝损伤的防护作用,及KD在酒精性肝病中的肝脏保护潜在机制。
-
实验使用小鼠均为C57BL/6,雄性,8~10周龄,体重20~25 g,购自斯贝福。实验动物生产许可证号:SCXK(京)2019-0010,动物合格证编号:No.110324220103927236,动物饲养于军事医学研究院SPF级动物房,环境设施使用许可证号:syxk(军)2019-0004,饲养湿度40%~60%,温度为22~25 ℃,执行12 h昼夜周期,小鼠自由摄食及饮水。所有动物相关实验均获得军事医学研究院动物福利委员会审查和批准,伦理审批号:IACUC-DWZX-2021-637。在给予特殊饮食之前,小鼠自由饮食和饮水,适应环境1周后开始实验。急性酒精性肝损伤模型和慢性酒精性肝损伤模型,均设4组,即对照组、酒精对照组、金线莲苷组、金线莲粉末组,每组各6只。
-
Lieber-DeCarli标准型液体模型饲料(购自南通特洛菲,TP 4030C),5%乙醇液体饲料(购自南通特洛菲,TP 4030D),金线莲苷(购自乐美天生物,DJ0053-0500),金线莲粉末(金线莲−80 ℃放3个月,打碎即可),油红O染料(sigma,O0625-25G),苏木素伊红(HE)染色试剂盒(碧云天,C0105M)。
-
液体饲料喂养瓶(购自南通特洛菲,001型/50 ml玻璃喂养瓶(挂钩)。
-
普通PCR仪(Bio-Rad,MyCycler)、荧光定量PCR仪(Applied Biosystems, QuantStudio3)、离心机(Eppendorf,
5424 )、台式冷冻离心机(Eppendorf, 5417R)、酶标仪(TECAN, Infinite M200)。 -
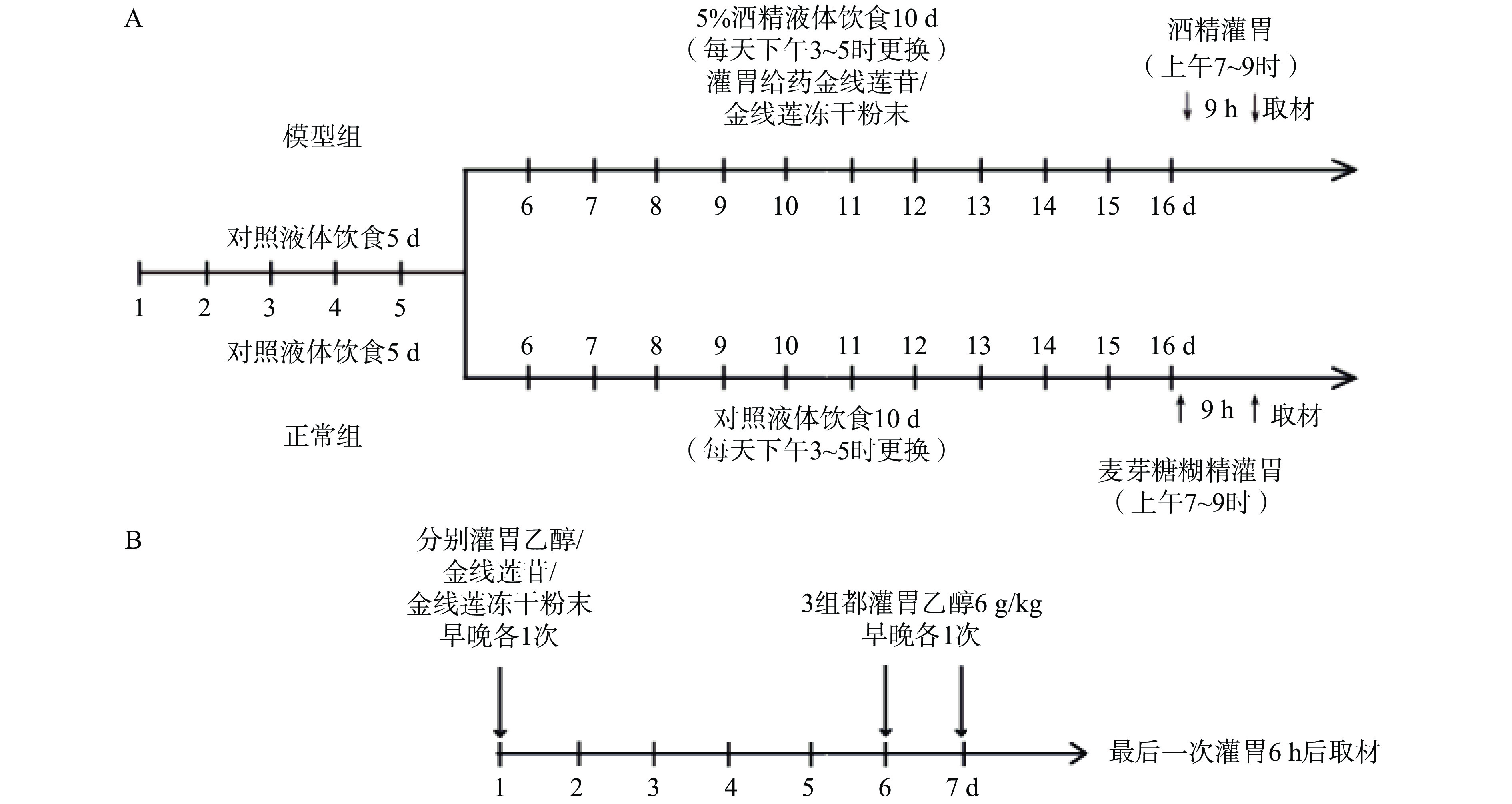
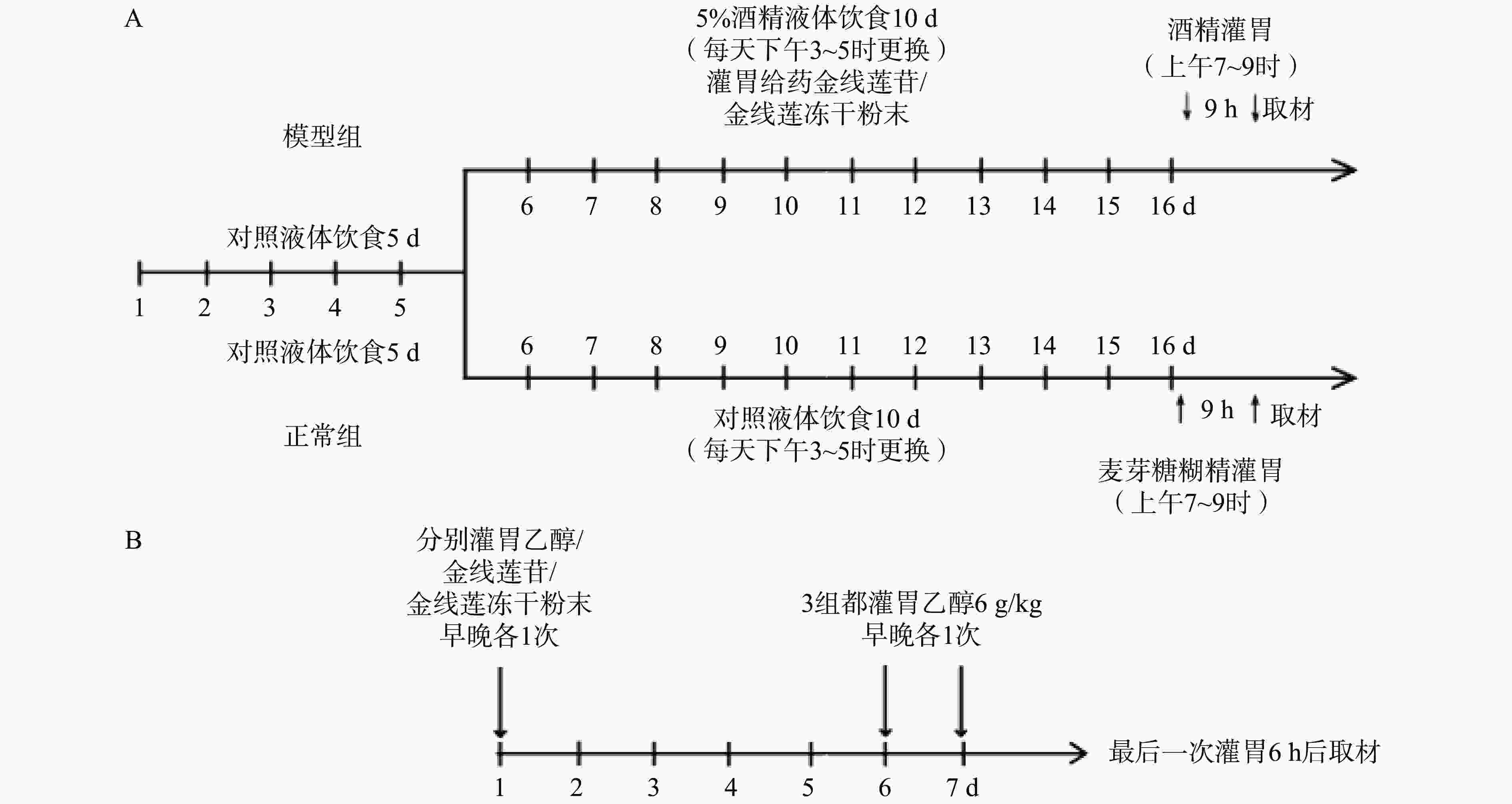
慢性酒精性肝损伤模型(Gao-Binge模型[17])(图1):采用C57BL/6雄性小鼠,先给予小鼠5 d的Lieber-DeCarli对照液体饮食(该食料的配方含粉末状酪蛋白、玉米油、橄榄油、右旋糖酐、麦芽糖、酒精、维生素、混合盐类、角叉菜胶。其中酒精给予量占总热量的40%左右)。适应期后采用含5%的乙醇液体饲料喂养10 d,在第16天上午7至9时对小鼠进行1次31.5%的高浓度酒精灌胃,剂量为5 g/kg体重。饲料需当天配制。实验期间不再额外提供固体饲料及饮水,液体饲料作为实验动物唯一的营养与水分来源。正常组(6只):15 d对照液体饮食,第16天灌胃一次45%麦芽糖糊精(9 g/kg);模型组(3×6只):5 d对照液体饮食,10 d 5%乙醇液体饮食,其中,KD组每天灌胃一次金线莲苷(50 mg/kg),AR组每天灌胃一次金线莲粉末(250 mg/kg),第16 天上午7至9时灌胃一次31.5%的高浓度酒精(5 g/kg)。
急性酒精性肝损伤模型[18]:采用C57BL/6雄性小鼠,实验动物自由饮水,普通饲料喂养。第1~6天,对照组(6只)和模型组(6只)灌胃生理盐水,KD组(6只)灌胃金线莲苷(50 mg/kg,早晚各灌胃1次),AR组(6只)灌胃金线莲粉末(250 mg/kg,早晚各灌胃1次);第6~7天除空白组外,都灌胃乙醇(100%乙醇,按照6 g/kg剂量,早晚各灌胃1次)。
-
所有小鼠称取体重后,取血,测量肝脏湿重,剪切取材,制备肝脏冰冻切片和石蜡切片标本,留取部分肝脏冻存于−80 ℃超低温冰箱,用于生化检测及血清学检测等实验。
-
石蜡切片3 μm厚切,经60 ℃烤片,进行脱蜡复水,依次进二甲苯(2次,10 min/次),100%乙醇(2次,5 min/次),95%乙醇(2次,5 min/次),85%乙醇(1次,5 min),75%乙醇(1次,5 min),水。苏木素染色5 min,1%盐酸-乙醇分化液分化3~10 s,温水浸泡返蓝。过95%乙醇,入伊红染液3~10 s,95%乙醇洗去浮色。过100%乙醇,二甲苯脱水透明,中性树脂封片。
-
从−80 ℃取出冰冻切片,−20 ℃融化20 min,然后在室温回温 20~30 min,蒸馏水洗3次,洗去残留的包埋剂;在 60%异丙醇中静置2 min;用吸水纸擦去多余的异丙醇,浸泡在油红O工作液中,室温,30 min;60%异丙醇调色:在显微镜下操作,需要严格控制时间,否则会导致脂滴弥散;封片:使用PBS与甘油1∶1混合,进行封片。
-
小鼠心脏取血后,室温静置30 min,3 000 r/min离心10 min后,分离得到血清,检测小鼠血清相关指标(肝功能:ALT、AST,血脂:TG、TC)。
-
肝脏组织采用 Trizol法提取总RNA,测定浓度后,取1 μg RNA作为模板,用反转录试剂盒(全式金)按说明将其反转录成cDNA。得到的cDNA用实时荧光定量PCR试剂盒(GeneStar)检测mRNA表达水平,引物序列见表1。
基因名称 上游引物 下游引物 β-actin GGCTGTATTCCCCT
CCATCGCCAGTTGGTAACAA
TGCCATGTSREBP1 CTGTCTCACCCCCA
GCATAGGATGTGCGAACTGG
ACACAGPPARα GTGGGTGGTTGAAT
CGTGAGGCAGTGGAGTTTGG
GTTGG -
所得实验数据用Excel分析软件进行统计分析,并用GraphPadPrism9.0作图,所列数据为(均值±标准误)。
-
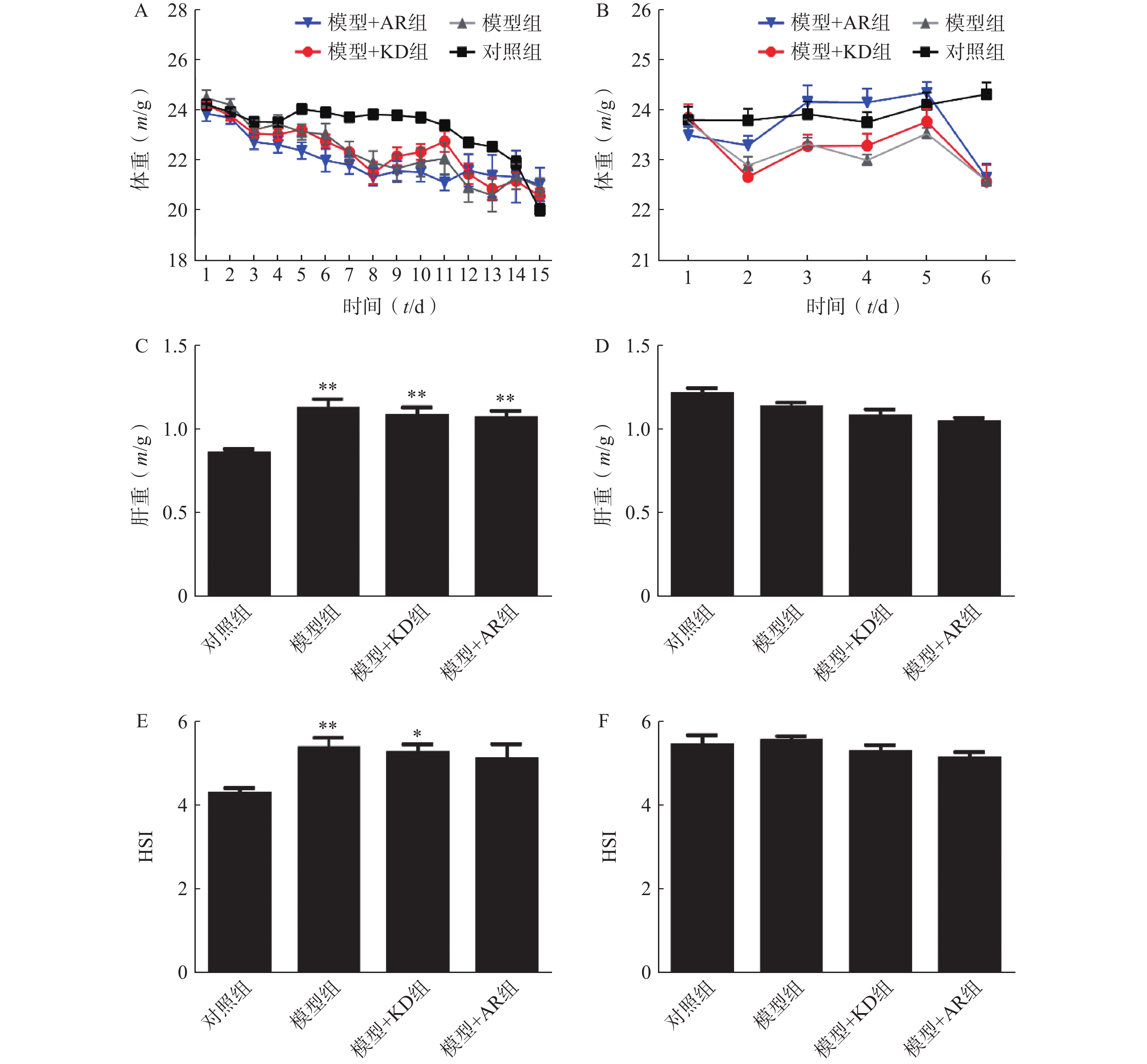
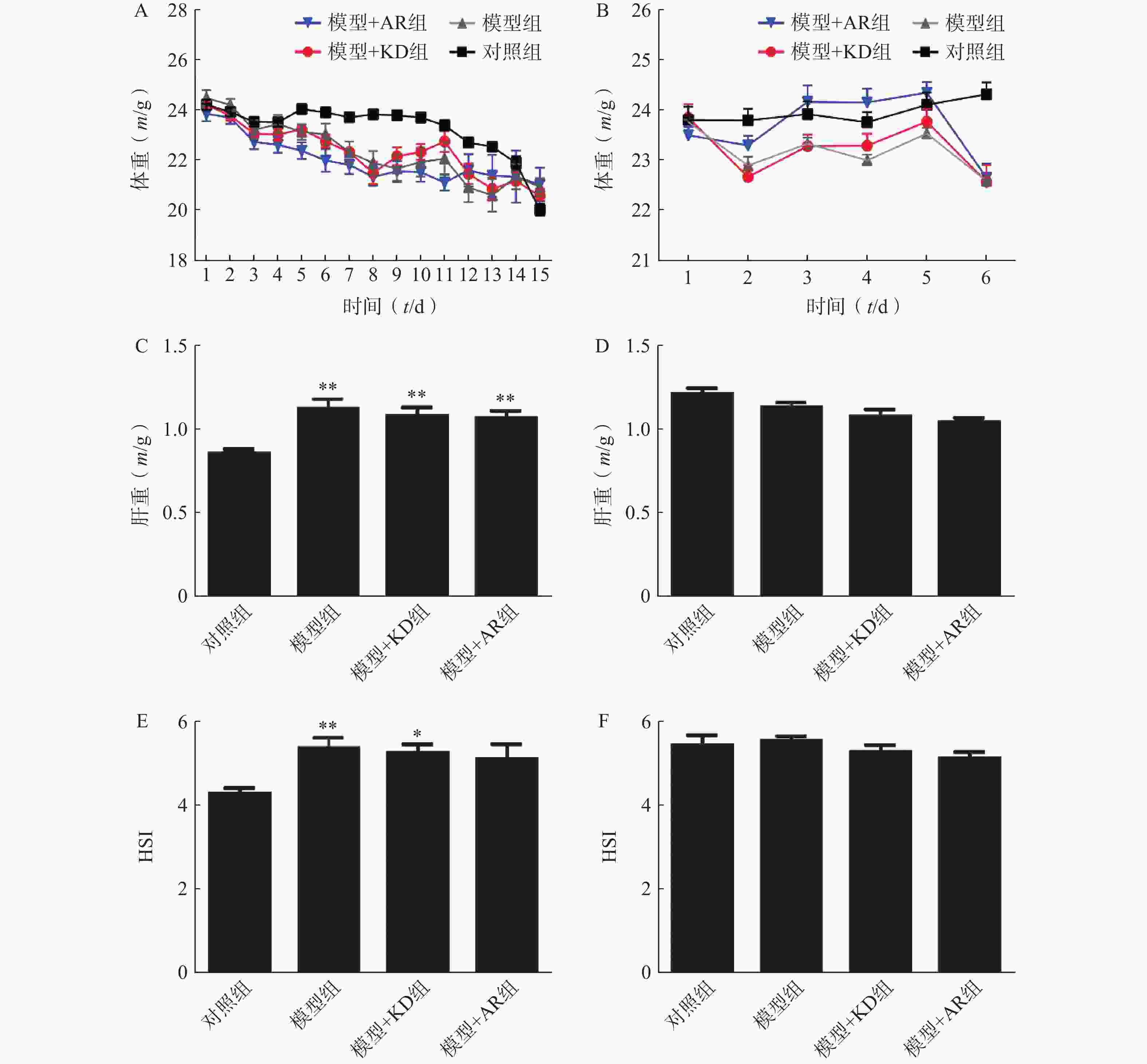
慢性酒精性肝损伤模型小鼠由于食物更换,引起小鼠体重下降,但是各组之间无明显差异(图2A);急性酒精性肝损伤模型组小鼠在最后2 d急性酒精灌胃期间体重骤降,给予AR或KD后与模型组无显著差异(图2B)。相比于对照组,慢性酒精性肝损伤模型组及给予AR或KD组小鼠的肝脏重量显著增加,而相比于模型组,给予AR或KD对于小鼠肝重量无明显差异(图2C),急性酒精性肝损伤模型组小鼠的肝脏重量无差异,给予AR或KD后小鼠的肝重量也未出现明显变化(图2D),慢性模型组及给予AR组小鼠肝脏指数增加,给予KD组小鼠肝脏指数无明显变化(图2E),急性酒精性肝损伤模型组及给予AR和KD组小鼠肝脏指数无差异(图2F)。
-
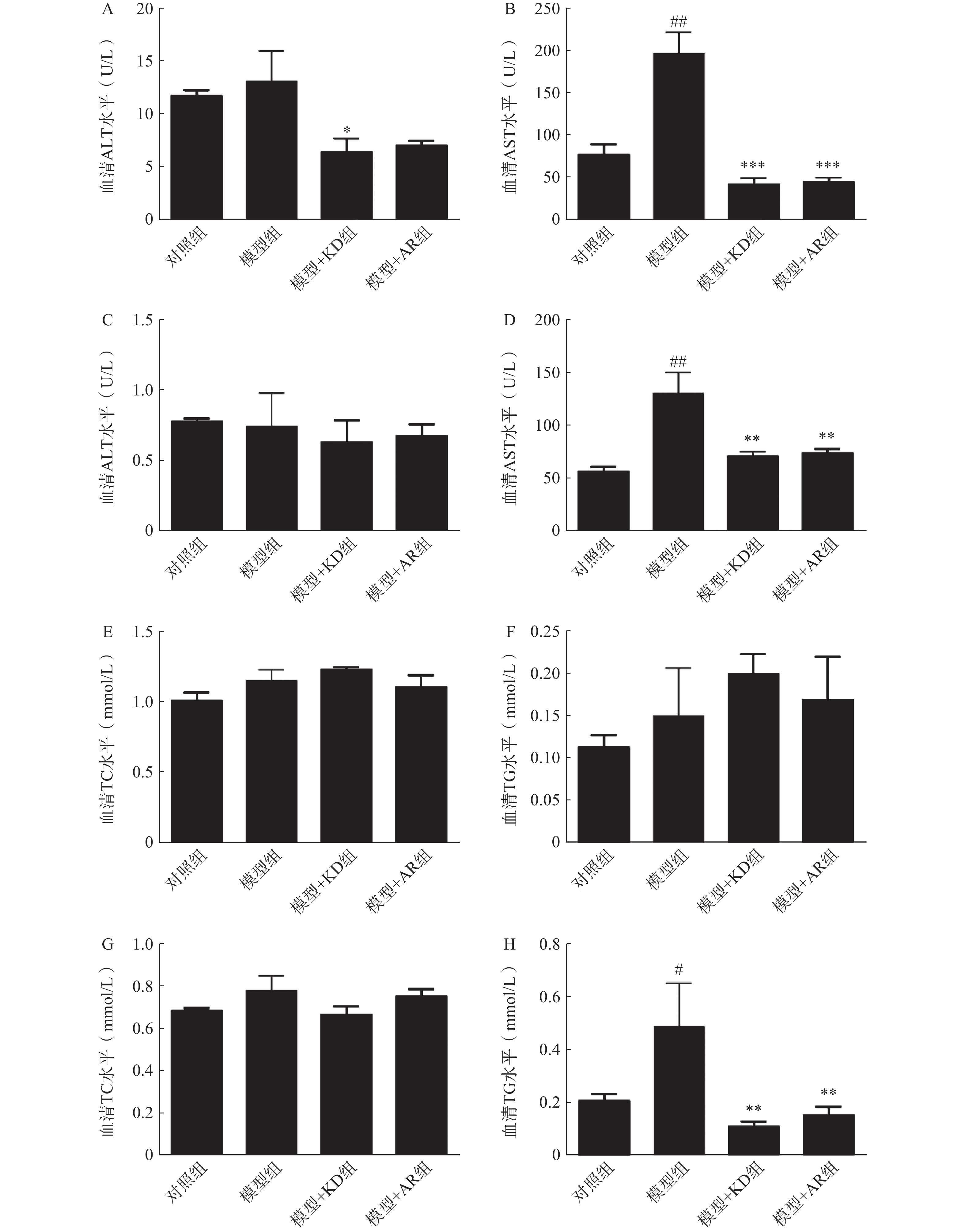
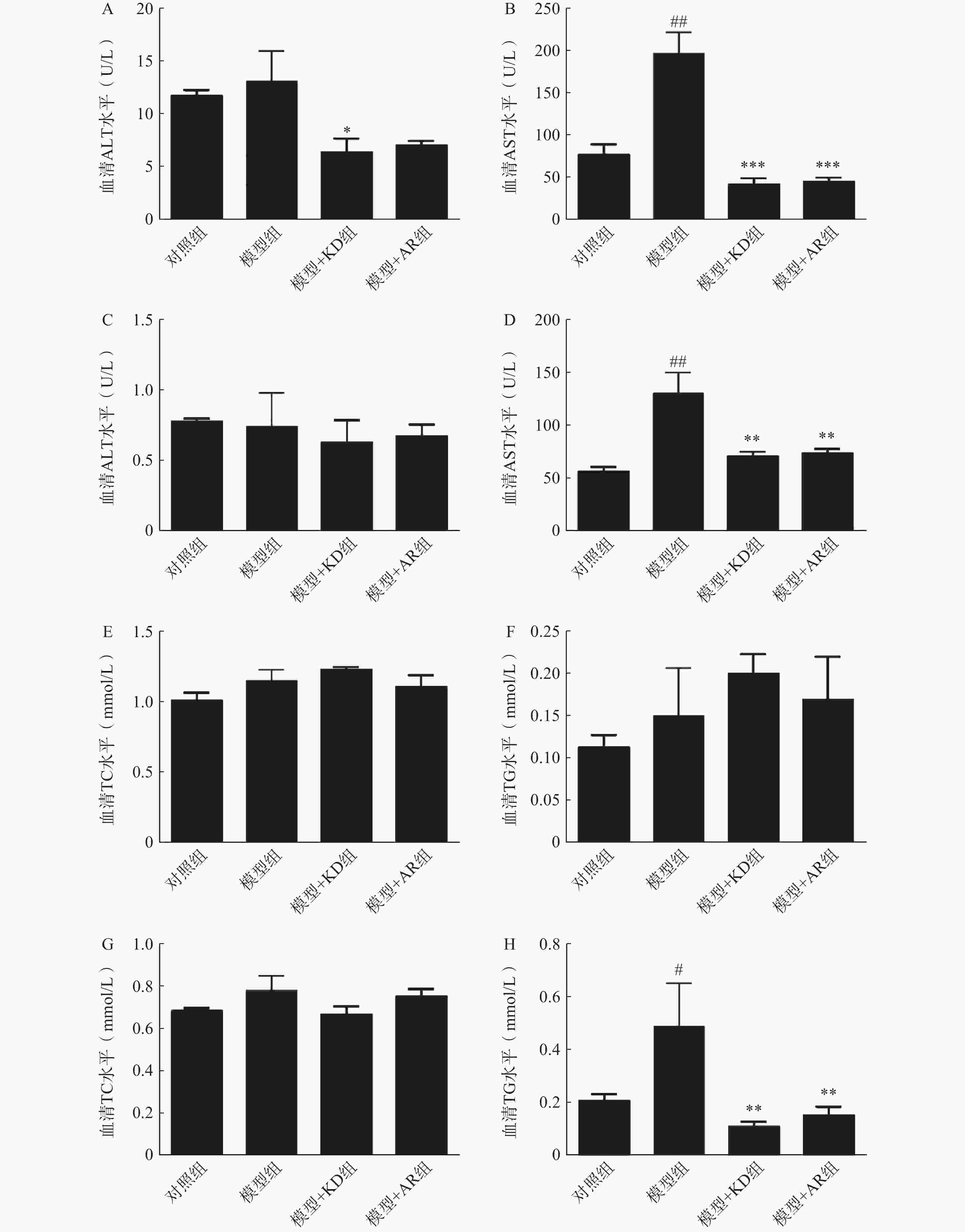
为了明确KD对酒精性肝损伤小鼠肝功能的影响,本研究分别检测了小鼠血清中肝转氨酶水平(ALT、AST)和脂质含量(TC、TG)。慢性酒精性肝损伤模型中,与对照组相比,模型组小鼠血清肝转氨酶ALT、AST水平显著升高,KD治疗后ALT明显降低,AR治疗后有降低趋势但无统计学差异(图3A),而AST水平KD和AR治疗后均显著降低(图3B)。急性酒精性肝损伤模型中,各组ALT水平无统计学差异(图3C),模型组AST水平显著升高,KD和AR治疗后都有显著降低(图3D)。慢性酒精性肝损伤模型中,各组TG、TC水平无统计学差异(图3E、3F)。急性酒精性肝损伤模型中,各组TC水平无明显差异(图3G),而与对照组相比,模型组小鼠血清的TG水平显著升高,KD和AR给药后TG水平都显著降低,但KD降低趋势更为明显(图3H)。综上,KD和AR给药后可降低小鼠的血脂和肝转氨酶水平,其中KD的降血脂和改善肝功能作用更加显著,表明KD作为AR的主要活性成分,可以显著改善小鼠肝功能和血脂代谢紊乱。
-
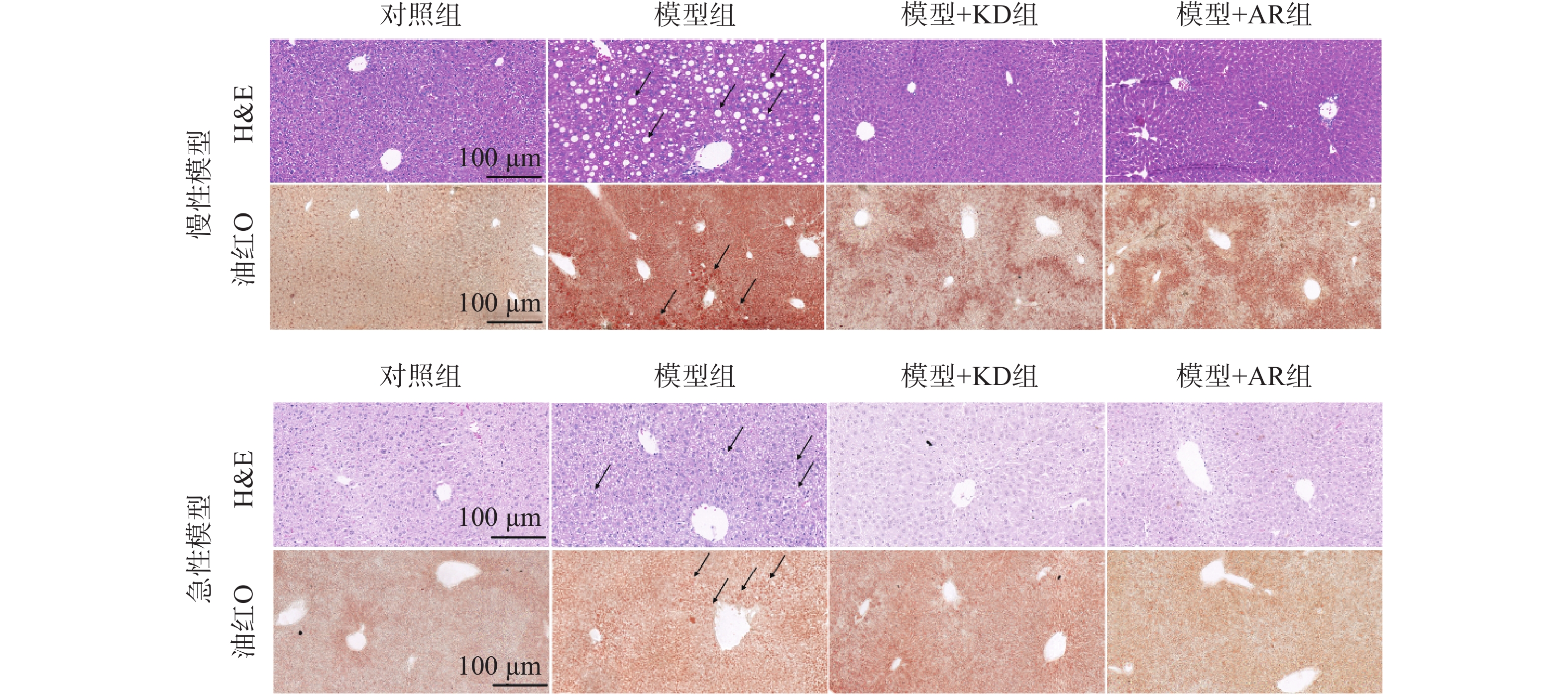
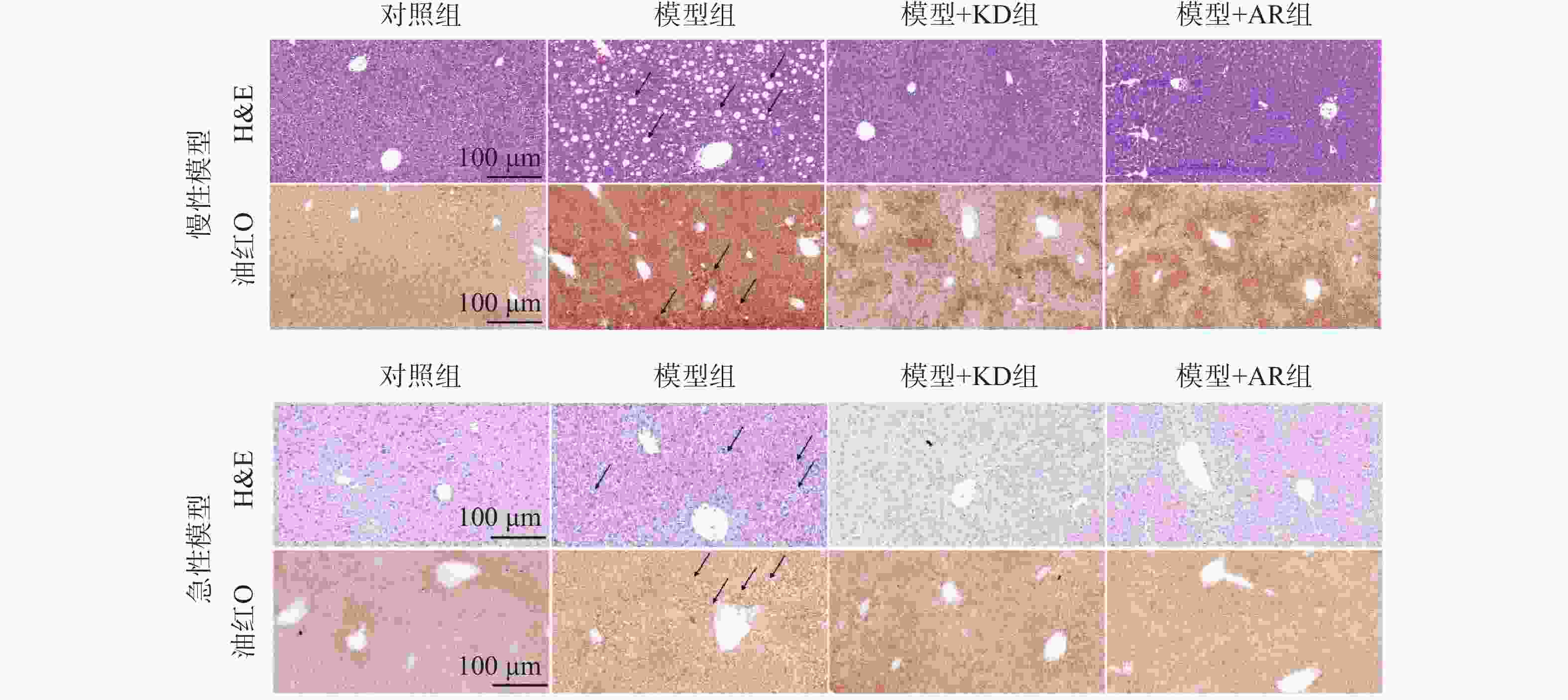
为了检测金线莲苷是否降低酒精性肝损伤小鼠肝脏脂质积累,本研究对小鼠肝脏组织进行H&E和油红O染色。慢性酒精性肝损伤模型(图4A)和急性酒精性肝损伤模型(图4B)中,肝组织H&E染色结果显示:对照组小鼠肝细胞以中央静脉为中心,向外周呈放射状排列,整齐有序,细胞均匀,而模型组小鼠肝脏中出现大量的空泡结构,肝细胞极度肿胀,呈圆形,体积明显增大;油红O染色结果也显示:模型组小鼠肝脏出现大量脂滴沉积,肝细胞明显肿大、变圆,胞内呈现深浅不等的油红O着色,中央静脉周围的肝细胞油红O着色较深,而在KD治疗后肝脏中的空泡结构和脂滴含量明显减少,且KD治疗效果较AR组更为明显。表明KD作为AR的主要活性成分,能够改善肝脏损伤,减轻酒精性肝脏脂质沉积。
-
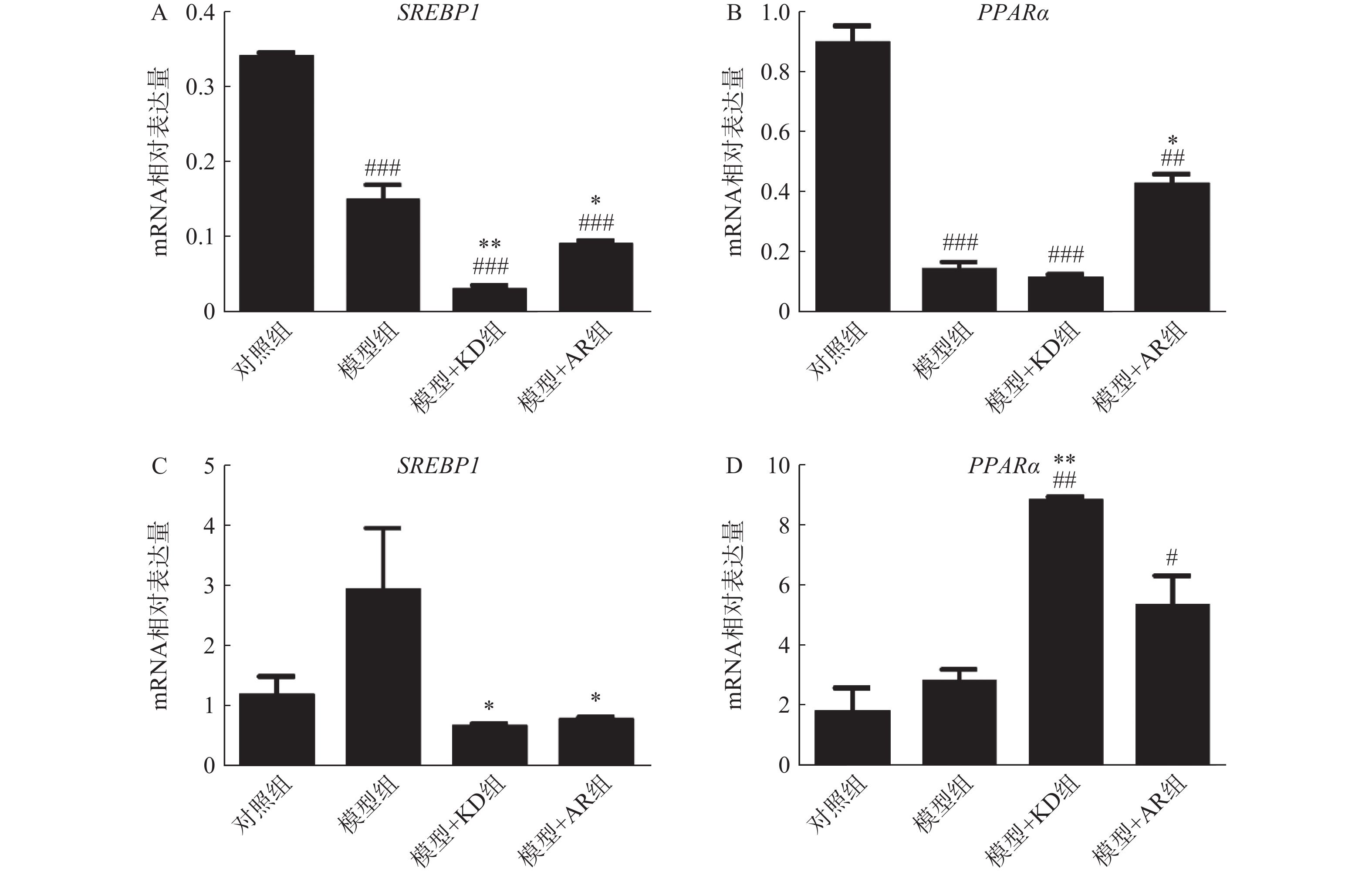
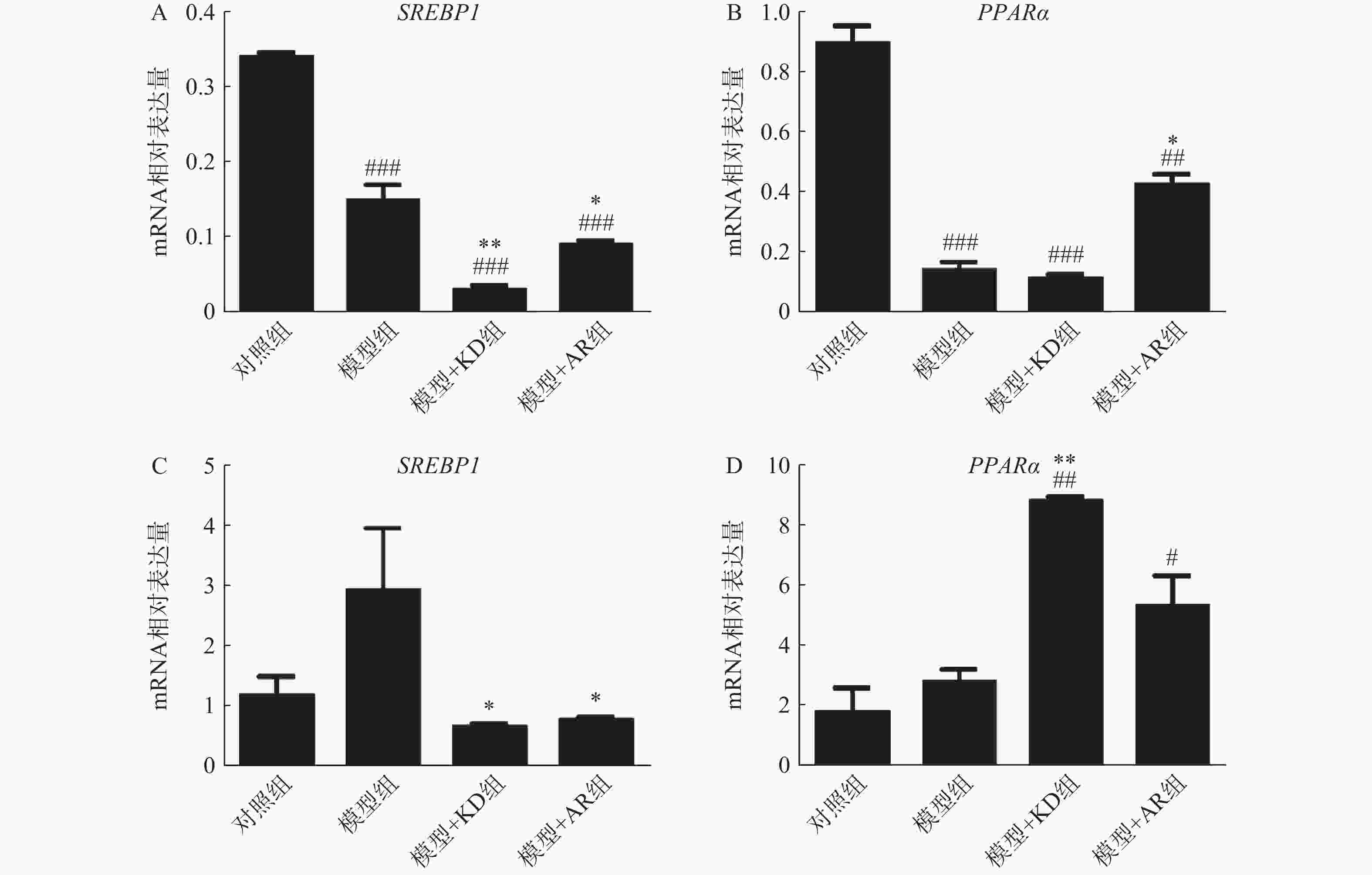
为阐明KD抑制肝脏脂质沉积的分子机制,使用qPCR技术检测脂质生成和脂肪酸分解代谢相关基因SREBP1和PPARα的mRNA表达水平。慢性酒精性肝损伤模型中,KD通过抑制SREBP1从而抑制脂肪生成且抑制效果强于AR组(图5A),而AR组能够同时促进PPARα表达增加脂质分解,减少脂质积累,但KD组PPARα没有显著变化(图5B)。急性酒精性肝损伤模型中,KD通过抑制SREBP1的产生,抑制脂肪生成(图5C),同时通过促进PPARα的产生,促进脂肪分解(图5D)。
-
据报道,金线莲具有广泛的药理活性,包括护肝、降血糖、抗炎和抗骨质疏松作用[19-20]。本研究在小鼠中建立了慢性和急性酒精摄入模型,比较AR和KD在两种模型中治疗ALD的效果。在慢性和急性酒精性肝损伤模型中,KD和AR给药后,小鼠的肝转氨酶水平均显著降低,而血脂水平只在急性酒精性肝损伤模型中下降,慢性酒精性肝损伤模型中,各组血脂水平无统计学差异。在2种模型中,KD和AR均能抑制SREBP1的转录活性,进而抑制脂肪生成,影响肝脏脂质代谢;同时,在急性酒精性肝损伤模型中,KD 和AR还能通过上调PPARα的水平,促进脂质分解、减少脂质积累。说明KD作为AR的主要活性成分,在保肝护肝中发挥主要作用。
迄今为止,已有多种ALD小鼠模型,其中Liber-DeCarli模型[21]和Gao-Binge模型应用较多。本研究在重复Gao-Binge模型后,发现小鼠在适应饮食的5 d期间,摄食量和体重无明显改变,而第6天给予酒精液体饲料后,模型组小鼠出现厌食,部分小鼠出现活动减少。随着实验进展,小鼠摄食量降低,进而导致模型组小鼠体重持续降低,但是药物处理对小鼠体重没有影响。
本研究中,利用KD和AR对2种酒精性肝损伤模型小鼠进行治疗,血清学结果显示KD的降血脂作用和改善肝功能作用更加显著;病理结果提示,与AR比较,KD减少肝损伤后的空泡结构更为显著、脂滴的堆积也更明显。之前的研究多停留在AR的粗提物,未对AR的活性成分进行比较,而本实验得出结论:KD作为AR护肝的主要活性成分,对于ALD的修复效果更佳,这对金线莲药用价值的开发和临床应用提供了可靠的数据支持。
慢性饮酒通过SREBP1和PPARα破坏肝脏脂质代谢,从而促进脂肪变性,SREBP1通过脂肪酸合酶和负责脂肪酸去饱和的酶,如硬脂酰辅酶a去饱和酶,可增加脂肪酸的生物合成 [22-23]。PPARα可以防止乙醇诱导的脂肪变性,乙醛在肝细胞中降低其表达,在慢性酒精摄入过程中通过下调类视黄醇X受体(retinoid X receptor,RXR),阻止其异源二聚到PPARα,并随后改变PPARα的信号传导[24-26]。本实验的慢性酒精性肝损伤模型中,KD 通过抑制SREBP1抑制脂肪生成;在急性酒精性肝损伤模型中,KD通过下调SREBP1的表达抑制脂肪生成, 同时通过激活PPARα促进脂肪分解。本研究阐明了KD作为AR的主要有效成分,在治疗酒精性肝损伤中的改善作用,并探讨了其发挥作用的潜在靶点,为相关疾病的药物开发提供了理论基础和潜在靶点,具有重要的临床前价值。
Mechanism of Kinsenoside in alcoholic liver injury in mice
doi: 10.12206/j.issn.2097-2024.202309030
- Received Date: 2023-09-14
- Rev Recd Date: 2024-06-08
- Available Online: 2026-01-22
- Publish Date: 2026-01-25
-
Key words:
- kinsenoside /
- alcoholic liver injury /
- lipid deposition /
- PPARα /
- SREBP1
Abstract:
| Citation: | HU Wenyu, SHI Wenjun, WANG Xuewu, LI Shuoshuo. Mechanism of Kinsenoside in alcoholic liver injury in mice[J]. Journal of Pharmaceutical Practice and Service, 2026, 44(1): 12-19. doi: 10.12206/j.issn.2097-2024.202309030 |







 DownLoad:
DownLoad: