-
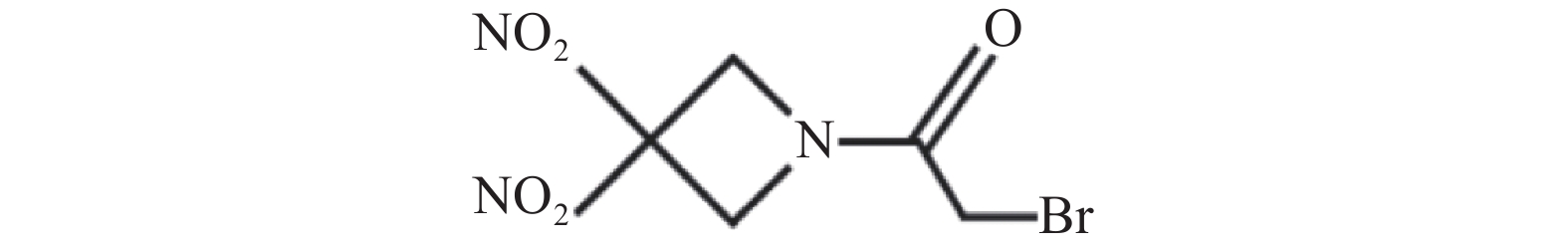
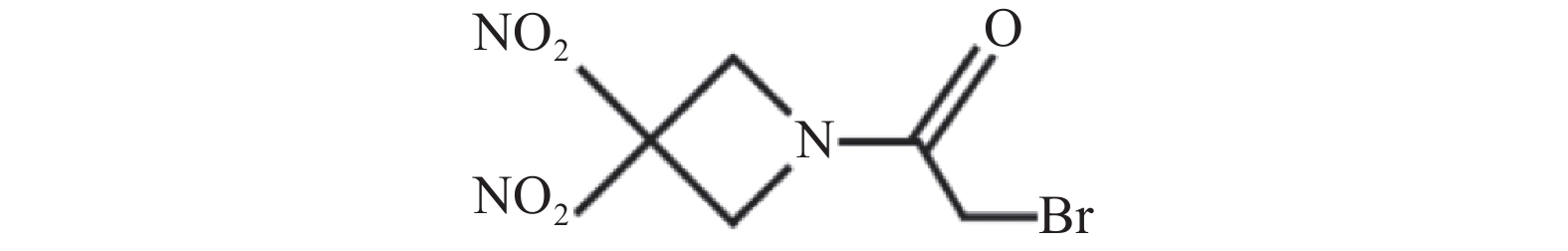
RRx-001化学名称为2-溴-1-(3, 3-二硝基氮杂环丁烷-1-基)乙烷-1-酮,结构如图1所示。RRx-001是由EpicentRx公司研发、具有首创潜质的小分子药物,经过美国食品药品监督管理局(FDA)批准,RRx-001作为孤儿药进入临床试验用于治疗小细胞癌、神经内分泌癌和胶质母细胞瘤的患者。另外,RRx-001作为放疗增敏剂也已进入临床试验。RRx-001不仅可作为单药用于临床,还可与化疗、放疗、靶向药物及其他免疫疗法联合使用[1, 2]。RRx-001具有较短的半衰期,体内代谢较快[3],临床试验采用口服给药或静脉给药[4]。作为一种新型抗肿瘤药物,RRx-001因其结构中包含的α-溴乙酰基片段,可通过双分子亲核取代反应机制与游离的巯基如还原性谷胱甘肽和血红蛋白β链上Cys93等发生选择性化学反应[5]。 RRx-001最常见的副作用是静脉输液相关疼痛,因此临床试验研究时将RRx-001与患者血液混合后给药,并且控制较慢的输注速度 [6, 7]。本文综述了RRx-001的作用机制研究最新进展,总结了近年来RRx-001临床试验的研究结果,为RRx-001进一步结构优化和临床应用研究提供了事实依据和指导方向。
-
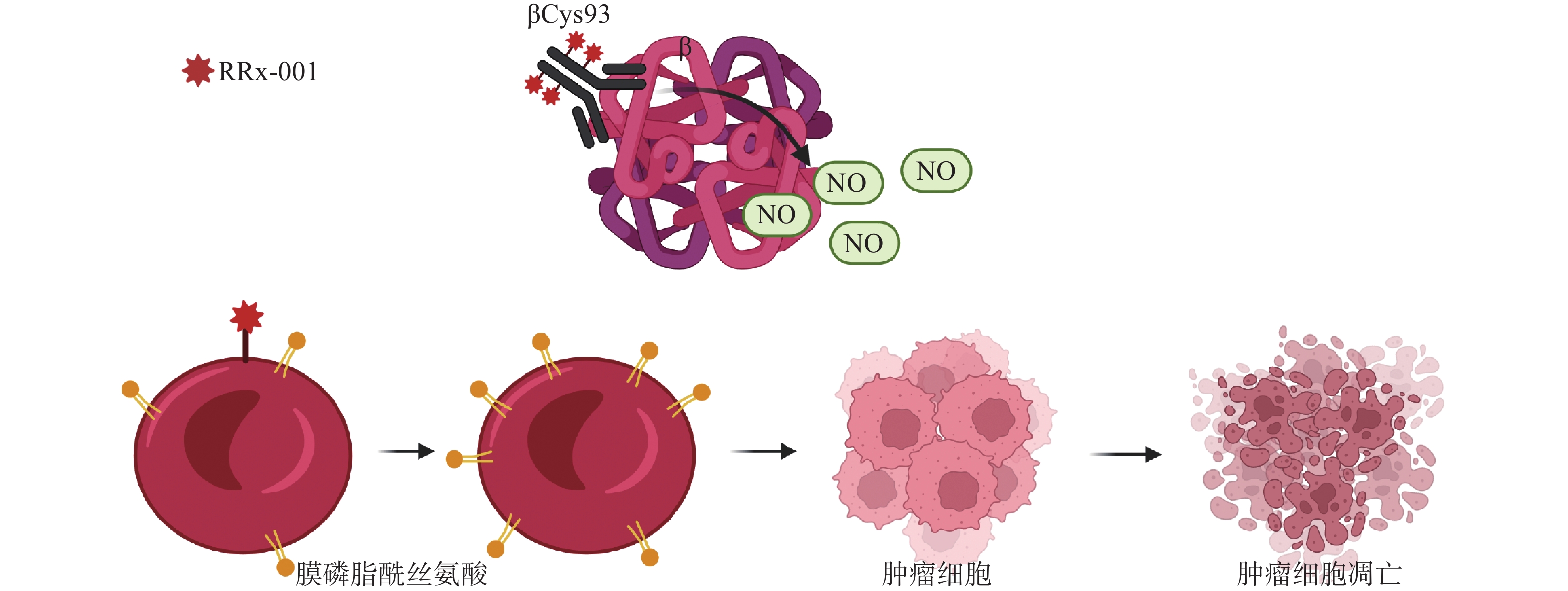
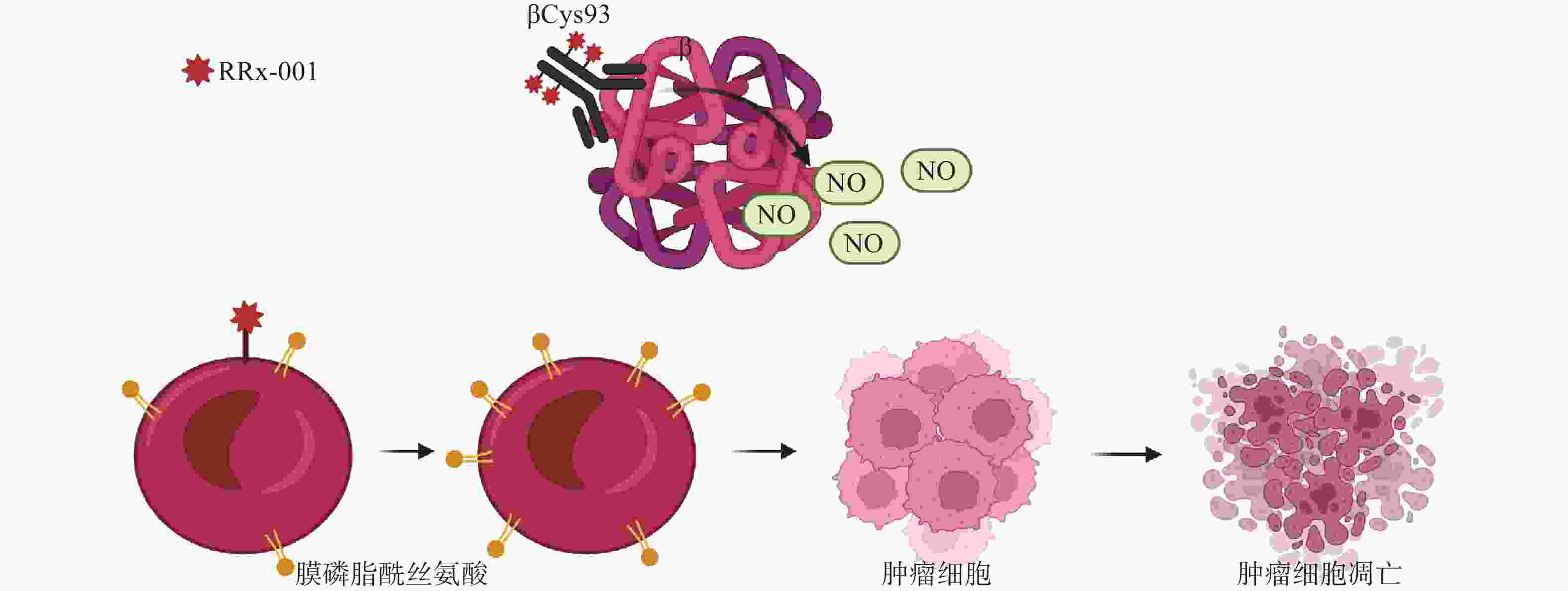
早期研究表明,RRx-001是一种NO拮抗剂,不仅可作为NO供体,而且能作为“红细胞吞噬免疫治疗剂”,可增加红细胞对肿瘤血管的依附性[8]。血红蛋白β链上的Cys93与RRx-001结合位后,释放出NO并入血。在缺氧条件下,RRx-001能增强脱氧血红蛋白亚硝酸盐还原酶的活性,使NO的生成大大增加[9]。RRx-001能选择性并不可逆地与血红蛋白β链上的Cys93结合[10],增加红细胞对内皮的黏附能力,提高红细胞膜磷脂酰丝氨酸表达量,并且可使红细胞优先定位到实体瘤 [11]。与RRx-001结合后的红细胞优先粘附在肿瘤血管内皮后,肿瘤便以“特洛伊木马”的方式内化和分解代谢,释放具有氧化还原活性的RRx-001和红细胞代谢物(图2)[12]。
此外,RRx-001是一种Myc蛋白抑制剂,通过抑制Myc可下调PD-L1的表达从而抑制免疫逃逸。研究表明,RRx-001还可作为Nrf2诱导剂发挥放化疗保护作用,Nrf2是bZip转录因子,属于调控蛋白,Nrf2能通过细胞氧化还原状态的改变而被激活,并通过上调抗氧化剂、异种生物代谢和其他细胞保护酶来恢复细胞内稳态[13]。RRx-001能促进Nrf2在人克隆结肠腺癌细胞(Caco-2细胞)核内的积累,导致血清HO-1的表达显著增加[14]。但RRx-001对Nrf2的调控具有“双刃剑”作用,Nrf2长期激活亦有促癌作用,可以诱导氧化应激,使老年人或慢性病患者OS水平升高[15]。抑制G6PD活性可能是RRx-001发挥抗肿瘤作用的另一个重要机制,研究发现,RRx-001能以浓度依赖的方式抑制G6PD [16]。作为一种有效的G6PD抑制剂,RRx-001已处于临床试验用于小细胞肺癌患者的治疗。并且,RRx-001与JQ1的联合治疗显著降低了皮下肿瘤组织中KEAP1的表达水平,通过调控KEAP1-Nrf2-G6PD轴,抑制小细胞肺癌细胞的氧化还原代谢[17]。
迄今为止,RRx-001的作用机制尚未明确。近年来研究表明,RRx-001除可能通过以上作用机制发挥抗肿瘤活性以外,还可能作为CD47小分子调节剂发挥抗肿瘤免疫活性。并且也可作为NLRP3抑制剂起到抗炎作用,进一步拓展其在抗肿瘤和抗炎药物开发的应用。
-
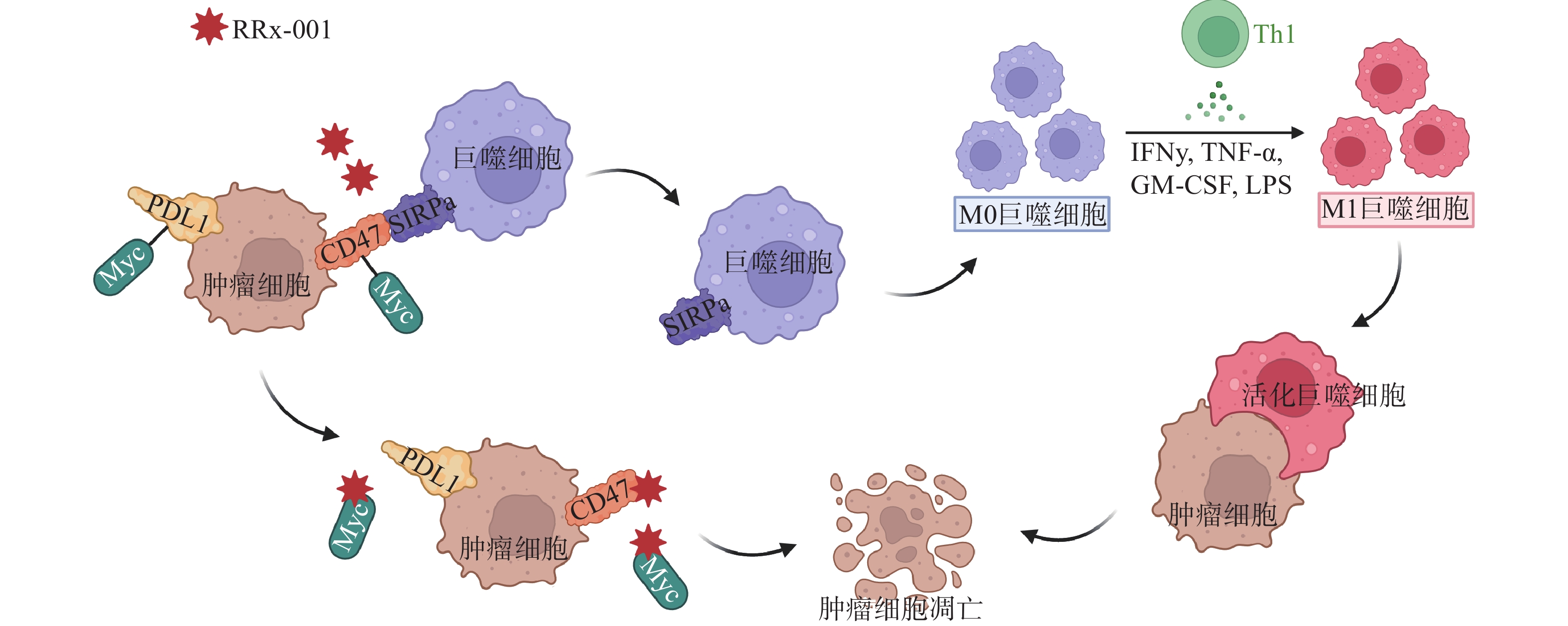
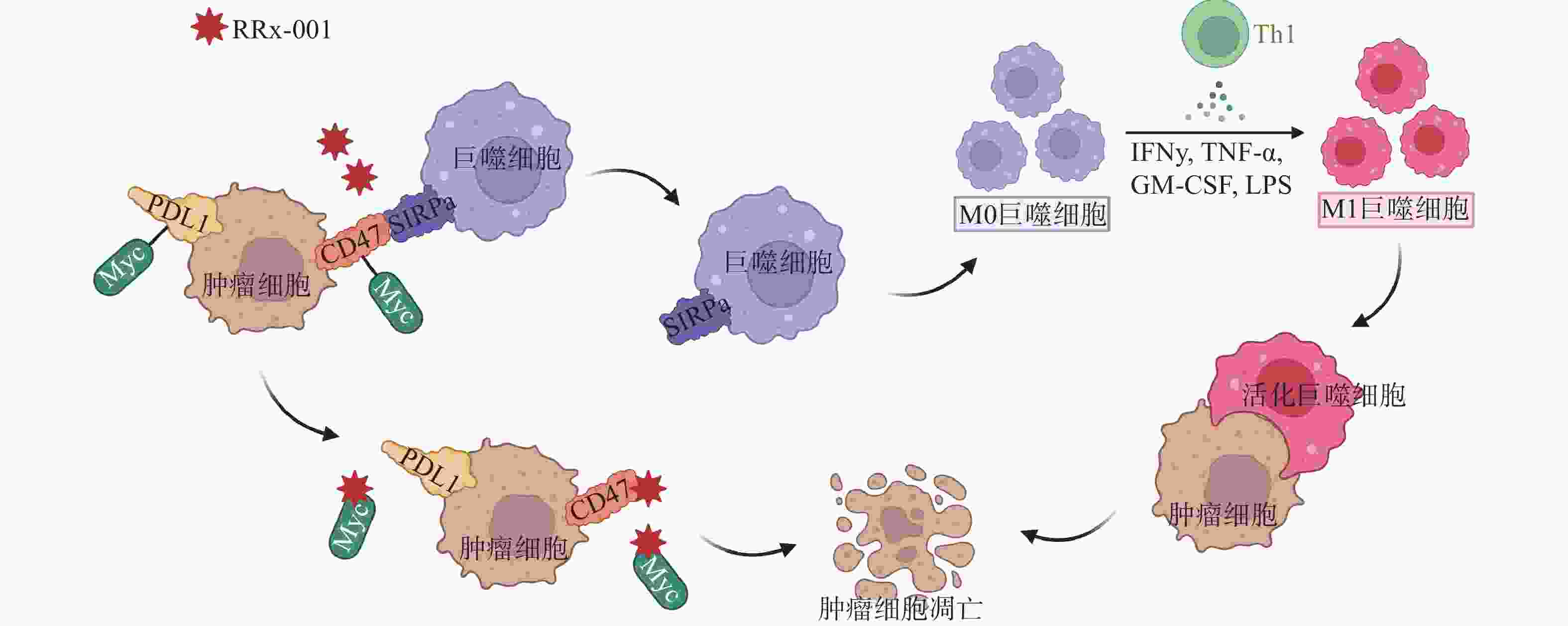
CD47是肿瘤细胞上一种广泛表达的细胞表面蛋白,能传递抗吞噬的信号从而阻止巨噬细胞介导的对肿瘤细胞的吞噬[18]。通过下调CD47的表达,可恢复巨噬细胞的作用,使巨噬细胞向M1巨噬细胞分化,刺激颗粒细胞瘤(GCT)的吞噬作用从而可达到杀灭肿瘤细胞的作用[19]。RRx-001是首个进入临床的CD47小分子调节剂,降低了肿瘤细胞和单核/巨噬细胞上CD47的表达水平,恢复了CD47-SIRPα相互作用导致的吞噬抑制功能(图3)。体内研究证实,肿瘤微环境中浸润巨噬细胞的存在是RRx-001具有抗肿瘤活性的必要条件[20]。研究表明,作为CD47小分子调节剂,RRx-001还可以与pH响应型纳米药物以及T型钙通道抑制剂联用,将药物输送到肺肿瘤中对肿瘤细胞起到杀伤作用[21]。
-
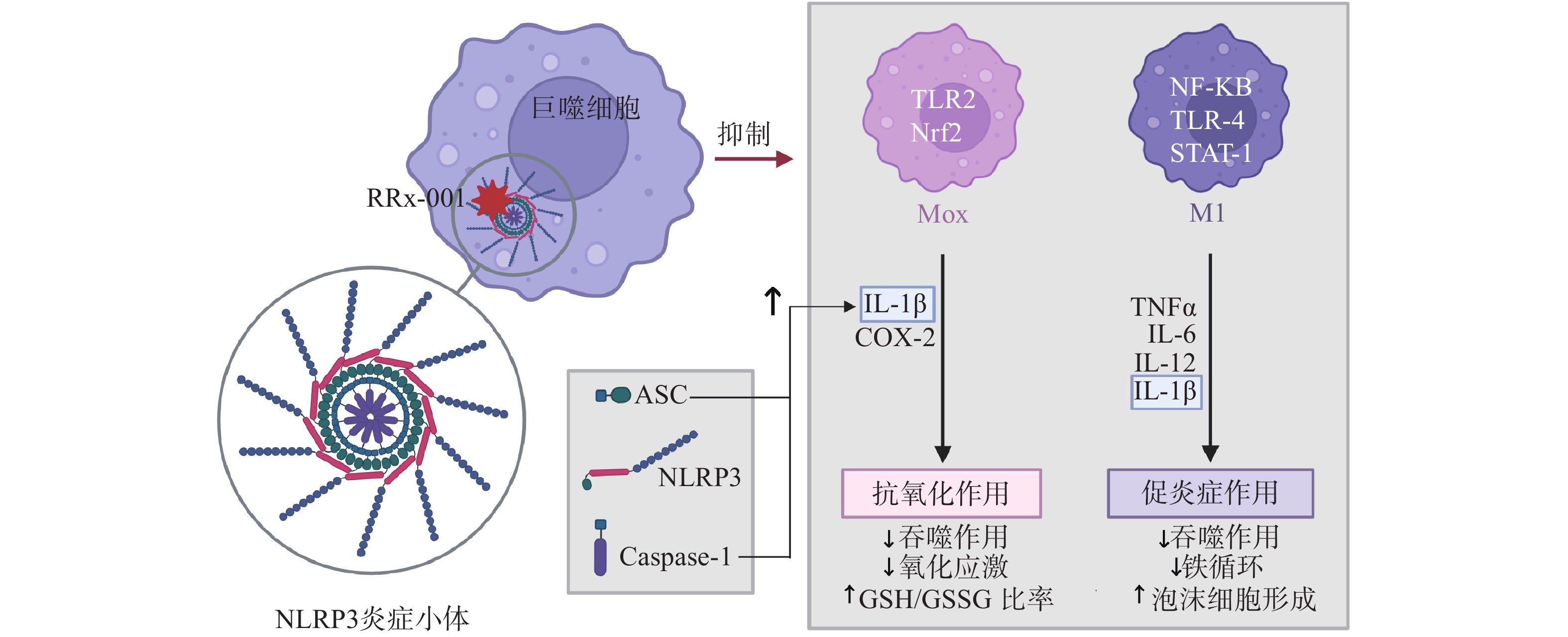
NLRP3炎症小体是固有免疫的主要组成成分之一,在机体免疫反应和炎症性疾病发生发展过程中起到了非常重要的作用,炎症小体激活的失调导致一些自身炎症性疾病如代谢综合征、2型糖尿病、阿尔兹海默病、心血管疾病、癌症等,这些疾病与较高水平的IL-1β和IL-18分泌有关[20]。RRx-001是NLRP3炎症小体的双重抑制剂,能选择性与NLRP3中心结构域的半胱氨酸结合[15],并且与NLRP3的结合能以级联的方式抑制巨噬细胞的极化,减少IL-1β的释放,阻滞增强的免疫反应和自身免疫的发生(图4)[14]。RRx-001还能剂量依赖性抑制ASC的聚合,直接抑制NEK7、NLRP3和ASC间的相互作用以及NEK7和NLRP3之间的相互作用,进而抑制NLRP3炎症小体的组装过程。[22]
-
RRx-001的临床研究主要是以肿瘤为适应症,进展最快的已进入Ⅲ期临床试验,研究较多的为小细胞肺癌和非小细胞肺癌,其他如结直肠癌、脑转移癌等研究亦有所涉及。除肿瘤外,因发现RRx-001可作为NLRP3抑制剂,一些炎症相关和神经保护的临床试验研究也正在开展,在今年热点COVID-9领域中的研究也证明了RRx-001对于新冠肺炎导致的急性呼吸道症状可能具有治疗作用[23-25]。综述[26]总结了RRx-001的3个主要临床试验:ROCKET、G-FORCE和QUADRUPLE THREAT,本文在此基础上,对RRx-001的临床试验进行了深入系统总结(表1)。
序号 名称 临床试验 临床阶段 试验时间 给药剂量 适应证 1 剂量依赖性试验 NCT01359982 Ⅰ期 2011.10至2013.03 推荐剂量16.7 mg/m2 肿瘤 2 PRIMETIME NCT02518958 Ⅰ期 2015.01至2015.11 剂量递增,最大剂量16 mg 晚期转移性癌症 3 G-FORCE-1 NCT02871843 Ⅰ期 2016.07至2018.05 推荐剂量4 mg 高级别胶质母细胞瘤 4 BRAINSTORM NCT02215512 Ⅰ/Ⅱ期 2015.02至2017.02 推荐剂量10 mg/m2 脑转移瘤全颅放疗 5 ROCKET NCT02096354 Ⅱ期 2014.06起 4 mg 三/四线转移性结直肠癌 6 QUADRUPLE THREAT NCT02489903 Ⅱ期 2015.06起 4 mg+自体静脉血12 ml 小细胞肺癌,EFGR突变的非小细胞肺癌,
高级别神经内分泌肿瘤,卵巢肿瘤7 PREVLAR NCT03515538 Ⅱ期 2018.07至2019.08 4 mg 口腔黏膜炎 8 REPLATINUM NCT03699956 Ⅲ期 2019.03起 4 mg 三线小细胞肺癌 -
剂量依赖性临床试验是一项较早开展,首次进入人体的开放式I期临床试验。研究评估了RRx-001的安全性、耐受性、剂量推荐和毒性反应情况。研究于2011-2013年共招募25例患者,给药剂量递增前有两周观察期,3名患者的起始剂量为10 mg/m2,剂量递增依次为 16.7、24.6、33、55 mg/m2和 83 mg/m2,每个剂量组中至少入组3名患者。治疗持续到病情进展或出现剂量依赖毒性反应或其他不良事件出现,每个治疗日都进行标准的血液检查和化学检查,同时观测治疗效果。从研究结果可以看出,RRx-001总体具有良好的耐受性,不良反应多为1~2级,主要不良反应为输液相关手臂疼痛,因而推荐每周16.7 mg/m²的剂量为Ⅱ期临床试验剂量[27]。
-
PRIMETIME是一项针对于晚期转移性癌症的I期先导性研究,研究采用了3+3的形式确定每个剂量水平的联合用药安全性。研究选用的给药方法是对于入选的晚期癌症患者每周使用一次递增剂量的RRx-001,同时与每隔一周3 mg/kg的纳武利尤单抗联合使用,RRx-001的最高剂量为16 mg,每6周评估一次治疗效果。由于样本量较小,研究结果暂无统计学意义,现有数据表明RRx-001参与的治疗总体耐受性良好,肿瘤相关巨噬细胞密度可能与RRx-001相关联。但是,RRx-001给药期间观察到假性进展即肿瘤先随着免疫细胞的渗透而增大,后因肿瘤细胞的清除退化趋于稳定。此项临床试验研究初步提供了RRx-001有效性的证据,以及进一步的临床研究方案依据[28]。
-
G-FORCE-1是一项非随机、开放式,分为两部分的I期临床试验,研究放疗时RRx-001和替莫唑胺剂量递增或固定剂量带来的临床治疗效果。临床试验包括6组患者,所有患者均接受了总剂量60 G,30次照射。前4组患者照射期间接受每日75 mg/m2剂量的替莫唑胺和每周递增剂量的RRx-001,依次为0.5、1、2、4 mg,最多治疗6次。替莫唑胺的剂量由放疗结束6周后开始,起始剂量变为150 mg/m2,28 d为一个周期,连续治疗5个周期,如无2级以上不良反应则增加到200 mg/m2,连续治疗6个周期。第5和第6组患者则是在照射期间接受每日75 mg/m2剂量的替莫唑胺和每周固定剂量的RRx-001(4 mg),放疗结束6周后,第5组患者开始接受100 mg/m2替莫唑胺和0.5 mg RRx-001,第6组患者接受100 mg/m2替莫唑胺和4 mg RRx-001,治疗结束的标准均为病情进展或完成6个周期的治疗。结果表明,在放疗和替莫唑胺治疗方案中添加RRx-001可以增加其治疗耐受性,提高受试者生活质量。并且,降低了毒性如血液学毒性的减少、部分骨髓保护作用[29]。
-
BRAINSTORM是一项单臂、多机构、开放式I/Ⅱ期临床试验,旨在研究RRx-001对于脑转移瘤患者全颅放疗的安全性和有效性。在此研究中,患者在全颅放疗前两周,每周两次,以及放疗前的第2天和第4天静脉给药RRx-001,并且在放疗疗程进行的第1、4、8、11天接受RRx-001治疗,剂量升级梯度为10、17、33、55 mg/m²。治疗期间使用磁共振对患者炉内病灶进行评估,对最佳颅内总反应率和总生存期进行计算评估。研究表明,RRx-001和全颅放疗之间具有潜在协同作用,RRx-001治疗总体耐受良好。尽管接受RRx-001治疗的患者颅内疾病控制率和仅接受全颅放疗的患者相比无统计学改善,并且总生存期也没有明显改变。但是,没有出现患者死于神经系统疾病,这一定程度上肯定了RRx-001对于脑的保护作用[30]。
-
ROCKET是一项旨在比较RRx-001 和伊立替康联合使用与瑞格菲尼单药在既往接受伊立替康治疗的三、四线结肠直肠癌患者中的安全性和有效性。34例患者以2∶1的比例接受RRx-001治疗,即RRx-001治疗组的患者先用4 mg的RRx-001作为“入门药”治疗两个月,若被认为临床适用则给予180 mg/m2的伊立替康。另一组则是患者接受160 mg瑞格菲尼,若被认为临床适用则再给予180 mg/m2的伊立替康。治疗后每周观察患者病情进展情况并计算患者的无进展生存期和总生存期。研究表明,在三、四线晚期结直肠癌的治疗中,先使用RRx-001,然后再给予伊立替康治疗可能是一种有效的治疗方案,这种方法比瑞格菲尼单药带来更好的疗效,显著改善无进展生存期和总生存期,并且毒性更低。但此研究规模较小,需要进一步扩大样本量确认RRx-001的有效性[31]。ROCKET实验后,动物实验又验证了RRx-001与瑞格菲尼联用的可能性,实验结果证明联合用药可以提升抗肿瘤活性并且减小副作用[32]。
-
QUADRUPLE THREAT是一项探索性、开放式Ⅱ期临床试验,评估了既往治疗过的小细胞肺癌、EGFR突变的非小细胞肺癌、恶性程度较高神经内分泌肿瘤和卵巢癌患者使用RRx-001后再进行铂类化疗的安全性和可行性。此项研究中患者接受每周一次4 mg的RRx-001混合自身12 ml自体静脉血共同输注,这是为了减少剂量增加后导致的凝血和溶血风险。在RRx-001治疗的过程中通过影像检查评估患者的肿瘤进展状况,若出现肿瘤进展或临床恶化则使用6个周期化疗药物治疗,如给予100 mg/m2的依托泊苷或60 mg/m2的顺铂。研究结果证明,RRx-001的耐受性良好并与既往治疗过的小细胞肺癌患者中对依托泊苷和其他铂类药物的后续反应相关。临床目前的标准治疗并不有效,对于接受临床三线及以上治疗的患者,RRx-001给此类患者的后续治疗提供了可能性[33]。动物实验将RRx-001的疗效和安全性与铂类药物进行对比,结果证明RRx-001的疗效明显高于其他铂类药物略低于顺铂,但毒性明显低于顺铂,与临床结果一致[3]。
-
PREVLAR是一项随机、无盲、开放式Ⅱa期临床试验,旨在研究RRx-001对头颈部癌症患者化放疗导致口腔黏膜炎的治疗方案安全性和有效性。在此研究中53名患者被分为4组,在以顺铂为基础的化放疗外,1~3组在开始化放疗两周前地塞米松处理后接受每周两次4 mg的RRx-001,第4组则不接受RRx-001的干预。1~3组在开始化放疗后进行不同处理,第2组在疗程的第2和第5周再接受两次4 mg的RRx-001,第3组则在疗程的前6周每周接受一次4 mg的RRx-001,第1组疗程内不接受RRx-001的干预。化放疗开始后每周对口腔黏膜炎进行两次评估,直至溃疡性口腔黏膜炎消除,此为观察结束终点。研究结果表明,接受RRx-001治疗后溃疡性口腔黏膜炎的病程缩短,严重程度和症状有明显减轻,因而体现出放疗保护作用。研究还指出RRx-001似乎不能降低放疗期间罹患溃疡性口腔黏膜炎的绝对风险,但可显著缩短其持续时间。并且,RRx-001治疗方案未见明显不良反应,耐受性良好。此研究使RRx-001获得FDA快速通道资格,可作为放疗保护剂预防或改善严重的口腔黏膜炎[15, 34]。
-
REPLATINUM是一项随机、开放式Ⅲ期临床试验,旨在分析RRx-001和铂类药物联合治疗与仅用铂类药物治疗三线小细胞肺癌的疗效差异。研究将患者1∶1随机分配到两组中,一组接受3周为一个周期、每周一次4 mg的RRx-001和第1~3天的依托泊苷100 mg/m2以及另一种铂类药物如顺铂60 mg/m2或卡铂治疗,若病情好转则交替使用连续两周每周一次4 mg的RRx-001和减量单药铂类药物维持治疗。另一组则仅接受21天为周期的第1~3天的依托泊苷100 mg/m2以及另一种铂类药物如顺铂60 mg/m2或卡铂治疗。治疗一个周期后通过CT评估,此后每两个治疗周期评估一次,安全性评估则贯穿整个治疗过程。目前此研究正在进行中,研究结果将揭示RRx-001对于铂类药物化疗的敏感性,以及和铂类药物交替使用的可行性和安全性[35]。
-
RRx-001作为一种首创小分子药物,主要作用机制除了NO拮抗剂、Myc抑制剂、G6PD抑制剂以及对于红细胞的作用以外,作用机制研究的热点是作为NLRP3抑制剂、Nrf2诱导剂、CD47抑制剂。目前,RRx-001已经进入了III期临床试验阶段,在此之前,I和Ⅱ期临床试验已经证实其在小细胞肺癌、结直肠癌、头颈部癌、脑转移和神经胶质瘤以及肺部炎症等的治疗效果以及放化疗的增敏和保护作用。尽管RRx-001还没有获批上市,现有临床试验一定程度上证实了RRx-001作为单药使用时以及与其他药物联用时的有效性和安全性,但仍需进一步扩大临床样本开展更大规模的临床试验证实。但是,基于现有临床数据,RRx-001有望成为治疗晚期癌症患者或是恶性程度较高癌症患者的治疗药物。
Clinical research progress on RRx-001
doi: 10.12206/j.issn.2097-2024.202402028
- Received Date: 2024-02-23
- Rev Recd Date: 2024-03-29
-
Key words:
- RRx-001 /
- tumor immunology /
- review /
- clinical trials
Abstract: It is difficult to treat malignant tumors, neurodegenerative diseases, and vascular diseases. For pathogenesis complexity of these diseases, researchers have focused on finding more drugs with high efficacy and low side effects. As a potential first-in-class drug, RRx-001 is expected to be an important first-line drug in tumor immunology, radiosensitizer and radio protecter. Currently, RRx-001 entered phase III clinical trials. The data of the phase II clinical trials demonstrated its safety and effectivity as a single agent and in combination with first-line clinical drugs. The novel mechanisms of RRx-001 and the result of main clinical trials were summarized, which could be valuable to further optimization and clinical application.
| Citation: | GONG Yangyang, LOU Chunyang, ZHANG Huojun, MIAO Zhenyuan. Clinical research progress on RRx-001[J]. Journal of Pharmaceutical Practice and Service. doi: 10.12206/j.issn.2097-2024.202402028 |







 DownLoad:
DownLoad: