-
外周神经系统(PNS)是中枢神经系统发出,导向人体各部分的神经,也称周围神经系统。外周神经的主要成分是神经纤维,包括传入神经纤维和传出神经纤维。外周神经损伤约占所有创伤的2.8%[1],可导致患者的感觉与运动功能发生障碍。外周神经损伤后机体自身有一定的再生能力但修复速度很慢,因此,借助药物途径促进外周神经再生修复是临床治疗的关键[2-3]。了解与外周神经再生相关的信号通路,有助于外周神经损伤后修复药物的研发。
-
雪旺细胞(Schwann cells,SCs)是PNS的支持细胞,可以分化为PNS的髓鞘,它能增殖,迁移到受损神经区域的远端,对于维持外周神经损伤后再生有着重要作用。外周神经损伤后,外周神经系统中的成熟神经元也可以通过增强内在的生长能力来再生轴突。以下主要介绍这两类细胞中与外周神经再生相关的信号通路。
-
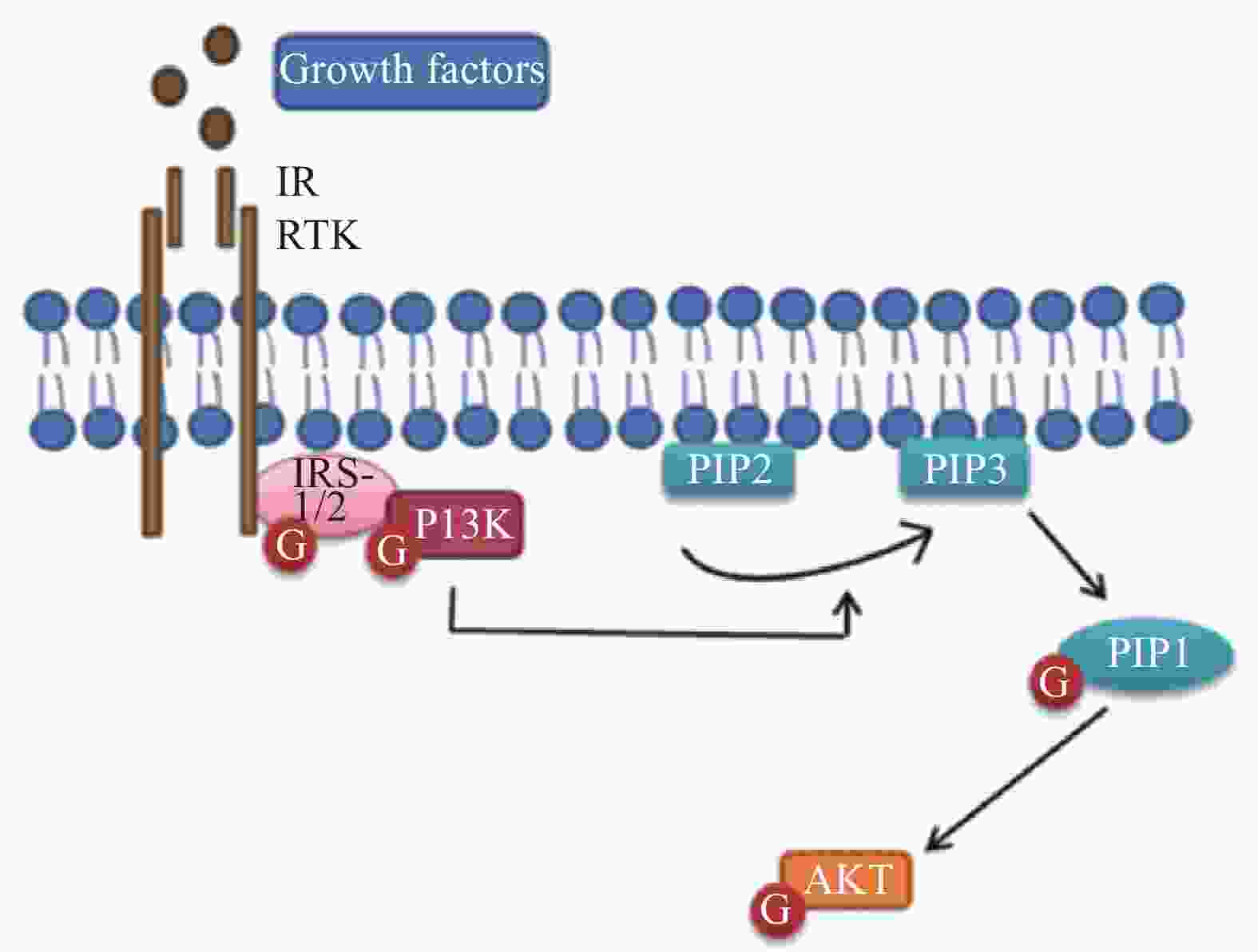
蛋白激酶B(Akt)被认为是髓鞘形成过程中磷酸肌醇3激酶(PI3K)的主要效应物,Akt的激活增加了髓磷脂蛋白的表达,包括与髓鞘再生相关的髓磷脂碱性蛋白(MBP)和髓鞘蛋白(MPZ)的表达。有研究证明,用LY294002(PI3K活性抑制剂)抑制PI3K/Akt途径可显著减弱SCs的迁移[4-5]。此外,该信号通路的抑制也明显降低了SCs中增殖细胞核抗原(PCNA)的合成[6]。这些发现表明,PI3K/Akt途径参与了外周神经损伤后的修复过程,相关的信号通路见图1。
-
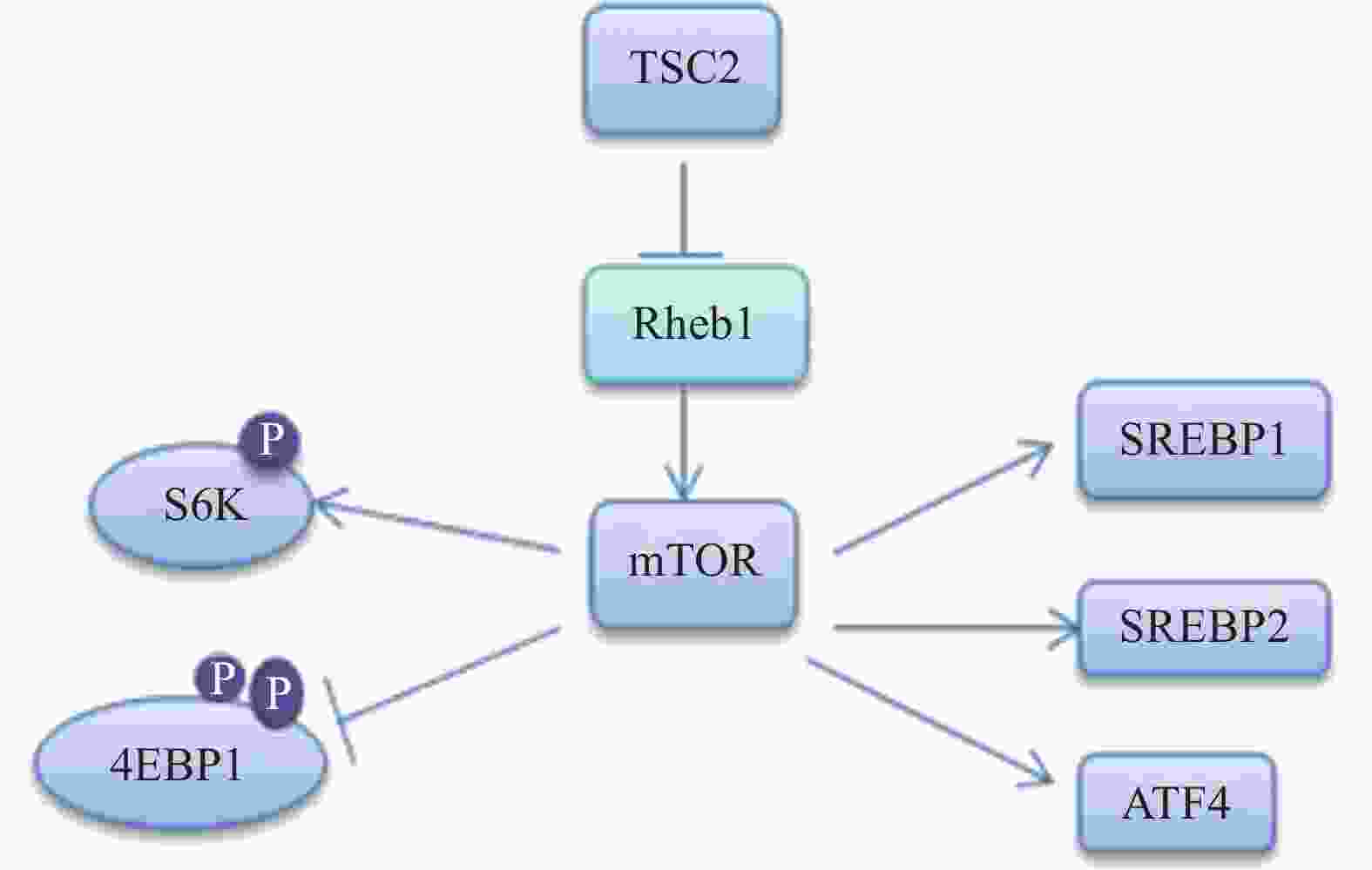
髓磷脂的形成需要合成大量的脂质,尤其是胆固醇。雷帕霉素靶蛋白(mTOR)包含两个核蛋白(mTORC1和mTORC2)。在SCs中,mTORC1通过甾醇调节元件结合转录因子(SREBP)1和2调节脂质的合成[7-8],其中,SREBP1调节脂肪酸和甘油三酰的合成,SREBP2主要是调节胆固醇合成[9],相关的信号通路见图2。
-
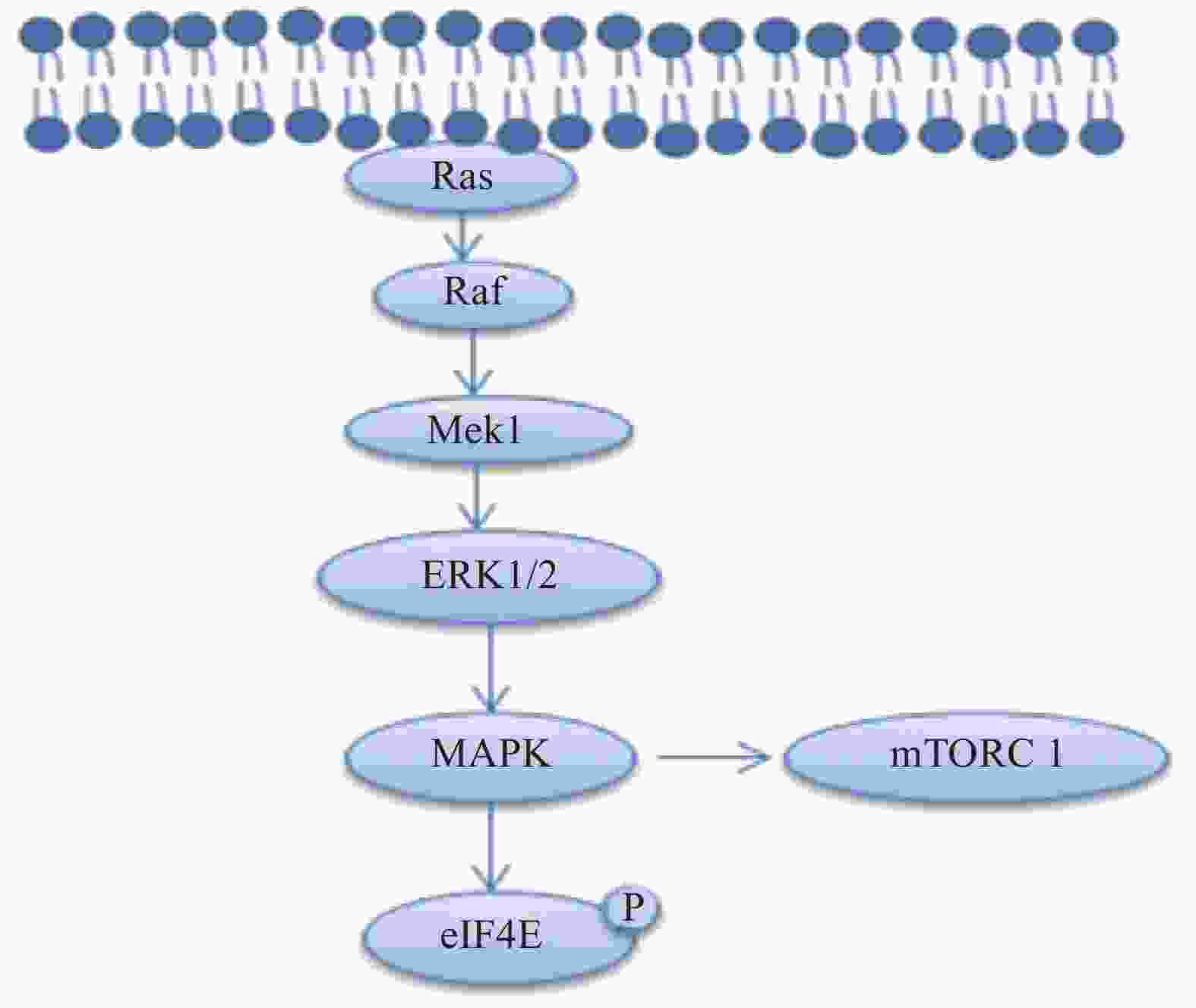
丝裂原活化蛋白激酶激酶1(MAP kinase kinase1, Mek1)通过磷酸化细胞外信号调节蛋白激酶(extracellular signal-regulated kinases,ERK1/2)激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)的信号传导,MAPK信号传导通过磷酸化eIF4E,S6K和4EBP1蛋白,增强雪旺细胞中的髓磷脂蛋白和控制脂质生物合成的酶的合成[10-11],相关的信号通路见图3。
-
神经调节蛋白1(NRG1)刺激Ca2+内流,细胞内Ca2+水平的持续增加激活细胞质中的钙调神经磷酸酶,使活化的T细胞核因子(nuclear factor of activated T-cells,NFATc)蛋白去磷酸化,进入细胞核并组装成 NFAT 转录复合物。钙调神经磷酸酶/NFAT信号传导通过两个途径调节雪旺细胞的发育:一是通过作用于神经调节蛋白和酪氨酸激酶受体(ErbB)的下游,在髓鞘前期形成阶段直接激活转录激活因子(Krox20),进而促进髓鞘基因的表达。另一种是通过在髓鞘形成阶段激活编码髓鞘结构蛋白的基因,如 P0[12],相关的信号通路见图4。
-
NRG1是神经元和神经胶质细胞存活、增殖、分化和迁移所必需的一系列生长因子之一[13-14],其中NRG1的β形式(NRGβ1)可以通过加速外周神经损伤后的SCs迁移来促进神经再生。NRGβ1先是与ErbB2/3受体结合,随后促进黏着斑激酶(focal adhesion kinase, FAK)磷酸化并激活与迁移活性相关的下游信号的转导[15-16],SCs的迁移对于外周神经损伤后的再生至关重要。
-
核转录因子(NF-κB)可能在正常生理条件下正调控Krox-20的表达,Krox20 是对PNS髓鞘形成至关重要的转录因子,在外周神经髓鞘形成过程中,Krox-20部分地调节胆固醇/脂质生物合成基因的表达。有研究表明,Krox-20和SREBP的反式激活剂可协同激活许多SREBP靶基因的启动子,从而调节髓鞘的形成[17],相关的信号通路见图5。
-
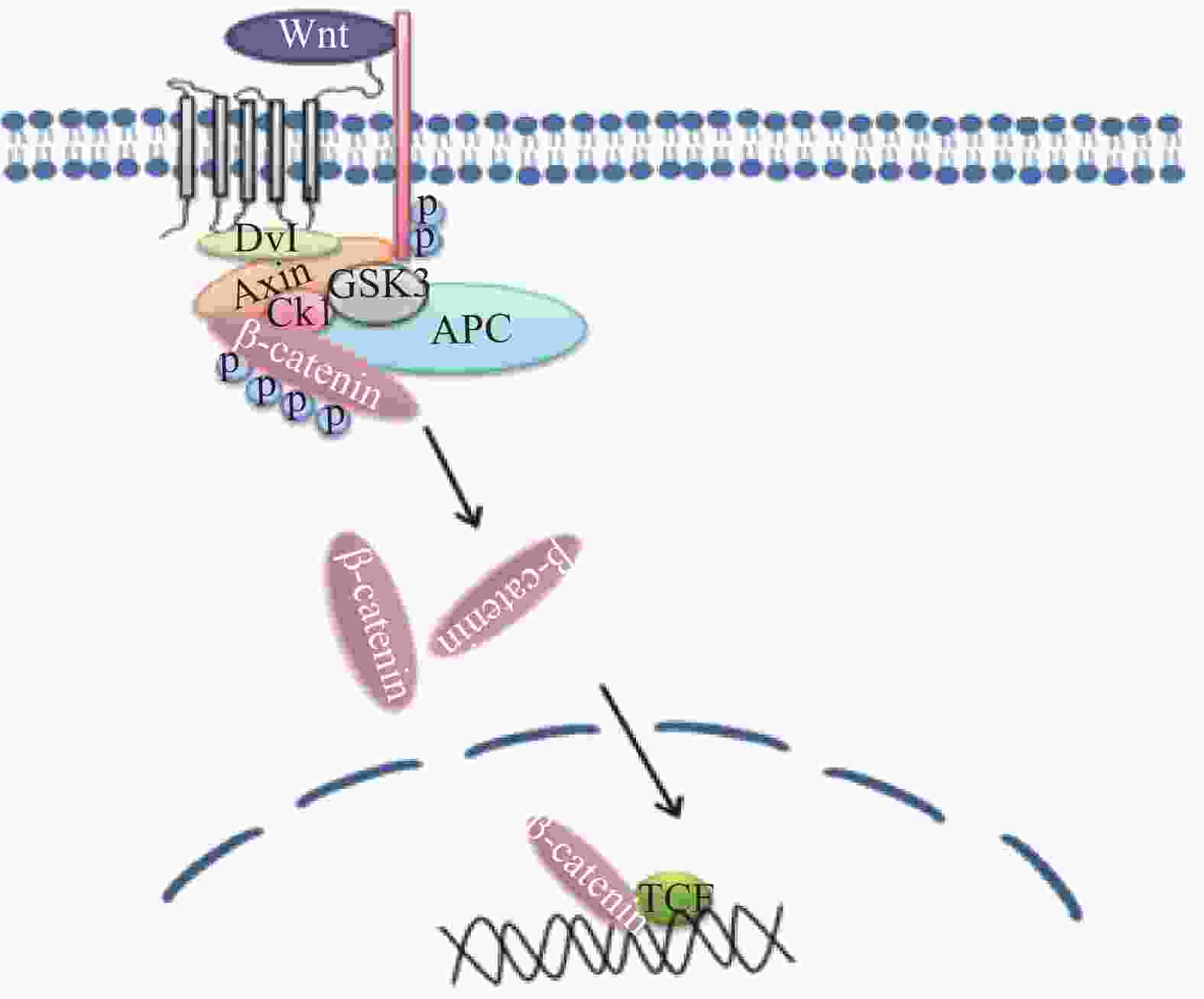
Wnt/β-catenin途径参与雪旺细胞髓磷脂基因启动子活性的调控,促进雪旺细胞中髓磷脂蛋白基因的表达。在跨膜受体(frizzled, FZD)蛋白家族接收Wnt信号后,可通过下游蛋白激酶的磷酸化作用抑制β-catenin的降解活性,随后细胞质中积累高水平的β-catenin蛋白易位进入细胞核,与转录因子(T cell factor/lymphoid enhancer factor, TCF/LEF)形成复合物,并激活与细胞存活、增殖和分化相关的目标基因[18]。有研究发现抑制Wnt/β-catenin信号传导途径,将抑制雪旺细胞的增殖[19],相关的信号通路见图6。
-
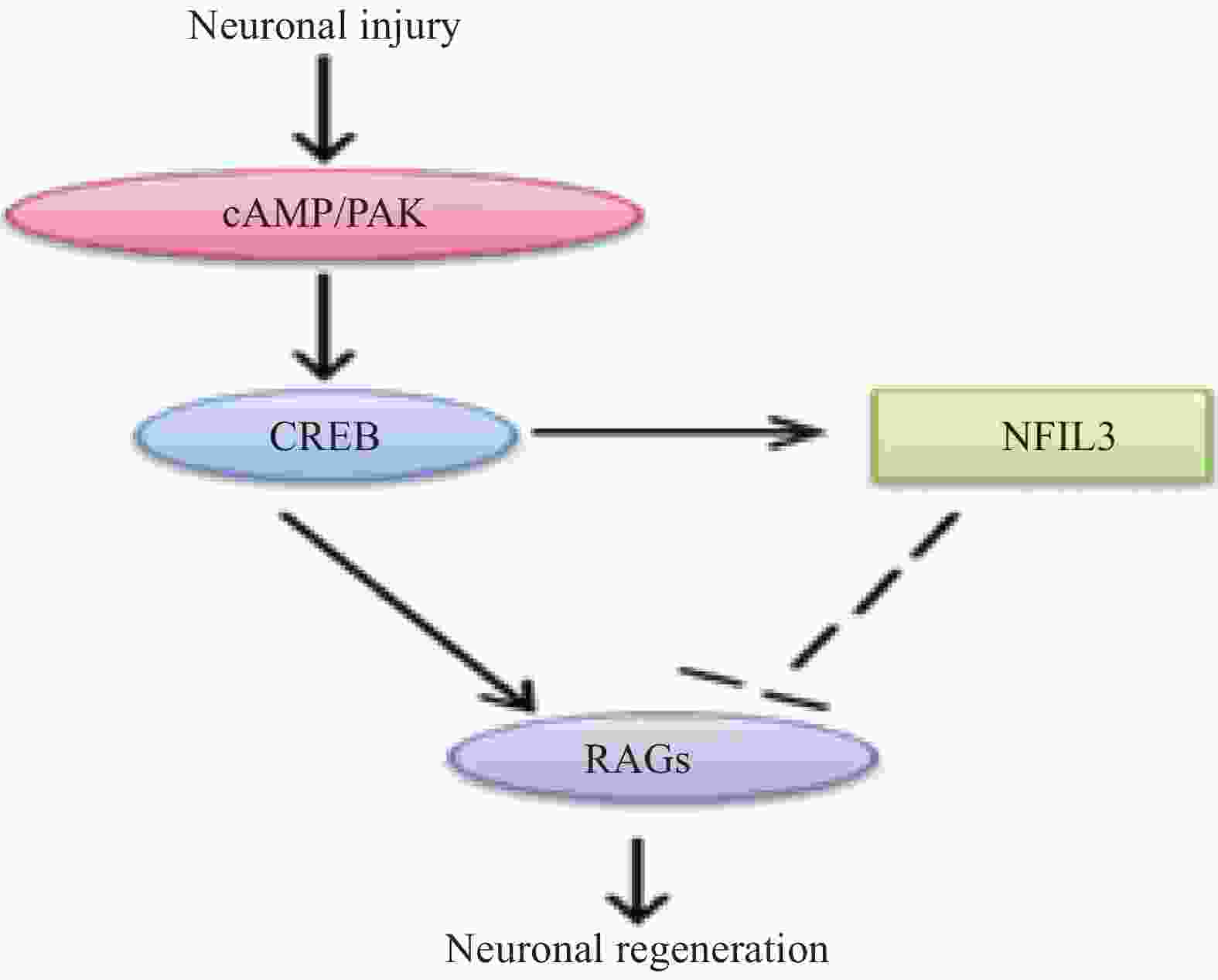
外周损伤后,钙依赖性腺苷酸环化酶产生的cAMP影响cAMP反应元件结合蛋白1 (CREB1)的活性,并调节靶基因的表达,进而影响神经元的生长。另外,在外周神经损伤后,cAMP 信号通路也能促进PAK等促再生信号通路的激活[20],相关的信号通路见图7。
-
在神经元损伤后,DLK诱导下游应激信号,包括磷酸化的c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)逆行向核传播,导致c-Jun磷酸化[21],进而促进损伤后的轴突再生[22]。最近的研究揭示了DLK/JNK途径激活的机制[23],但仍未确定直接影响DLK上游的因素,相关的信号通路见图8。
-
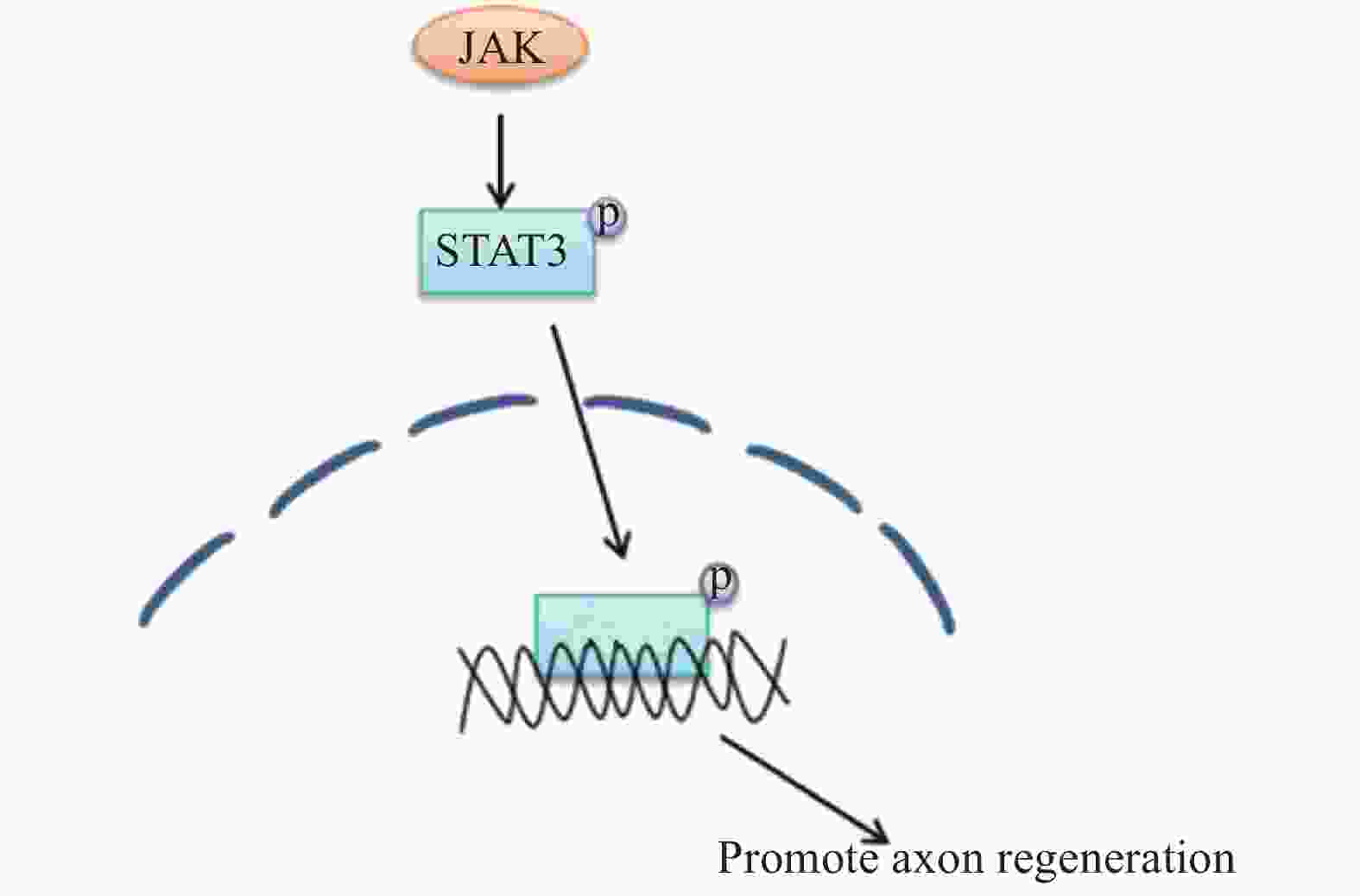
在外周神经损伤后,信号转导与转录激活因子3(STAT3)被酪氨酸激酶(JAK)磷酸化[24],磷酸化的STAT3逆行转移到细胞核中以激活再生程序,进而调节神经元的生长。因此,JAK/STAT3信号通路在增强外周神经损伤后神经元的生长能力方面有着很重要的作用[25-26],相关的信号通路见图8。
-
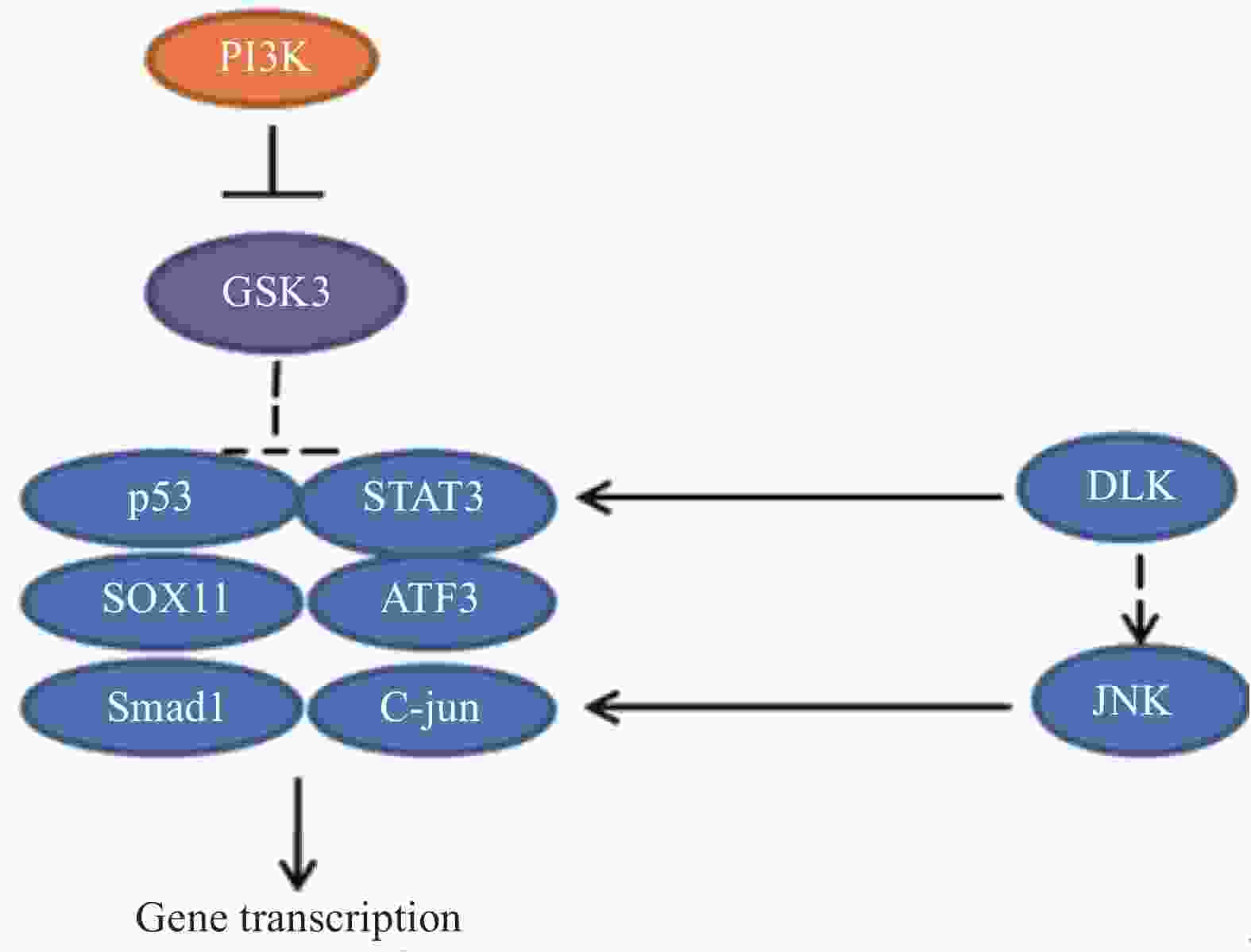
外周神经损伤激活了PI3K信号途径,导致糖原合酶激酶3(GSK3)失活,通过控制 GSK3 在胞体中的活性可以增强轴突生长能力。研究发现GSK3 是轴突再生的主要调节因子,可以在胞体和远端轴突中协调再生反应。一方面,通过抑制细胞体中的 GSK3 刺激转录依赖性轴突再生程序,增强了轴突内在生长能力。另一方面,一定程度上抑制生长锥中GSK3 活性,可以促进局部细胞骨架组装。然而,失活的程度应该被控制,较大程度抑制GSK3活性,会急剧阻断轴突生长[27-28]。相关的信号通路见图9。
-
外周神经损伤在临床上较为常见, 给患者的健康带来了巨大的损害。研究外周神经损伤的类型及其相关信号通路的调控机制,为促进外周神经损伤后再生提供理论依据。目前对信号通路进行的研究提示,未来以信号通路为治疗方向可以解决外周神经损伤后再生的一些复杂过程。
Signal pathways related to regeneration after peripheral nerve injury
-
摘要: 由于神经元损伤后的自身再修复能力有限,临床上对于神经损伤一直缺乏有效的治疗手段,因此,寻找促进神经损伤后修复的药物,以及探索其相关作用机制始终是神经科学领域的研究热点。有研究表明,在外周神经组织中,神经元细胞和雪旺细胞内的信号通路对于外周神经损伤后再生有着重要作用。本文综述了雪旺细胞和神经元内与外周神经再生相关的信号通路以及与外周神经损伤相关的疾病,为进一步探索外周神经损伤后再生机制提供依据。Abstract: Due to the limited self-repair ability of neurons after injury, there has been a lack of effective treatments for nerve injury in clinical practice. So, to find drugs that promote the repair after nerve injury has become a research hotspot. Schwann cells and neurons play an important role in regeneration of the peripheral nerves after injury. This review summarizes the classification of peripheral nerve injury, the signaling pathways related to peripheral nerve regeneration in Schwann cells and neurons as well as diseases related to peripheral nerve injury, and provides a basis for further exploration of the regeneration mechanism after peripheral nerve injury.
-
Key words:
- peripheral nerve injury /
- regeneration /
- Schwann cell /
- neuron /
- signal pathway
-
[1] MA F K, XIAO Z F, CHEN B, et al. Linear ordered collagen scaffolds loaded with collagen-binding basic fibroblast growth factor facilitate recovery of sciatic nerve injury in rats[J]. Tissue Eng Part A,2014,20(7-8):1253-1262. doi: 10.1089/ten.tea.2013.0158 [2] HÖKE A. A (heat) shock to the system promotes peripheral nerve regeneration[J]. J Clin Invest,2011,121(11):4231-4234. doi: 10.1172/JCI59320 [3] AMNIATTALAB A, MOHAMMADI R. Functional, histopathological and immunohistichemical assessments of cyclosporine A on sciatic nerve regeneration using allografts: a rat sciatic nerve model[J]. Bull Emerg Trauma,2017,5(3):152-159. [4] LV J, SUN X L, MA J X, et al. Netrin-1 induces the migration of Schwann cells via p38 MAPK and PI3K-Akt signaling pathway mediated by the UNC5B receptor[J]. Biochem Biophys Res Commun,2015,464(1):263-268. doi: 10.1016/j.bbrc.2015.06.140 [5] DOMÈNECH-ESTÉVEZ E, BALOUI H, MENG X S, et al. Akt regulates axon wrapping and myelin sheath thickness in the PNS[J]. J Neurosci,2016,36(16):4506-4521. doi: 10.1523/JNEUROSCI.3521-15.2016 [6] HE B, LIU S Q, CHEN Q, et al. Carboxymethylated chitosan stimulates proliferation of Schwann cells in vitro via the activation of the ERK and Akt signaling pathways[J]. Eur J Pharmacol,2011,667(1-3):195-201. doi: 10.1016/j.ejphar.2011.06.001 [7] CHRAST R, SAHER G, NAVE K A, et al. Lipid metabolism in myelinating glial cells: lessons from human inherited disorders and mouse models[J]. J Lipid Res,2011,52(3):419-434. doi: 10.1194/jlr.R009761 [8] LEWIS C A, GRIFFITHS B, SANTOS C R, et al. Regulation of the SREBP transcription factors by mTORC1[J]. Biochem Soc Trans,2011,39(2):495-499. doi: 10.1042/BST0390495 [9] CARON A, RICHARD D, LAPLANTE M. The roles of mTOR complexes in lipid metabolism[J]. Annu Rev Nutr,2015,35:321-348. doi: 10.1146/annurev-nutr-071714-034355 [10] TOPISIROVIC I, SONENBERG N. mRNA translation and energy metabolism in cancer: the role of the MAPK and mTORC1 pathways[J]. Cold Spring Harb Symp Quant Biol,2011,76:355-367. doi: 10.1101/sqb.2011.76.010785 [11] AGTHONG S, KAEWSEMA A, TANOMSRIDEJCHAI N, et al. Activation of MAPK ERK in peripheral nerve after injury[J]. BMC Neurosci,2006,7:45. doi: 10.1186/1471-2202-7-45 [12] KAO S C, WU H, XIE J M, et al. Calcineurin/NFAT signaling is required for neuregulin-regulated Schwann cell differentiation[J]. Science,2009,323(5914):651-654. doi: 10.1126/science.1166562 [13] LEMKE G. Neuregulins in development[J]. Mol Cell Neurosci,1996,7(4):247-262. doi: 10.1006/mcne.1996.0019 [14] MEI L, XIONG W C. Neuregulin 1 in neural development, synaptic plasticity and schizophrenia[J]. Nat Rev Neurosci,2008,9(6):437-452. doi: 10.1038/nrn2392 [15] SCHLOSSHAUER B, MÜLLER E, SCHRÖDER B, et al. Rat Schwann cells in bioresorbable nerve guides to promote and accelerate axonal regeneration[J]. Brain Res,2003,963(1-2):321-326. doi: 10.1016/S0006-8993(02)03930-6 [16] TSENG C Y, HU G L, AMBRON R T, et al. Histologic analysis of Schwann cell migration and peripheral nerve regeneration in the autogenous venous nerve conduit (AVNC)[J]. J Reconstr Microsurg,2003,19(5):331-340. doi: 10.1055/s-2003-42502 [17] LEBLANC S E, SRINIVASAN R, FERRI C, et al. Regulation of cholesterol/lipid biosynthetic genes by Egr2/Krox20 during peripheral nerve myelination[J]. J Neurochem,2005,93(3):737-748. doi: 10.1111/j.1471-4159.2005.03056.x [18] NUSSE R. WNT targets. Repression and activation[J]. Trends Genet,1999,15(1):1-3. doi: 10.1016/S0168-9525(98)01634-5 [19] ZHOU X, ZHAN Z Y, TANG C G, et al. Silencing Celsr2 inhibits the proliferation and migration of Schwann cells through suppressing the Wnt/β-catenin signaling pathway[J]. Biochem Biophys Res Commun,2020,533(4):623-630. doi: 10.1016/j.bbrc.2020.09.015 [20] YU J, WANG S J, WU C, et al. Deep sequencing reveals the significant involvement of cAMP-related signaling pathways following sciatic nerve crush[J]. Neurochem Res,2017,42(12):3603-3611. doi: 10.1007/s11064-017-2409-3 [21] FERNANDES K A, HARDER J M, FORNAROLA L B, et al. JNK2 and JNK3 are major regulators of axonal injury-induced retinal ganglion cell death[J]. Neurobiol Dis,2012,46(2):393-401. doi: 10.1016/j.nbd.2012.02.003 [22] NIX P, HISAMOTO N, MATSUMOTO K, et al. Axon regeneration requires coordinate activation of p38 and JNK MAPK pathways[J]. Proc Natl Acad Sci USA,2011,108(26):10738-10743. doi: 10.1073/pnas.1104830108 [23] SIMON D J, PITTS J, HERTZ N T, et al. Axon degeneration gated by retrograde activation of somatic pro-apoptotic signaling[J]. Cell,2016,164(5):1031-1045. doi: 10.1016/j.cell.2016.01.032 [24] YAMAUCHI K, OSUKA K, TAKAYASU M, et al. Activation of JAK/STAT signalling in neurons following spinal cord injury in mice[J]. J Neurochem,2006,96(4):1060-1070. doi: 10.1111/j.1471-4159.2005.03559.x [25] MOLET J, MAUBORGNE A, DIALLO M, et al. Microglial Janus kinase/signal transduction and activator of transcription 3 pathway activity directly impacts astrocyte and spinal neuron characteristics[J]. J Neurochem,2016,136(1):133-147. doi: 10.1111/jnc.13375 [26] QIU J, CAFFERTY W B, MCMAHON S B, et al. Conditioning injury-induced spinal axon regeneration requires signal transducer and activator of transcription 3 activation[J]. J Neurosci,2005,25(7):1645-1653. doi: 10.1523/JNEUROSCI.3269-04.2005 [27] HUR E M, SAIJILAFU, LEE B D, et al. GSK3 controls axon growth via CLASP-mediated regulation of growth cone microtubules[J]. Genes Dev,2011,25(18):1968-1981. doi: 10.1101/gad.17015911 [28] HUR E M, SAIJILAFU, ZHOU F Q. Growing the growth cone: remodeling the cytoskeleton to promote axon regeneration[J]. Trends Neurosci,2012,35(3):164-174. doi: 10.1016/j.tins.2011.11.002 [29] EBENEZER G J, O'DONNELL R, HAUER P, et al. Impaired neurovascular repair in subjects with diabetes following experimental intracutaneous axotomy[J]. Brain,2011,134(Pt 6):1853-1863. [30] WANG L, CHOPP M, SZALAD A, et al. Thymosin β4 promotes the recovery of peripheral neuropathy in type II diabetic mice[J]. Neurobiol Dis,2012,48(3):546-555. doi: 10.1016/j.nbd.2012.08.002 -




 下载:
下载: