-
结直肠癌(CC)发生率占所有肿瘤发生率的第3位,病死率仅次于肺癌,属于下消化系统恶性肿瘤[1]。目前,结肠癌的治疗主要采用多学科的综合治疗模式[2]。包括5-氟尿嘧啶、奥沙利铂与贝伐单抗等的组合[3-5]。然而,这些常规的化疗方案可能造成患者不耐受以及骨髓等的抑制。因此,寻找新的有效的药物对于现今结肠癌治疗具有重要意义。
紫杉醇(PTX)是一种广谱抗肿瘤活性的化疗药物,来源于太平洋紫杉树皮(红豆杉)[6,7]。临床试验结果表明,PTX在几种癌症治疗中有较好的活性,包括:乳腺癌、皮肤恶性肿瘤、非小细胞肺癌以及卵巢癌等[8,9]。然而,由于结肠癌中过表达的P糖蛋白(P-gp)引起了多重耐药性(MDR),导致PTX对结肠癌临床治疗效果不甚理想[10]。此外,PTX生物半衰期短,其一代药物Taxol以聚氧乙烯蓖麻油为表面活性剂,具有引起患者过敏反应的风险,从而限制了PTX临床疗效的发挥[11]。因此,迫切需要对PTX进行结构改进与剂型设计,改善其药物递送效率,提高生物利用度[12]。
脂肪酸作为生物膜和生物信号分子的重要成分,参与了细胞能量产生、代谢的过程。由于肿瘤细胞增殖快速,需要大量的细胞合成物质和能量的供应,因此,患有恶性肿瘤的患者其脂肪酸合成也较快。其中,肿瘤细胞因为迅速繁殖对含有16个碳原子的棕榈酸(PA)为主的脂肪酸需求量大,因此利用PA进行修饰有利于药物被肿瘤细胞摄取[13,14]。再者,研究发现,由PA修饰的紫杉醇,能降低其对P-gp的亲和力,避免了PTX进入肿瘤细胞后的外排,提高紫杉醇对于结肠癌治疗的有效性[15]。
此外,作为一种成熟的药物载体,脂质体(Lip)在体内可被降解、无毒性和免疫原性,能够增强药物在体内的稳定性,从而可以减少给药剂量、降低毒副作用,并且其表面具有可修饰性[16],例如,采用聚乙二醇磷脂(PEG-DSPE)修饰的脂质体因其空间位阻效应可延长其在体内的循环时间[17]。同时结合肿瘤组织的增强通透性和滞留效应(EPR),使药物通过被动靶向递送到靶部位[18]。
结合以上背景,本研究首先通过棕榈酸酯与紫杉醇共价键结合构建紫杉醇棕榈酸酯(PTX-PA),并建立基于高效液相(HPLC)的定量分析方法,旨在降低其对P-gp的亲和力,避免PTX进入肿瘤细胞后被外排,从而改善紫杉醇毒性较大、生物半衰期短、成药性差等问题,提高紫杉醇对于结肠癌治疗的有效性。其次,我们将PTX-PA包载进PEG修饰的脂质体构建紫杉醇棕榈酸酯的脂质体(PTX-PA/Lip),以实现其长循环,增加PTX的疗效、降低其毒副作用。最后,采用工艺筛选与单因素处方优化的方法制备最佳PTX-PA/Lip,为PTX-PA的制剂学研究奠定基础[19]。
-
高效液相色谱仪(安捷伦科技有限公司,美国);十万分之一电子天平(MS105DU,梅特勒托利多公司,瑞士);超滤管(30 kD,密理博公司,美国);低温高速离心机(Eppendorf-200,艾本德公司,德国);高压均质机(NanoGenizer,美国);Zeta-sizer Nano粒度仪(Nano-ZS,马尔文公司,英国)。
-
紫杉醇购自江苏红豆杉生物科技股份有限公司,纯度≥98%;棕榈酸购自中国医药集团上海化学试剂公司,纯度≥99%;蛋黄卵磷脂(PC98-T)、胆固醇、DSPE-PEG 2000均购自上海艾韦特医药科技有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)、4-二甲氨基吡啶(DMAP)、乙酸乙酯、二氯甲烷、无水乙醇、石油醚均购自中国医药集团上海化学试剂公司,分析纯;乙酸乙酯、PC-98T蛋黄卵磷脂(上海艾韦特医药科技有限公司);胆固醇(上海艾韦特医药科技有限公司);二氯甲烷、DSPE-PEG 2000(上海艾韦特医药科技有限公司);无水乙醇、石油醚购自中国医药集团上海化学试剂公司;甲醇购自美国默克公司,色谱纯。
-
PTX-PA前药由PTX与PA发生酯化反应合成,其合成过程如下[20,21]:精密称取PTX 0.85 g,加入无水二氯甲烷 30 ml。依次加入精密称取的EDC 0.19 g、DMAP 0.15 g和PA 0.31 g,在氮气保护下室温搅拌反应12 h。反应结束后,用5%柠檬酸水溶液、饱和食盐水洗涤3遍,旋蒸除去有机溶剂,即得PTX-PA粗品。采用石油醚和乙酸乙酯通过柱层析法对PTX-PA进行分离、纯化。洗脱完成后,将产物旋蒸去除有机溶剂,得到的白色固体即为PTX-PA,样品经核磁共振氢谱、碳谱确定为PTX-PA,样品纯度98.5%。
-
精密取适量的PTX-PA粉末采用甲醇溶解,定容,通过全波长(190~400 nm)扫描测定其紫外最大吸收波长λmax。
本实验采用Agilent Eclipse plus C18色谱柱(4.6 mm×250 mm,5 μm),流动相采用甲醇/水(95∶5,V/V),进样量20 μl,流速1.0 ml/min。
-
空白溶液的配制:精密量取不含药的空白脂质体1 ml加入适量的甲醇溶液,超声,用甲醇定容至25 ml,0.45 μm的微孔滤膜过滤,滤液即为空白溶液。
对照品溶液的配制:精密称取PTX-PA 粉末50 mg,用甲醇溶解并定容至50 ml,过滤,即得PTX-PA对照品储备溶液。
供试品溶液的配制:精密量取1 ml PTX-PA/Lip,加入适量甲醇溶解、超声破乳、定容至25 ml,过滤,滤液即为供试品溶液。
-
分别取适量空白溶液、对照品溶液和供试品溶液,用流动相稀释至适当的浓度后,按照“色谱条件”中建立的高相液相参数进行进样分析。
-
精密量取适量PTX-PA对照品储备液依次稀释为浓度1、5、10、25、50、100 μg/ml的PTX-PA系列浓度。按照“色谱条件”中的高效液相参数进行进样分析(n=5),并记录不同浓度的PTX-PA的色谱峰面积。以浓度(C)为X轴、峰面积(A)为Y轴进行回归。
-
日内精密度考察:精密吸取3种不同浓度(5、25、100 μg/ml)的 PTX-PA对照品溶液,对同一浓度溶液连续进样5次,每次10 µl,按照“2.2.1”项下色谱条件进行分析,记录各个浓度吸收峰面积。
日间精密度考察:精密吸取3种不同浓度(5、25、100 μg/ml)的 PTX-PA对照品溶液,对同一浓度溶液连续进样5 d,每天1次,每次10 µl,按照“2.2.1”项下色谱条件进行分析,记录第0、1、2、3、4天的吸收峰面积,计算样品浓度,考察仪器的日间精密度。
-
空白脂质体超声破乳,配制成3种不同浓度(1、10、100 μg/ml),连续进样5次,每次10 µl,记录各吸收峰面积,考察重复性。精密吸取浓度为50 μg/ml的 PTX-PA供试品溶液,于0、2、4、6、8、12、24 h进样测定,每次进样10 µl,记录各紫外吸收峰面积,考察样品的稳定性。
-
空白脂质体超声破乳,分别加入浓度为1 mg/ml的PTX-PA溶液0.5、2.5、5 ml,采用流动相稀释定容至100 ml,分别进样,并结合PTX-PA的理论浓度(5、25、50 μg/ml)进行加样回收率的计算与分析。
-
(1) 薄膜分散法
精密称取PTX-PA 20 mg、蛋黄卵磷脂350 mg、胆固醇5 mg和DSPE-PEG2000 25 mg,加入适量的二氯甲烷使其充分溶解。然后旋蒸除去有机溶剂,使圆底烧瓶底部形成一层均匀透明的薄膜,再加入预热至同等温度的重蒸水10 ml,震荡、水化,得PTX-PA/Lip粗品。将得到的粗品经探头超声(1 min)、过滤处理后,即得PTX-PA/Lip纳米给药系统[19]。
(2) 高压均质法
将薄膜分散法制得的PTX-PA/Lip粗品置于高压均质机中,经3次均质处理后(均质压力12 000 psi),即得PTX-PA/Lip纳米给药系统[23,24]。
(3)挤出法
将薄膜分散法制得的PTX-PA/Lip粗品置于挤出器中,使分别经过孔径为0.2、0.1、0.05 μm的聚碳酸酯膜,即得PTX-PA/Lip纳米给药系统[25-27]。
-
(1)磷脂种类的选择
采用薄膜分散法考察不同磷脂制备的PTX-PA/Lip,包括:氢化磷脂(HSPC)、蛋黄卵磷脂(PC98-T)、蛋黄磷脂(EPCS)、二棕榈酸磷脂酰胆碱(DPPC),以形态、粒径、包封率为指标进行评价。
(2)磷脂和药物/胆固醇比例的考察
分别以磷脂和药物的质量比(5∶1、10∶1、20∶1、30∶1、40∶1)/PC98-T和胆固醇的质量比(4∶0.05、4∶0.1、4∶0.2、4∶0.3、4∶0.4、4∶0.5)为自变量制备PTX-PA/Lip脂质体,考察不同处方的粒径、粒径分布、包封率,确定处方中磷脂与药物/胆固醇的质量比。
(3)药物和DSPE-PEG2000比例的考察
以PTX-PA和DSPE-PEG2000的质量比(1∶0.5、1∶1、1∶1.5、1∶2、1∶2.5)为自变量,考察其用量对制剂的外观澄明度、纳米粒子大小等是否产生影响。
(4)薄膜蒸发法的温度考察
将旋转蒸发仪温度分别设置为35、40、45、50、55 ℃,考察薄膜蒸发过程中温度对PTX-PA/Lip形态、粒径、包封率等的影响。
(5)探头超声时间的考察
以探头超声PTX-PA/Lip粗品的时间为自变量,考察不同超声时间(30、60、90、180、240 s)对PTX-PA/Lip纳米制剂形态、纳米粒子大小的影响。
-
数据采用IBM SPSS Statistics 27.0进行统计分析,采用单因素方差分析ANOVA进行显著性检验与评价。
-
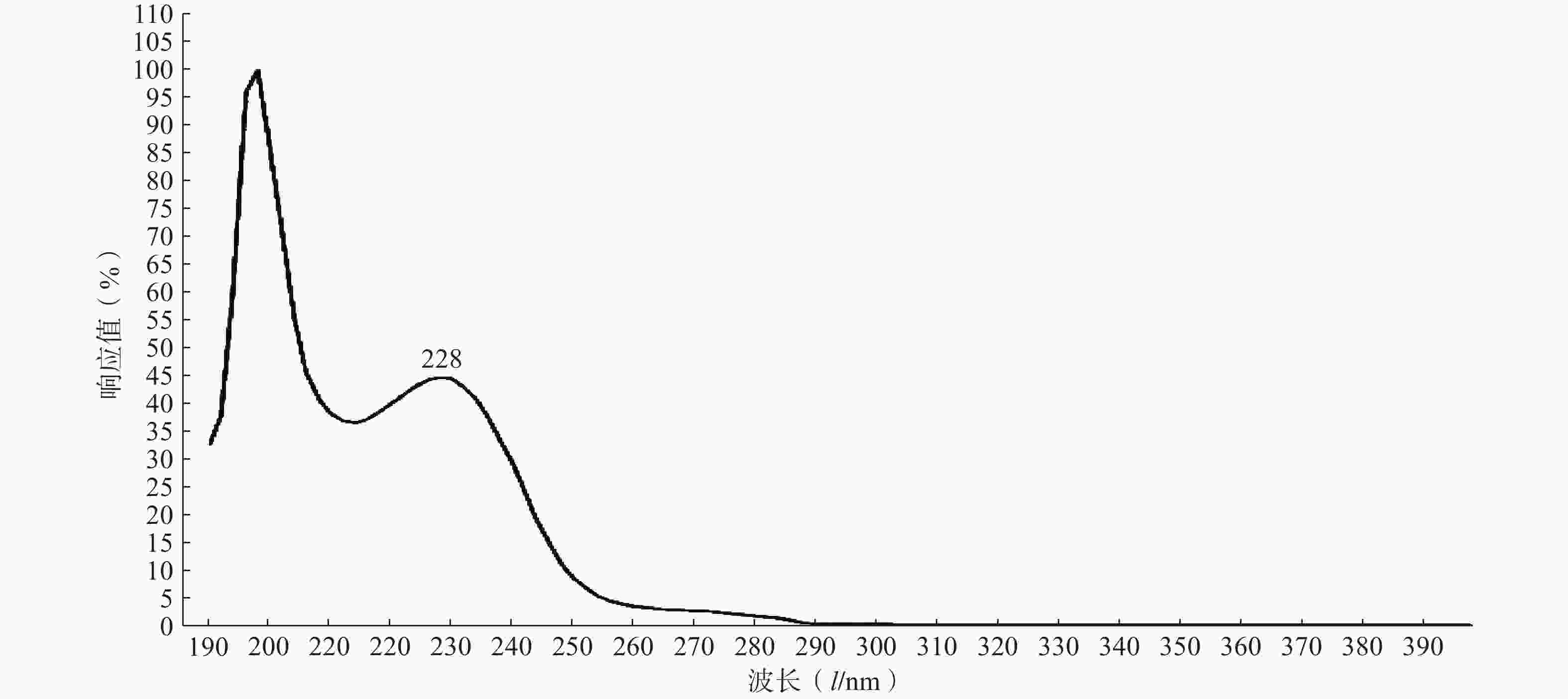
实验结果如图1所示,选用PTX-PA的最大吸收波长为228 nm为测定波长。
-
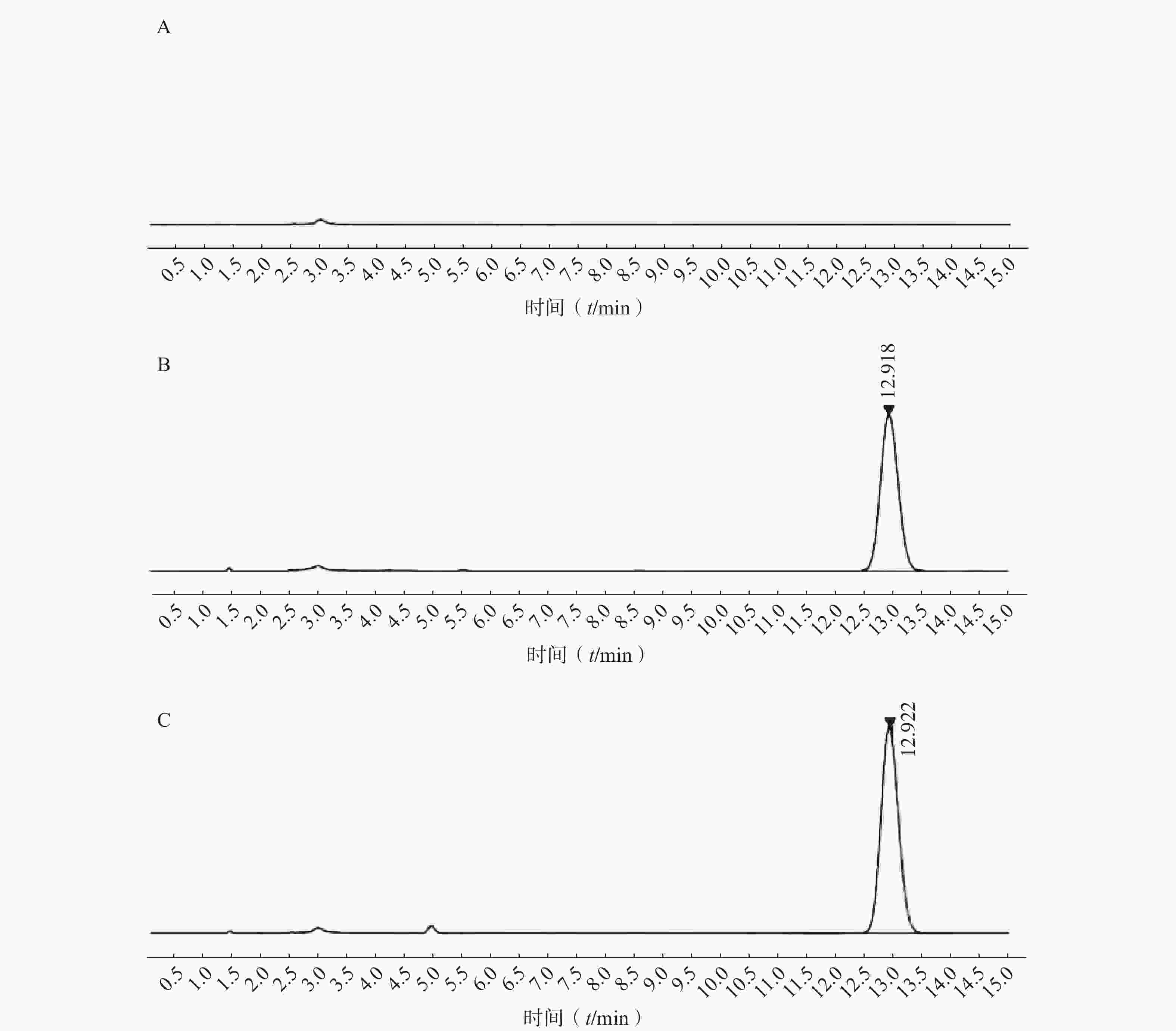
如图2所示,本章所建立的色谱条件对PTX-PA检测具有专属性,溶剂以及样品中的辅料对PTX-PA的检测不产生干扰。
-
按照2.2.4方法进行回归,得PTX-PA的吸收峰面积-浓度在1~100 μg/ml的浓度范围内为线性方程:A=15.14 C+10.81(r=0.999 8)。
-
按照“2.2.5”方法进行精密度考察,结果如表1所示,日内与日间精密度各时间点峰面积的RSD均小于3%,表明仪器的日内与日间精密度符合测定要求。
表 1 PTX-PA的精密度考察结果(n=5)
理论浓度(μg/ml) 实测浓度(μg/ml) RSD(%) 日内 5.00 4.98±0.13 2.65 25.00 25.30±0.55 2.18 100.00 99.66±1.11 1.11 日间 5.00 4.99±0.11 2.31 25.00 25.50±0.57 2.23 100.00 100.65±1.38 1.37 -
按照2.2.6方法进行研究,精密吸取3种不同浓度的 PTX-PA溶液,连续进样5次并记录各吸收峰面积。各浓度峰面积RSD均<3%,表明仪器符合检测检测要求。此外,稳定性结果表明,样品溶液峰面积的RSD为0.81%,表明制备的PTX-PA溶液在24 h内稳定。
-
按照2.2.7方法计算加样回收率,结果如表2所示:低、中高3个浓度的加样回收率均在95%~105%之间,且RSD分别为2.39%、1.80%、2.34%,表明本实验建立的高效液相色谱定量方法可用于PTX-PA的含量测定。
表 2 PTX-PA的加样回收率测试结果(n=5)
理论浓度(μg/ml) 检测浓度(μg/ml) 回收率(%) RSD(%) 回收率 5 5.02±0.12 100.4 2.39 25 24.98±0.45 99.92 1.80 50 50.01±1.17 100.02 2.34 -
采用不同方法制备的PTX-PA/Lip表征结果如表3所示,按照2.4方法进行统计学分析,3种制备方法的包封率无显著性差异,但采用薄膜分散法制备的PTX-PA/Lip粒径与PDI更小。因此,本研究优选薄膜分散法来构建PTX-PA/Lip。
表 3 3种常规制备方法对PTX-PA/Lip粒径、粒径分布、包封率的影响
制备方法 粒径(l/nm) PDI 包封率(%) 薄膜分散法 76.76±3.39 0.104±0.02 79.38±2.00 高压均值法 125.11±5.32 0.139±0.03 78.87±2.00 挤出法 128.87±4.92 0.239±0.05 81.38±1.11 -
(1)磷脂种类的选择
按照2.3.2(1)制备的PTX-PA/Lip表征结果如表4所示,以PC98-T为膜材制备的纳米给药系统粒径小、外观澄明、粒径分布均匀、包封率较高,因此选择PC98-T作为本研究中的磷脂。
表 4 磷脂种类对脂质体的外观形态、颗粒大小、药物包封率的影响
磷脂种类 外观 粒径(l/nm) PDI 包封率(%) PC98-T 半透明 76.76±3.39 0.104±0.02 79.38±2.00 HSPC 有沉淀 177.86±5.39 0.532±0.08 59.06±1.32 EPCS 半透明 135.12±5.65 0.108±0.03 73.23±1.15 DPPC 有沉淀 158.26±4.11 0.669±0.05 53.27±2.68 (2)磷脂和药物比例的考察
按照2.3.2(2)项下确定处方中药物和磷脂的用量,其结果如表5所示,磷脂PC98-T和药物的质量比大于10时,制备的PTX-PA/Lip外观澄明度、粒子大小、粒径分散系数等参数无显著性差别。随着磷脂浓度不断增加,药物的包封率不断增加,当PC98-T和PTX-PA的质量比为20:1时,脂质体对药物的包封率最高,后期考虑到经济成本,将PC98-T和PTX-PA的质量比定为20:1。
表 5 磷脂和药物质量比对脂质体的外观澄明度、颗粒大小、对药物包封率的影响
磷脂∶药物 外观 粒径(l/nm) PDI 包封率(%) 5∶1 略透明 134.62±2.95 0.364±0.04 58.15±1.73 10∶1 有沉淀 90.29±4.66 0.151±0.04 71.56±1.60 20∶1 半透明 84.58±1.33 0.11±0.02 83.50±0.92 30∶1 半透明 86.06±2.71 0.09±0.05 73.44±4.44 40∶1 有沉淀 88.86±1.91 0.199±0.05 68.37±11.08 (3)磷脂和胆固醇比例的考察
按照2.3.2(2)方法研究,结果如表6所示,随着胆固醇用量增多,制剂变浑浊,粒径增大,载药量显著降低。因此,胆固醇不加入本制剂的处方中。
表 6 磷脂和胆固醇质量比对脂质体外观澄明度、颗粒大小、对药物包封率的影响
磷脂∶胆固醇 外观 粒径(l/nm) PDI 包封率(%) 4∶0.05 半透明 115.37±4.48 0.200±0.07 71.57±1.28 4∶0.1 半透明 160.16±3.15 0.251±0.01 61.08±3.13 4∶0.2 半透明 182.75±2.43 0.217±0.04 54.97±0.95 4∶0.3 乳白色 241.90±12.09 0.697±0.12 54.11±1.64 4∶0.4 乳白色 255.33±8.27 0.700±0.138 48.84±0.78 (4)药物和DSPE-PEG2000比例的考察
按照2.3.2(3)方法研究,其结果如表7所示,DSPE-PEG2000对包封率没有显著性影响,但当DSPE-PEG2000含量不断增加时,纳米粒子的颗粒大小先降低,当药物与DSPE-PEG2000质量比小于1∶1.5时,粒径无显著性变化,因此,药物与DSPE-PEG2000的质量比选择1∶1.5。
表 7 PTX-PA和DSPE-PEG2000的质量比对脂质体外观、粒径、药物包封率的影响
药物∶DSPE-
PEG2000外观 粒径(l/nm) PDI 包封率(%) 2∶1 半透明 82.86±2.15 0.107±0.01 90.48±0.49 1∶1 半透明 78.16±2.05 0.351±0.38 90.41±0.34 1∶1.5 半透明 72.23±2.60 0.110±0.02 89.66±1.25 1∶2 半透明 74.64±1.81 0.140±0.04 90.90±2.93 1∶2.5 半透明 75.38±2.10 0.097±0.04 89.48±0.67 (5)薄膜蒸发法的温度考察
按照2.3.2(4),采用不同温度制备纳米制剂表征结果如表8所示,在筛选的5个温度中,当温度为45 ℃时,脂质体粒径最小、粒径分散性好、包封率最高,因此,本研究选用45 ℃作为薄膜蒸发温度。
表 8 温度对PTX-PA/Lip外观、粒径、包封率的影响
温度(T/ ℃) 外观 粒径(l/nm) PDI 包封率(%) 35 略透明 159.42±2.42 0.545±0.08 54.94±1.85 40 半透明 105.93±6.13 0.269±0.03 73.98±1.60 45 半透明 76.97±2.50 0.105±0.049 91.13±1.45 50 半透明 91.93±2.60 0.181±0.05 80.27±2.13 55 半透明 112.23±6.37 0.233±0.06 74.15±2.12 (6)探头超声时间的考察
按照2.3.2(5)方法进行研究,结果如表9所示:处理时间较短时,纳米粒径较大,颗粒大小分布不均匀;随着超声处理的延长,粒径减小,包封率也提高;超声时间过长反,脂质体结构破坏,导致药物泄露、包封率降低。因此将探头超声处理时间定为90 s。
表 9 超声处理对脂质体的外观澄明度、颗粒大小、对药物包封率的影响
超声时间(t/s) 外观 粒径(l/nm) PDI 包封率(%) 30 沉淀 278.09±4.73 0.857±0.10 42.83±2.76 60 半透明 113.21±11.16 0.485±0.04 54.96±2.41 90 半透明 78.13±2.78 0.055±0.02 92.74±0.77 180 半透明 123.17±8.39 0.430±0.08 76.29±1.76 240 沉淀 261.85±4.94 0.915±0.20 50.42±2.74 -
综上研究,采用的最优处方和制备工艺如下:精密称取PTX-PA 20 mg、PC98-T 400 mg、DSPE-PEG2000 30 mg,加入适量二氯甲烷溶解,接着45 ℃旋蒸去除有机溶剂,再向圆底烧瓶底部薄膜中加入10 ml重蒸水(预热至同等温度),震荡、水化,得PTX-PA/Lip粗品,最后粗品探头超声(90 s)、过滤(0.22 μm),得最终样品PTX-PA/Lip纳米给药系统。
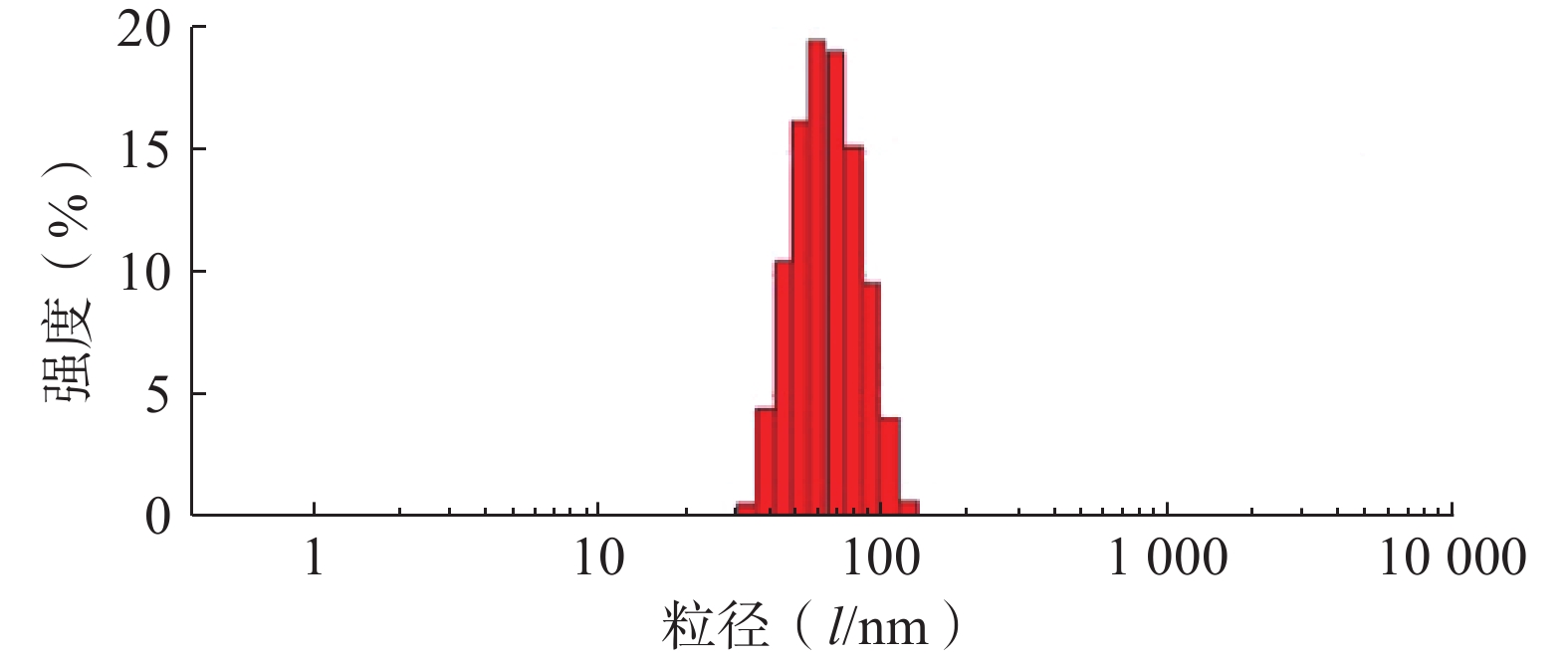
采用Zeta-sizer Nano粒度仪测定最优PTX-PA/Lip的粒径、PDI与zeta电位。结果如图3所示,制备的PTX-PA/Lip脂质体粒径大小为(62.75±1.81) nm,PDI为(0.076±0.020),Zeta电位为(−15.9±0.21) mV,表明制备的PTX-PA/Lip纳米给药系统粒径较小、分布均匀、具有良好的分散性。
-
本实验合成紫杉醇前药—紫杉醇棕榈酸酯PTX-PA,建立PTX-PA的HPLC定量测定方法,经一系列方法学验证,表明其符合PTX-PA定量分析要求,为后续试验奠定了基础。本实验采用薄膜分散法制备PTX-PA脂质体,工艺简便,技术成熟,并通过单因素筛选对PTX-PA脂质体进行处方优化。本文基于纳米技术成功制备出棕榈酸修饰的紫杉醇脂质体,增强了紫杉醇在靶细胞的递送,为PTX-PA后续的药效学研究奠定基础。
Synthesis of paclitaxel palmitate and the formulation optimization of its liposomes
-
摘要:
目的 通过对紫杉醇(PTX)的结构改造联合相应脂质体的构建,改善肿瘤细胞摄取,增加药物疗效。 方法 通过酯化反应制备了紫杉醇前药PTX-PA,并建立含量方法学研究。采用单因素筛选,结合粒径、包封率等指标评价不同方法、条件下制备的PTX-PA/Lip,确定其最佳处方和制备工艺。 结果 通过酯化反应成功制备PTX-PA,且建立的HPLC定量分析方法符合方法学要求。利用单因素筛选,确定了PTX-PA/Lip的最佳处方和制备工艺,通过最优处方制备的PTX-PA/Lip纳米粒径为(2.75±1.81) nm,PDI为(0.076±0.020),药物包封率达到90%以上。 结论 基于纳米技术成功制备出棕榈酸修饰的紫杉醇脂质体,增强了紫杉醇在靶细胞的递送,为PTX-PA的药效学研究奠定基础。 Abstract:Objective To improve the cellular uptake efficiency and the therapeutic effect of the drug through the structural modification of paclitaxel (PTX) and the preparation of corresponding liposomes. Methods The prodrug of paclitaxel, PTX-PA, was prepared by esterification reaction, and the quantitative detection method of PTX-PA was established. Next,the optimal formulation and preparation of PTX-PA/Lip was obtained through single factor screening based on their appearance, particle size, and encapsulation efficiency. Results The PTX-PA was successfully synthesized, and the established HPLC quantitative analysis method for PTX-PA meet the methodological requirements. After the optimal preparation and formulation research through single factor screening, the particle size of optimized PTX-PA/Lip was (62.75±1.81) nm with a PDI of (0.076±0.02), while the drug encapsulation rate reached more than 90%. Conclusion This research successfully prepared palmitic acid modified paclitaxel liposomes based on nanotechnology, enhancing the drug delivery efficiency of paclitaxel and laying the foundation for the pharmacodynamics research of PTX-PA. -
Key words:
- paclitaxel /
- palmitic acid /
- liposomes /
- prodrug /
- pharmaceutical research
-
表 1 PTX-PA的精密度考察结果(n=5)
理论浓度(μg/ml) 实测浓度(μg/ml) RSD(%) 日内 5.00 4.98±0.13 2.65 25.00 25.30±0.55 2.18 100.00 99.66±1.11 1.11 日间 5.00 4.99±0.11 2.31 25.00 25.50±0.57 2.23 100.00 100.65±1.38 1.37 表 2 PTX-PA的加样回收率测试结果(n=5)
理论浓度(μg/ml) 检测浓度(μg/ml) 回收率(%) RSD(%) 回收率 5 5.02±0.12 100.4 2.39 25 24.98±0.45 99.92 1.80 50 50.01±1.17 100.02 2.34 表 3 3种常规制备方法对PTX-PA/Lip粒径、粒径分布、包封率的影响
制备方法 粒径(l/nm) PDI 包封率(%) 薄膜分散法 76.76±3.39 0.104±0.02 79.38±2.00 高压均值法 125.11±5.32 0.139±0.03 78.87±2.00 挤出法 128.87±4.92 0.239±0.05 81.38±1.11 表 4 磷脂种类对脂质体的外观形态、颗粒大小、药物包封率的影响
磷脂种类 外观 粒径(l/nm) PDI 包封率(%) PC98-T 半透明 76.76±3.39 0.104±0.02 79.38±2.00 HSPC 有沉淀 177.86±5.39 0.532±0.08 59.06±1.32 EPCS 半透明 135.12±5.65 0.108±0.03 73.23±1.15 DPPC 有沉淀 158.26±4.11 0.669±0.05 53.27±2.68 表 5 磷脂和药物质量比对脂质体的外观澄明度、颗粒大小、对药物包封率的影响
磷脂∶药物 外观 粒径(l/nm) PDI 包封率(%) 5∶1 略透明 134.62±2.95 0.364±0.04 58.15±1.73 10∶1 有沉淀 90.29±4.66 0.151±0.04 71.56±1.60 20∶1 半透明 84.58±1.33 0.11±0.02 83.50±0.92 30∶1 半透明 86.06±2.71 0.09±0.05 73.44±4.44 40∶1 有沉淀 88.86±1.91 0.199±0.05 68.37±11.08 表 6 磷脂和胆固醇质量比对脂质体外观澄明度、颗粒大小、对药物包封率的影响
磷脂∶胆固醇 外观 粒径(l/nm) PDI 包封率(%) 4∶0.05 半透明 115.37±4.48 0.200±0.07 71.57±1.28 4∶0.1 半透明 160.16±3.15 0.251±0.01 61.08±3.13 4∶0.2 半透明 182.75±2.43 0.217±0.04 54.97±0.95 4∶0.3 乳白色 241.90±12.09 0.697±0.12 54.11±1.64 4∶0.4 乳白色 255.33±8.27 0.700±0.138 48.84±0.78 表 7 PTX-PA和DSPE-PEG2000的质量比对脂质体外观、粒径、药物包封率的影响
药物∶DSPE-
PEG2000外观 粒径(l/nm) PDI 包封率(%) 2∶1 半透明 82.86±2.15 0.107±0.01 90.48±0.49 1∶1 半透明 78.16±2.05 0.351±0.38 90.41±0.34 1∶1.5 半透明 72.23±2.60 0.110±0.02 89.66±1.25 1∶2 半透明 74.64±1.81 0.140±0.04 90.90±2.93 1∶2.5 半透明 75.38±2.10 0.097±0.04 89.48±0.67 表 8 温度对PTX-PA/Lip外观、粒径、包封率的影响
温度(T/ ℃) 外观 粒径(l/nm) PDI 包封率(%) 35 略透明 159.42±2.42 0.545±0.08 54.94±1.85 40 半透明 105.93±6.13 0.269±0.03 73.98±1.60 45 半透明 76.97±2.50 0.105±0.049 91.13±1.45 50 半透明 91.93±2.60 0.181±0.05 80.27±2.13 55 半透明 112.23±6.37 0.233±0.06 74.15±2.12 表 9 超声处理对脂质体的外观澄明度、颗粒大小、对药物包封率的影响
超声时间(t/s) 外观 粒径(l/nm) PDI 包封率(%) 30 沉淀 278.09±4.73 0.857±0.10 42.83±2.76 60 半透明 113.21±11.16 0.485±0.04 54.96±2.41 90 半透明 78.13±2.78 0.055±0.02 92.74±0.77 180 半透明 123.17±8.39 0.430±0.08 76.29±1.76 240 沉淀 261.85±4.94 0.915±0.20 50.42±2.74 -
[1] MÁRMOL I, SÁNCHEZ-DE-DIEGO C, PRADILLA DIESTE A, et al. Colorectal carcinoma: a general overview and future perspectives in colorectal cancer[J]. Int J Mol Sci, 2017, 18(1):197. doi: 10.3390/ijms18010197 [2] DEKKER E, TANIS P J, VLEUGELS J L A, et al. Colorectal cancer[J]. Lancet, 2019, 394(10207):1467-1480. doi: 10.1016/S0140-6736(19)32319-0 [3] ATTOUB S, ARAFAT K, KHALAF T, et al. Frondoside A enhances the anti-cancer effects of oxaliplatin and 5-fluorouracil on colon cancer cells[J]. Nutrients, 2018, 10(5):560. doi: 10.3390/nu10050560 [4] FUJIE Y, YAMAMOTO H, NGAN C Y, et al. Oxaliplatin, a potent inhibitor of survivin, enhances paclitaxel-induced apoptosis and mitotic catastrophe in colon cancer cells[J]. Jpn J Clin Oncol, 2005, 35(8):453-463. doi: 10.1093/jjco/hyi130 [5] OHISHI T, KANEKO M K, YOSHIDA Y, et al. Current targeted therapy for metastatic colorectal cancer[J]. Int J Mol Sci, 2023, 24(2):1702. doi: 10.3390/ijms24021702 [6] 陈炳辰, 于恩达. 增强紫杉醇对结直肠癌化疗疗效的研究进展[J]. 药学实践杂志, 2020, 38(6):501-505. [7] MARUPUDI N I, HAN J E, LI K W, et al. Paclitaxel: a review of adverse toxicities and novel delivery strategies[J]. Expert Opin Drug Saf, 2007, 6(5):609-621. doi: 10.1517/14740338.6.5.609 [8] ALQAHTANI F Y, ALEANIZY F S, EL TAHIR E, et al. Paclitaxel[J]. Profiles Drug Subst Excip Relat Methodol, 2019, 44:205-238. [9] LILENBAUM R C, RATAIN M J, MILLER A A, et al. Phase I study of paclitaxel and topotecan in patients with advanced tumors: a cancer and leukemia group B study[J]. J Clin Oncol, 1995, 13(9):2230-2237. doi: 10.1200/JCO.1995.13.9.2230 [10] BEKAII-SAAB T S, RODA J M, GUENTERBERG K D, et al. A phase I trial of paclitaxel and trastuzumab in combination with interleukin-12 in patients with HER2/neu-expressing malignancies[J]. Mol Cancer Ther, 2009, 8(11):2983-2991. doi: 10.1158/1535-7163.MCT-09-0820 [11] HU T, TO K K, WANG L, et al. Reversal of P-glycoprotein(P-gp)mediated multidrug resistance in colon cancer cells by cryptotanshinone and dihydrotanshinone of Salvia miltiorrhiza[J]. Phytomedicine, 2014, 21(11):1264-1272. doi: 10.1016/j.phymed.2014.06.013 [12] YANG C P H, HORWITZ S B. Taxol®: the first microtubule stabilizing agent[J]. Int J Mol Sci, 2017, 18(8):1733. doi: 10.3390/ijms18081733 [13] ZHU L Y, CHEN L Q. Progress in research on paclitaxel and tumor immunotherapy[J]. Cell Mol Biol Lett, 2019, 24:40. doi: 10.1186/s11658-019-0164-y [14] WANG X T, ZHANG C N, BAO N. Molecular mechanism of palmitic acid and its derivatives in tumor progression[J]. Front Oncol, 2023, 13:1224125. doi: 10.3389/fonc.2023.1224125 [15] FHU C W, ALI A. Fatty acid synthase: an emerging target in cancer[J]. Molecules, 2020, 25(17):3935. doi: 10.3390/molecules25173935 [16] 韦武豪, 陈新美, 陈建明, 等. 紫杉醇饱和脂肪酸酯脂质体的药效学及组织分布研究[J]. 中国新药杂志, 2023, 32(7):728-734. doi: 10.3969/j.issn.1003-3734.2023.07.012 [17] KAN P, TSAO C W, WANG A J, et al. A liposomal formulation able to incorporate a high content of Paclitaxel and exert promising anticancer effect[J]. J Drug Deliv, 2011, 2011:629234. [18] NGUYEN A, CHAO P H, ONG C Y, et al. Chemically engineering the drug release rate of a PEG-paclitaxel conjugate using click and steric hindrance chemistries for optimal efficacy[J]. Biomaterials, 2022, 289:121735. doi: 10.1016/j.biomaterials.2022.121735 [19] WU J. The enhanced permeability and retention(EPR)effect: the significance of the concept and methods to enhance its application[J]. J Pers Med, 2021, 11(8):771. doi: 10.3390/jpm11080771 [20] 陈炳辰. 紫杉醇棕榈酸酯纳米给药系统的构建及抗结直肠癌作用研究[D]. 海军军医大学, 2021. [21] HU Y J, GU C C, WANG X F, et al. Asymmetric total synthesis of taxol[J]. J Am Chem Soc, 2021, 143(42):17862-17870. doi: 10.1021/jacs.1c09637 [22] XU M Q, HAO Y L, WANG J R, et al. Antitumor Activity of α-Linolenic Acid-Paclitaxel Conjugate Nanoparticles: in vitro and in vivo[J]. Int J Nanomedicine, 2021, 16:7269-7281. doi: 10.2147/IJN.S331578 [23] 余侬, 陈建明. HPLC法同时测定大鼠血浆中紫杉醇棕榈酸酯及其活性代谢产物紫杉醇的含量[J]. 海峡药学, 2016, 28(5):23-25. doi: 10.3969/j.issn.1006-3765.2016.05.010 [24] 程丹, 余侬, 许幼发, 等. 紫杉醇棕榈酸酯脂质体的制备及初步药效学和安全性评价[J]. 中国药学杂志, 2018, 53(8):614-619. doi: 10.11669/cpj.2018.08.010 [25] PENOY N, GRIGNARD B, EVRARD B, et al. A supercritical fluid technology for liposome production and comparison with the film hydration method[J]. Int J Pharm, 2021, 592:120093. doi: 10.1016/j.ijpharm.2020.120093 [26] NAJLAH M, HIDAYAT K, OMER H K, et al. A facile approach to manufacturing non-ionic surfactant nanodipsersions using proniosome technology and high-pressure homogenization[J]. J Liposome Res, 2015, 25(1):32-37. doi: 10.3109/08982104.2014.924140 [27] SHAH V M, NGUYEN D X, PATEL P, et al. Liposomes produced by microfluidics and extrusion: a comparison for scale-up purposes[J]. Nanomed-Nanotechnol Biol Med, 2019, 18:146-156. doi: 10.1016/j.nano.2019.02.019 -




 下载:
下载: