-
根据世界卫生组织最新统计显示,心脑血管疾病如心肌梗死、缺血性卒中等是目前全球最主要的致死原因[1]。血小板作为动脉血栓形成的一项重要介质,其高反应性是导致动脉血栓事件发病率和病死率增加的重要危险因素[2, 3]。尽管现有的抗血栓药物可有效减少心血管疾病患者的动脉血栓形成,但出血的不良反应也极大限制了它们的使用。因此为了开发出能在抗血栓形成效果和出血之间取得更好平衡的新一代安全有效的抗血栓药物,迫切需要了解导致血管血栓闭塞的致病机制,开展新靶标的基础研究[4, 5]。
分泌蛋白可由机体各种组织器官分泌,在生理、病理过程中起关键作用,具备良好的研究前景,有望开发成为心脑血管疾病防治的药物、靶标、生物标志物[6, 7]。近期有多项研究表明部分分泌蛋白大量存在于血液之中,可直接作用于血栓调控[8-10]。Metrnl是本实验室前期通过构建限食模型筛选获得的一种与神经营养因子Metrn同源的新型分泌蛋白[11]。迄今为止,多项研究结果表明Metrnl在免疫炎症及代谢性心脑血管疾病中发挥重要作用,例如调节胰岛素敏感性、维持肠道稳态、对抗动脉粥样硬化、促进血管新生等[12-17]。此外,临床研究显示,血液Metrnl水平与冠心病、心肌梗死、缺血性脑卒中等多种血栓性疾病存在相关性[18-20]。以上结果均提示Metrnl在心脑血管疾病病理过程中扮演重要角色,但是Metrnl在血栓形成特别是其对血小板的直接作用尚未可知。
前期,本实验室通过使用Metrnl全身性敲除小鼠,已在多种血栓模型下证明Metrnl缺乏会导致血栓形成能力增强,并且在进一步的血小板功能检测中,证实Metrnl缺乏会导致血小板活性增强[21]。然而,我们尚未证明究竟是循环Metrnl还是血小板Metrnl的缺乏在促进血栓形成中扮演主要角色,且血小板Metrnl是否可以直接调控血小板活性改变,从而在血小板高活性与动脉血栓形成事件发生率增加之间建立联系,目前尚不清楚。
因此,本研究使用Metrnlloxp/loxp小鼠和Pf4-Cre小鼠进行交配繁殖,旨在构建一株血小板特异性Metrnl敲除小鼠作为深入研究血小板内源性Metrnl在动脉血栓中的作用及调控机制的工具,并对该敲除小鼠的构建成功与否展开验证工作。
-
鼠尾DNA提取试剂盒(CW2094S)购自北京康为世纪生物科技有限公司,5×Evo M-MLV RT Master Mix(AG11706)、通用型RNA提取试剂盒(AG21022)购自湖南艾科瑞生物工程有限公司,小鼠Actin抗体(
66009 -1-IG)购自武汉三鹰技术有限公司,Anti-METRNL抗体(ab235775)购自Abcam公司,辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(A0216)、辣根过氧化物酶标记山羊抗兔IgG(H+L)(A0208)购自上海碧云天生物技术有限公司,红细胞裂解液(BL503B)购自北京兰杰柯科技有限公司。实时荧光定量PCR仪(LightCycler96)来自Roche公司,PCR仪(TP600)来自Takara公司,化学发光分析系统(5200S)来自Tanon公司,动物全血计数仪(pocH-100iV)来自希森美康公司。
-
Metrnlloxp/loxp小鼠为实验室前期构建所得。SPF级8周龄Pf4-Cre小鼠购自上海南方模式生物技术有限公司。
所有实验小鼠均饲养在独立通气笼盒(IVC)系统中,温度(24±2) ℃,相对湿度为40%~60%,饲养期间笼盒内保持清洁,小鼠在笼内自由活动、进食及饮水,动物房内照明系统为自动控制(12 h照明、12 h黑暗)。动物实验标准均依照国家《实验动物护理使用卫生指南》,并经过海军军医大学大学医学研究伦理委员会批准指导。
-
将剪刀消毒后剪取小鼠尾尖约3 mm,剪碎,按照DNA提取试剂盒的说明书方法提取DNA。之后,对目的基因进行PCR扩增,各引物序列如表1。
表 1 PCR扩增实验中的引物序列
基因名称 上游引物(5’→3’) 下游引物(5’→3’) Metrnl loxp TGAGGGTTGGAGGCTCCTAGC GGATGAGCGTTTGAGCACAGC Pf4-Cre CCAAGTCCTACTGTTTCTCACTC TGCACAGTCAGCAGGTT 内参基因 CAAATGTTGCTTGTCTGGTG GTCAGTCGAGTGCACAGTTT 将PCR产物进行1.2% 琼脂糖凝胶电泳,上样量为每孔6 μl,电泳条件为100 V×30 min,结束后进行拍照、分析。
-
将小鼠称重后,腹腔注射1%戊巴比妥钠溶液(100 mg/kg),待小鼠处于深度麻醉后,打开其腹腔,用1 ml注射器吸取约100 μl 2%枸橼酸钠溶液(柠檬酸钠三盐·二水0.2 g,蒸馏水定容至10 ml),自腹主动脉处缓慢抽取抗凝血液,并转移至15 ml离心管中。组织灌流后迅速剪取小鼠心、肝、脾、肺、肾、脑、结肠组织,放入组织冻存管扔进液氮速冻,待取材结束后及时转入−80 ℃超低温冰箱储存。骨髓提取分离小鼠股骨并剪去多余肌肉和纤维组织,剪掉股骨两端,在干净PBS中反复冲洗骨髓腔,收集冲洗液室温离心
1000 r/min×5 min获得骨髓细胞,用1 ml Triozl溶液重悬混匀,储存至−80 ℃超低温冰箱。 -
向小鼠抗凝全血中加入等体积0.9%生理盐水,并加入Apyrase(终浓度2 U/ml),快速颠倒混匀后室温离心800 r/min×10 min;离心后收集最上层富血小板血浆(PRP),转移至新的15 ml离心管,室温离心
1700 r/min×5 min,弃去上清液,取适量台式液重悬。 -
小鼠心脏采抗凝血后,室温离心
1000 r/min×5 min,弃去上清液后加入5 ml的红细胞裂解液,室温作用10 min,室温离心1000 r/min×5 min,重复1次,在血细胞沉淀中加入5 ml PBS洗涤,室温离心1000 r/min×5 min,弃去上清后根据白细胞沉淀的量加入100~500 μl PBS重悬。红细胞提取在全血中加入等体积红细胞保存液(枸橼酸钠Na3C6H5O7·5H2O 0.8 g,葡萄糖2.05 g,枸橼酸0.0325 g,氯化钠0.42 g,蒸馏水定容至100 ml), 室温离心2 000 r/min×10 min,连续离心洗涤3次后,取压积红细胞加入100~500 μl红细胞保存液重悬。 -
使用RNA提取试剂盒提取组织RNA,Triozl法提取骨髓RNA,将得到的RNA进行浓度测定与吸光度测定后进行逆转录,得到cDNA用于实时荧光定量PCR实验,各引物序列如表2。
表 2 实时荧光定量PCR实验中的引物序列
基因名称 上游引物(5′—3′) 下游引物(5′—3′) Human Metrnl ACCAGCGACTTCGTAATTCAC CAGCTCCACGTCATGGGTG Mouse Gapdh GTATGACTCCACTCACGGCAAA GGTCTCGCTCCTGGAAGATG -
取适量组织至2 ml高速离心管,加入蛋白裂解液后,使用高通量匀浆仪匀浆240 s。取出高速离心管,离心:
12000 g×15 min。将上清液转移至另一干净1.5 ml EP管中,进行蛋白浓度测定,剩余样品加入5×蛋白上样缓冲液,97 ℃变性10 min得到蛋白样品。使用10% SDS-PAGE凝胶进行电泳,电泳条件为:150 V×60 min。使用PVDF膜进行转膜,转膜条件为100 V×60 min。
转膜结束后,使用快速封闭液封闭20 min,之后使用1 × TBST缓冲液洗膜,5 min×3次。加入一抗孵育液(1∶
1000 稀释)4 ℃孵育过夜。次日去除一抗孵育液,使用1×TBST缓冲液洗膜,10 min×3次。加入二抗孵育液(1∶1000 稀释)常温孵育1 h,用1×TBST缓冲液洗去二抗,10 min×2次,结束后即可进行扫膜。 -
实验数据使用GraphPad Prism 9.5进行统计分析。两组间的比较使用two-tailed Student’s t test检验,P<0.05视为结果存在统计学意义。
-
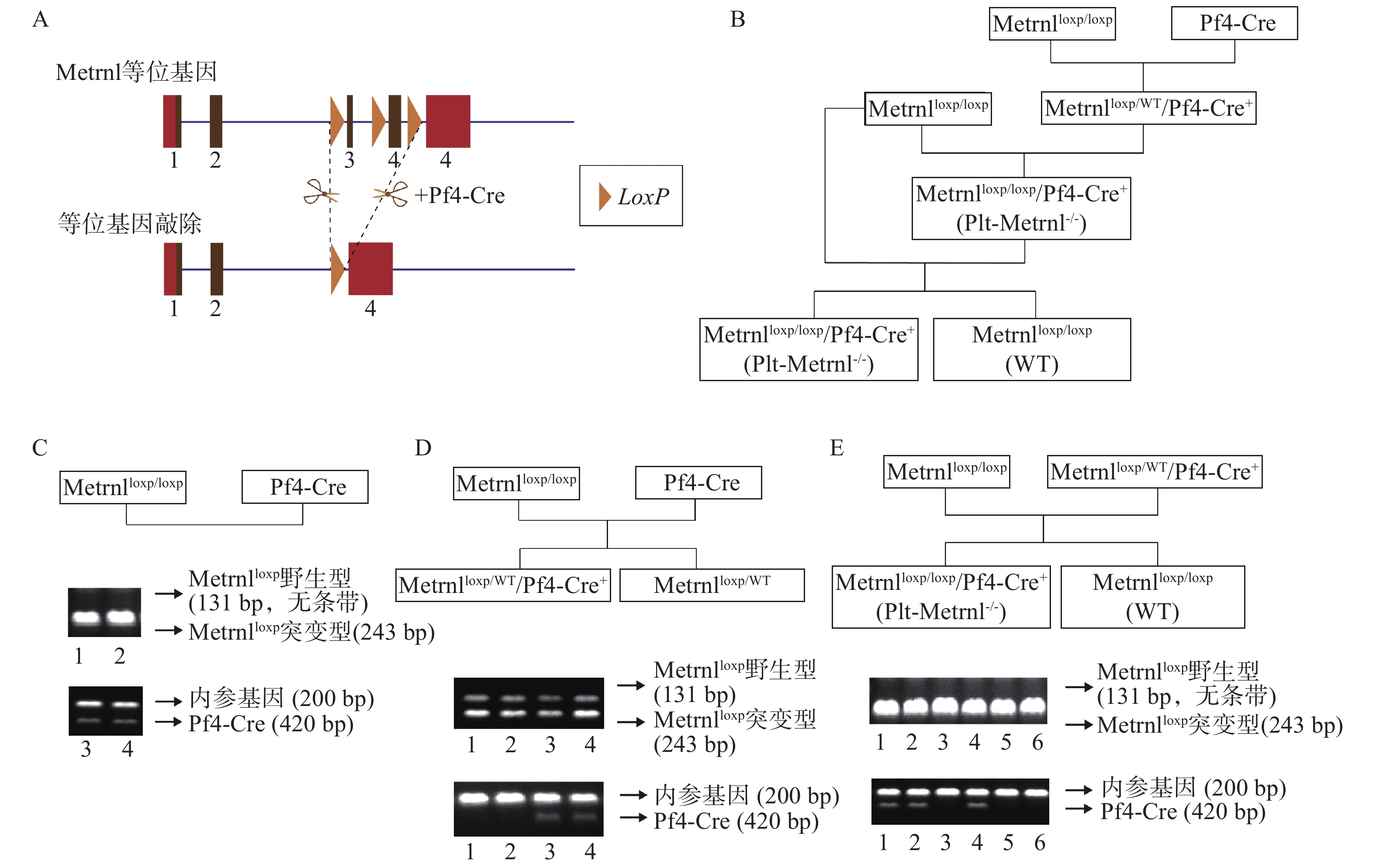
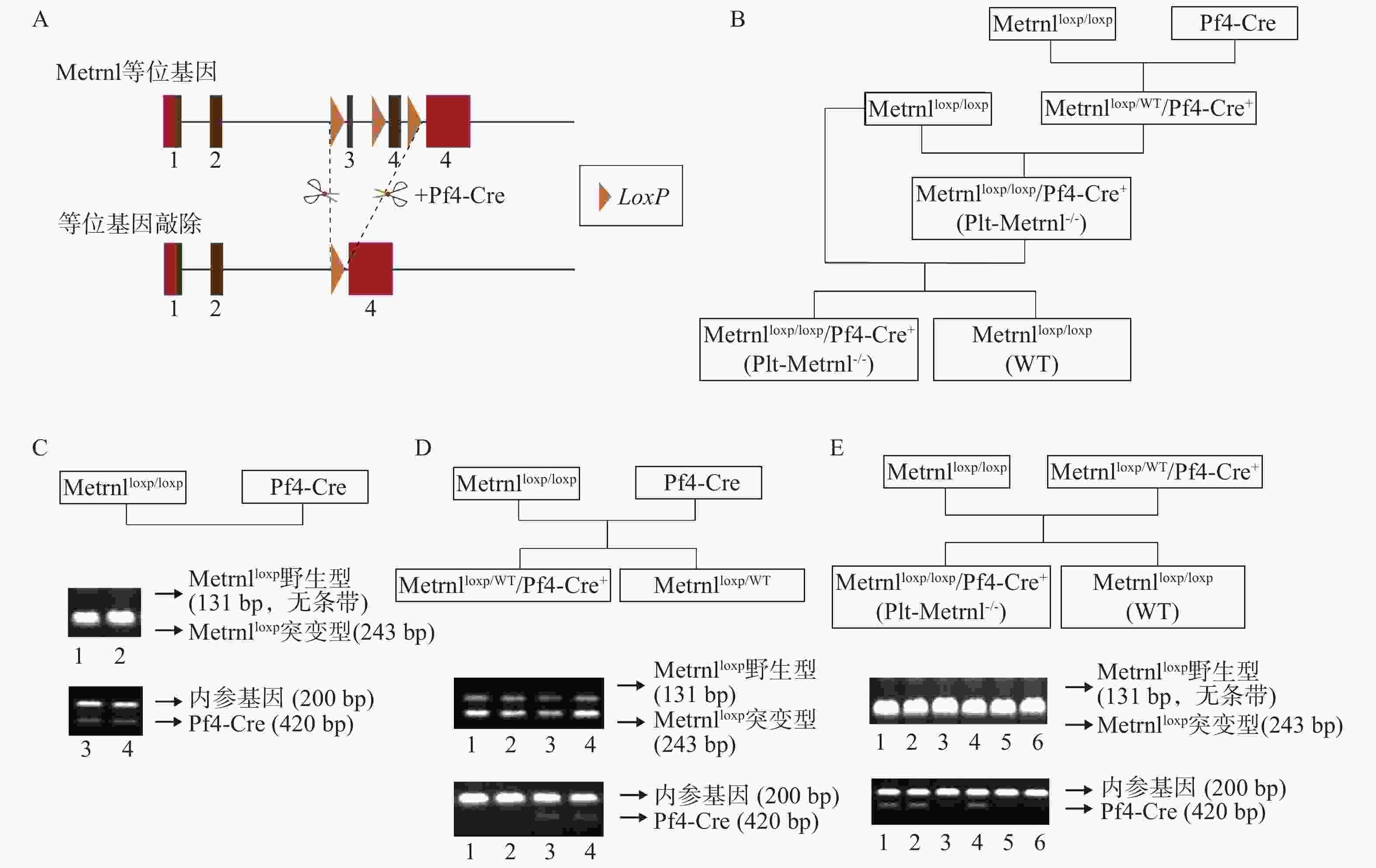
本研究构建策略基于前期构建的Metrnlloxp/loxp小鼠和Cre-LoxP重组酶系统,所构建血小板特异性Metrnl敲除小鼠(Metrnlloxp/loxp/Pf4-Cre+)简称Plt-Metrnl−/-小鼠,具体构建策略如图1A所示。
Metrnlloxp/loxp小鼠是前期构建而成,该小鼠Metrnl基因的3号外显子两侧和4号外显子编码区的都插有同向LoxP位点(即图1A中所示“等位基因”),可基于Cre-LoxP系统在Cre酶的作用下,将LoxP位点之间的序列切除(图1A)[12]。
Pf4-Cre小鼠是由Pf4基因启动子Cre重组酶在巨核细胞及血小板谱系表达的工具鼠,最初开发用于研究APC-Wnt调节途径在巨核细胞生成和血小板产生中的作用,其Cre重组酶的表达受巨核细胞特异性受体Pf4基因的启动子介导,在巨核细胞的成熟Ⅰ期(最早可识别形态期)中即开始发生转录激活,之后广泛表达于成熟的血小板[22, 23]。
将Metrnlloxp/loxp小鼠和Pf4-Cre小鼠进行交配繁殖,巨核细胞特异性表达的Cre酶可将Metrnl同向LoxP位点之间的序列切除,以达到在巨核细胞及血小板谱系特异性敲除Metrnl基因的目的,具体构建繁殖流程如图1B所示,最终可以获得Plt-Metrnl−/-小鼠及其对照小鼠(WT)。
繁殖过程中进行基因型鉴定时,需确认Metrnlloxp基因和Pf4-Cre基因的表达情况。采用相应基因上下游引物分别进行鼠尾基因型鉴定,Metrnlloxp突变型基因阳性条带为243bp,对应野生型序列条带为131bp,Pf4-Cre基因阳性条带为420bp,内参基因阳性条带为200bp。我们对培育繁殖过程中的母代及子代小鼠均进行了基因型鉴定,如图1C、D、E中DNA电泳条带图所示:图1C中泳道1、2为母代Metrnlloxp/loxp小鼠,泳道3、4为母代Pf4-Cre小鼠;图1D中泳道1、2为Metrnlloxp/WT小鼠,泳道3、4为Metrnlloxp/WT/Pf4-Cre+小鼠;图1E泳道1、2、4为Plt-Metrnl−/-小鼠,泳道3、5、6为WT小鼠。
-
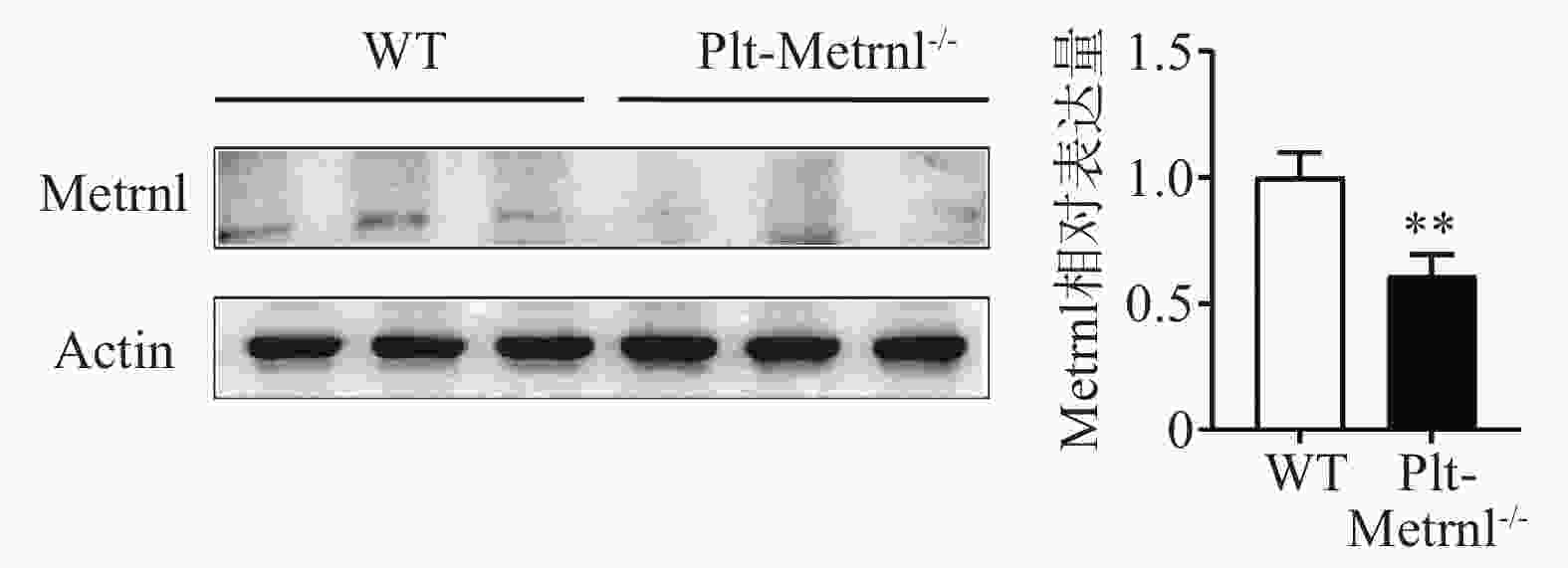
为验证血小板特异性Metrnl敲除小鼠是否实现血小板特异性Metrnl基因敲除,分别提取Plt-Metrnl−/-小鼠及对照WT小鼠血小板蛋白,使用蛋白免疫印迹实验方法验证敲除情况,结果如图2所示,Plt-Metrnl−/-小鼠血小板蛋白Metrnl表达较对照WT小鼠明显降低,提示Plt-Metrnl−/-小鼠血小板Metrnl成功敲除。
-
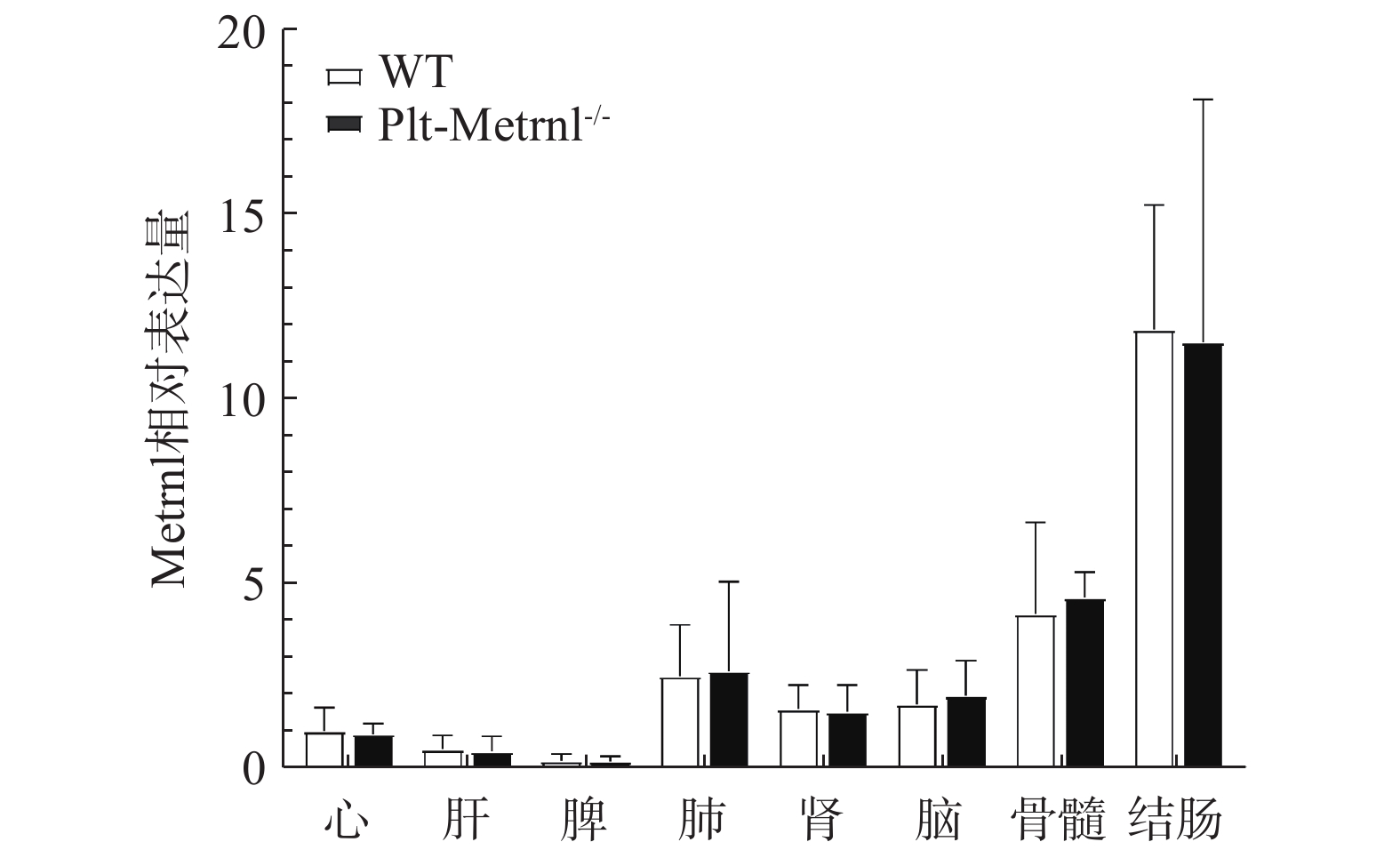
为验证血小板特异性Metrnl敲除小鼠是否存在其他组织非特异性敲除,本研究首先利用实时荧光定量PCR技术检测了该小鼠各组织中Metrnl mRNA的表达情况。如图3所示,以WT对照小鼠的心脏Metrnl mRNA表达量为1,Plt-Metrnl−/-小鼠在心、肝、脾、肺、肾、脑、结肠、骨髓组织mRNA水平上并未存在显著差异。该结果说明,血小板特异性Metrnl基因敲除小鼠在组织mRNA水平上并未发生其他组织非特异性敲除。
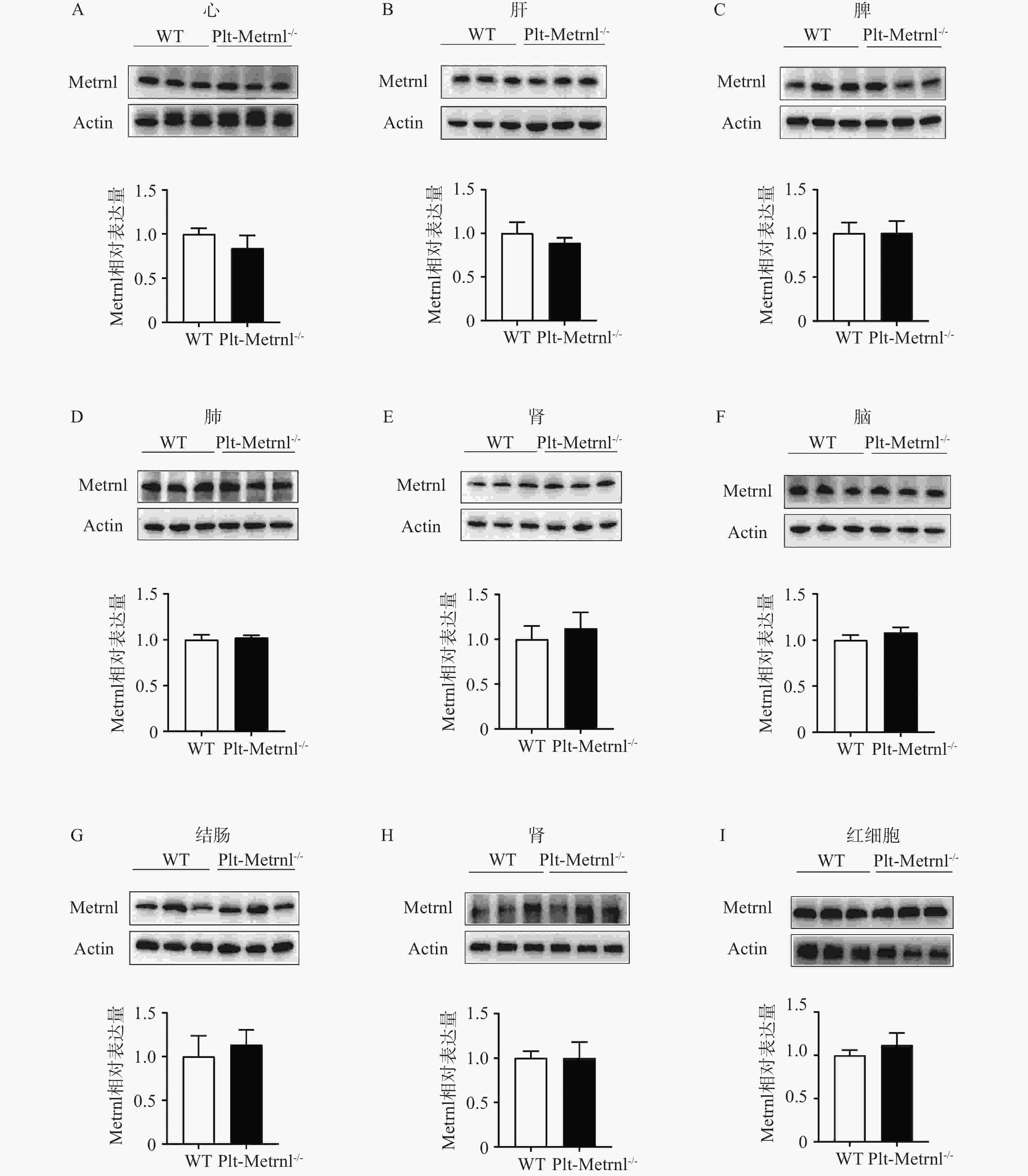
然后,本研究提取血细胞及各组织的蛋白,使用蛋白免疫印迹实验方法验证Plt-Metrnl−/-小鼠各血细胞及组织中Metrnl蛋白表达情况。如图4所示,并未发现Metrnl蛋白在Plt-Metrnl−/-小鼠和对照WT小鼠各组织中存在显著差异,该结果提示,Plt-Metrnl−/-小鼠在其他血细胞蛋白水平及各组织蛋白水平上并未发生非特异性敲除。
-
分别对Plt-Metrnl−/-小鼠及对照WT小鼠外周血进行血常规指标检测,结果如表3所示,外周血血常规计数红细胞、白细胞、血小板数量未见明显改变,血小板大小及分布未见显著差异,提示血小板特异性敲除Metrnl后不影响外周血细胞数量,且对血小板形态没有明显影响。
表 3 Plt-Metrnl−/-小鼠及对照WT小鼠血常规指标对比(n=6)
血常规检验项目 WT Plt-Metrnl−/- 白细胞计数(109/L) 2.10±0.50 2.25±0.30 淋巴细胞计数(109/L) 1.28±0.20 1.52±0.20 淋巴细胞比率(%) 63±3 68±3 嗜酸性粒细胞计数(109/L) 0.10±0.05 0.05±0.02 嗜酸性粒细胞比率(%) 3.0±1.8 1.0±0.3 其他细胞计数(109/L) 0.72±0.20 0.68±0.10 其他细胞比率(%) 34.0±3.3 31±3 红细胞计数(1012/L) 8.49±0.40 7.83±0.40 血红蛋白(g/L) 122.0±5.5 113.0±4.6 红细胞压积(%) 42±2 37±2 平均红细胞体积(fL) 49.1±0.8 47.7±0.9 平均血红蛋白含量(pg) 14.30±0.08 14.5±0.1 平均血红蛋白浓度(g/L) 292±5 304.0±7.7 红细胞分布宽度-SD(fL) 27.6±0.4 26.2±0.6 红细胞分布宽度-CV(%) 13.2±0.4 12.4±0.3 血小板计数(109/L) 1121 ±581049 ±132血小板平均宽度(fL) 6.7±0.4 6.1±0.1 平均血小板体积(fL) 6.20±0.26 5.80±0.08 大型血小板比率(%) 1.9±1.0 3.5±0.3 -
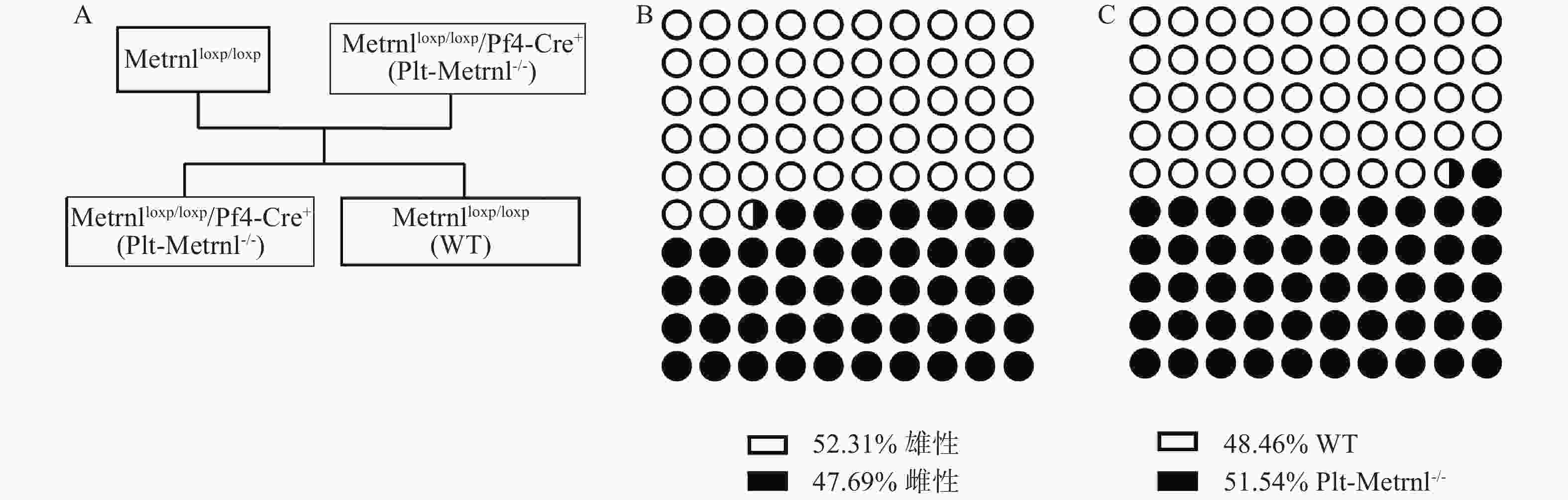
Metrnlloxp/loxp/Pf4-Cre+(Plt-Metrnl−/-)小鼠和对照WT小鼠为首次繁殖培育的转基因动物,在生理状态下,血小板Metrnl缺失是否影响动物繁殖情况尚未见报道,因此我们统计记录了小鼠基因型分布情况。Plt-Metrnl−/-小鼠扩大繁殖流程如图5A所示,按照遗传学规律,Metrnlloxp/loxp/Pf4-Cre+(Plt-Metrnl−/-)小鼠和Metrnlloxp/loxp小鼠杂交繁殖获得子代鼠中Plt-Metrnl−/-小鼠和WT小鼠的比例应为1∶1。如图5B、5C所示,对繁殖过程中所获得的16窝次共计130只目的鼠进行统计,Plt-Metrnl−/-小鼠共有67只,其中雄鼠31只,雌鼠36只;WT小鼠共有63只,其中雄鼠37只,雌鼠26只。结果表明繁殖鼠遗传规律基本符合预期,无明显差异,提示血小板特异性敲除Metrnl对小鼠胚胎发育和性别比例无明显影响。
-
Cre/LoxP重组酶系统主要用于构建条件性基因敲除小鼠模型,是当前阐释基因功能的最直接的方式之一。Pf4-Cre工具鼠长期以来应用于巨核谱系基因敲除动物的构建,虽然有研究表明Pf4-Cre表达不仅限于巨核细胞/血小板谱系,也表达于其他骨髓造血干细胞以及远端肠道的上皮细胞中,但是该小鼠目前仍是巨核细胞谱系遗传修饰的最佳工具,且不影响血小板和血栓形成功能的考察[22-24]。因此本研究利用Pf4-Cre工具鼠和实验室前期构建的Metrnlloxp/loxp小鼠进行杂交繁殖,最终获得血小板特异性Metrnl敲除小鼠,即Plt-Metrnl−/-小鼠。
本研究从mRNA水平、组织蛋白水平、外周血常规水平考察了Plt-Metrnl−/-小鼠血小板Metrnl敲除的情况。本研究结果显示,Plt-Metrnl−/-小鼠血小板Metrnl蛋白表达较对照WT小鼠减低约50%,可能是由于本实验室前期构建的Metrnlloxp/loxp小鼠插入的loxp序列位点在3、4号外显子,因此Pf4-Cre仅介导3、4号外显子间的同向基因序列切除,并未实现Metrnl基因全长敲除。另外,血小板是骨髓巨核细胞分化形成的“细胞碎片”,由于无法获得原代骨髓巨核细胞,本研究并未对骨髓巨核细胞的Metrnl敲除情况进行验证,未证实Metrnl敲除是否会对骨髓巨核细胞的生成和形态产生影响,我们仅从血常规计数中初步得知血小板的生成未受到明显影响。Metrnl与骨髓巨核细胞之间的关系也可作为下一步的研究方向。
在小鼠培育的过程中,尚未发现Plt-Metrnl−/-小鼠和同窝对照WT小鼠在体重、形态等方面的差异。基于孟德尔遗传定律,Plt-Metrnl−/-小鼠和Metrnlloxp/loxp小鼠杂交进行扩大繁殖和保种的得率也接近50%,说明血小板Metrnl缺失不影响小鼠繁殖情况。
前期本课题组已证实Metrnl全身敲除小鼠血栓形成能力增强,血小板活性明显增强,构建Plt-Metrnl−/-小鼠可考虑用于血小板内源性Metrnl与血小板功能相关性的研究,并且该小鼠可与Metrnl全身敲除小鼠进行血栓形成能力比较,比较全身Metrnl和局部血小板Metrnl的作用,深入研究其作用方式及机制,为血栓性疾病的防治提供新靶点。
Construction and validation of a platelet-specific Metrnl gene knockout mouse model
-
摘要:
目的 构建血小板特异性Metrnl基因敲除的小鼠(Plt-Metrnl−/-小鼠)模型。 方法 基于Cre-LoxP系统利用Pf4-Cre小鼠与实验室前期构建的Metrnlloxp/loxp小鼠进行交配繁殖,得到目的Plt-Metrnl−/-小鼠。对该目的小鼠进行基因型鉴定,收集其血液及心、肝、脾、肺、肾、脑、结肠、骨髓组织,利用实时荧光定量PCR技术、蛋白免疫印迹实验,考察血小板特异性Metrnl敲除小鼠的敲除情况。 结果 Plt-Metrnl−/-小鼠的血小板Metrnl蛋白水平显著低于对照组WT小鼠,其他外周血细胞及各组织mRNA水平、蛋白水平、血常规指标、生长发育一般情况与对照组WT小鼠无明显差异。 结论 血小板特异性Metrnl敲除小鼠(Plt-Metrnl−/-小鼠)模型构建成功。 Abstract:Objective To construct the platelet-specific Metrnl gene knockout (Plt-Metrnl−/-)mice model. Methods Based on the Cre-LoxP system, Metrnlloxp/loxp mice, previously constructed in our laboratory, were mated with Pf4-Cre mice to generate Plt-Metrnl−/- mice. The genotypes of the offspring were identified, and tissues of the platelet, other peripheral blood cells, heart, liver, spleen, lung, kidney, brain, colon, and bone marrow were collected. The expression of the Metrnl gene in Plt-Metrnl−/- mice was investigated by quantitative real-time PCR and western blot. Also, the blood routine index was tested in Plt-Metrnl−/- mice. Results Compared with wild-type mice, the level of Metrnl protein in platelets was significantly decreased in Plt-Metrnl−/- mice. There was no significant difference in mRNA and protein levels of other peripheral blood cells and tissues, as well as in blood routine index, growth, and development between Plt-Metrnl−/- mice and WT mice. Conclusion Platelet-specific Metrnl knockout mice(Plt-Metrnl−/- mice)model was successfully constructed. -
Key words:
- Metrnl /
- gene-knockout mouse /
- platelet
-
表 1 PCR扩增实验中的引物序列
基因名称 上游引物(5’→3’) 下游引物(5’→3’) Metrnl loxp TGAGGGTTGGAGGCTCCTAGC GGATGAGCGTTTGAGCACAGC Pf4-Cre CCAAGTCCTACTGTTTCTCACTC TGCACAGTCAGCAGGTT 内参基因 CAAATGTTGCTTGTCTGGTG GTCAGTCGAGTGCACAGTTT 表 2 实时荧光定量PCR实验中的引物序列
基因名称 上游引物(5′—3′) 下游引物(5′—3′) Human Metrnl ACCAGCGACTTCGTAATTCAC CAGCTCCACGTCATGGGTG Mouse Gapdh GTATGACTCCACTCACGGCAAA GGTCTCGCTCCTGGAAGATG 表 3 Plt-Metrnl−/-小鼠及对照WT小鼠血常规指标对比(n=6)
血常规检验项目 WT Plt-Metrnl−/- 白细胞计数(109/L) 2.10±0.50 2.25±0.30 淋巴细胞计数(109/L) 1.28±0.20 1.52±0.20 淋巴细胞比率(%) 63±3 68±3 嗜酸性粒细胞计数(109/L) 0.10±0.05 0.05±0.02 嗜酸性粒细胞比率(%) 3.0±1.8 1.0±0.3 其他细胞计数(109/L) 0.72±0.20 0.68±0.10 其他细胞比率(%) 34.0±3.3 31±3 红细胞计数(1012/L) 8.49±0.40 7.83±0.40 血红蛋白(g/L) 122.0±5.5 113.0±4.6 红细胞压积(%) 42±2 37±2 平均红细胞体积(fL) 49.1±0.8 47.7±0.9 平均血红蛋白含量(pg) 14.30±0.08 14.5±0.1 平均血红蛋白浓度(g/L) 292±5 304.0±7.7 红细胞分布宽度-SD(fL) 27.6±0.4 26.2±0.6 红细胞分布宽度-CV(%) 13.2±0.4 12.4±0.3 血小板计数(109/L) 1121 ±581049 ±132血小板平均宽度(fL) 6.7±0.4 6.1±0.1 平均血小板体积(fL) 6.20±0.26 5.80±0.08 大型血小板比率(%) 1.9±1.0 3.5±0.3 -
[1] World health statistics 2024: monitoring health for the SDGs, Sustainable Development Goals[M]. Geneva: World Health Organization, 2024. [2] KOUPENOVA M, CLANCY L, CORKREY H A, et al. Circulating platelets as mediators of immunity, inflammation, and thrombosis[J]. Circ Res, 2018, 122(2):337-351. [3] TRIP M D, CATS V M, VAN CAPELLE F J, et al. Platelet hyperreactivity and prognosis in survivors of myocardial infarction[J]. N Engl J Med, 1990, 322(22):1549-1554. doi: 10.1056/NEJM199005313222201 [4] MACKMAN N. Triggers, targets and treatments for thrombosis[J]. Nature, 2008, 451(7181):914-918. doi: 10.1038/nature06797 [5] JENNINGS L K. Mechanisms of platelet activation: need for new strategies to protect against platelet-mediated atherothrombosis[J]. Thromb Haemost, 2009, 102(2):248-257. [6] PENG B, KONG G C, YANG C, et al. Erythropoietin and its derivatives: from tissue protection to immune regulation[J]. Cell Death Dis, 2020, 11(2):79. doi: 10.1038/s41419-020-2276-8 [7] LEONG D P, MCMURRAY J J V, JOSEPH P G, et al. From ACE inhibitors/ARBs to ARNIs in coronary artery disease and heart failure(part 2/5)[J]. J Am Coll Cardiol, 2019, 74(5):683-698. doi: 10.1016/j.jacc.2019.04.068 [8] QI Z Y, HU L, ZHANG J J, et al. PCSK9(proprotein convertase subtilisin/kexin 9)enhances platelet activation, thrombosis, and myocardial infarct expansion by binding to platelet CD36[J]. Circulation, 2021, 143(1):45-61. doi: 10.1161/CIRCULATIONAHA.120.046290 [9] CHEN Y F, FU W R, ZHENG Y B, et al. Galectin 3 enhances platelet aggregation and thrombosis via Dectin-1 activation: a translational study[J]. Eur Heart J, 2022, 43(37):3556-3574. doi: 10.1093/eurheartj/ehac034 [10] CHEN Y F, HONG J, ZHONG H X, et al. IL-37 attenuates platelet activation and thrombosis through IL-1R8 pathway[J]. Circ Res, 2023, 132(9):e134-e150. [11] LI Z Y, ZHENG S L, WANG P, et al. Subfatin is a novel adipokine and unlike Meteorin in adipose and brain expression[J]. CNS Neurosci Ther, 2014, 20(4):344-354. doi: 10.1111/cns.12219 [12] LI Z Y, SONG J, ZHENG S L, et al. Adipocyte metrnl antagonizes insulin resistance through PPARγ signaling[J]. Diabetes, 2015, 64(12):4011-4022. doi: 10.2337/db15-0274 [13] QI Q, HU W J, ZHENG S L, et al. Metrnl deficiency decreases blood HDL cholesterol and increases blood triglyceride[J]. Acta Pharmacol Sin, 2020, 41(12):1568-1575. doi: 10.1038/s41401-020-0368-8 [14] LI Z Y, FAN M B, ZHANG S L, et al. Intestinal Metrnl released into the gut lumen acts as a local regulator for gut antimicrobial peptides[J]. Acta Pharmacol Sin, 2016, 37(11):1458-1466. doi: 10.1038/aps.2016.70 [15] BAHT G S, BAREJA A, LEE D E, et al. Author Correction: Meteorin-like facilitates skeletal muscle repair through a Stat3/IGF-1 mechanism[J]. Nat Metab, 2020, 2(8):794. doi: 10.1038/s42255-020-0257-y [16] REBOLL M R, KLEDE S, TAFT M H, et al. Meteorin-like promotes heart repair through endothelial KIT receptor tyrosine kinase[J]. Science, 2022, 376(6599):1343-1347. doi: 10.1126/science.abn3027 [17] ZHENG S L, LI Z Y, SONG J, et al. Endothelial METRNL determines circulating METRNL level and maintains endothelial function against atherosclerosis[J]. Acta Pharm Sin B, 2023, 13(4):1568-1587. doi: 10.1016/j.apsb.2022.12.008 [18] DADMANESH M, AGHAJANI H, FADAEI R, et al. Lower serum levels of Meteorin-like/Subfatin in patients with coronary artery disease and type 2 diabetes mellitus are negatively associated with insulin resistance and inflammatory cytokines[J]. PLoS One, 2018, 13(9):e0204180. doi: 10.1371/journal.pone.0204180 [19] LIU Z X, JI H H, YAO M P, et al. Serum Metrnl is associated with the presence and severity of coronary artery disease[J]. J Cell Mol Med, 2019, 23(1):271-280. doi: 10.1111/jcmm.13915 [20] MIAO Z W, WANG N, HU W J, et al. Chronic vascular pathogenesis results in the reduced serum Metrnl levels in ischemic stroke patients[J]. Acta Pharmacol Sin, 2024, 45(5):914-925. doi: 10.1038/s41401-023-01204-5 [21] 缪朝玉, 郑斯莉, 缪竹威, 等. Metrnl抗血栓用途. 中国: 201710778140.5 [P]. 2017-09-01. [22] TIEDT R, SCHOMBER T, HUI H S, et al. Pf4-Cre transgenic mice allow the generation of lineage-restricted gene knockouts for studying megakaryocyte and platelet function in vivo[J]. Blood, 2007, 109(4):1503-1506. doi: 10.1182/blood-2006-04-020362 [23] CALAMINUS S D, GUITART A V, SINCLAIR A, et al. Lineage tracing of Pf4-Cre marks hematopoietic stem cells and their progeny[J]. PLoS One, 2012, 7(12):e51361. doi: 10.1371/journal.pone.0051361 [24] PERTUY F, AGUILAR A, STRASSEL C, et al. Broader expression of the mouse platelet factor4-cre transgene beyond the megakaryocyte lineage[J]. J Thromb Haemost, 2015, 13(1):115-125. doi: 10.1111/jth.12784 -




 下载:
下载: