-
万古霉素是广泛应用于临床的三环糖肽类抗生素,临床上主要用于耐甲氧西林金黄色葡萄球菌所致感染,也常用于腹膜透析相关性腹膜炎覆盖G+菌的经验性治疗。最常见的药物不良反应(ADR)是过敏反应、肝肾毒性、耳毒性和血液系统ADR[1],近年来,万古霉素致中性粒细胞减少、血小板减少的文献报道不断增多[2-4],但其致全血细胞减少的个案报道仅4篇[5-8]。笔者对临床工作中发现的1例万古霉素引起腹膜透析患者全血细胞减少的病例进行分析,以期引起临床工作人员对这一不良反应的关注,提高对万古霉素用药安全性的警惕。
HTML
-
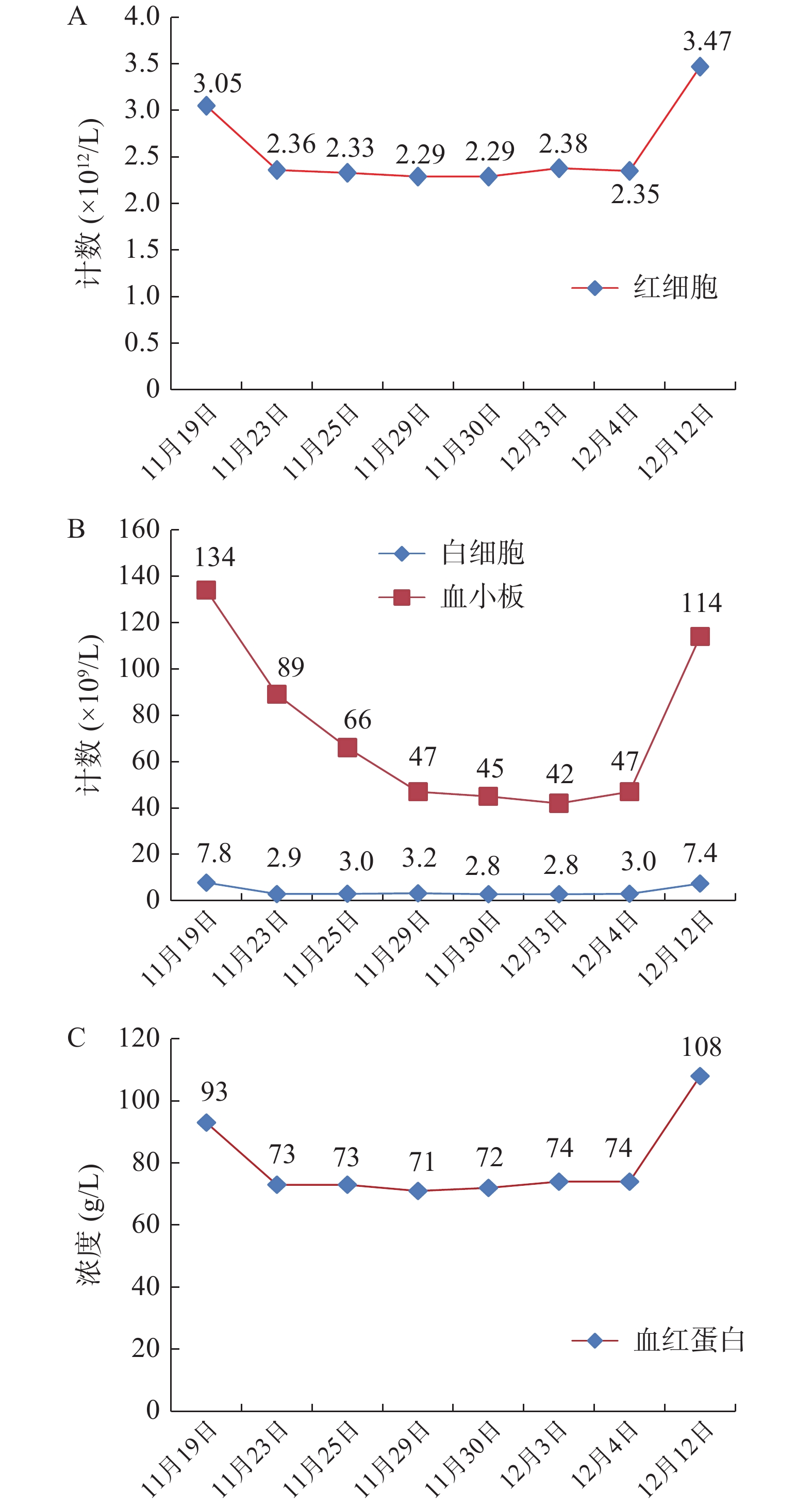
患者,男,78岁,体重65 kg,维持性腹透5年余,因腹痛、腹泻3 d,腹透液浑浊,现为腹膜评估收住入院。入院诊断:腹膜透析相关性腹膜炎、慢性肾脏病5期、维持性腹膜透析。目前腹透方案:连续不卧床腹膜透析(continuous ambulatory peritoneal dialysis,CAPD),具体为15%低钙腹膜透析液(PD4)2 L×3袋+25% PD4×2袋,夜间留腹,每天超滤400~500 ml。2019年11月19日,入院查体:T38.8 ℃,血压100/58 mmHg,神清,精神可,HR 78次/min;血常规:白细胞7.8×109/L,红细胞3.05×1012/L,血红蛋白93 g/L,血小板计数134×109/L,C反应蛋白(CRP)75.72 mg/L,降钙素原(PCT)3.05 ng/ml;血清肌酐(SCr)612 μmol/L;腹水常规:腹透液淡黄、混浊;李凡他试验:阳性;细胞总数:3 420×106/L,有核细胞计数:1 715×106/L;嗜中性分叶核细胞98%,腹透相关性腹膜炎诊断明确。根据腹膜炎治疗经验,暂给予注射用盐酸万古霉素1 g加入腹透液中(留腹大于6 h),q3d;注射用头孢他啶1 g qd,加夜间腹透液;注射用美罗培南1 g+氯化钠注射液100 ml qd,静脉滴注抗感染治疗,患者住院期间使用的主要治疗药物详见表1,待腹透液细菌培养结果和药敏结果回报后进一步调整抗菌药物。考虑患者本身肾功能不全,以及万古霉素安全范围窄且不良反应大,临床药师建议用药过程中进行万古霉素的血药浓度监测,密切关注ADR,定期复查血常规及肝、肾功能。
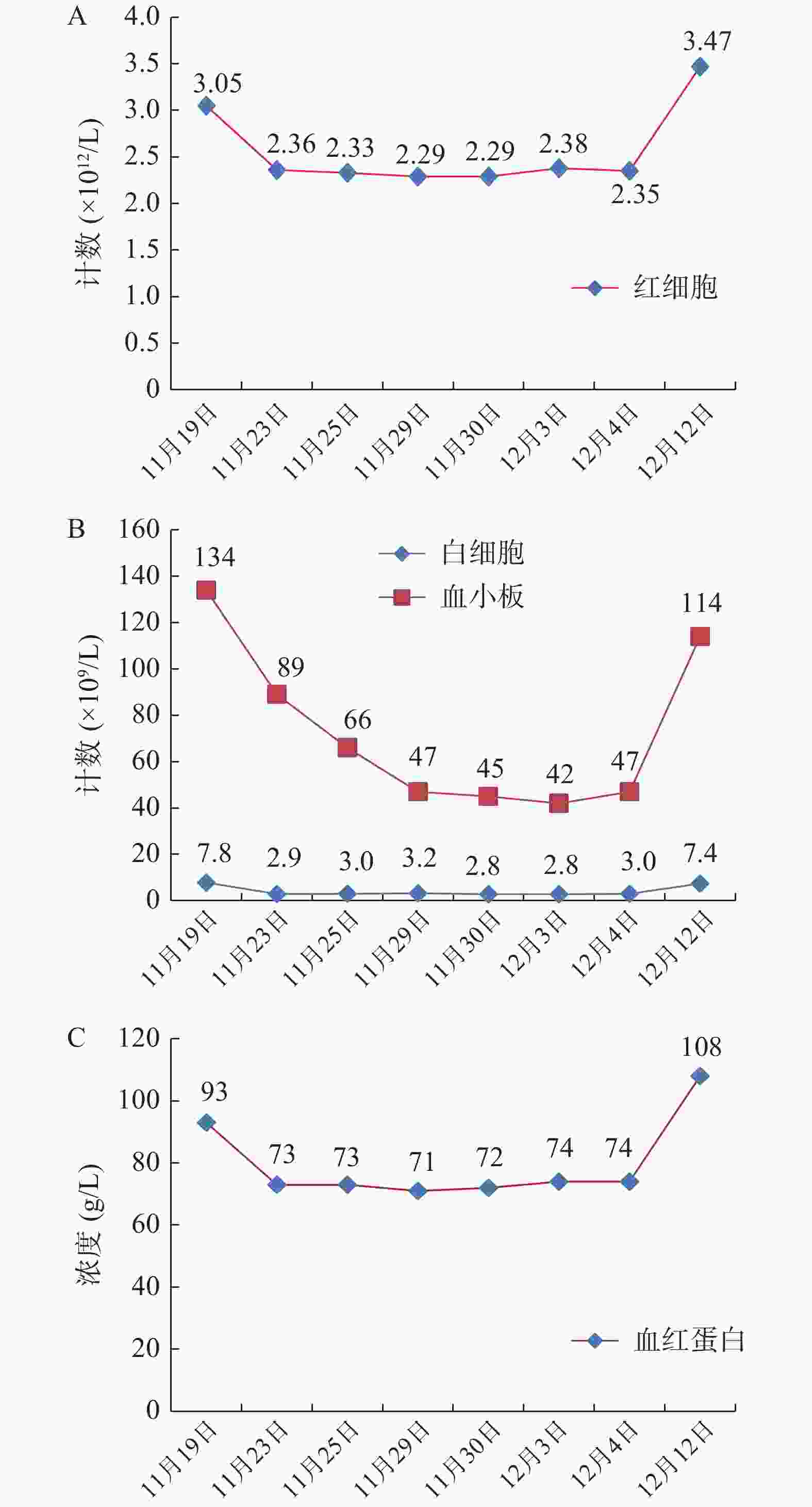
开始用药 药品名称及用法用量 停止用药 2019-11-19 注射用盐酸万古霉素1 g,留腹时间>6 h 注射用头孢他啶1 g qd,加夜间腹透液 2019-11-23 注射用美罗培南1 g+氯化钠注射液100 ml qd 静脉滴注 2019-11-23 2019-11-22 注射用盐酸万古霉素1 g加入头孢他啶留腹的腹透液中 2019-11-25 注射用盐酸万古霉素1 g加入腹透液中 重组人促红素注射液5000 U,皮下注射 2019-11-28 注射用盐酸万古霉素1 g加入腹透液中 2019-12-03 注射用盐酸万古霉素1 g加入腹透液中 11月23日,患者腹痛、腹泻症状较前明显好转,无发热,腹软,上腹轻压痛,无反跳痛,腹透液细菌培养:非解乳链球菌,药敏结果示:万古霉素敏感,故予停用美罗培南、头孢他啶,继续万古霉素1 g q3d,腹膜透析用抗感染治疗。患者全血细胞减少(图1),临床药师分析认为因感染所致或抗菌药物不良反应,目前已停用美罗培南、头孢他啶,根据病情仍需使用万古霉素,密切关注患者血常规变化。
11月25日,患者无明显腹痛、腹泻症状,感染症状明显好转,继续使用万古霉素抗感染治疗,足疗程2周治疗。患者血红蛋白73 g/L,目前仍有贫血,给予重组人促红素注射液5 000 U,皮下注射纠正贫血。11月28日,患者无腹痛、腹泻,腹软,无压痛,无反跳痛,腹透液正常,凝血功能:凝血酶原时间(PT)12.6 s,部分活化凝血酶原时间(APTT)26.6 s,国际标准比率(INR)1.07,血小板66×109/L,血小板进行性下降。据文献报道万古霉素可致血小板减少[4],临床药师分析可能为万古霉素引起的不良反应,仔细询问并对患者进行查体,患者无牙龈出血、咯血、呕血、黑便,全身未见瘀点、瘀斑等出血倾向,感染仍为其主要矛盾,临床药师告知患者:若出现出血现象,及时告知医生和护士,密切复查血常规,若血小板低于30×109/L,可给予重组人白介素-11或重组人血小板生成素注射液,必要时给予输注血小板。
11月30日,患者腹透液澄清透明、无腹泻、无发热等症状,精神状态良好。腹透液检查结果详见表2,测得万古霉素血药浓度:15.4 μg/ml,继续维持万古霉素腹腔灌注治疗。患者本身肾功能不全,加之万古霉素的肾毒性,监测其肾功能是首要任务之一,肾功能主要指标详见表3;观察血细胞是否还是处于持续下降状态(图1)。12月4日,患者腹透液澄清透明、中性细胞数正常,无腹泻、无发热等症状,精神状态良好,病情稳定,予以出院,嘱患者1周后复查血常规。12月12日,复查血常规:白细胞7.4×109/L,红细胞3.47×1012/L,血红蛋白108 g/L,血小板114×109/L,基本恢复正常。
日期 腹透液透明度 李凡他试验 细胞总数(×106/L) 有核细胞计数(×106/L) 2019-11-19 浑浊 阳性 3 420 1715 2019-11-20 微浑 阴性 546 402 2019-11-21 透明 阴性 45 20 2019-11-22 透明 阴性 8 4 2019-11-24 透明 阴性 12 0 2019-11-26 透明 阴性 5 2 2019-11-28 透明 阴性 7 6 2019-11-30 透明 阴性 7 2 2019-12-02 透明 阴性 3 1 日期 血肌酐(μmol/L) 2019-11-19 612↑ 2019-11-23 566↑ 2019-11-26 629↑ 2019-12-03 698↑
-
《腹膜透析相关感染的防治指南(2018)》[9](简称《指南》)指出:出现典型腹膜炎表现的患者,在留取透析液标本和更换连接短管后,应尽早开始经验性抗生素治疗,无需等待腹水常规及培养结果。经验性抗生素的抗菌谱须同时覆盖G+菌和G−菌。根据《2016版国际腹膜透析学会(ISPD)指南》[10]:推荐使用万古霉素或第1代头孢菌素治疗G+菌感染,使用第3代头孢菌素(如头孢他啶)或氨基糖苷类抗生素治疗G−菌感染。推荐腹透液中加入抗生素留腹治疗,间断给药留腹治疗需持续至少6 h[9]。对于CAPD患者,腹腔内抗生素推荐剂量如下[10]:万古霉素15~30 mg/kg,每5~7 d加入腹透液中;头孢他啶1 000~1 500 mg qd,腹膜透析用。ISPD指南的推荐剂量和频次变异程度较大,给临床用药带来一定的困难。万古霉素经腹膜透析清除率的大小主要依据:患者残存肾功能、腹膜的渗透率以及透析时间。结合患者实际情况,临床药师认为每3 d给药一次的方案为好,并建议进行血药浓度监测,根据监测结果调整治疗方案。该患者体重65 kg,万古霉素使用1 g q3d 加入腹透液;头孢他啶使用1 g qd加夜间腹透液。患者入院体温38.8 ℃,CRP、PCT均升高,属于严重腹膜炎,腹膜透析相关感染的防治指南(2018)》指出:严重腹膜炎患者合并发热(体温超过38.5℃),建议联合静脉抗生素治疗[9],细菌性腹膜炎的病原菌主要为G−菌,其中,大肠杆菌为主要致病菌,其次为G+菌,其中以凝固酶阴性葡萄球菌为主,故联合使用了广谱抗菌药物美罗培南静脉滴注抗感染治疗。美罗培南为广谱碳青霉烯类抗生素,对厌氧菌、G+菌与G−菌抗菌活性更强,对大多数β-内酰胺酶(包括G+菌与G−菌所产生的青霉素酶和头孢菌素酶,金属β-内酰胺酶除外)的水解作用具有较强的稳定性;根据《抗菌药物药代动力学/药效学理论临床应用专家共识》[11]:对于肌酐清除率<10 ml/min的患者,美罗培南推荐剂量为0.5 g qd。该患者肌酐清除率为8.08 ml/min,美罗培南使用1 g qd,剂量偏大,临床药师建议:美罗培南给药剂量调整为0.5 g qd。
入院第5天,腹透液培养结果为非解乳链球菌。腹透液细菌培养结果显示患者对万古霉素敏感,故停用头孢他啶和美罗培南,继续万古霉素1 g q3d加入腹透液抗感染治疗。入院第12天,患者腹膜炎明显好转,但全血细胞数下降,血小板进行性降低,患者已使用万古霉素灌腹4次,根据《万古霉素临床应用剂量中国专家共识》[12]:万古霉素血药谷浓度是指导剂量调整最关键和最实用的方法,应在第5次给药前,测定万古霉素血药浓度,故临床药师建议抽血测血药浓度。在透析患者中,由于存在血药浓度的反弹,治疗药物监测(TDM)宜在透析结束后6 h进行[13]。正确的采血时间是血药浓度监测结果指导个体化用药的前提,为了保证测得的血药浓度的准确性,临床药师与临床医师、护士提前做好沟通工作,在他们的帮助下完成透析结束后6 h的采血,测得万古霉素血药浓度为15.4 μg/ml。近年来国际上的指南和共识均建议万古霉素血药谷浓度应保持在15 mg/L以上[9-10],该患者使用万古霉素第5剂给药前监测万古霉素谷浓度,此时患者体内万古霉素血药浓度已达稳态,测得血药浓度值为15.4 mg/L,符合指南推荐的目标血药浓度范围。此治疗方案合理。临床药师建议按疗程继续维持万古霉素灌腹治疗。
-
该老年患者血清肌酐(SCr)612 μmol/L,根据肌酐-肾小球滤过率(EPI)公式得肾小球滤过率(eGFR)为7.75 ml/(min·1.73m2),属于慢性肾脏病5期,无尿,腹透液交换是万古霉素最主要的排泄途径,需密切监测肾功能的变化。《成人万古霉素治疗与监测实践指南》中推荐万古霉素治疗数日后,多次(至少2~3次)监测血清肌酐浓度增高(比基线值增高5 mg/L或超过基础水平50%以上)且没有其他原因解释,则可视为发生了万古霉素肾毒性。该患者用药3 d后SCr 566 μmol/L,用药6 d后SCr 629 μmol/L,用药13 d后SCr 698 μmol/L,SCr较前有所升高但幅度不大,临床药师认为是腹膜炎导致腹膜功能下降从而引起SCr升高,判断其未发生肾毒性。对于一般非重度耐甲氧西林金黄色葡萄球菌(MRSA)感染或预防感染的患者,推荐目标谷浓度为10~15 μg/ml,对于严重MRSA感染的成人患者,建议目标谷浓度维持在15~20 μg/ml,以提高抗感染治疗成功率,但应注意监测患者的肾功能[14]。近年来国际上的指南和共识均建议万古霉素血药谷浓度应保持在15 μg/ml以上[9-10]。该患者的万古霉素血药浓度为15.4 μg/ml,在安全范围内。然而,在入院第5天,患者全血细胞数较前减少;做了几次血常规检验发现,患者血小板进行性下降,引起临床药师的关注。
-
不良反应的发生是否由药物引起的,根据国家药品不良反应评价中心制定的不良反应关联性评价标准,评价标准如下:①用药与不良反应/事件的出现有无合理的时间关系;②反应是否符合该药已知的不良反应类型;③停药或减量后,反应是否消失或减轻;④再次使用可疑药品是否再次出现同样反应/事件;⑤反应/事件是否可用合并用药的作用、患者病情的进展、其他治疗的影响来解释。并将ADR关联性评价分为肯定、很可能、可能、可能无关、待评价、无法评价共6级。患者入院后初始用药给予头孢他啶、万古霉素加入腹透液,美罗培南静滴抗感染。在入院第5天,血常规检验结果显示全血细胞较入院时下降,此时刚停用头孢他啶和美罗培南,未采取相应措施,观察血细胞指标。之后2次检验结果大致同前。入院第12天,患者腹膜炎明显好转,但全血细胞数仍较正常水平下降,血小板进行性降低(图1),从用药时间上全血细胞的减少与万古霉素的使用存在合理的时间关系。万古霉素说明书中介绍其多种血细胞减少发生率小于0.1%,血小板减少频率不明。国内外有万古霉素引起全血细胞减少的相关文献报道[5-8]。万古霉素致全血细胞减少的反应与其已知的不良反应类型相吻合。患者出院后第8天(12月12日)至门诊随访,全血细胞计数较出院时回升(图1),未出现牙龈出血、咯血、呕血、黑便、全身未见瘀点瘀斑等现象与头晕等贫血症状。该患者未再次使用万古霉素。患者疾病因素与该不良反应可能无关,因为感染所致的全血细胞减少多伴有发热,多数患者随着疾病进展会出现血象进行性下降导致全血细胞减少,随着疾病好转血象逐渐恢复正常,外周血表现多为中性粒细胞比例或绝对值的增高等,而该患者使用万古霉素抗感染后,病情逐渐好转,但是白细胞、红细胞、血红蛋白和血小板较前降低,血小板进行性下降,无法用疾病来解释出现全血细胞减少的原因。根据不良反应判断标准,患者符合上述5条标准中的①、②、③、⑤4条内容,所以判定全血细胞减少很可能是万古霉素所致。
-
抗菌药物所致血细胞减少症主要分为两种类型:一是骨髓被药物毒性作用抑制所致,如氯霉素类、磺胺类药物等,临床表现的严重程度与用药剂量相关,一旦发现减少,及时停药多可恢复。二是药物通过免疫机制破坏骨髓造血系统,发病率较高的药物如磺胺类、抗结核类药物,而许多药物所致的血细胞减少是双重机制引起。目前万古霉素引起全血细胞减少的机制尚不清楚,一些学者在做患者的骨髓活检时发现了粒细胞的增多或减少,故而认为万古霉素引起全血细胞减少的机制可能是骨髓抑制[6]。《临床用药须知(2005年版)》中提到万古霉索可偶见粒细胞减少、血小板减少,可能与免疫机制有关[15]。目前多数研究认为,万古霉素致血小板减少和粒细胞减少是通过免疫机制介导的[16-17],主要机制是由万古霉素刺激机体产生的特异性万古霉素依赖性抗血小板抗体,与相应抗原血小板膜上的血小板膜糖蛋白GP Ⅱ b 和(或)GP Ⅲa 结合成免疫复合物,从而引起血小板结构的破坏和功能的丧失,进而引起血小板计数的降低和血液系统的凝血功能障碍。总之,万古霉素相关全血细胞减少的原因可能是单一机制,也可能是多种因素共同作用的结果,具体原因有待进一步研究探讨。
2.1. 抗感染治疗方案评价和调整
2.2. 万古霉素的不良反应监护
2.2.1. 万古霉素与全血细胞减少的关联性评价
2.2.2. 万古霉素致全血细胞减少的机制探讨
-
腹膜透析相关性腹膜炎是腹膜透析最常见的并发症,也是导致患者退出腹膜透析的常见原因之一。万古霉素腹腔灌注是《指南》推荐的治疗措施,该患者腹透液培养结果为非解乳链球菌,腹透液细菌培养结果显示对万古霉素敏感,经万古霉素腹腔灌注后腹膜炎症状明显好转,腹透液生化明显改善。万古霉素最常见的不良反应是耳、肾毒性,临床药师对其不良反应进行了监护,治疗过程中未发生耳、肾毒性;但患者出现了全血细胞减少,临床药师通过查找文献分析可能与使用万古霉素有关,根据不良反应判断标准,患者全血细胞减少的原因很可能是万古霉素所致。临床药师建议在万古霉素达稳态后对该药进行血药浓度监测,根据监测结果调整用药方案。告知医师与护士有关万古霉素采血的时机与有效血药浓度范围的事宜。经监测万古霉素血药浓度为15.4 μg/ml,处于我国和ISPD指南推荐的血药浓度范围内,考虑到该患者的治疗方案有效,且患者未发生严重血细胞减少与其他严重不良反应,故临床药师建议继续当前用药方案的抗感染治疗,但需在用药期间密切监测患者血常规。
以血药浓度监测为指导的个体化治疗为临床药师参与临床治疗提供了新思路。对于本文患者,在应用万古霉素期间患者出现的全血细胞减少,并未盲目地停药或更改用药方案,而是进行了万古霉素血药谷浓度的监测,同时密切关注其血常规变化,并对万古霉素的耳、肾毒性进行用药监护。血药浓度监测结果提示药物浓度在相关指南推荐范围内,万古霉素用药方案合理;用药监护中患者未发生耳、肾毒性及血细胞减少等严重不良反应,所以临床药师建议继续当前用药方案抗感染治疗,并加强对患者的血细胞监测,获得医师采纳。最终患者的感染得到了有效控制,在万古霉素停药后血细胞指标有所好转。
临床上发现万古霉素引起全血细胞减少的病例较少,尽管可逆,但是万古霉素可诱导机体产生相应的抗体,产生的抗体除引起血小板破坏之外,还会引起红细胞和白细胞的破坏,严重者可发生出血和免疫抑制。临床药师应注意当发现有使用万古霉素并出现全血细胞减少的患者,应提高警惕,定期监测血常规,密切关注血小板计数及观察有无出血现象,加强万古霉素的用药监护,提高使用万古霉素的安全性。






 DownLoad:
DownLoad: