-
近年来,侵袭性真菌感染(IFD)的发病率和病死率逐年增高,临床上常见的侵袭性真菌主要有以念珠菌为主的酵母样真菌和以曲霉为主的丝状真菌。而念珠菌引起的IFD的总发病率达0.03%~0.50%,病死率可达35%~80%[1],白念珠菌(Candida albicans)是侵袭性真菌感染中最常见的致病真菌,约占40.1%[2]。尽管目前已研发出有效的抗真菌药物可供临床治疗,但仍存在着耐药性、价格昂贵、毒性大等问题亟需解决[3]。随着抗真菌药物经年累月使用,耐药性问题越发突出。唑类药物是临床常用的抗真菌药物,疗效好、毒性低,但因应用历史较长,临床上对其耐药的真菌越来越多[4]。目前,临床可选择的药物数量有限,解决真菌对药物的耐药性问题便成为一个必须攻克的难关。联合用药是一种有效的克服药物耐药性的方法,两者的协同作用不仅可以克服药物的耐药性,还可以增强原有药物的抗真菌作用[4]。
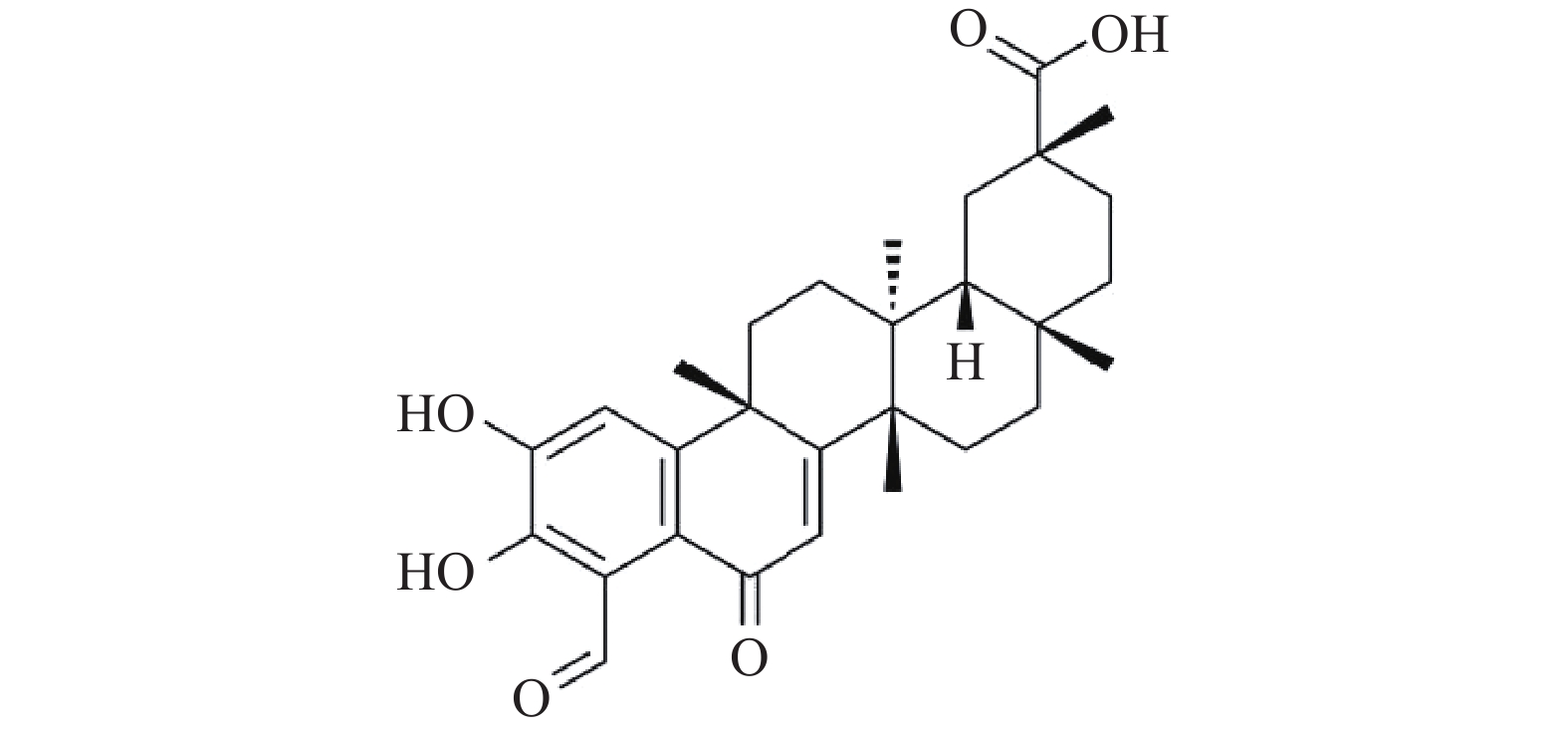
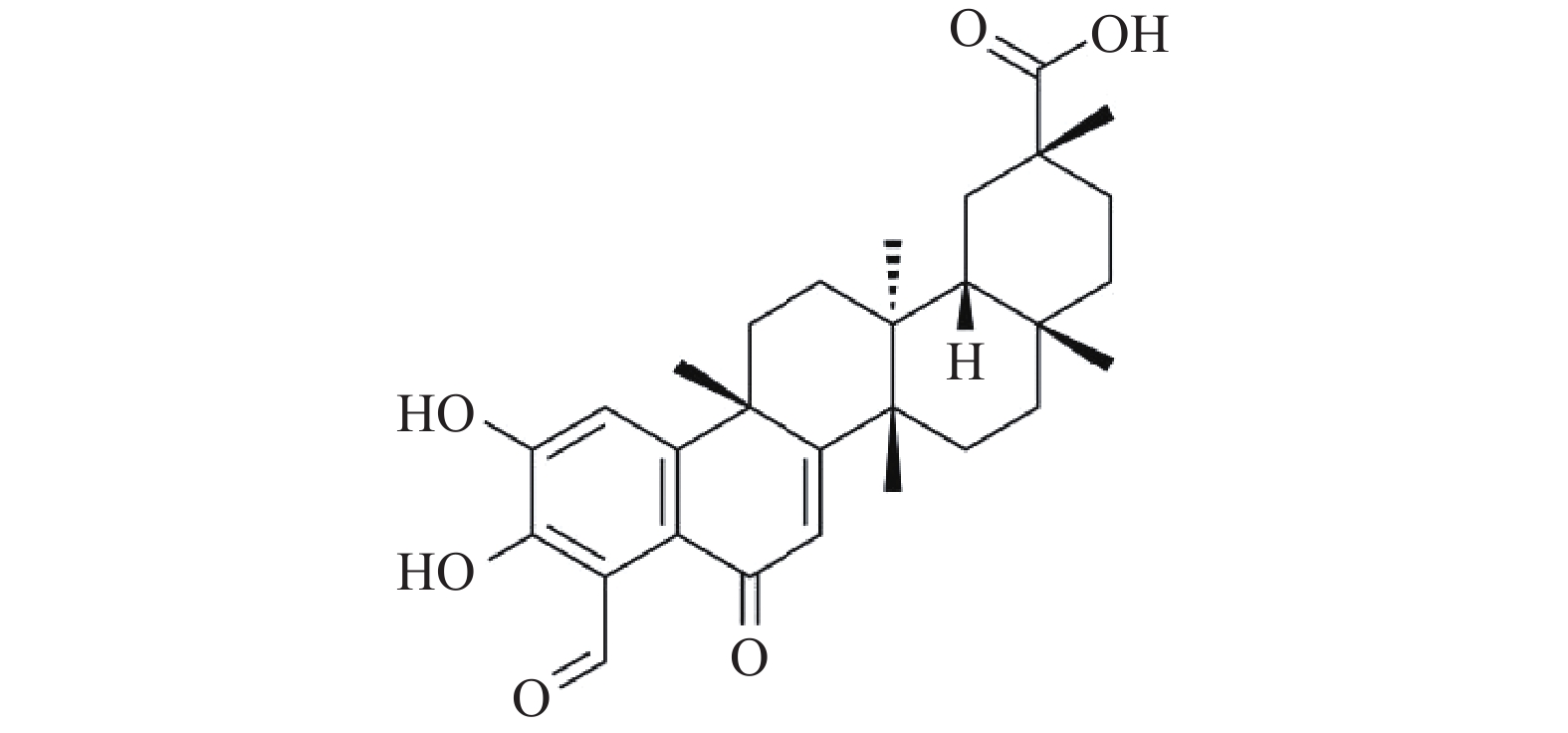
去甲泽拉木醛(DMZ)是从雷公藤根皮中提取的三萜类单体化合物,是雷公藤中含量较高的单体成分,其分子式是C29H36O6(图1)。DMZ具有抗炎、抗癌、免疫调节、抗生育、雌激素代谢调节等药理活性[5],但其在抗真菌方面的研究尚未见报道。本研究发现,DMZ具有良好的广谱抗真菌活性,并且与氟康唑联合使用具有协同抗耐药真菌作用。
-
白念珠菌实验株SC5314来自美国Georgetown大学。白念珠菌(C. albicans)临床株103、7879、9161、10066、9296、10060、10061、7654、901、904、632,耳念珠菌(Candida auris)0029,克柔念珠菌(Candida krusei)62588、4996、10153,热带念珠菌(Candida tropicalis)8915、409,烟曲霉(Aspergillus fumigatus)7544,近平滑念珠菌(Candida parapsilosis)22019、90018,须毛癣菌(Trichophyton mentagrophytes)T5a、T5b由海军军医大学第二附属医院提供。小鼠胚胎成纤维细胞(NIH/3T3)来自中国科学院典型培养物保藏委员会细胞库。
-
DMZ购自陶术生物有限公司;氟康唑(FLC)购自Macklin公司;二甲基亚砜(DMSO)购自国药集团化学试剂有限公司。
-
YPD培养液:酵母浸膏10.0 g,蛋白胨20.0 g。D-葡萄糖20.0 g,加超纯水800 ml溶解,再以超纯水定容至1 000 ml,经高压蒸汽灭菌(121°C,15 min),自然冷却至室温后于4°C保存备用。
PBS缓冲溶液:NaCl 8.0 g,Na2HPO4·12H2O 3.57 g,KCl 0.2 g,KH2PO4 0.24 g,用三蒸水溶解并定容至1 000 ml,高温高压灭菌(121°C,15 min)后室温保存。
RPMI 1640培养基:RPMI 1640(Gibco BRL) 10.0 g,NaHCO3 2.0 g,3-吗啉丙磺酸(MOPS)34.5 g,NaOH 2.7 g,以超纯水定容至1 000 ml,经0.22 μm微孔滤膜抽滤灭菌后于4°C保存备用。
含药SDA培养基:蛋白胨10 g,D-葡萄糖40 g,琼脂20 g,加超纯水800 ml溶解,调整PH为7.0,以超纯水定容至1 000 ml,高压蒸汽灭菌(121 ℃,15 min)。待冷却至50~55 ℃,将适当药物溶液加入液体状态的SDA培养液中,混合均匀,分倒入9 mm细菌培养皿中,自然冷却凝固后于4 ℃保存备用。
DMEM完全培养基:45 ml DMEM高糖培养基中加入5 ml小牛血清,充分混匀后置于4 ℃保存。
-
生物安全柜(BSC-1004II A2,苏州安泰空气技术有限公司);生物显微镜(LW100T,北京测维光电技术有限公司);霉菌培养箱(MJ-150-I,上海一恒科学仪器有限公司);酶标仪(Thermo Multiskan FC,赛默飞世尔上海仪器有限公司)。
-
于−80°C低温保存箱中取出冻存的待测菌株,吸取10 μl菌液加入装有1 ml YPD培养液的15 ml玻璃摇菌管中,置于30°C气浴恒温振荡培养箱中,200 r/min振荡培养。24 h后从YPD菌悬液中吸取10 μl加入到新的1 ml YPD培养液中,继续30°C振荡培养16 h,活化完成,此时的真菌即处于指数生长末期。
取处于指数生长末期的待测菌株置于1.5 ml离心管中,离心(3 000 r/min,1 min),吸弃上清液,用1 ml PBS缓冲溶液洗涤菌株,离心(3 000 r/min,1 min),吸弃上清液,重复洗涤3次。取10 μl真菌原液稀释100倍后,使用血细胞计数板于生物显微镜下计数,计算出真菌原液的菌浓度,然后用RPMI1640培养液稀释配制成实验所需浓度的菌悬液。
-
根据CLSI出版的微量液基稀释法实验手册M27-A3所推荐的标准实验方法来测定[6]。取处于指数生长末期的待测菌株,用RPMI 1640培养基稀释配置成1×103 CFU/ml的菌悬液。取96孔细胞培养板,于第1列加入100 μl RPMI 1640培养基作为空白对照;第2列加入200 μl菌液,3~12列加入100 μl菌液,于第2列每孔分别加入6.4 μl药液,依次2倍倍比稀释至11列,最高药物浓度为64 g/L,12号孔菌液作为生长对照。96孔板置于30°C恒温培养箱中静置培养(白念珠菌24 h,烟曲霉48 h),之后用酶标仪测定630 nm处A值。与生长对照孔比较,抑制80%以上真菌生长对应的最低药物浓度即为MIC80。实验至少重复3次,取较为稳定的结果作为最终的测定结果。
-
取处于指数生长末期的待测菌株,用RPMI 1640培养基稀释配置成1×103 CFU/ml的菌悬液。将配制好的菌悬液涡旋均匀后,转移至6孔细胞培养板中,第1孔加入2.6 ml,第2~6孔每孔加入1.3 ml。取83.2 μl待测化合物溶液加入第1孔中使其终浓度为64 g/L,依次进行倍半稀释,使得第1~6孔中的化合物终浓度分别为64、32、16、8、4、2 g/L。将在6孔细胞培养板中配制好的含药菌悬液按化合物浓度从高到低(64→2 g/L)依次对应转移至96孔细胞培养板的A~F行中,第1列每孔加入200 μl,第2~10列每孔加入100 μl。第11列的A11~F11孔和第G行的G1~G10孔中加入未加药的空白菌悬液100 μl/孔。将配制好的FLC溶液分别加入第1列的A1~G1孔中,每孔加入6.4 μl使其终浓度为64 g/L。各列从左到右依次进行倍半稀释,使得第1~9列的FLC终浓度分别为64→0.25 g/L。96孔细胞培养板第11列的A11~F11孔中为未加任何药物作用的菌悬液,作为阴性对照组。第12列和H行各孔中分别加入100 μl的RPMI 1640培养液,作为空白对照组。将96孔细胞培养板置于30°C恒温培养箱中静置培养,48 h后使用酶标仪测定每孔真菌在630 nm处的光密度值A630。以阴性对照组的A630值为100%,利用公式计算协同指数FICI。FICI的计算公式为:FICI=MIC80 化合物(联用)/MIC80 化合物(单用)+MIC80 FLC(联用)/MIC80 FLC(单用)
-
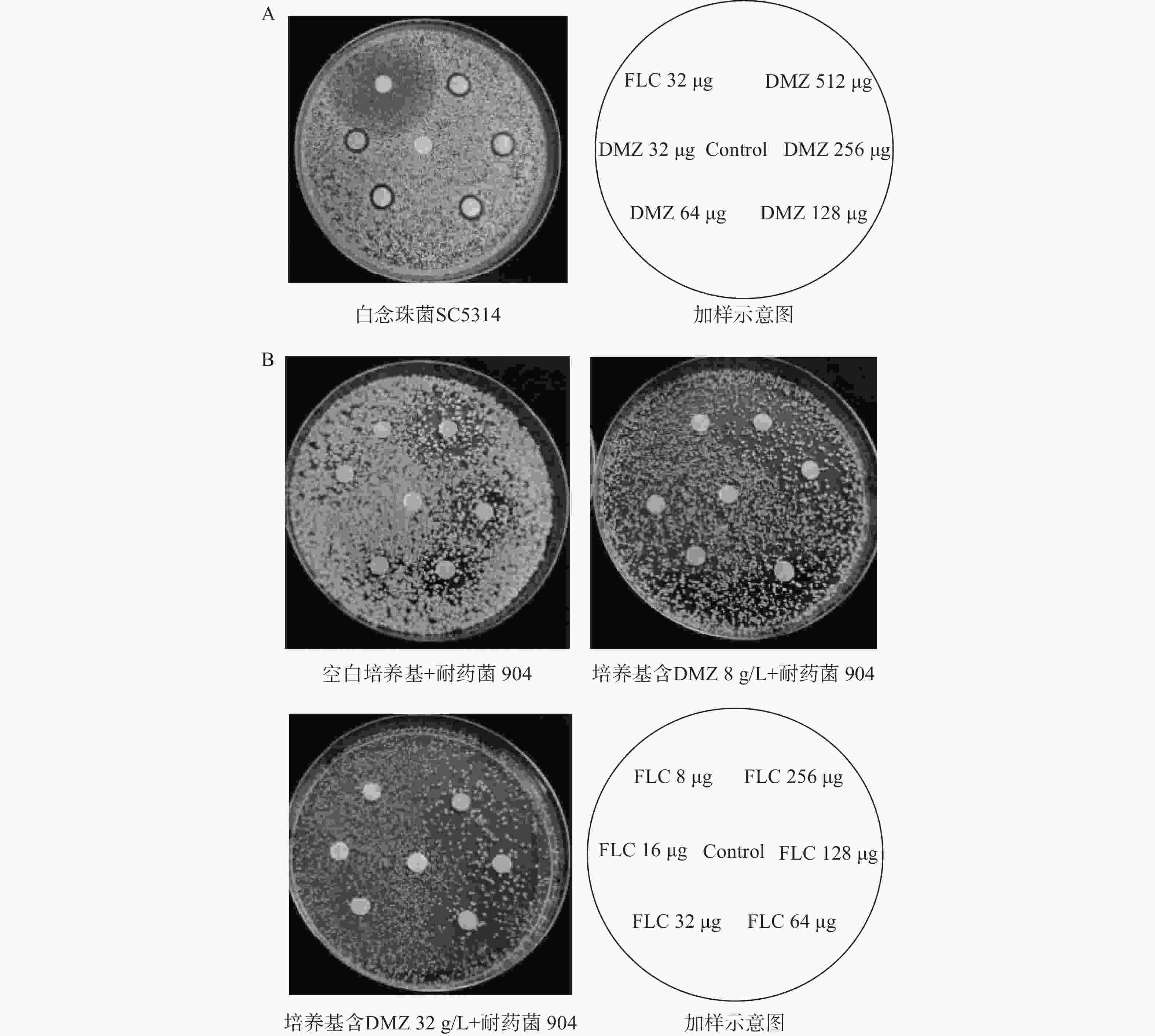
取己洗涤的待测真菌,用PBS缓冲溶液稀释配制成实验所需浓度(1x106 CFU/ml)的菌悬液,吸取100 μl均匀涂布于含药的SDA培养基中(考察协同作用时培养基中应加入适宜浓度的DMZ)。在培养基中等距放置7枚灭菌纸片,向纸片中滴加药液,使纸片载药量分别为0、2、4、8、16、32 μg(载药量视实验情况而定),置于30°C恒温培养箱中静置培养48 h,观察真菌生长情况并拍照记录[7]。
-
取小鼠胚胎成纤维细胞(NIH/3T3),胰酶消化后,离心收集细胞并用DMEM完全培养基重悬。血细胞计数板计数后调整细胞密度至5x104个/ml。取96孔板划分出实验区、对照区、无细胞区。实验区、对照区每孔加入100 μl细胞液,无细胞区加100 μl DMEM完全培养基,注意尽量使孔内细胞分布均匀。细胞于37°C培养箱中贴壁过夜。第2天,取无菌EP管,用DMEM完全培养基对待测药物进行倍比稀释,随后取出96孔板,吸弃培养基。每孔加100 μl含不同浓度药物的DMEM完全培养基,37°C继续孵育24 h。取出96孔板,吸弃培养基,每孔加110 μl含CCK-8的DMEM完全培养基(CCK-8∶DMEM完全培养基=1∶10),37°C孵育2 h。测量各孔的A450。处理结果时用实验区、对照区A值减去无细胞区的A值,以对照区细胞活力为1.0,计算各组细胞活力。重复3次实验,用GraphPad作图并统计分析。
-
测定DMZ对临床中常见的病原真菌的抗菌活性,共计23株。实验结果显示,DMZ对所试真菌都有一定的抑制效果(表1)。对白念珠菌(含11株临床株)的MIC范围为4~16 g/L,值得注意的是,其中有3株临床菌对FLC显示出较强的耐药性(901、904、632),DMZ对它们的MIC稳定在8 g/L,表现出与敏感菌类似的抗菌活性。对FLC天然耐药的耳念珠菌与克柔念珠菌,DMZ也表现出较好的抗真菌活性,MIC分别为32 g/L、2~8 g/L。对其他的念珠菌如热带念珠菌、近平滑念珠菌也有较强的抗菌活性,MIC为4~16 g/L,对丝状菌如烟曲霉菌、须毛癣菌有较好的抗菌活性,MIC分别为32 g/L和2 g/L。以上结果表明,DMZ对常见的病原真菌均表现出较好的抗菌活性,抗菌谱较广。
菌种 菌株 MIC80(g/L) FLC DMZ 白念珠菌 FLC敏感菌株 SC5314 0.25 8 7654 0.25 4 103 2 16 9161 0.25 4 10066 2 8 10060 0.25 4 10061 0.25 4 7879 1 8 9296 0.25 8 FLC耐药菌株 901 64 8 904 64 8 632 64 8 耳念珠菌 0029 64 32 热带念珠菌 8915 16 8 409 1 16 烟曲霉 7544 64 32 近平滑念珠菌 22019 2 4 90018 1 8 克柔念珠菌 4996 16 8 62588 16 8 10153 32 2 须毛癣菌 T5b 32 2 T5a 32 2 -
选取3株对FLC耐药的白念珠菌901、904和632,采用棋盘微量液基稀释法考察DMZ与FLC联合使用是否存在协同作用。结果显示,在与2 g/L DMZ联合使用的情况下,FLC对上述3株耐药菌的有效浓度从64 g/L降低至0.25 g/L(表2),是原抗菌浓度的1/256,两药联合使用的FICI为0.129~0.254,表明DMZ与FLC具有较强的协同抗耐药菌作用。
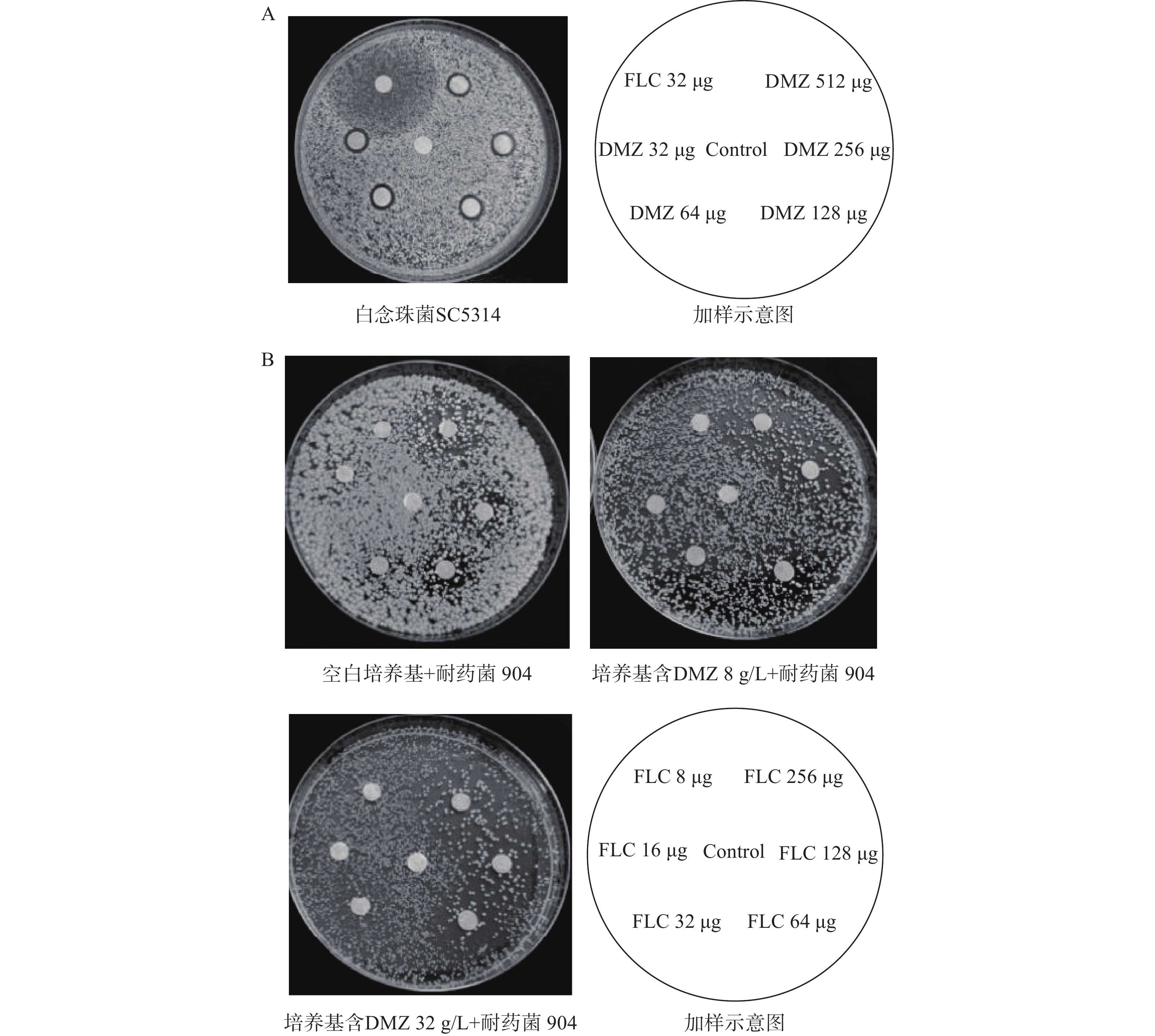
菌株 MIC80(g/L) 协同指数 单用FLC 单用DMZ 联用FLC 联用DMZ 901 64 8 0.25 2 0.129 904 64 16 0.25 2 0.254 632 64 8 0.25 2 0.254 应用琼脂平板扩散实验更直观地验证了DMZ与FLC的协同抗真菌作用。结果显示,在单用DMZ的情况下,不同浓度的DMZ均产生了明显的抑菌圈,但抑菌圈直径的大小并没有显示出剂量依赖性;单用FLC能产生较大的抑菌圈,但抑菌作用较弱,抑菌圈内部仍有少量真菌菌落生长(图2A)。进一步用抑菌圈实验验证两药联用对耐药菌的抗真菌效果。结果显示,在含有一定浓度DMZ的琼脂中,真菌长得稀薄,DMZ的浓度越高,真菌长得越稀薄,表现出剂量依赖性。在含有不同浓度FLC的纸片周围都出现了直径较大的抑菌圈(图2B),抑菌圈的大小与FLC的含量呈现出明显的剂量依赖关系。上述实验结果表明,DMZ与FLC联合使用具有协同抗耐药菌的作用。
-
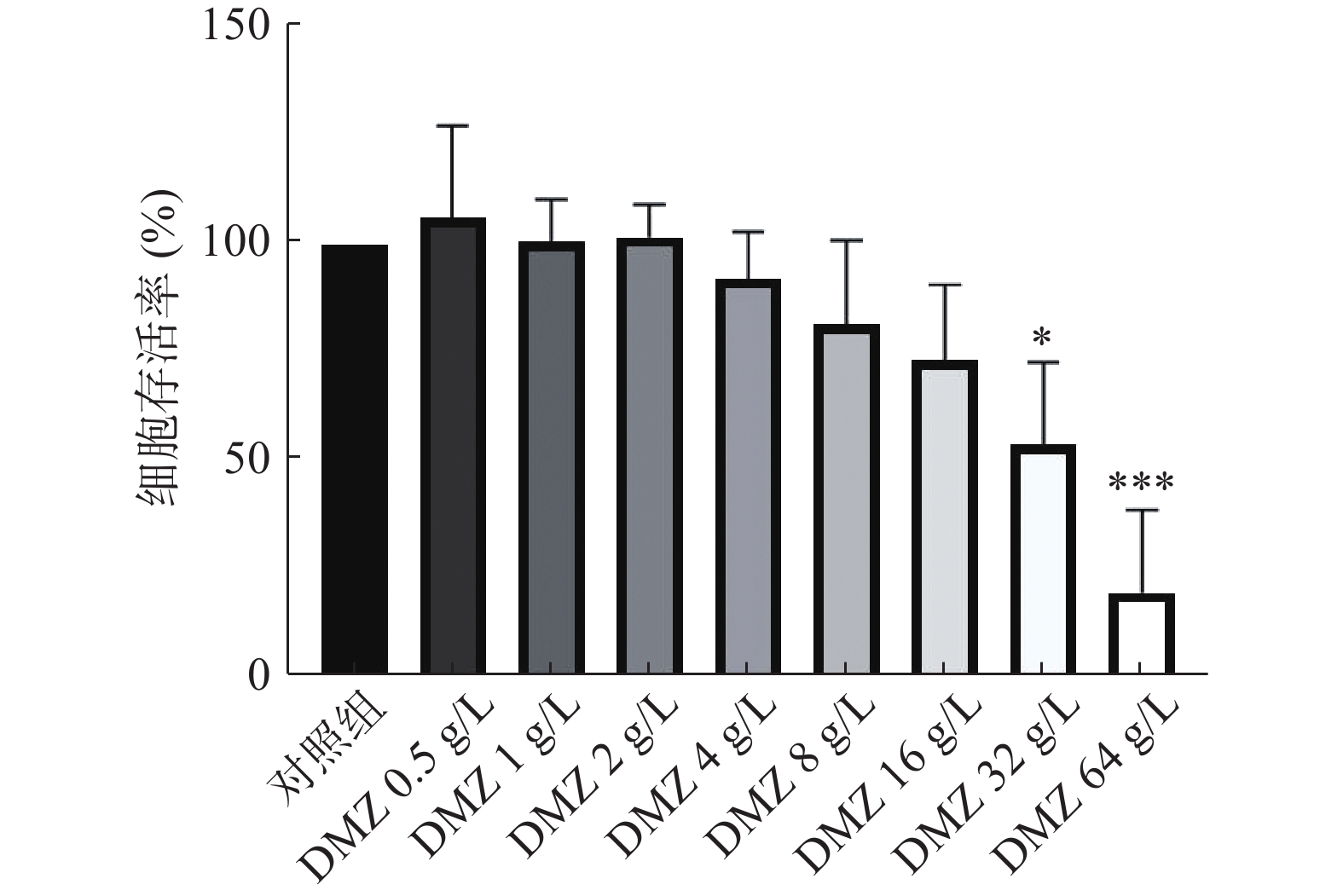
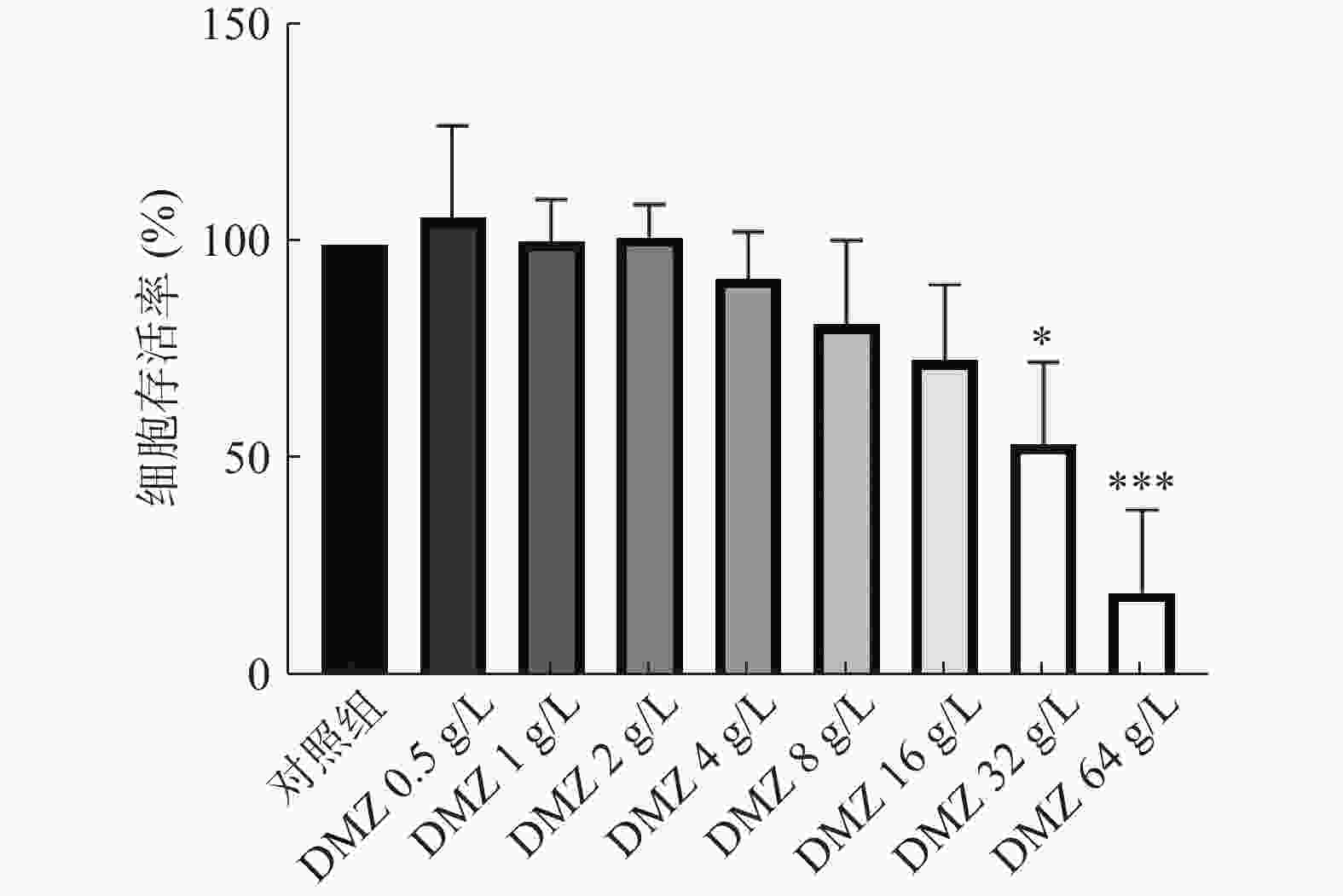
利用CCK-8法考察DMZ对小鼠胚胎成纤维细胞的毒性。CCK-8试剂中含有WST-8,在电子载体的作用下被细胞中的脱氢酶还原为具有高度水溶性的黄色甲瓒产物,生成的甲瓒物的数量与活细胞的数量成正比。因此,可利用这一特性考察DMZ对哺乳动物细胞的毒性。结果显示,当DMZ浓度为32 g/L时,小鼠胚胎成纤维细胞的存活率下降到54%,显示出一定毒性,而低于32 g/L时DMZ的毒性较低,没有表现出显著的细胞毒作用(图3)。实验结果通过单因素方差分析(ANOVA),然后进行事后Dunnett-t检验,标准偏差基于3次独立实验。
-
中药作为我国传统药物,在抗真菌病方面有极佳的待研发前景,从中草药中提取出疗效佳、毒副作用小、不易耐药、价格低廉的新型抗真菌药物已成为目前的研究热点[8]。DMZ是从雷公藤树皮中分离提取的酚性去甲基三萜化合物,是雷公藤中含量较高的单体,是一种结构明确、易分离的天然产物[9]。本研究考察了DMZ的抗真菌作用和协同FLC抗真菌的作用。
IFD每年的发病率为每6万人中约有100例[10]。侵袭性念珠菌感染(IC)在IFD中占主要地位,约有80%的IFD是IC引起的[11]。其中,白念珠菌是导致IC的最主要的念珠菌种类[12],但近年来,其他念珠菌的占比在逐渐升高[13]。DMZ的抗菌谱很广,对常见的念珠菌如白念珠菌、热带念珠菌、近平滑念珠菌、克柔念珠菌等均有较好的抗菌活性,MIC在2~16 g/L,对其他IFD中常见的病原菌如烟曲霉菌也有很好的抗菌活性。耳念珠菌是近年来新兴的一种念珠菌,因其多重耐药性而受到关注,又被称为“超级真菌”,不到10年的时间里已在全球范围内传播,且发病率、病死率高[14]。有研究表明[15],耳念珠菌中有高达90%的分离株对氟康唑产生耐药。DMZ对耳念珠菌也有一定的抗菌活性(MIC值为32 g/L),为研发抗耳念珠菌的药物提供了新的选择。
FLC是一种典型的唑类抗真菌药物,已在临床上使用近30年。鉴于FLC的抗真菌作用强且安全性高,长期以来都是一线抗真菌药物。然而,唑类药物的广泛使用导致了真菌对其有严重的耐药性,从而降低了治疗效果。其耐药机制主要包括:药物靶点的突变、甾醇生物合成途径的变化以及转录因子的功能突变导致麦角甾醇生物合成基因和多药外排泵的组成性上调等[16]。DMZ对氟康唑耐药的念珠菌有类似于敏感菌的抗菌活性,这表明DMZ的抗菌作用机制可能与FLC不同,有潜力用于抗耐药真菌。已有研究报道,DMZ通过激活外源性细胞凋亡在体外抑制癌细胞的细胞生长,并降低了癌细胞中的线粒体膜电位[17],这将为DMZ的抗真菌机制提供研究方向。
药物联合使用是应对耐药菌的一种常用策略。DMZ与FLC具有较强的协同抗菌效果,能有效抑制耐药菌的生长。两药联用可以将FLC的有效浓度降低数百倍,DMZ的疗效也增加数倍。细胞毒性实验结果表明,DMZ在抗真菌作用浓度范围时(特别是与FLC联合使用时),毒性相对较低。两药联合使用时,DMZ起效浓度仅有细胞毒浓度的几十分之一。在增加药物疗效的同时,降低了药物用量,从而减少了毒副作用。另外,DMZ与FLC作为两种不同作用机制的抗真菌药物联合使用,还能起到预防真菌耐药的作用。总之,DMZ作为一种广谱、高效的抗真菌天然产物,具有较强的与FLC协同抗真菌能力,有潜力成为抗真菌候选先导化合物。同时,还有潜力成为一种增效剂,与FLC联合使用应对耐药真菌。
Study on antifungal effect of demethylzelamaldehyde in vitro
doi: 10.12206/j.issn.2097-2024.202310011
- Received Date: 2023-10-10
- Rev Recd Date: 2024-02-20
- Available Online: 2024-04-24
- Publish Date: 2024-04-25
-
Key words:
- Candida albicans /
- demethylzeylasteral /
- fluconazole /
- synergistic effects /
- drug resistance
Abstract:
| Citation: | HAN Lei, ZHONG Hua, WANG Xinrong, WANG Yan. Study on antifungal effect of demethylzelamaldehyde in vitro[J]. Journal of Pharmaceutical Practice and Service, 2024, 42(4): 151-156. doi: 10.12206/j.issn.2097-2024.202310011 |






 DownLoad:
DownLoad: