-
雷公藤为卫矛科雷公藤属植物雷公藤Tripterygium wilfordii Hook.f.的干燥根,是一种公认的同时具有较强药效和较强毒性的中药材,广泛用于治疗类风湿性关节炎、肾病综合征、系统性红斑狼疮等疾病[1]。但其毒性较大,不良反应高发且严重,常使患者不能耐受[2]。雷公藤的主要有效成分为二萜类、三萜类和生物碱类,研究表明各种成分均具有不同程度的抗炎、抗肿瘤和免疫抑制等活性[3-4],其中生物碱的毒性要小于二萜和三萜类成分,临床应用具有疗效好,不良反应较小的特点[5]。雷公藤次碱是雷公藤生物碱中含量较高的一种倍半萜类单体化合物。目前研究显示其具有良好的杀虫活性,其他药理活性和机理研究较少,特别是抗炎和免疫抑制活性方面。
本研究主要通过建立脂多糖(LPS)诱导的RAW264.7细胞炎症模型,探讨雷公藤次碱对LPS诱导的炎性因子NO,IL-1β,TNF-α和IL-6释放的影响,用免疫印迹法考察雷公藤次碱对TRAF6、IRAK、NF-κB、IκBα、JNK、ERK、p38等关键蛋白表达或磷酸化的影响,探讨其可能的抗炎作用机制,为促进雷公藤次碱的应用研究提供基础。
-
雷公藤次碱(纯度98%,上海纯优生物科技有限公司);DMEM细胞培养基、胎牛血清(Life Technologies GIBCO);Griess试剂、细胞计数盒-8 (CCK-8)(上海碧云天生物技术有限公司);脂多糖(LPS, Sigma-Aldrich);IL-1β、TNF-α和IL-6检测试剂盒(达科为生物技术有限公司);核质提取试剂盒(Dojindo Laboratories);TRAF6、IRAF、p-IRAF、p-p38、p38、p-JNK、JNK、p-ERK、ERK、p-IκBα、IκBα、NF-κB p65、β-actin、HRP山羊抗兔抗体(Cell Signaling Technology);RAW264.7细胞购自中国科学院上海细胞库。
-
RAW264.7细胞在含10%的新生小牛血清及100 U/ml青霉素、链霉素的DMEM高糖培养液中进行培养,培养条件为5%CO2、37 ℃,隔天换液,每日观察细胞的生长状况。实验时取对数生长期RAW264.7细胞,胰酶消化,加入新鲜培养基反复吹打成细胞混悬液,细胞增殖实验、细胞因子分泌含量测定调整细胞浓度为1×105 cells/ml,以每孔100 μl细胞悬液接种于96孔细胞培养板中,细胞蛋白表达测定调整细胞浓度到2.25×105 cells/ml,以每孔2 ml接种于6孔细胞培养板中,然后细胞置于37 ℃、5%CO2培养箱中培养过夜。在药物处理前2 h给予LPS溶液(使其终浓度为1 μg/ml)诱导RAW264.7细胞发生炎症反应建立模型。设空白组(不给予LPS和药物处理)、模型组(给予LPS处理)、药物组(给予LPS诱导后再给予相应浓度的药物进行处理),每组设6个复孔(n=6)。
-
设空白组和药物组,药物组分别给予终浓度为200、100、50和25 μmol/L的雷公藤次碱药液进行处理。细胞分别培养24和48 h,实验结束4 h前加入10 μl CCK-8试剂,结束后以酶标仪于450 nm处检测吸光度(A)。
-
设空白组、模型组和药物组,药物组细胞给予LPS诱导后分别给予终浓度为100、50、25 μmol/L的药液进行处理。细胞培养24 h后取出,吸取细胞上清液,Griess试剂法检测上清中NO光密度值,ELISA试剂盒检测上清中IL-1β、TNF-α和IL-6的光密度值。
-
设空白组、模型组和药物组,药物组细胞给予LPS诱导后分别给予终浓度为100、50、25 μmol/L的药液进行处理。细胞培养24 h后取出,用4 ℃预冷的PBS液洗涤各孔两次,然后,吸弃PBS液,每孔中加入200 μl 4 ℃预冷的RIPA提取细胞蛋白,在13000 r/min下离心20 min,弃去上清,得各样本。用Bradford法对蛋白定量;使用细胞核/质提取试剂盒制备用于检测p65/NF-κB的胞质和核提取物。每孔加入20 μg蛋白上样,在SDS-PAGE凝胶中电泳,蛋白转移到PVDF膜上,用BSA封闭2 h。分别用相应一抗4 ℃孵育过夜,然后用与辣根过氧化物酶偶联的二抗(1∶1000)孵育2 h。最后用 ECL超敏发光液显影,于凝胶成像仪中曝光,使用 LAS成像软件对条带进行定量分析
-
实验数据的统计分析用(
$ \bar x \pm s $ )表示,采用单因素方差分析法进行统计学处理。应用Alpha软件处理Western Blot实验所得目标带的光密度值,并以各自的β-actin蛋白条带灰度值与目标条带灰度值的比值作为蛋白相对表达水平值。 -
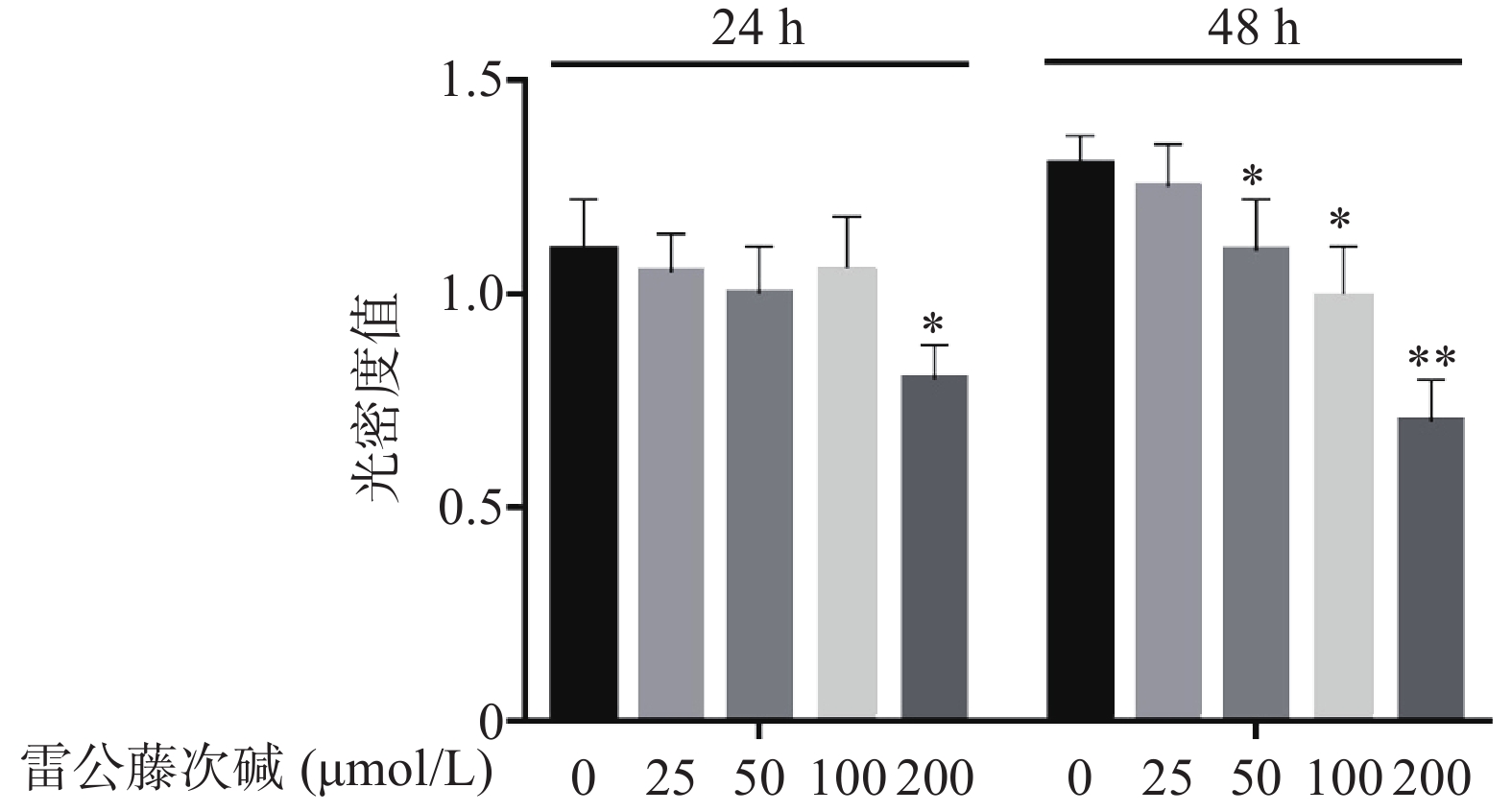
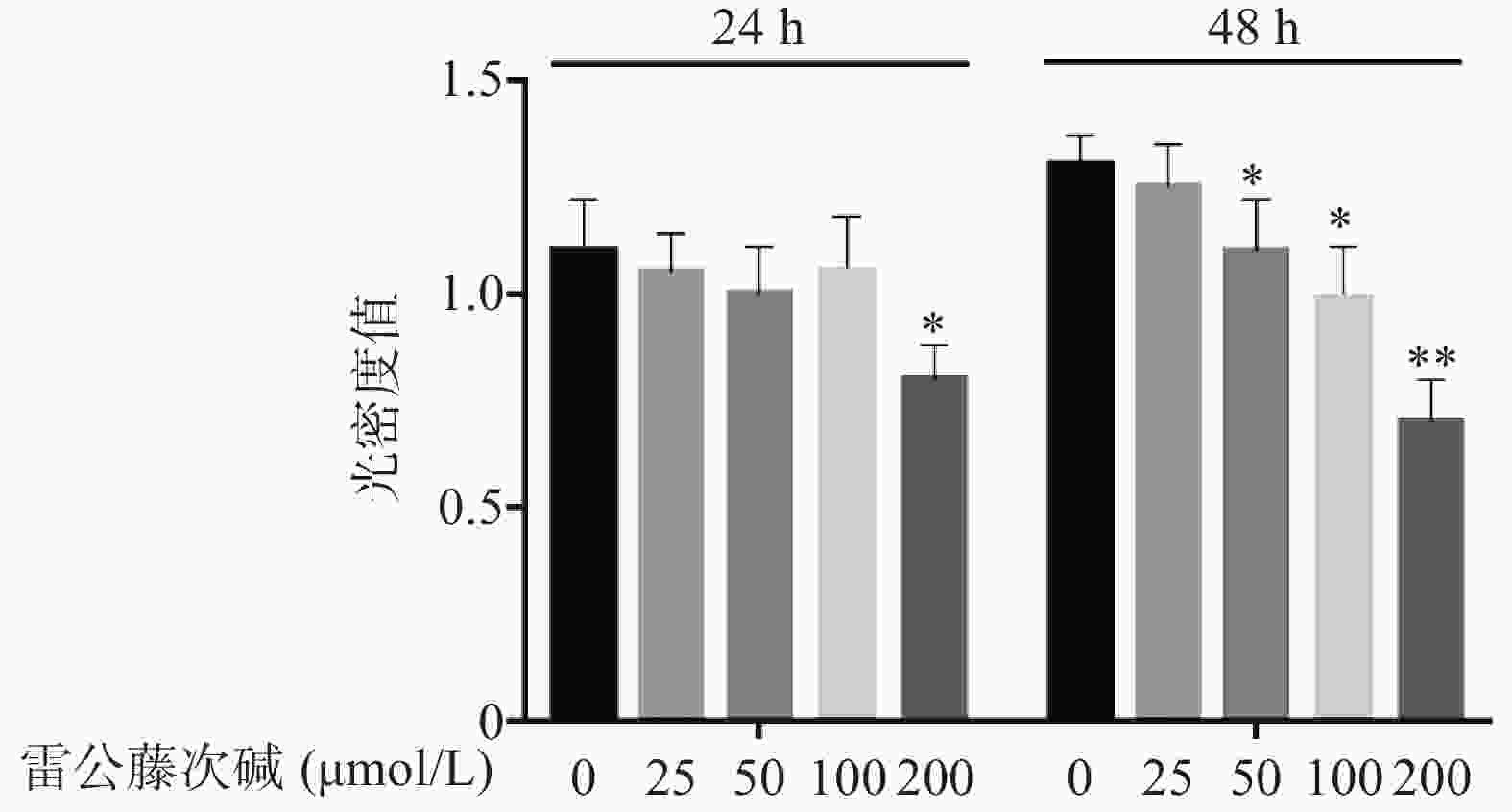
图1显示了不同浓度雷公藤次碱对RAW264.7细胞的细胞毒性作用。给予雷公藤次碱(25~200 μmol/L)孵育24 h后,200 μmol/L雷公藤次碱可显著抑制RAW264.7细胞活性;孵育48 h后,50、100和200 μmol/L雷公藤次碱均可显著抑制RAW264.7细胞的活性。
-
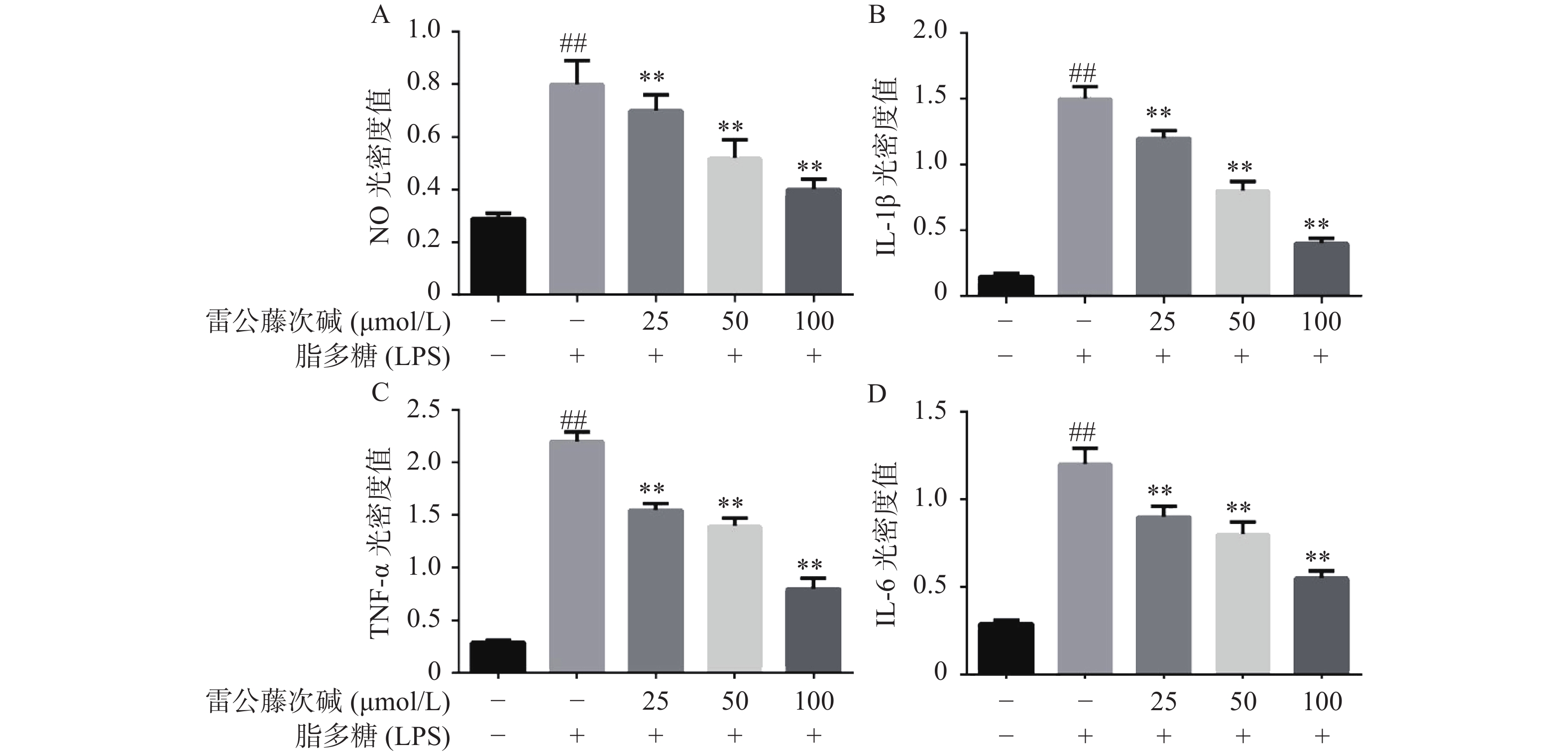
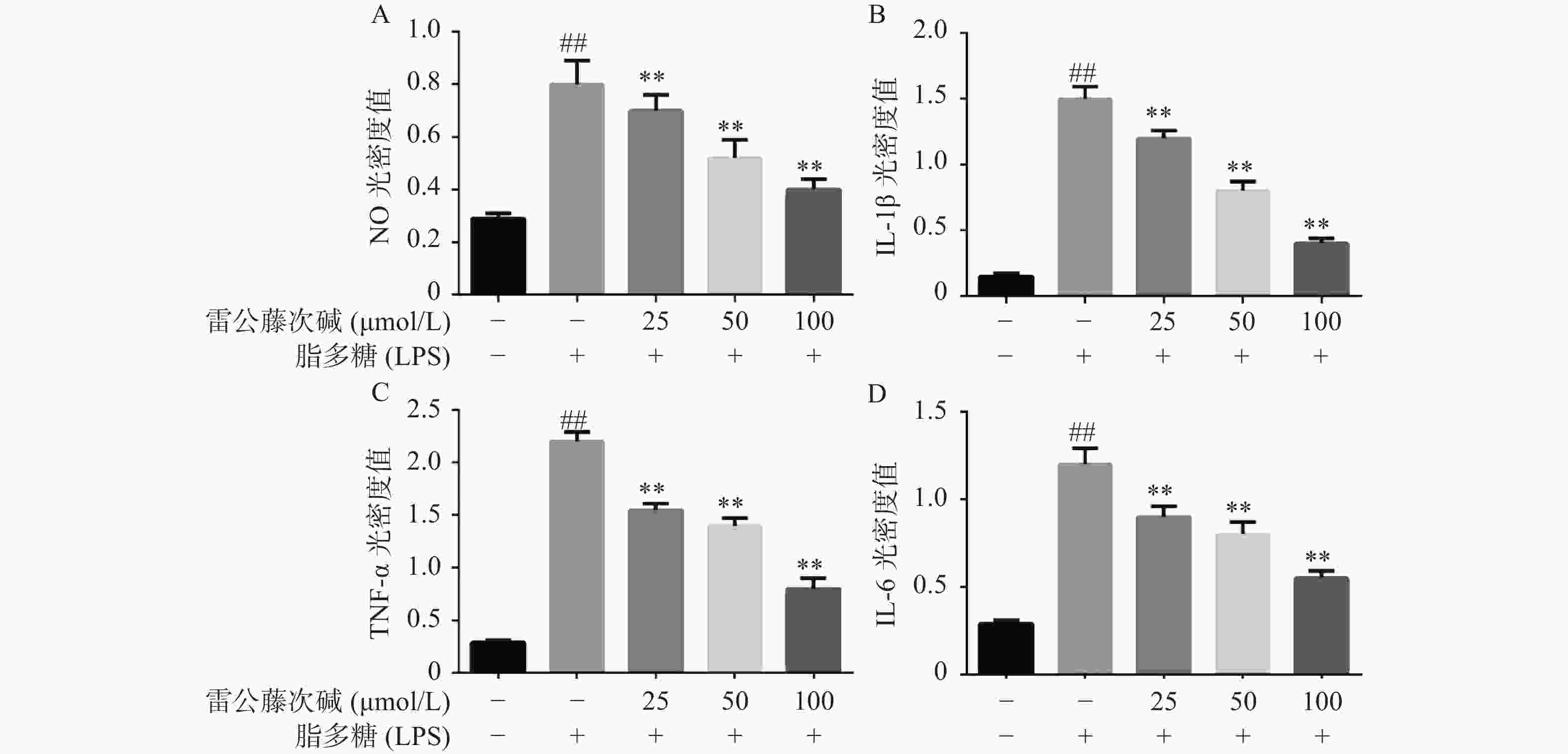
为了进一步研究雷公藤次碱体外抗炎活性,检测了雷公藤次碱对LPS刺激RAW264.7细胞分泌炎症因子的影响。结果显示(图2),给予LPS刺激后的RAW264.7细胞,NO、IL-1β、TNF-α和IL-6等促炎因子释放水平急剧增加(P<0.01),给予不同浓度雷公藤次碱(100、50和25 μmol/L)处理后,上述因子分泌水平呈剂量依赖性显著降低(P<0.01)。由此提示,雷公藤次碱的抗炎作用可能与抑制细胞释放NO、IL-1β、TNF-α和IL-6等促炎因子有关。
-
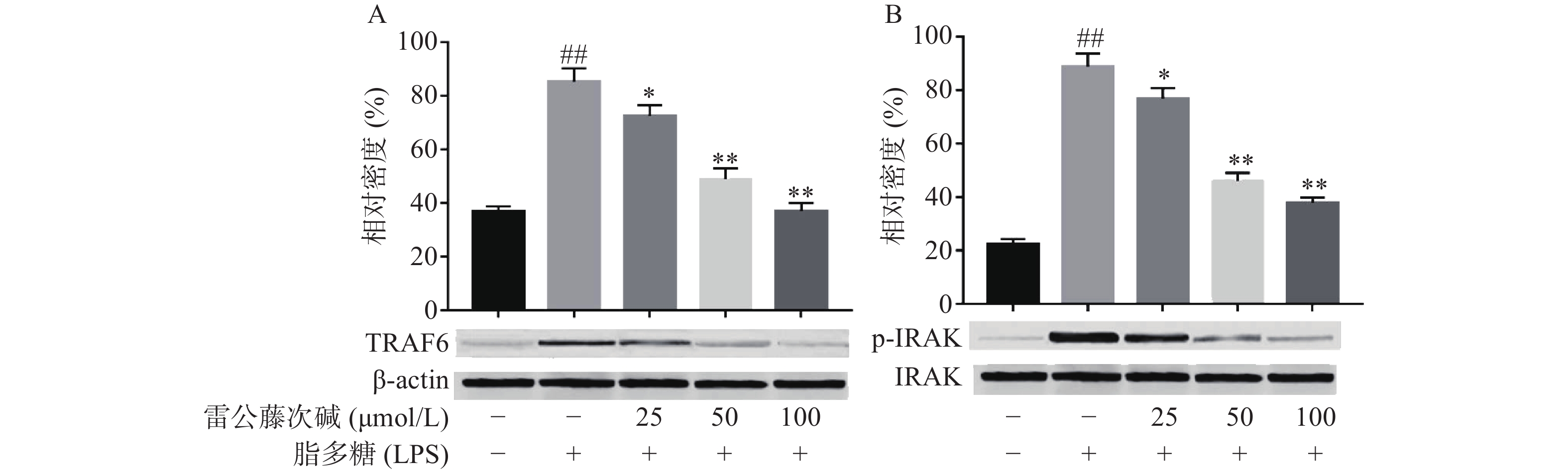
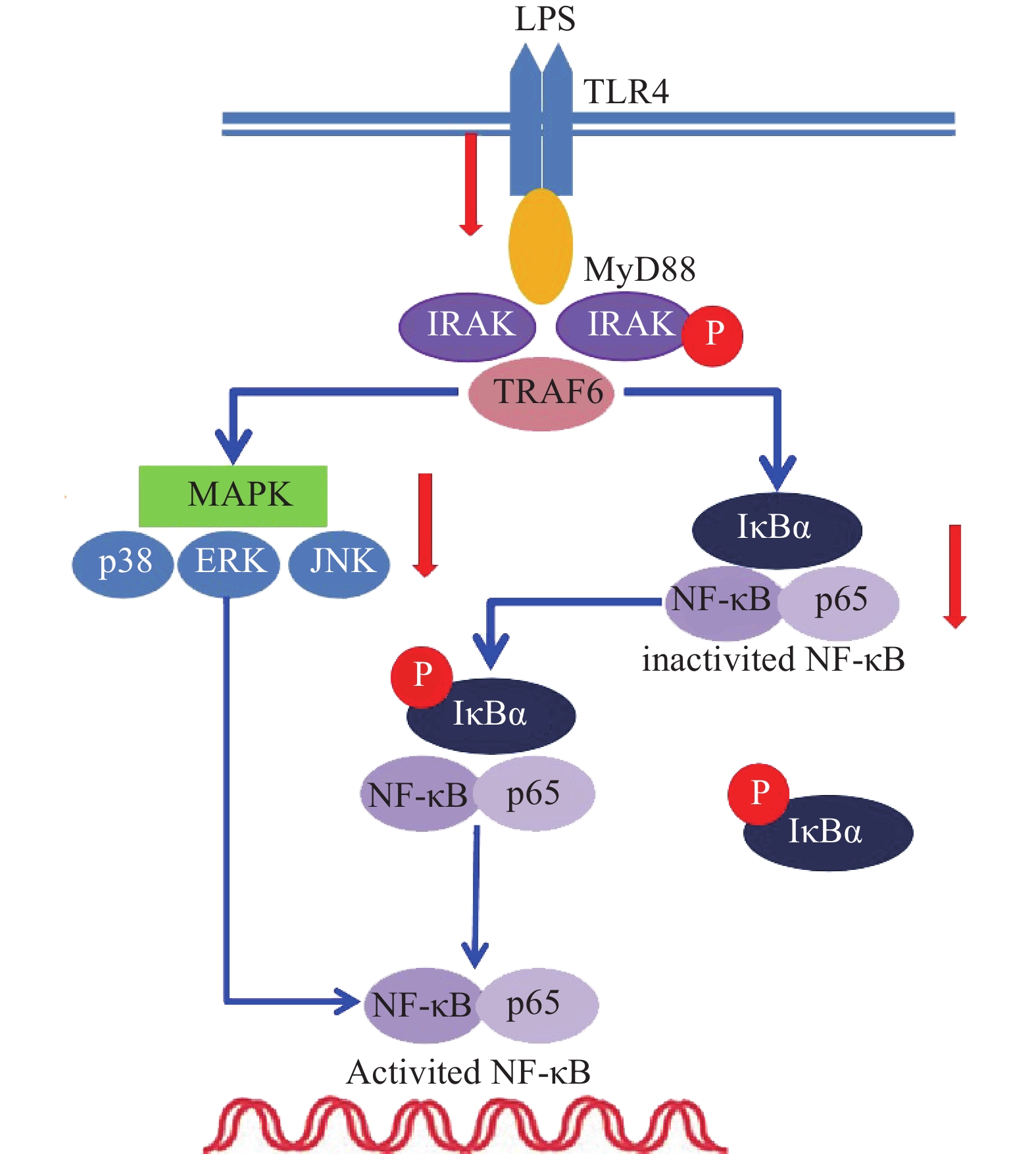
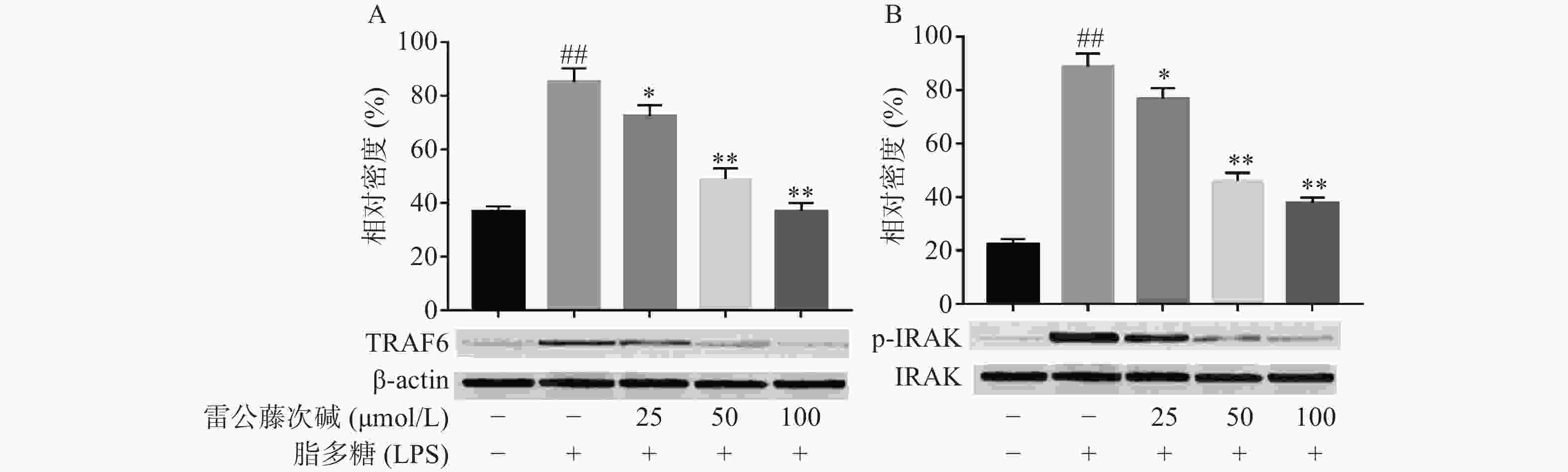
LPS是引发炎症的早期关键因素,可诱发多种细胞内信号事件,LPS-TLR4/MyD88信号通路可调节促炎基因表达,并控制炎症相关细胞因子的表达,其中IRAK及TRAF6是MyD88依赖性途径中的关键信号传导的分子。TLR4受体受LPS诱导后,可导致IRAK磷酸化从而脱离MyD88与TRAF6的结合体,使得游离的TRAF6活化后续信号转导途径[6]。为了评估雷公藤次碱对LPS激活TLR4/MyD88信号通路的影响,蛋白印迹法考察了雷公藤次碱对IRAK磷酸化和TRAF6表达的影响。结果显示(图3),与空白组相比,LPS刺激的模型组IRAK磷酸化和TRAF6表达明显增加(P<0.01);与模型组相比,雷公藤次碱各剂量组可显著抑制IRAK磷酸化和降低TRAF6表达(P<0.01)。
-
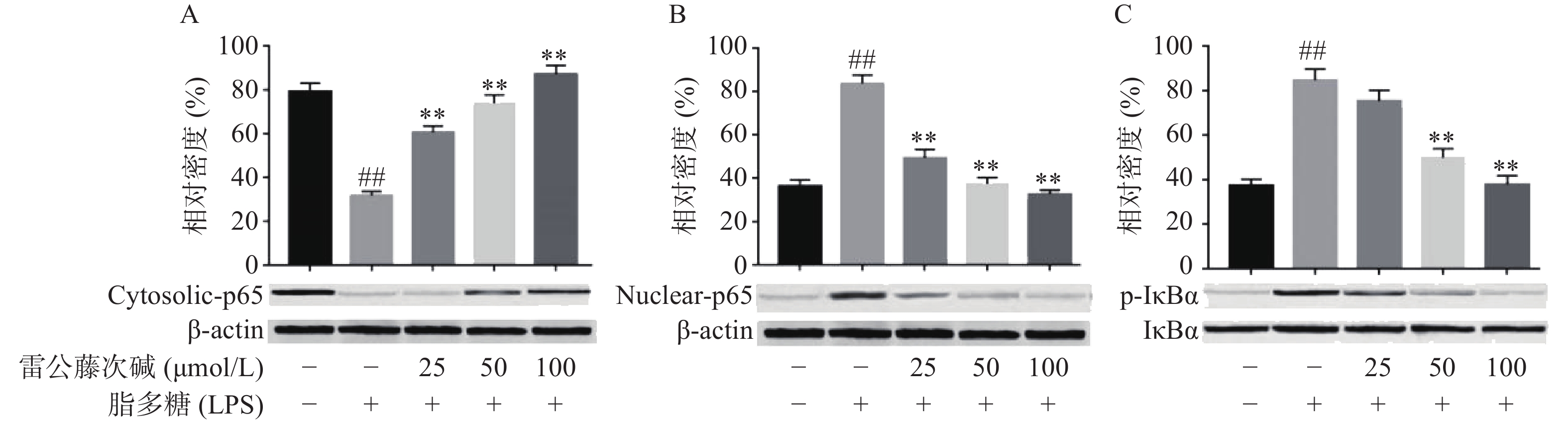
NF-κB是MyD88信号通路中重要的转录因子[7]。我们考察了雷公藤次碱对LPS诱导的RAW264.7细胞中NF-κB活化的潜在影响。如图4所示,RAW264.7细胞LPS刺激后,细胞核内NF-κB p65水平增高而细胞质内NF-κB p65水平降低,说明NF-κB p65活化后由细胞质进入到细胞核内,而给予雷公藤次碱处理后,细胞质内NF-κB p65水平增高而细胞核内NF-κB p65水平降低,说明雷公藤次碱以浓度依赖的方式显著地阻止了NF-κB p65从细胞质转运到细胞核。 NF-κB p65易位进入核内与TLR4途径中的IκBα磷酸化有关。因此,我们考察了雷公藤次碱对NF-κB抑制蛋白IκBα磷酸化的影响。结果表明,雷公藤次碱以浓度依赖的方式显著抑制LPS诱导的IκBα磷酸化和降解。
-
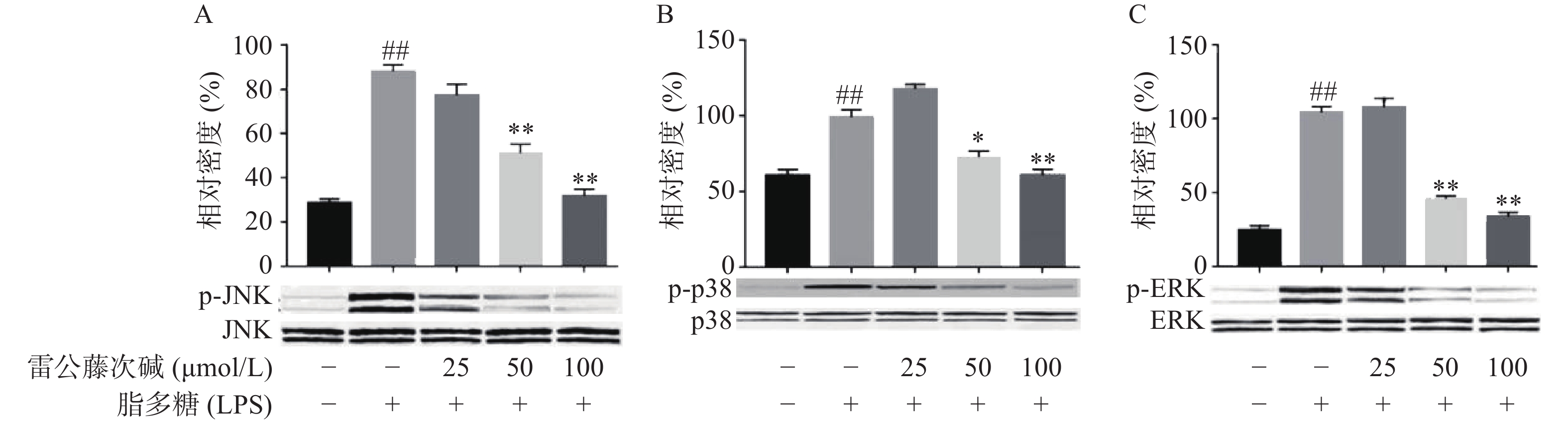
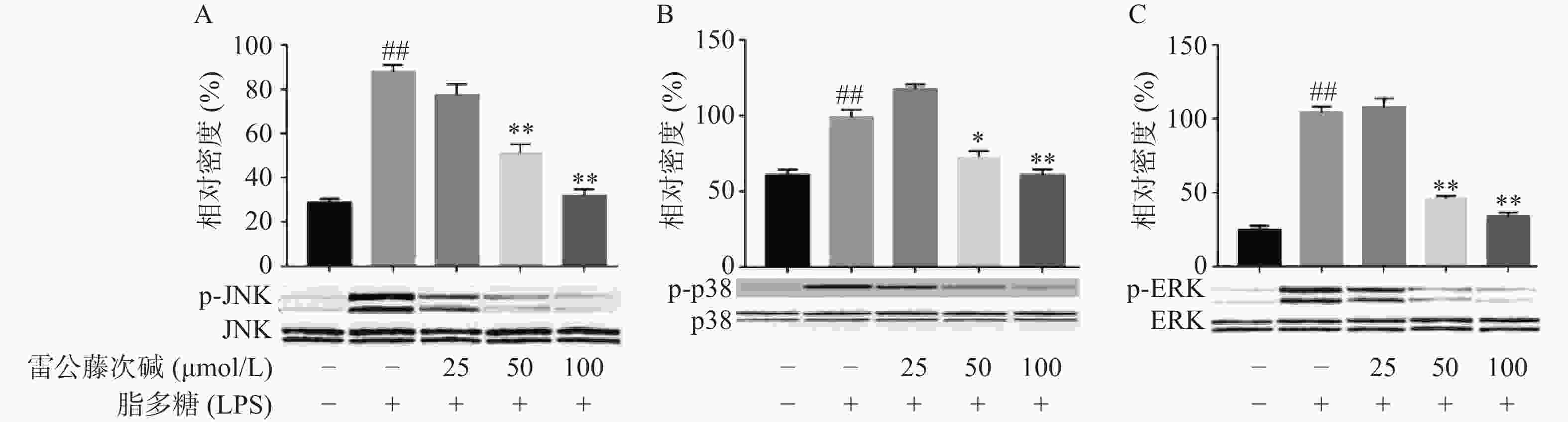
MAPKs是信号从细胞表面传导到细胞核内部的重要传递者。为了进一步研究雷公藤次碱是否调节MAPKs,考察了其对LPS诱导的RAW264.7细胞中ERK、p38和JNK等MAPKs磷酸化的影响。如图5所示,LPS暴露可显著促进RAW264.7细胞中ERK、JNK和p38的磷酸化。给予雷公藤次碱可以显著抑制LPS诱导的ERK、p38和JNK的磷酸化,但并未影响ERK、p38和JNK的表达。上述结果表明,MAPKs的磷酸化可能参与了雷公藤次碱对RAW264.7细胞中LPS刺激炎症的抑制作用。
-
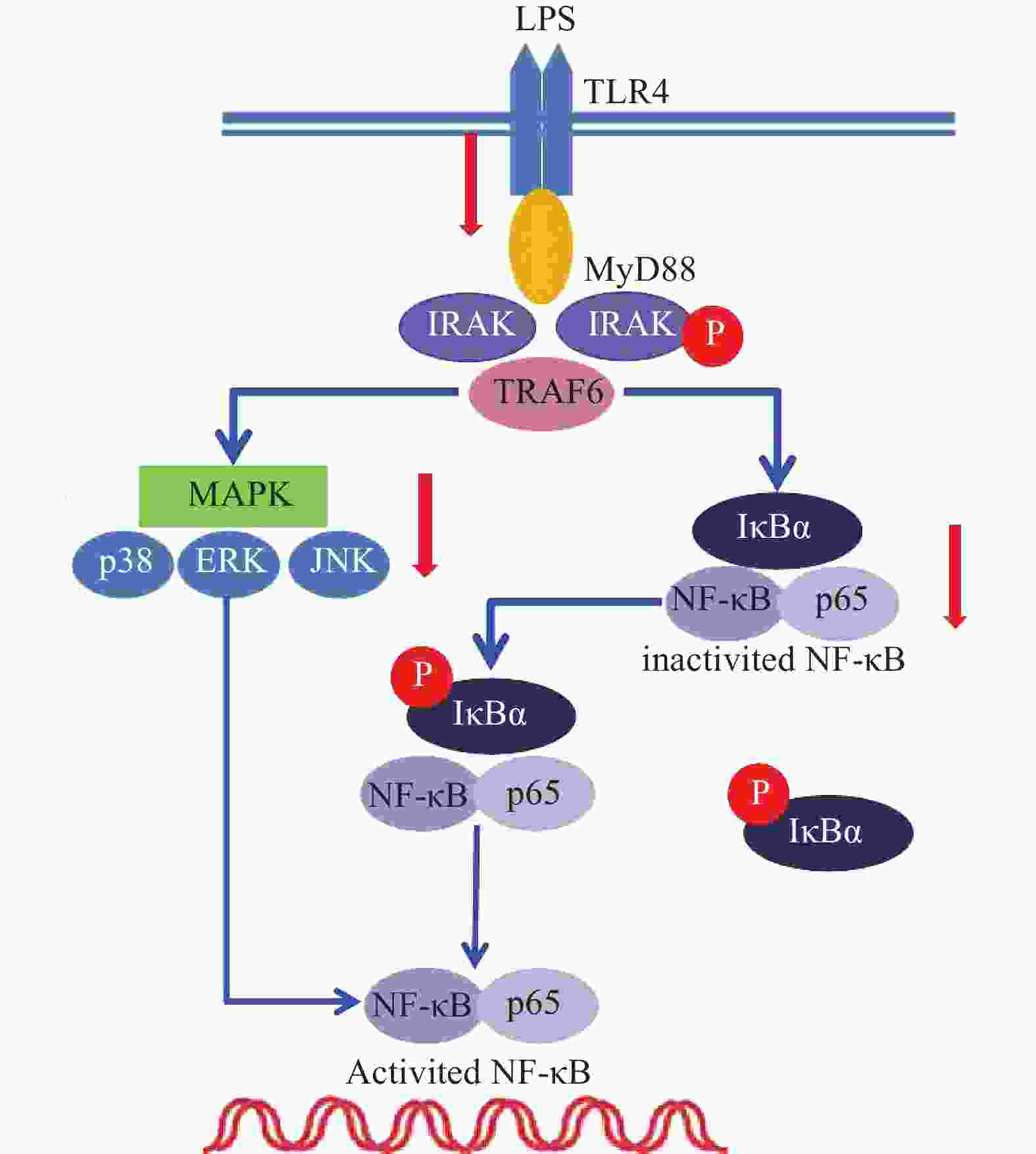
雷公藤次碱是雷公藤的代表性生物碱成分之一,但是自从被分离以来,其生物学活性除了杀虫外,其他方面了解甚少[8]。本研究显示,雷公藤次碱对LPS诱导的RAW264.7细胞炎症模型显示出显著的抗炎活性。雷公藤次碱可减少LPS刺激引起的NO、IL-1β、TNF-α及IL-6等促炎因子的产生,并抑制LPS诱导的TLR4/MyD88通路中信号传导的分子IRAK磷酸化及TRAF6表达,从而影响MAPKs和NF-κB的激活,如图6所示。
已有证据显示,LPS可引发多种细胞内信号事件,包括导致TLR4,NF-κB及p38,ERK和JNK等丝裂素活化蛋白激酶(MAPKs)途径激活[9-10]。研究发现,LPS诱导后RAW264.7细胞Toll样受体4(TLR4)的表达明显增高,说明LPS是或可引导TLR4的配体与TLR4结合,二者结合后可启动细胞内一系列信号级联反应,最终诱导目的基因的表达。TLRs亚型中除TLR3外,均需要髓样分化因子88(MyD88)来激活下游释放信号分子的通路,这种途径成为MyD88依赖性途径。静息状态下,MyD88与IRAK及TRAF6形成细胞信号转导复合物,受到诱导后导致IRAK磷酸化,IRAK磷酸化后TRAF6从信号转导复合物中解离出来,TRAF6的活化可引起两条不同的信号转导途径,一条为MAPK家族(包括p38、JNK),另一条为活化MP3K(mitogen activated protein kinase kinase kinase)家族成员NIK(NF-κB inducing kinase),后者的磷酸化激活IκB激酶,导致IκB的磷酸化而使NF-κB/IκB复合物解离,NF-κB由此活化转位进入细胞核[11]。在本研究中,数据显示雷公藤次碱可以抑制IRAK磷酸化和TRAF6的表达。
NF-κB是一种多效性的转录因子,参与调控炎症反应、免疫、肿瘤等相关的细胞因子、趋化因子、黏附分子、炎症介质等的转录过程。IκB是其抑制蛋白,正常情况下二者结合而使NF-κB处于失活状态,IκBα是IκB的亚分子,受到LPS刺激,IκBα磷酸化增加,从而导致游离NF-κB p65释放并从细胞质转移至细胞核,与DNA上的相应位点结合,导致特定靶基因(如TNF-α、IL-1β和IL-6)的转录表达[12-13]。在本研究中,数据显示雷公藤次碱可抑制IκBα磷酸化,并以浓度依赖的方式阻止NF-κB p65由细胞质进入细胞核,从而阻止炎症相关因子的转录表达。
此外,NF-κB的易位也受ERK、p38和JNK等丝裂素活化蛋白激酶途径调节,该途径可控制炎症反应过程中细胞因子的合成和释放。丝裂素活化蛋白激酶激活后,细胞质或细胞核中的转录因子又被激活,从而触发引起生物学反应的靶基因的表达,包括促炎性介质的表达。本研究显示,LPS诱导的RAW264.7细胞中,雷公藤次碱可显著抑制ERK、JNK和p38的磷酸化。
Wilforine inhibits LPS-induced inflammatory response in RAW264.7 cells by regulating the TLR4/MyD88/TRAF6 signaling pathway
doi: 10.12206/j.issn.2097-2024.202111068
- Received Date: 2021-11-16
- Rev Recd Date: 2022-09-07
- Available Online: 2022-11-28
- Publish Date: 2022-11-25
-
Key words:
- Tripterygium wilfordii /
- wilforine /
- anti-inflammation /
- TLR4 /
- MyD88 /
- NF-κB
Abstract:
| Citation: | WANG Ying, ZHANG Minxin, LIN Bing. Wilforine inhibits LPS-induced inflammatory response in RAW264.7 cells by regulating the TLR4/MyD88/TRAF6 signaling pathway[J]. Journal of Pharmaceutical Practice and Service, 2022, 40(6): 505-509. doi: 10.12206/j.issn.2097-2024.202111068 |









 DownLoad:
DownLoad: