-
水合氯醛,又称水合三氯乙醛,具有镇静、催眠、抗惊厥等作用,临床上以溶液口服或灌肠方式给药。但水合氯醛稳定性较差,临床使用制成溶液制剂有效期很短,其主要的杂质有三氯甲烷、甲酸、氯乙酸等,其中三氯甲烷是原料生产与储存过程中比较重要的降解杂质[1]。国内较多数的文献对水合氯醛及其制剂的稳定性研究采用滴定法或紫外法[2-3],此方法准确度差,专属性不足,不能准确评估水合氯醛及其制剂的质量状况。目前,《中国药典》以及国外各国药典收载的水合氯醛及其制剂的质量标准中有关的检查方法专属性均较低[4-7]。
各国药典中鉴别、酸度、炽灼残渣与溶液澄清度是水合氯醛药物的基本理化分析项,醇合三氯乙醛则为控制本品合成过程中产生的一种杂质。水合氯醛在生产、运输过程中可能产生的降解杂质有甲酸、三氯甲烷、氯乙酸、二氯乙酸、三氯乙酸等,现有的法定标准对此部分降解产物未进行控制,有关物质项存在缺失。本文旨在对主要降解产物进行定量检测,如甲酸、三氯甲烷、氯乙酸、二氯乙酸、三氯乙酸进行检测方法开发,其中,水合氯醛通过碳碳键断裂降解成等比例甲酸、三氯甲烷,检测甲酸或检测三氯甲烷均可。
三氯甲烷主要采用气相、气质色谱法[8-10]进行检查,氯乙酸等卤代羧酸可采用液相色谱法和离子色谱法[11-13]分析,水合氯醛专属性较强的检测方法为气相色谱法[10-14]。因卤代羧酸具有沸点高、强极性特点,不易气化,无法直接进样进行气相色谱分析,需进行衍生化处理,故本文将卤代羧酸检测方法与三氯甲烷检测方法分别开发建立。
-
Thermo trace 1300 GC(赛默飞气相色谱仪);电子天平 ME-204E(梅特勒科技);三氯甲烷 (北京通广试剂公司);氯乙酸、二氯乙酸、三氯乙酸(标准品,CATO);正庚烷(fisher);甲醇、硫酸、硫酸钠;水合氯醛(青岛宇龙海藻药业,批号20190403)。
-
色谱柱温:40 ℃保持3 min;以5 ℃/min的速度升至80 ℃,以20 ℃/min升至160 ℃,再以30 ℃/min升至250 ℃;进样口温度:150 ℃;检测器:ECD,温度280 ℃;色谱柱:DB-5.625 30 m×0.25 mm,0.25 μm;进样体积1 μl。
-
分别确定水合氯醛检测三氯甲烷和卤代羧酸的样品处理方法,详见表1。
溶液名称 前处理1 前处理2 供试品溶液(测定卤代羧酸) / 称取水合氯醛约10 mg,置50 ml具塞试管中,精密加入甲醇2 ml,20%的硫酸乙醇溶液2 ml(V/V),无水硫酸钠0.1 g,密塞,漩涡使溶解,置50 ℃水浴加热40 min,取出后迅速冲凉,精密加入4 ml正庚烷,漩涡混匀,加入
20 ml水,振摇,静置20 min,分层,取上清液即得。卤代羧酸对照品溶液 / 分别称取氯乙酸、二氯乙酸、三氯乙酸适量,分别用甲醇配制成浓度为100 μg/ml的储备液,取1 ml置10 ml量瓶中,用甲醇定容至刻度即得;取上述溶液各1 ml,置50 ml具塞试管中,精密加入1 ml甲醇,20%的硫酸乙醇溶液2 ml(V/V),无水硫酸钠0.1 g,密塞,漩涡使溶解,置50 ℃水浴加热
40 min,取出后迅速冲凉,精密加入4 ml正庚烷,漩涡混匀,加入20 ml水,振摇,静置20 min,分层,取上清液即得各对照品溶液。供试品溶液(测定三氯甲烷) 称取水合氯醛约10 mg,置10 ml具塞试管中,加甲醇溶液完全,定容后过滤取续滤液即得。 称取水合氯醛约100 mg,置10 ml具塞试管中,加入饱和氯化钠溶液
0.35 ml,氯化钠0.5 g,正己烷5 ml,密塞,振摇提取,静置20 min,取正己烷层,取续滤液即得。三氯甲烷对照品溶液 称取三氯甲烷适量,甲醇溶解至
60 μg/ml即得。称取三氯甲烷适量,用正己烷配置成浓度为20 μg/ml的储备液;取1 ml置10 ml量瓶中,用正己烷定容至刻度即得。 -
按照图1方法,配制用于氯乙酸、二氯乙酸、三氯乙酸检测的对照品溶液,并按照“1.2色谱条件”进样检测,结果如下。
对照品溶液浓度分别为氯乙酸 9.95 μg/ml,二氯乙酸 13.49 μg/ml,三氯乙酸9.45 μg/ml,连续进样5针,氯乙酸、二氯乙酸、三氯乙酸的保留时间分别为4.33、5.89和7.38 min,各峰面积RSD分别为0.75%、1.00%、1.00%,满足系统适用性要求。衍生化转化目标物更容易被气化,氯乙酸、二氯乙酸、三氯乙酸经衍生化后分别以氯乙酸乙酯、二氯乙酸乙酯、三氯乙酸乙酯形式被检测。
-
分别取氯乙酸、二氯乙酸、三氯乙酸对照品适量,加甲醇溶解稀释制成浓度为10 μg/ml的储备液,分别取储备液适量置具塞试管中,按照表1衍生化处理后,取正庚烷层,即得各自的工作曲线样品溶液,按照“1.2色谱条件”进样检测,以峰面积为纵坐标,相应卤代羧酸浓度为横坐标,进行线性回归。结果见表2,并按照信噪比大于3和大于10分别规定检测限和定量限。
样品名称 线性方程 回归系数 r 线性范围(μg/ml) 检测限(μg/ml) 定量限(μg/ml) 氯乙酸 Y=0.0042X+0.0002 0.9997 0.25~5 0.025 0.05 二氯乙酸 Y=0.1106X+0.005 0.9998 0.125~2.5 0.05 0.125 三氯乙酸 Y=0.32X+0.0164 0.9998 0.0625~2.5 0.01 0.0625 将上述信噪比满足定量限的各对照品溶液连续进样5针,氯乙酸、二氯乙酸、三氯乙酸峰面积RSD为别为5.27%、1.94%、1.15%,显示各目标物的定量限浓度下检测精密度满足要求(RSD<15%)。
-
按表1前处理方法进行配制供试品溶液和对照品溶液,平行取6份供试品溶液,连续采集,记录并计算各供试品溶液中氯乙酸、二氯乙酸、三氯乙酸的含量,氯乙酸均未检出,二氯乙酸含量RSD为4.43%,三氯乙酸含量结果RSD为4.56%,按照本方法进行卤代羧酸含量检测,含量结果RSD均小于6%。 按照《中国药典》2020年版“通则9101分析方法验证指导原则”要求[15],本供试品中卤代羧酸的含量(10 ppm)重复性要求RSD小于6%。本方法重复性满足要求。
-
采用加样回收率进行方法准确度考察,精密称取10 mg水合氯醛原料药10份,分别置10个50 ml锥形瓶中,编号1~3加入混合对照品溶液1.2 ml,编号4~6加入混合对照品溶液1 ml,编号7~9加入混合对照品溶液0.8 ml,上述混合对照品溶液中,氯乙酸浓度为 9.95 μg/ml,二氯乙酸 浓度为13.49 μg/ml,三氯乙酸浓度为9.45 μg/ml,第10份不加混合对照品溶液,同步取样混合对照品1 ml置50 ml锥形瓶中,得到11份样品,按照表2衍生化处理,取正庚烷层进样检测,结果如表3。
编号 原有量(m/mg) 加入量(m/μg) 测得量(m/μg) 回收率(%) 氯乙酸 二氯乙酸 三氯乙酸 氯乙酸 二氯乙酸 三氯乙酸 氯乙酸 二氯乙酸 三氯乙酸 1 10.23 3.00 3.00 3.00 3.14 2.88 3.11 104.5 95.45 95.82 2 10.17 3.00 3.00 3.00 2.72 2.85 2.99 90.64 94.35 91.75 3 9.97 3.00 3.00 3.00 2.61 2.70 3.35 86.99 89.44 103.7 4 10.00 2.50 2.50 2.50 2.46 2.38 2.51 98.25 94.44 91.13 5 9.95 2.50 2.50 2.50 2.13 2.44 2.50 85.09 96.70 90.44 6 10.08 2.50 2.50 2.50 2.52 2.35 2.48 100.9 93.22 89.86 7 10.11 2.00 2.00 2.00 1.71 1.89 2.03 85.53 93.40 89.49 8 9.88 2.00 2.00 2.00 1.82 1.86 2.05 91.01 91.88 90.83 9 10.01 2.00 2.00 2.00 1.78 1.88 2.09 88.82 92.87 92.85 按照本方法进行卤代羧酸含量检测准确度试验,回收率结果符合相关要求。 按照《中国药典》2020年版“通则9101分析方法验证指导原则”要求,本供试品中卤代羧酸的含量(10 ppm)回收率限度要求为80%~115%。本方法准确度满足要求。
-
取“2.1.1”项下的各对照品溶液,分别于24 h内不同时间进样检测,结果显示氯乙酸、二氯乙酸、三氯乙酸峰面积RSD分别为4.0%、2.1%、1.6%,表明本方法样品溶液24 h内稳定性良好。
-
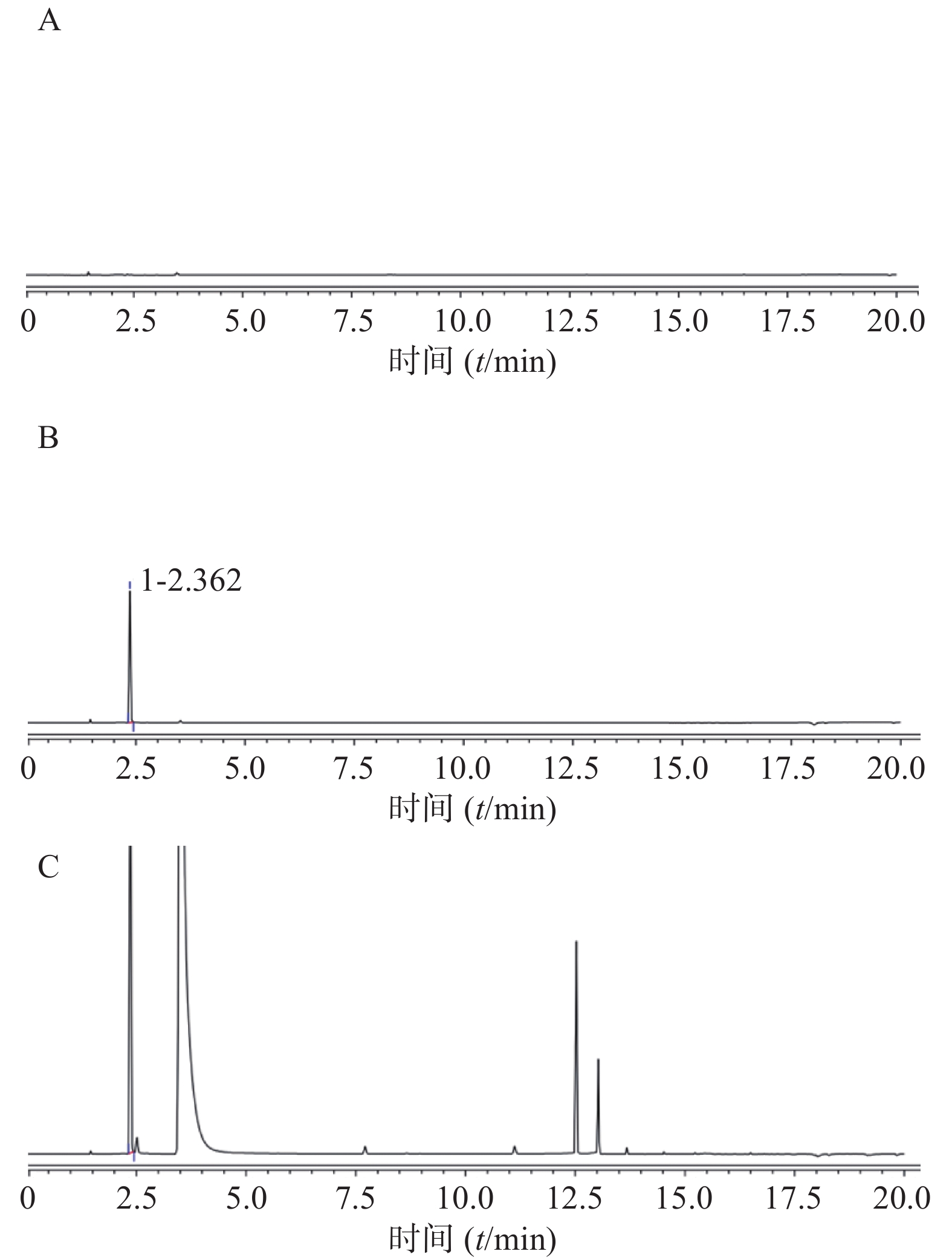
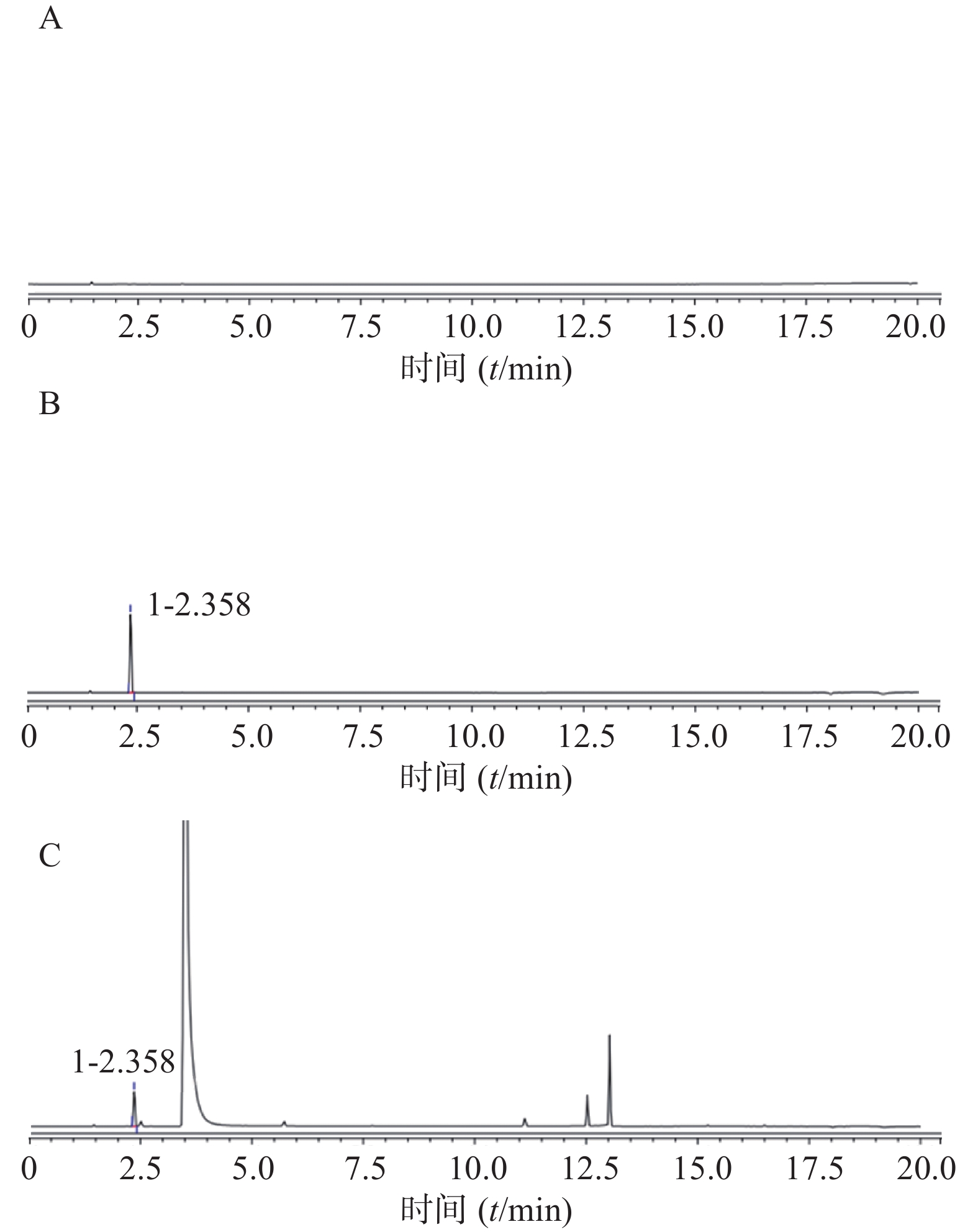
分别按照表1中两种前处理方式配制对照品溶液、供试品溶液。前处理1测定色谱图见图2,前处理2测定色谱图见图3。在上述色谱条件下,两种前处理使用的正己烷和甲醇均不干扰三氯甲烷的测定,三氯甲烷保留时间约为2.5 min。
-
分别按照前处理1和前处理2方法制备6份供试品;另取三氯甲烷对照品适量,分别用甲醇溶解稀释至60 μg/ml;用正己烷溶解稀释至2 μg/ml。将以上供试品与对照品,按照“1.2 色谱条件”进样检测,结果见表4。
样品名称 前处理方法1 前处理方法2 峰面积 含量(%) 峰面积 含量(%) 对照品溶液 1.5129 / 0.2863 / 供试品1 0.7824 3.19 0.0608 0.00212 供试品2 1.4486 5.91 0.0616 0.00215 供试品3 1.6091 6.56 0.0596 0.00208 供试品4 0.6147 2.51 0.0582 0.00203 供试品5 0.8345 3.40 0.0653 0.00228 供试品6 1.0321 4.21 0.0679 0.00237 RSD(%) 37.46 5.89 因水合氯醛对热不稳定,熔点低57 ℃,在高温条件下碳碳键断裂产生三氯甲烷和甲酸,直接进样或顶空进样均可导致水合氯醛降解而使检测结果偏高,不能反映其实际三氯甲烷含量。而且依据ICH Q3C(R6)残留溶剂指导原则,三氯甲烷属于药品生产中应限制使用的溶剂(二类溶剂),其限度要求是60 ppm(即残留上限0.006%),结合本品原料药检测结果与重复性结果,前处理方法2检测结果准确真实。
连续进样5针正己烷配制的三氯甲烷对照品溶液,峰面积RSD为2.45%,表明本法的系统适用性试验结果良好。
-
精密称取三氯甲烷对照品,用正己烷溶解稀释至20 μg/ml,分别取其中0.2、0.4、0.8、1.0、1.5 ml置10 ml量瓶,用正己烷稀释至刻度即得工作曲线样品,按照“1.2 色谱条件”进样,以峰面积为纵坐标,相应浓度为横坐标进行线性回归,得线性方程Y=0.1094X+0.0222, r =0.9998,表明三氯甲烷在浓度0.2408~3.011 μg/ml范围内线性良好。将三氯甲烷对照品溶液逐级稀释,得0.02、0.001 μg/ml进样分析,信噪比分别为14和4,分别为定量限和检测限。
-
取水合氯醛原料药,按表2中前处理方法2配制,平行9份,编号1~3加入0.6 ml对照品溶液,编号4~6加入对照品储备液0.5 ml,编号7~9加入对照品储备液0.6 ml,分别置10 ml离心管中,加入饱和氯化钠0.5 ml,氯化钠0.5 g,4.4 ml正己烷,振摇溶解,静置30 min,分别取正己烷层进样检测,结果见表5。
样品编号 加入量(m/μg) 检测值(m/μg) 本底值(m/μg) 回收率(%) 供试品1 1.2042 2.30 1.19 91.53 供试品2 1.2042 2.18 1.19 81.70 供试品3 1.2042 2.39 1.19 99.71 供试品4 10.79 11.77 1.81 92.32 供试品5 10.79 11.60 1.81 90.71 供试品6 10.79 11.79 1.81 92.46 供试品7 12.948 13.25 1.81 88.29 供试品8 12.948 12.81 1.81 84.94 供试品9 12.948 14.04 1.81 94.41 按照本方法进行三氯甲烷含量检测的准确度试验,回收率符合《中国药典》相关要求。
-
取三氯甲烷对照品、水合氯醛原料药,按表2中前处理方法2进行配制对照品溶液、供试品溶液,按“1.2色谱条件”进样检测,考察24 h内不同时间样品的稳定性,结果显示供试品与对照品稳定性均小于5.0%,稳定性良好。
-
水合氯醛具有较强的挥发性与引湿性,在高温条件下挥发与降解性能均增强,结合《中国药典》2020年版药品稳定性试验技术要求,对本品进行影响因素试验与加速试验考察。将水合氯醛置样品瓶(封口)中,分别置温度25 ℃/湿度75%,温度40 ℃/湿度75%,温度60 ℃/湿度60%以及温度25 ℃/湿度60%、光照强度4500 lx条件下考察,并于不同时间点检测杂质含量变化,结果见表6。
放置条件 时间(t/d) 检测结果(%) 三氯乙酸 二氯乙酸 三氯甲烷 氯乙酸 温度25 ℃/湿度75% 10 0.001 0.003 0.004 未检出 30 0.001 0.003 0.004 未检出 温度40 ℃/湿度75% 10 0.001 0.003 0.152 未检出 30 0.001 0.003 0.323 未检出 温度60 ℃/湿度60% 10 0.001 0.004 0.546 未检出 30 0.001 0.004 0.871 未检出 温度25 ℃/湿度60%、
光照强度4500 lx10 0.001 0.003 0.045 未检出 30 0.001 0.003 0.151 未检出 以上数据显示,水合氯醛原料受温度和光照影响较大,主要的降解产物为碳碳键断裂的水解产物三氯甲烷,卤代羧酸未有明显的改变。三氯甲烷是主要的降解产物,其中三氯甲烷为二类毒性溶剂,但目前水合氯醛的国内外法定标准中均无三氯甲烷的含量检测和限度要求,且水合氯醛本身具有较大的毒性,则其降解产物的限度仍需结合长期稳定性结果和临床使用的安全性、有效性进行综合评估。另本次试验采用称量瓶封口存放,密封性不佳,会加速水合氯醛的挥发水解,本品应室温避光密封保存;在制剂研发和存储运输过程中,应严格控制温度与光照影响。
-
本文建立了气相色谱法测定水合氯醛原料药中杂质三氯甲烷、氯乙酸、二氯乙酸、三氯乙酸。利用检测目标物的理化性质,采用不同前处理方法进行三氯甲烷、卤代羧酸的检测,色谱峰形良好,方法简单、准确度高、重复性良好,可避免水合氯醛检测过程中的自身降解,准确高效的检测药物中杂质含量,满足目前市售原料及其制剂的检测需求。
本法中,三氯甲烷检测限浓度为供试品浓度的万分之0.005(0.5 ppm);氯乙酸检测限浓度为供试品浓度的万分之0.1(10 ppm);二氯乙酸检测限浓度为供试品浓度的万分之0.2(20 ppm);三氯乙酸检测限浓度为供试品浓度的万分之0.04(4 ppm)。本品多次检测以及稳定性试验中均未出现氯乙酸,说明本品中确无高于检出限的残留,也不易降解产生。
通过水合氯醛的稳定性实验发现,本品在温度、光照条件下均会发生降解,三氯甲烷为主要的降解产物,故进行本品相关制剂的研发、检测、生产和运输过程中需要严格控制生产工艺与储存条件,保证产品的质量稳定,保障用药安全性。
Analysis method optimization and stability test of related substances of chloral hydrate
doi: 10.12206/j.issn.2097-2024.202106092
- Received Date: 2021-06-17
- Rev Recd Date: 2022-02-08
- Available Online: 2023-07-14
- Publish Date: 2023-07-25
-
Key words:
- chloral hydrate /
- chloroform /
- halogenated carboxylic acid /
- related substances /
- stability
Abstract:
| Citation: | SONG Kaichao, FANG Xiaqin, LI He, HAO Yumei, TAN Xiaochuan, ZHENG Wensheng. Analysis method optimization and stability test of related substances of chloral hydrate[J]. Journal of Pharmaceutical Practice and Service, 2023, 41(7): 422-427. doi: 10.12206/j.issn.2097-2024.202106092 |










 DownLoad:
DownLoad: