-
红景天为景天科大花红景天[Rhodiola crenulata(Hook.f.et Thoms.)H. Ohba]的干燥根和根茎[1],是一种多年生草本或亚灌木植物。大部分生长于海拔3 500~5 000 m的石灰岩、花岗岩地冰川、山梁草地或山谷岩石上,享有“高原人参”、“雪山仙草”之美称,被当代医学界誉为“东方神草”,被全球医药界喻为“黄金植物”[2],己被前苏联科学家确定为植物适应原[3]。目前的研究表明,红景天具有抗应激、抗疲劳、抗氧化、抗癌、抗抑郁、保护肝肾、增强机体免疫力和神经保护等作用[4-7]。
目前,国内外对红景天多集中于其药效研究,体内药物含量测定和生物利用度研究又多以大鼠为研究对象。在以往研究的大鼠试验中,不同给药途径和不同剂量下,红景天苷绝对生物利用度(Fabs)结果为32.1%~98%[8-11],范围之大可能和红景天苷在体内的主动转运有关。而主要参与分子主动转运的钠依赖性葡萄糖转运体介导(SGLT1)在肠黏膜中所占的比例极其有限。在有限的肠道转运介导下,剂量不同可能会导致生物利用度研究结果不同。当口服红景天苷剂量大于24 mg/kg时,大鼠肠道出现了饱和吸收过程,且证明此饱和过程与SGLT1相关[12]。由于肠道中SGLT1占比有限,若给药剂量过高,可能会导致药物肠道重吸收较差,进而体现为生物利用度降低。因此,为了更加科学地考察体内生物利用度,合适剂量的选择尤为重要。
关于测定比格犬体内红景天苷含量的分析方法研究报道较少。Mao等[8]建立了测定犬血浆中红景天苷含量的HPLC法,线性范围为0.83~520 μg/ml(r=0.992 6),最低定量下限为0.83 μg/ml。因定量限较高,不足以满足其体内药动学分析。陈帅等[13]应用UHPLC-MS/MS法,采用柱前衍生化的样品处理同时测定了比格犬血浆中的红景天苷和酪醇含量。其中,红景天苷的定量下限为0.02 μmol/L,质量浓度相当于6.01 ng/ml。该方法的样品处理方式为先用乙腈蛋白沉淀法去除基质中的蛋白组分,上清溶液经碱化后孵育进行衍生化,最后用甲基叔丁基醚进行液液萃取,氮气吹干复溶后进样。虽检测限满足体内药动学分析,在批量处理样品时条件苛刻且步骤复杂。且以上研究均未对红景天苷在比格犬体内绝对生物利用度进行评估。
本实验旨在建立准确、快速、灵敏的LC-MS/MS法测定比格犬血浆中红景天苷含量,并对其绝对生物利用度进行研究。血浆样品预处理采用蛋白沉淀,并将验证后的方法应用于临床前药动学研究,包括生物利用度研究,为支持临床药动学试验设计提供依据。
HTML
-
Triple quad 5500型三重四极杆串联质谱仪,配备电喷雾电离源(加拿大AB Sciex公司);岛津液相色谱系统(包括DGU-20A3R型脱气机、LC-30AD型二元液相泵、SIL-30AC型自动进样器和CTO-20A型柱温箱,日本岛津公司)。Elma sonic P 300H超声波清洗器(德国埃尔玛公司);XPR6UD5和XPE205型电子分析天平(瑞士梅特勒公司)。
红景天苷(海军军医大学药学院药物分析教研室,含量99.0%,批号:20180901);天麻素(内标,上海同田生物技术有限公司,含量:98.9% 批号:4031921)。甲醇、乙腈、甲酸(均为色谱纯,Sigma-Aldrich公司);超纯水(自制,Millipore纯水仪)。
-
Symmetry RP18色谱柱(Waters公司,100 mm×4.6 mm, 3.5 μm);柱温:40 ℃;流动相:0.1%甲酸溶液,流动相B:含0.1%甲酸和20%乙腈的甲醇溶液;等度洗脱比例为35%流动相B;流速0.4 ml/min,进样量:2 μl。
-
离子源为电喷雾电离源;负离子方式检测;源喷射电压为−4500 V;去溶剂温度为550 ℃;雾化器压力(GS1): 75 psi;辅助气压力(GS2): 60 psi;气帘气体压力为35 psi;入口电压(EP): −10 V;碰撞室出口电压(CXP): −14 V;扫描方式为多反应监测,扫描时间为100 ms。雾化气、气帘气、碰撞气由氮气发生器产生;采用多反应监测(MRM)模式,离子监测通道为:m/z 299.1→118.9(红景天苷),m/z 285.1→122.9(天麻素)。红景天苷和天麻素去簇电压分别为−70和−40 eV,碰撞能量分别为−19和−17 eV。
-
分别精密称取红景天苷对照品2份,用40%乙腈水溶液溶解并定容,获得质量浓度均为0.2 mg/ml的红景天苷储备液2份,分别用于配制标准系列样品和质控样品工作液。按照一定的比例混合,用40%乙腈水溶液稀释,获得红景天苷浓度为:0.2、0.4、2、8、32、80、180 μg/ml的标准系列样品工作液和浓度为0.2、0.6、10、160 μg/ml的质控样品工作液。于4 ℃保存,备用。
-
精密称取天麻素对照品一份,用40%乙腈水溶液溶解并定容,获得质量浓度为0.1 mg/ml的天麻素储备液一份。以40%乙腈水溶液稀释内标储备液获得4 000 ng/ml的内标工作溶液,于4 ℃保存,备用。
-
取标准系列溶液或储备液50 μl至1.5 ml EP管中,加入比格犬空白血浆950 μl,涡旋10 s,获得红景天苷浓度为10、20、100、400、1 600、4 000、9 000、10 000 ng/ml的标准系列样品以及浓度为10、30、500和8 000 ng/ml质控样品。标准系列样品每日新鲜配制,质控样品于−20或−70 ℃保存,备用。
-
精密吸取血浆50 μl,置于Axygen 96孔深孔板中,加入内标50 μl,涡旋1 min,加入450 μl甲醇,涡旋3 min,3000 r/min离心10 min,取出上清液300 μl,氮气吹干,加入10%乙腈200 μl,涡旋3 min后,取2 μl进行LC-MS/MS分析。
-
动物实验部分在上海新冈实验动物场完成。比格犬,体重6~8 kg,雌雄各半;年龄24~30周,给药前禁食12 h,自由饮水,给药后4 h统一进食。
比格犬口服组(n=6,雌雄各半)给予红景天苷原料药15 mg/kg,分别于给药前0.5 h内和给药后即刻、15、30、45 min及1、1.5、2、3、4、5、6、8、10、16、24 h经前肢静脉取血1 ml置于肝素钠抗凝试管中,离心10 min (3 000 r/min,4 ℃)分离血浆,−70 ℃保存待测。
比格犬静脉注射组(n=6,雌雄各半)给予红景天苷原料药1.5 mg/kg,分别于给药前0.5 h内和给药后即刻、2、5、10、20、30、45 min及1、1.5、2、3、4、6、8、12 h经前肢静脉取血1 ml置于肝素钠抗凝试管中,离心10 min(3000 r/min, 4 ℃)分离血浆,−70 ℃保存待测。
-
将所建立并经过验证的方法应用于红景天苷动物药动学研究。所得的血浆浓度-时间数据采用Phoenix WinNonlin 8.1 (美国Pharsight公司)软件,以非房室模型计算药动学参数。绝对生物利用度(Fabs)计算方法见公式(1):
式中:AUC0−∞ (po)为口服给药后AUC0−∞统计值;AUC0−∞ (iv)为静脉注射后AUC0−∞统计值;Dosepo为口服剂量;Doseiv为静脉注射剂量。
1.1. 仪器与试剂
1.2. 色谱与质谱条件
1.2.1. 色谱条件
1.2.2. 质谱条件
1.3. 溶液的制备
1.3.1. 红景天苷储备液和工作溶液
1.3.2. 内标储备液和工作溶液
1.4. 标准系列样品和质控样品的制备
1.5. 血浆样品处理
1.6. 动物实验
1.7. 数据处理
-
分别取6个不同来源的比格犬空白血浆样品以及用相应比格犬空白血浆配制的定量下限(LLOQ)样品进行LC-MS/MS分析测定,考察不同来源空白血浆中的内源性物质是否干扰待测物及内标的测定。
结果表明,比格犬空白血浆中的内源性物质不干扰红景天苷的测定,同时内标不干扰待测物的测定,待测物对内标也无影响。
-
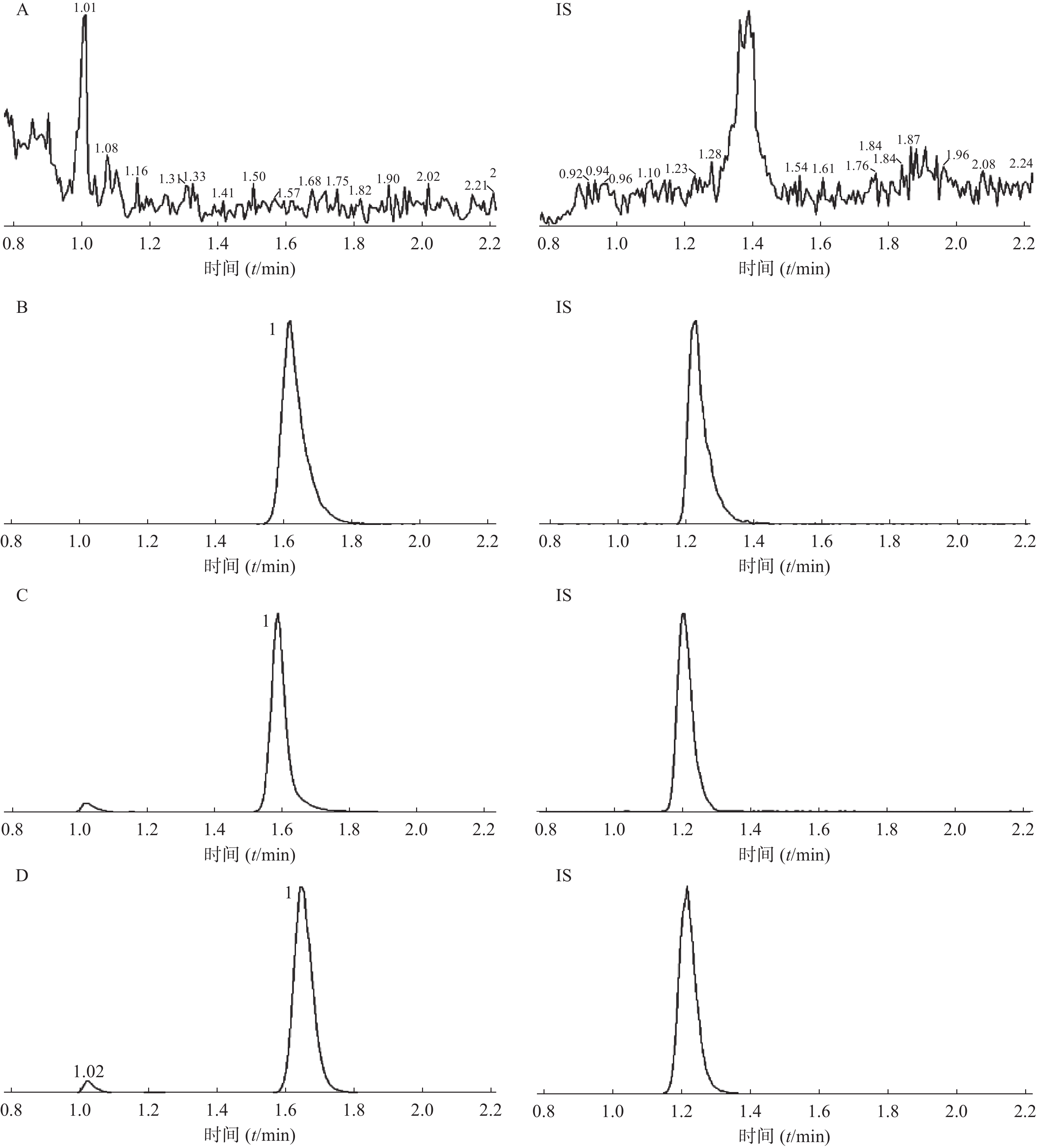
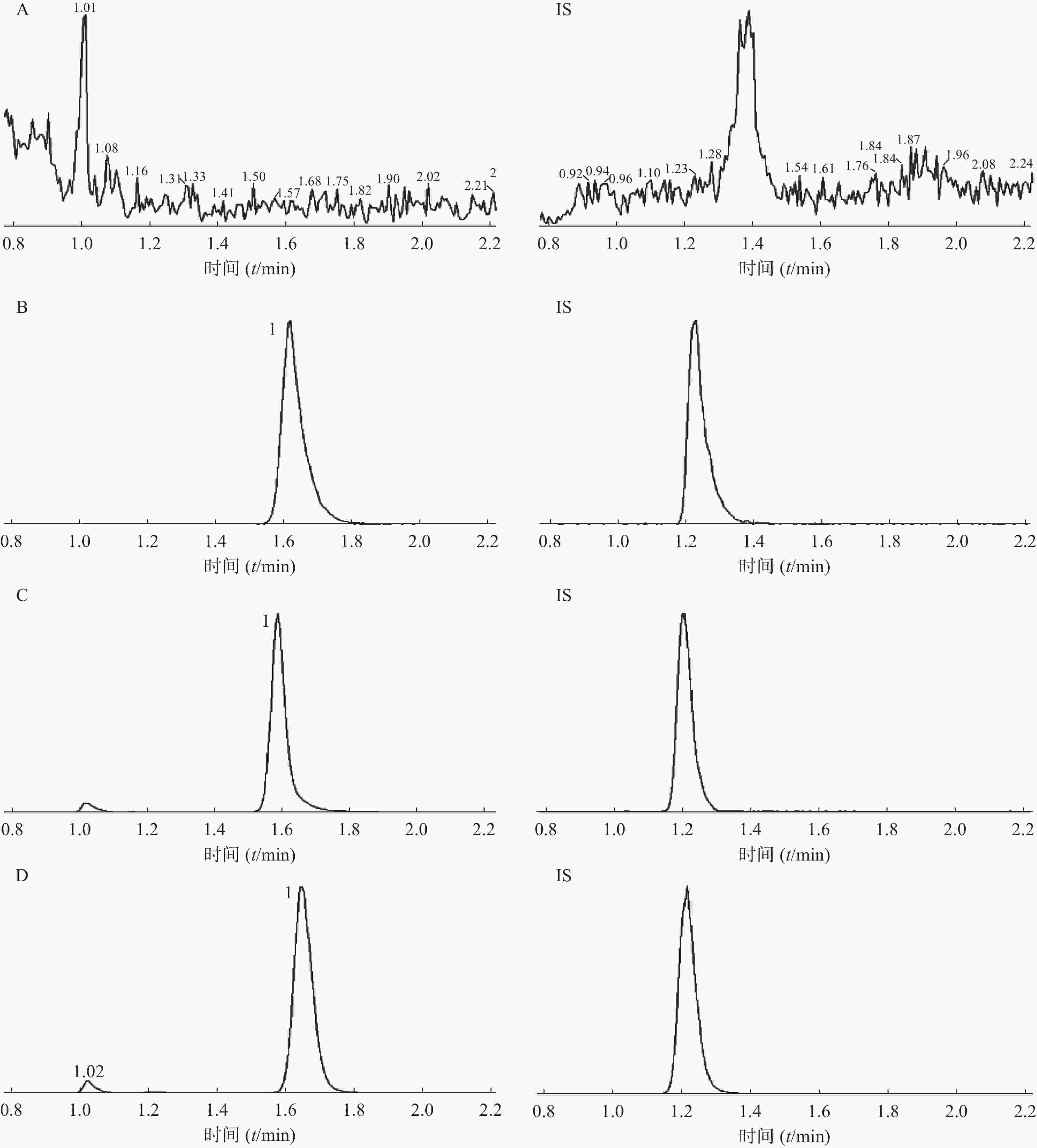
在选定的条件下,红景天苷和内标峰形良好,红景天苷的保留时间约为1.6 min,内标的保留时间约为1.2 min,内源性杂质不干扰测定。空白血浆、红景天苷及内标、红景天苷及内标加入空白血浆中的色谱图、比格犬口服1.5 h样品中红景天苷及内标色谱图见图1。
-
取“1.4”项下制备的标准含药血浆样品50 μl,按照“1.5”项下血浆样品前处理方法操作,以每个待测物浓度为横坐标,待测物与内标物的峰面积比值为纵坐标,采用加权(W= 1/X2)最小二乘法进行回归运算,求得的直线回归方程即为标准曲线,相关系数r均>0.998 6。比格犬血浆样品中红景天苷浓度在10~1 0000 ng/ml与峰面积比线性良好,最低定量浓度为10 ng/ml。典型标准曲线方程为:Y = 0.003 48X+0.000 397(r=0.999 1)。
-
取比格犬LLOQ血浆样品(红景天苷质量浓度为10 ng/ml)进行6份样本分析,连续测定3 d并分别根据当日标准曲线求得每份样本的测得浓度。求得该质量浓度红景天苷的日内精密度分别为8.3%,日间精密度为7.3%,准确度(RE)为6.0%。实验结果表明,LC-MS/MS法测定比格犬血浆中红景天苷的定量下限为10 ng/ml。
-
取比格犬低、中、高3个浓度质控样品,按照“1.5”项下操作,每个浓度进行6样本分析并在连续3 d内测试,分别根据当日标准曲线计算每份样本的测得浓度并根据QC样品结果计算本方法日内、日间精密度和准确度。
红景天苷质控(QC)样品的精密度与准确度结果见表1。待测物低、中、高质控样品的日内和日间精密度和准确度均符合生物样品测定相关要求。待测物低、中、高质控样品的日内和日间精密度和准确度均符合生物样品测定相关要求。
浓度(ng/ml) 日内(n=6) 日间(n=18) 准确度(RE/%) 精密度(RSD/%) 准确度(RE/%) 精密度(RSD/%) 10 8.3 10.0 7.3 6.0 30 9.7 −2.0 6.0 −1.3 500 3.3 −3.0 3.4 −0.2 8 000 3.8 −3.5 2.7 −1.5 -
分别取6个不同来源比格犬空白血浆和一份空白溶血血浆50 μl,不加内标溶液(用50 μl 40%乙腈替代内标工作溶液),按照“1.5”项下操作,40 ℃氮气下吹干,加入200 μl由流动相配制的相对应的低、高浓度对照质控溶液和内标溶液,涡流后离心5 min,取2 μl进行LC-MS/MS分析,获得相应峰面积(A)。同时,另取去离子水50 μl代替比格犬空白血浆,按上述方法操作获得相应峰面积(B)。以每一浓度两种处理方法的峰面积比值计算基质效应,公式为A/B×100%,并以分析物和内标的基质效应比值计算内标归一化的常规基质效应和溶血血浆基质效应。
在比格犬常规血浆样品中,红景天苷低、高浓度经内标校正后的基质效应分别为96.3%和96.6%,相对标准差分别为8.4%和4.1%。溶血血浆样品中,低、高浓度经内标校正后的基质效应分别为99.4%和96.7%,相对标准差分别为5.0%和7.0%。
结果表明,待测物红景天苷在本试验选择的色谱和质谱条件下,可忽略基质效应的影响。
-
采用比格犬空白血浆配制的低、中、高3个浓度的血浆样品,按照“1.5”项下操作,每个浓度进行6样本分析。同时另取比格犬空白血浆50 μl,不加内标溶液(用50 μl 40%乙腈溶液替代内标工作溶液),其余按照“1.5”项下操作,于40 ℃氮气下吹干后,加入对应的低、中、高浓度对照质控溶液和内标溶液,涡流5 min,取2 μl进行分析,获得相应峰面积(n=3)。用提取后色谱峰面积与未经提取的色谱峰面积之比计算提取回收率。
比格犬血浆样品经蛋白沉淀处理后,红景天苷在低、中、高浓度的回收率分别为91.8%、94.3%和89.5%。
-
考察了红景天苷储备液和工作溶液室温6 h、比格犬血浆样品室温放置24 h、比格犬血浆样品−20 ℃/−70 ℃经历5次冷冻−解冻循环的稳定性以及比格犬血浆样品−20 ℃/−70 ℃经历22 d冷冻后的稳定性。全血样品室温/湿冰放置2 h、样品处理后自动进样器放置96 h。
结果表明,红景天苷储备液和工作溶液室温至少6 h、血浆样品中在室温放置24 h、−20 ℃/−70 ℃冻存22 d、在−20 ℃/−70 ℃存放条件下反复室温冻融5次,以及样品处理后,在自动进样器放置96 h,红景天苷能够保持良好的稳定性。自全血采集至分离待测血浆样本的室温/湿冰2 h内,红景天苷在全血中保持稳定。
-
本实验考察了血浆浓度超出定量上限的比格犬血浆样品,经空白比格犬血浆稀释后的准确度。取红景天苷的稀释质控样品(比格犬血浆样品红景天苷质量浓度为80 000 ng/ml),用空白比格犬血浆稀释20倍后,按“1.5”项下操作,进行6份样本分析。结果表明,比格犬血浆样品经空白比格犬血浆稀释20倍后测定不影响结果的准确度。
-
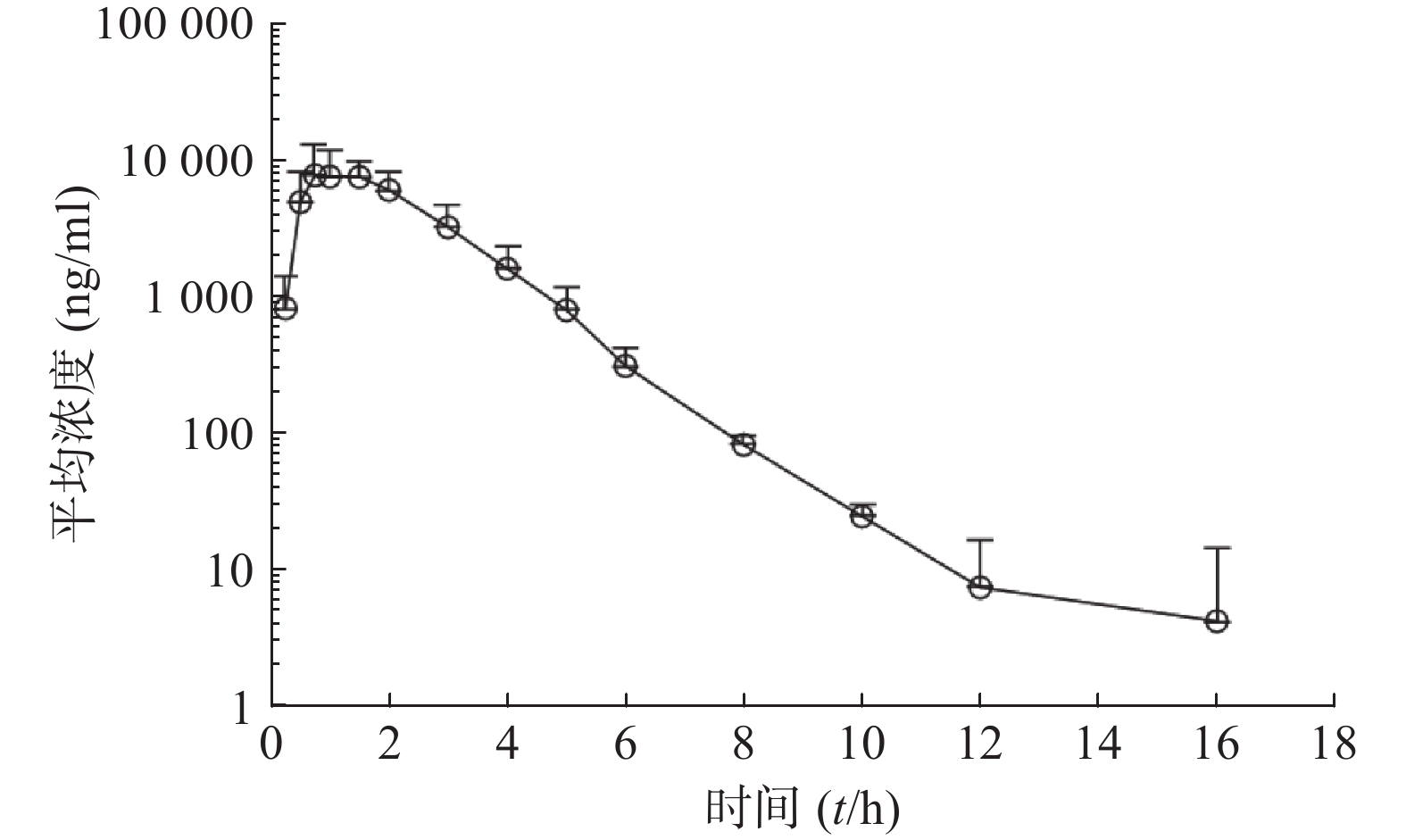
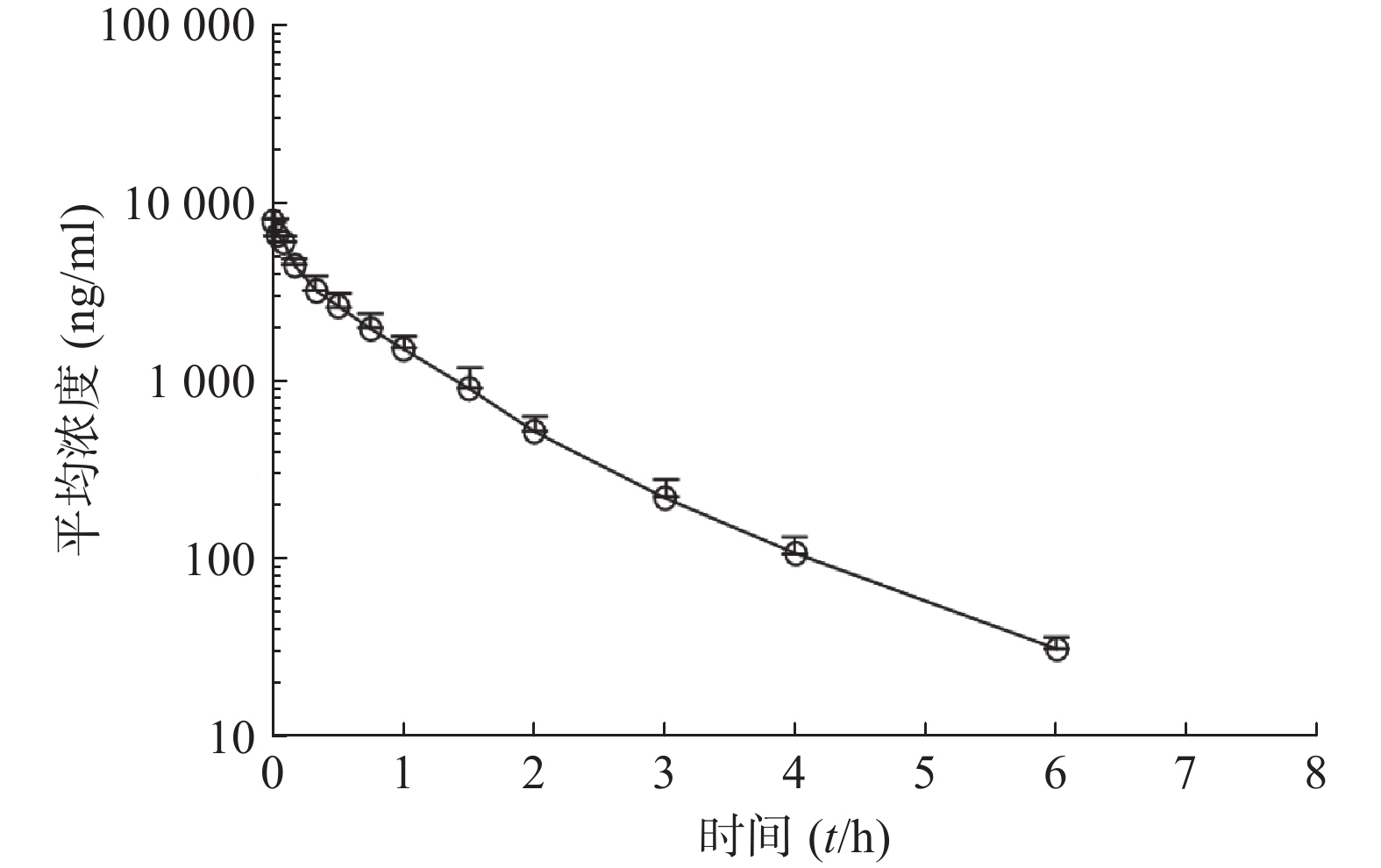
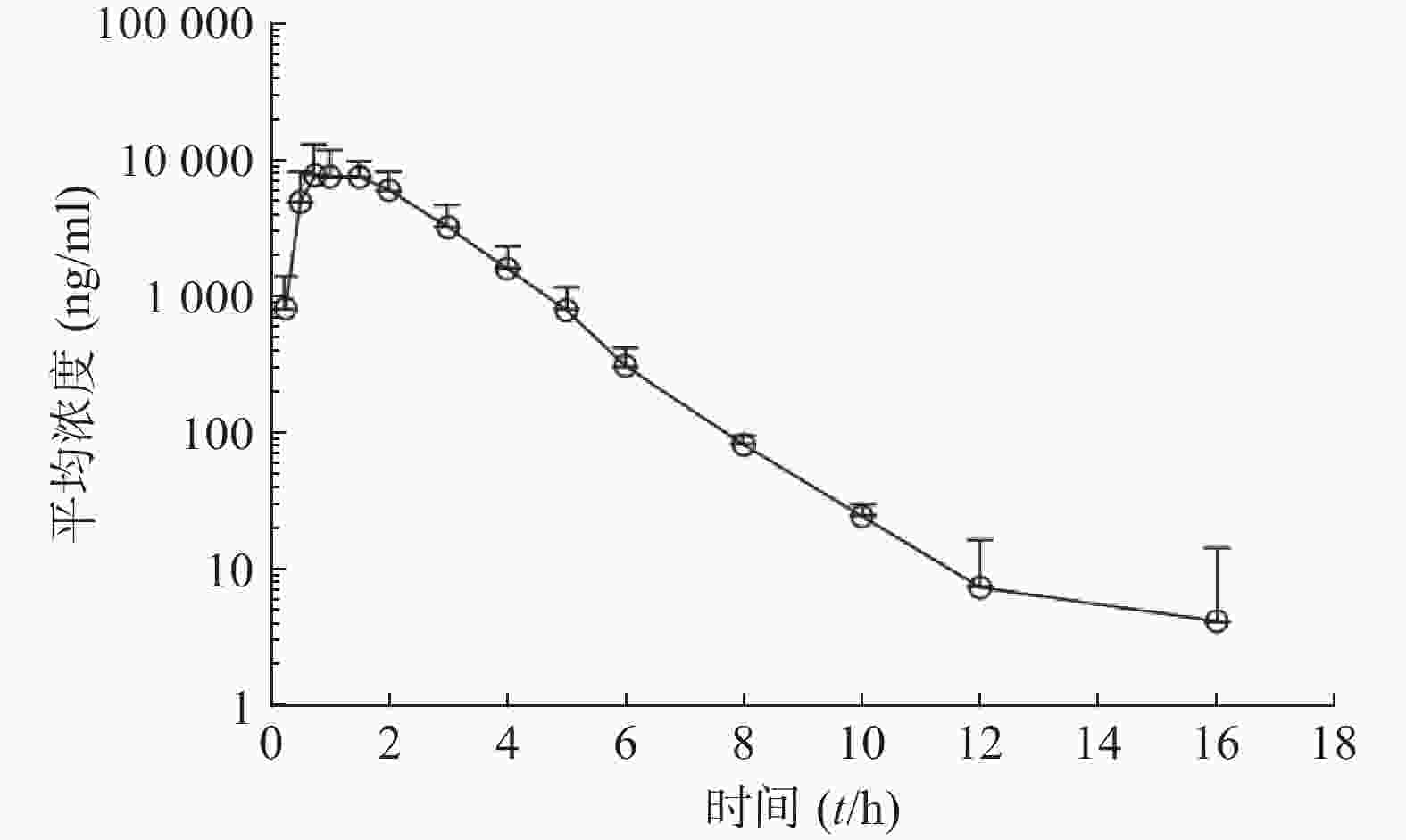
比格犬单剂量口服给药红景天苷15 mg/kg或静脉注射红景天苷1.5 mg/kg后,按“1.6”项下采集的各时间点血浆样品,并按照“1.5”项下操作,进行LC-MS/MS分析,测定红景天苷的比格犬血浆浓度。口服给药红景天苷15 mg/kg和静脉注射红景天苷1.5 mg/kg后的血药浓度-时间数据曲线分别见图2和图3。采用WinNonlin软件以非房室模型计算药动学参数(表2、表3)。
参数 雄性犬 雌性犬 平均值 AUC0−t(ng·h/ml) 15 976±1 702 25 095±1 527 20 535±5 200 AUC0−∞(ng·h/ml) 16 005±1 703 25 211±1 692 20 608±5 266 MRT0−∞(t/h) 2.20±0.561 2.39±0.055 2.29±0.371 t1/2z(t/h) 1.02±0.108 1.61±0.845 1.31±0.628 CLz(L/h·kg) 0.945±0.105 0.597±0.039 0.771±0.203 Vz(L/kg) 1.39±0.232 1.35±0.613 1.37±0.415 cmax(ng/ml) 7 867±2 978 11 493±3 995 9 680±3 725 F(%) 34.2±4.9 55.2±7.4 43.9±11.2 参数 雄性犬 雌性犬 平均值 AUC0-t(ng·h/ml) 4 735±1 050 4 557±415 4 646±721 AUC0-∞(ng·h/ml) 4 781±1 042 4 602±411 4 691±715 MRT0-∞(t/h) 1.010±0.064 1.030±0.048 1.020±0.052 t1/2z(t/h) 0.933±0.028 1.03±0.174 0.980±0.132 CLz(L/h·kg) 0.325±0.078 0.328±0.028 0.326±0.052 Vz(L/kg) 0.437±0.104 0.487±0.102 0.462±0.096 cmax(ng/ml) 9 000±1 526 9 620±2 037 9 310±1 645 本试验以比格犬单剂量静注给药红景天苷1.5 mg/kg后体内血药浓度-时间曲线下面积AUC0−∞为参比,计算比格犬单次口服给药红景天苷入血的绝对生物利用度。考虑到比格犬动物实验个体差异的特殊性,采用6条比格犬(雌雄各半)单剂量口服给药红景天苷15 mg/kg及6条比格犬(雌雄各半)单剂量静注给药红景天苷1.5 mg/kg后,血浆AUC0-∞的平均值进行比较,得到红景天苷在比格犬体内的绝对生物利用度为(43.9±11.2)%。
2.1. 专属性
2.2. 色谱特性
2.3. 线性范围
2.4. 定量下限
2.5. 精密度与准确度
2.6. 基质效应
2.7. 提取回收率
2.8. 稳定性试验
2.9. 稀释效应
2.10. 红景天苷在比格犬体内药动学研究
-
目前,对红景天苷的药动学研究多集中在小动物种属(大鼠、小鼠),仅有少量在比格犬上的研究,且绝对生物利用度未见文献报道。因此,本实验旨在建立一种快速、专属性强、灵敏度高的LC-MS/MS分析方法,并应用于比格犬体内红景天苷绝对生物利用度的考察。
在前期的方法考察中,血浆提取方法考察了蛋白沉淀法[沉淀试剂考察甲醇、乙腈、甲醇(含0.1%甲酸)和乙腈(含0.1%甲酸)]、液-液萃取法(萃取试剂考察乙酸乙酯、氯仿和异丙醇)。红景天苷在常规液液萃取溶剂中回收率较差。而蛋白沉淀法中基质效应较为明显,红景天苷及其内标天麻素在初始色谱条件下均表现出较强的基质抑制现象。
以往的研究中,并未见药典中针对生物分析方法验证所要求的特殊基质(溶血、高脂血等)基质效应的考察。因高脂血研究不适用于比格犬试验,固本次仅新增对溶血血浆中基质效应的考察。且前期发现在LC-MS/MS检测红景天苷浓度时,溶血血浆在提取后严重抑制了红景天苷的响应,使其无法准确定量。本实验最终采用甲醇作为沉淀试剂,蛋白沉淀后吹干的方式,对提取物进行浓缩,并使用10%乙腈溶液复溶,减少了进样过程中的溶剂效应,从而进一步改善了峰型。同时,通过对色谱柱的筛选和流动相成分的优化,使得原始方法中血浆的内源性共流出组分和待测物及内标在不同时间出峰,很大程度上避免了干扰现象,并显著改善了基质效应。
另外,结合以往对大鼠试验中对红景天苷生物利用度差异和剂量关系的研究,说明本试验在合理的给药剂量下,所呈现的生物利用度数值有着很高的可靠度和参考价值。在较低的给药剂量下,所建立的LC-MS/MS方法,定量范围为10~10 000 ng/ml,能充分满足本实验研究的需要。且此方法的专属性、准确度、精密度、基质效应、稳定性等均符合方法学要求,方法可靠,能够准确测定比格犬血浆中红景天苷的浓度,评价其在比格犬体内的药动学行为。
本研究填补了红景天苷在比格犬体内的绝对生物利用度研究的空白,为以后临床试验中推测人体内暴露量,考察生物利用度提供了参考数据,同时为临床选择给药途径提供了依据。








 DownLoad:
DownLoad: