-
信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)是一种信号转录蛋白[1]。该蛋白在结构上主要有N末端、卷曲螺旋、DNA接合、连结、SH2和转录激活区域6个位置域[2]。现有的研究结果表明,STAT3抑制剂可靶向作用于STAT3蛋白的不同结构区域,抑制其在细胞中的表达,为抗炎、抗癌治疗提供思路[3-4]。
HTML
-
近年来研究者对STAT3蛋白的探索不断加深,对其在体内的活化机制也有清晰的发现[5]。STAT3在细胞质中分析信号、转导,在细胞核中转录激活[6]。STAT3蛋白在细胞中扮演着重要角色,可影响细胞的生长凋亡机制,研究者们观察到失控的STAT3在异常激活中会导致细胞发生恶性转化,对肿瘤细胞的形成和发展具有重要影响[7]。
STAT3的激活可通过各种细胞因子、生长因子和激素与细胞表面的受体结合而实现。在Janus激酶(JAK)-STAT3信号途径中,细胞因子与细胞膜上的蛋白受体结合,成为二聚体。二聚体在细胞质中募集并激活JAK激酶蛋白,激活的JAK蛋白磷酸化受体酪氨酸残基。随后,STAT3的Tyr705残基被JAKs磷酸化,STAT3蛋白被活化再形成二聚体后,从细胞质转移到细胞核中,与特异性DNA反应元件结合,最终调节STAT3靶基因的表达[8]。
STAT3的每个结构域各有其独特的生物作用。STAT3的N末端结构域对STAT3二聚体核易位以及DNA结合具有重要作用;卷曲螺旋结构域对STAT3与各种蛋白质的协同效应具有一定影响。DNA结构域可匹配特殊的DNA序列,然后形成STAT3-DNA复合物。连接区域参加与细胞转录系统的相互作用。SH2结构域对于STAT3二聚化也至关重要。因为在肿瘤细胞中的过度激活现象,以及抗STAT3的抑制剂对于抗炎免疫具有良好效果,STAT3已成为近年来药物研发的一个热门方向,研究人员纷纷投入巨大热情,不断挖掘STAT3的医药价值[9-10]。
-
STAT3抑制剂可靶向作用于STAT3蛋白,抑制其在癌细胞中的磷酸化、二聚化以及核易位,使其转录功能丧失,有可能为疾病治疗提供新方向[11]。
-
Turkson等[12]研究了STAT3的结合肽PY*LKTK(Y*代表磷酸酪氨酸)在体外破坏STAT3活性的能力。核提取物中PY*LKTK的存在会导致STAT3的DNA结合活性水平显著降低,因此破坏了核易位。作为肽直接抑制STAT3的功能重要性的证据,发现PY*LKTK-mts(mts,膜移位序列)可在体内选择性抑制组成型和配体诱导的STAT3激活。此外,PY*LKTK-mts可抑制Src癌蛋白的转化。Turkson通过确定了抑制STAT3信号转导的最小肽,为使用该肽作为新型拟肽药物进行临床治疗STAT3异常激活的疾病提供了概念基础。
Timofeeva等[13]在表征STAT3-N末端域的选择性抑制剂ST3-H2A2的作用中,观察到该化合物使凋亡基因强烈激活,在癌细胞中诱导细胞凋亡。通过DNA-chip技术和平铺人类启动子阵列技术,发现响应ST3-H2A2的基因在表达激活的同时会伴随着STAT3染色质结合而改变。此外,将siRNA敲低可证实ST3-HA2A对基因表达和染色质结合的影响是STAT3依赖性的,而C/EBP同源蛋白(CHOP)启动子的STAT3结合区位于癌细胞中染色质的DNase I超敏位点中,而不是未转化细胞中,这表明STAT3结合和抑制作用极有可能与染色质结构有关。因此我们猜想,STAT3-N末端选择性抑制剂可调节癌细胞凋亡基因的表达,促使细胞凋亡,为癌症治疗提供新方案。
-
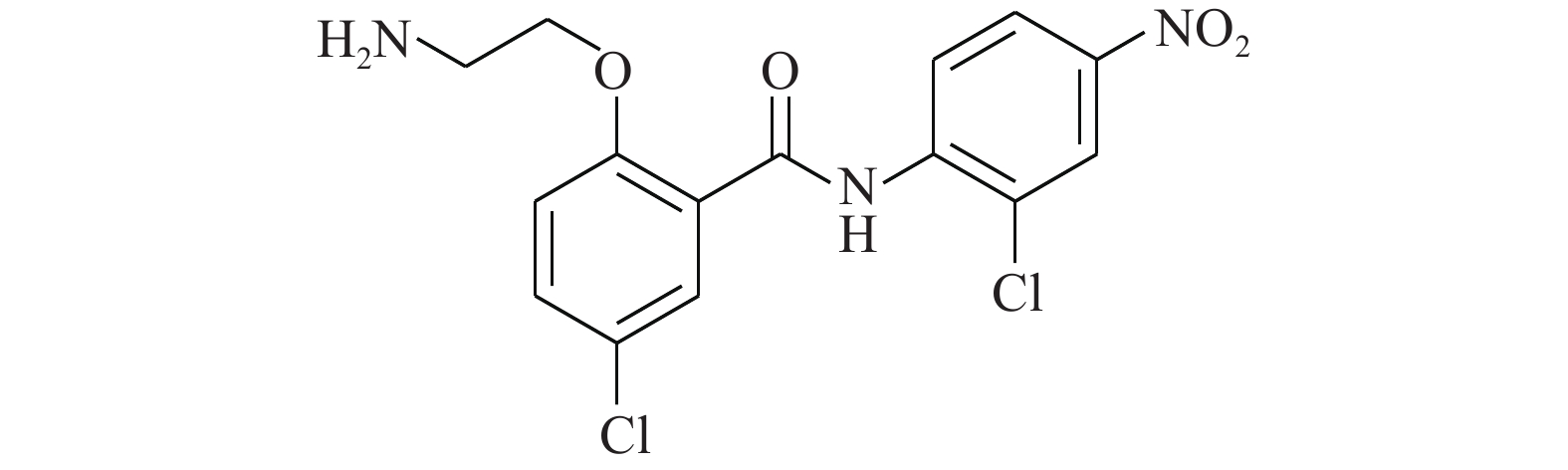
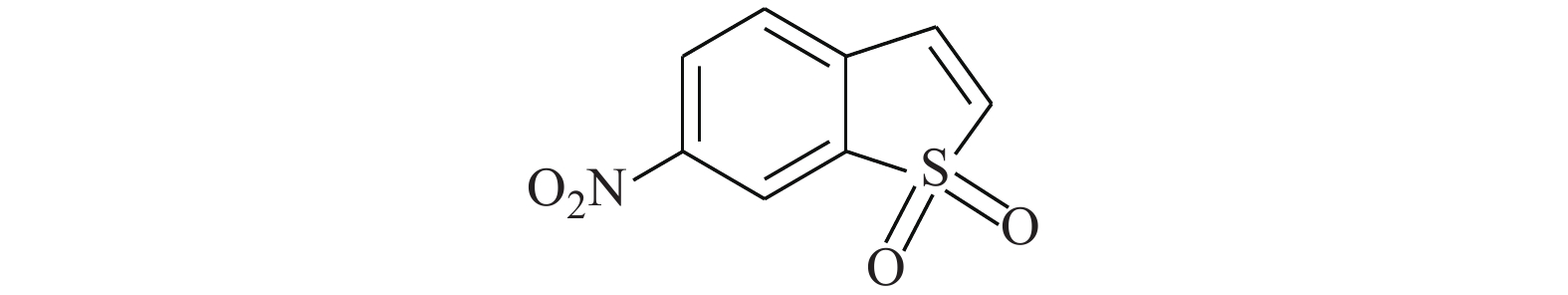
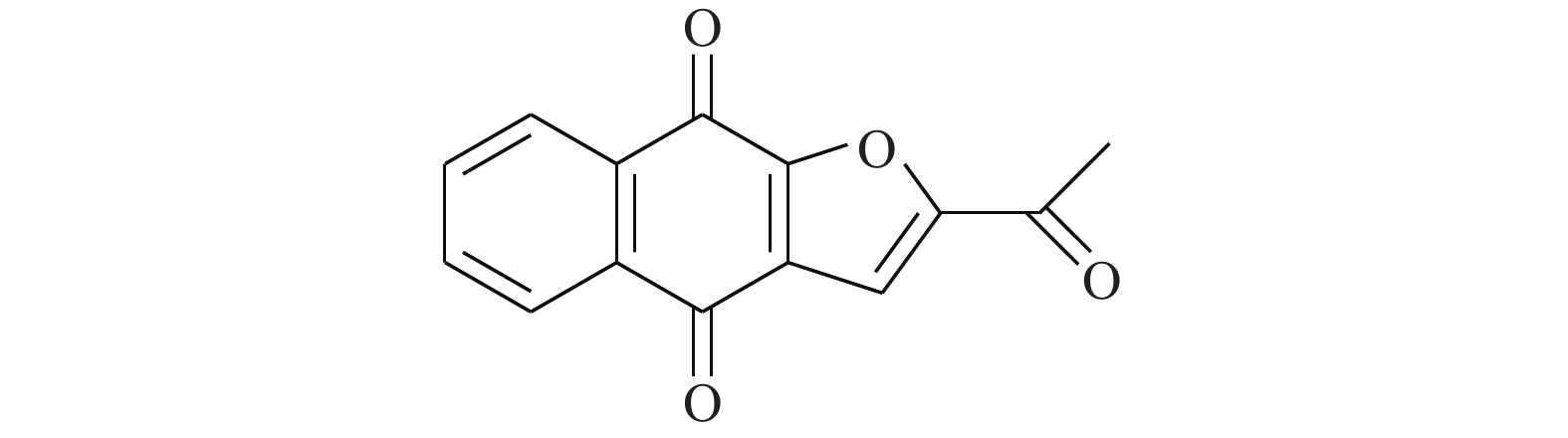
Huang等[14]使用计算机虚拟筛选(AlloFinder)的途径对STAT3的C端卷曲螺旋区域(CCD)进行匹配,通过对分数排名前15的化合物进行生物测定,筛得理论最佳化合物K116(图1)。在此化合物的作用下,荧光偏振显示STAT3的IC50值为7.99 μmol/L。在免疫印迹实验中,STAT3的Y705磷酸化被抑制,而上游的激酶Src及其磷酸化无影响。同时,在肿瘤细胞株MDAMB-468及DU145中,K116表现出对STAT3很强的抑制,IC50为4.46和23.85 μmol/L,表明K116具有良好的特异性抑制STAT3的作用。从K116的研究历程来看,未来进行虚拟筛选的计算化学方法将逐步成为药物研发的一种趋势,在此趋势发展的初期,我们还需要不断改进底层算法并完善数据库内容。
-
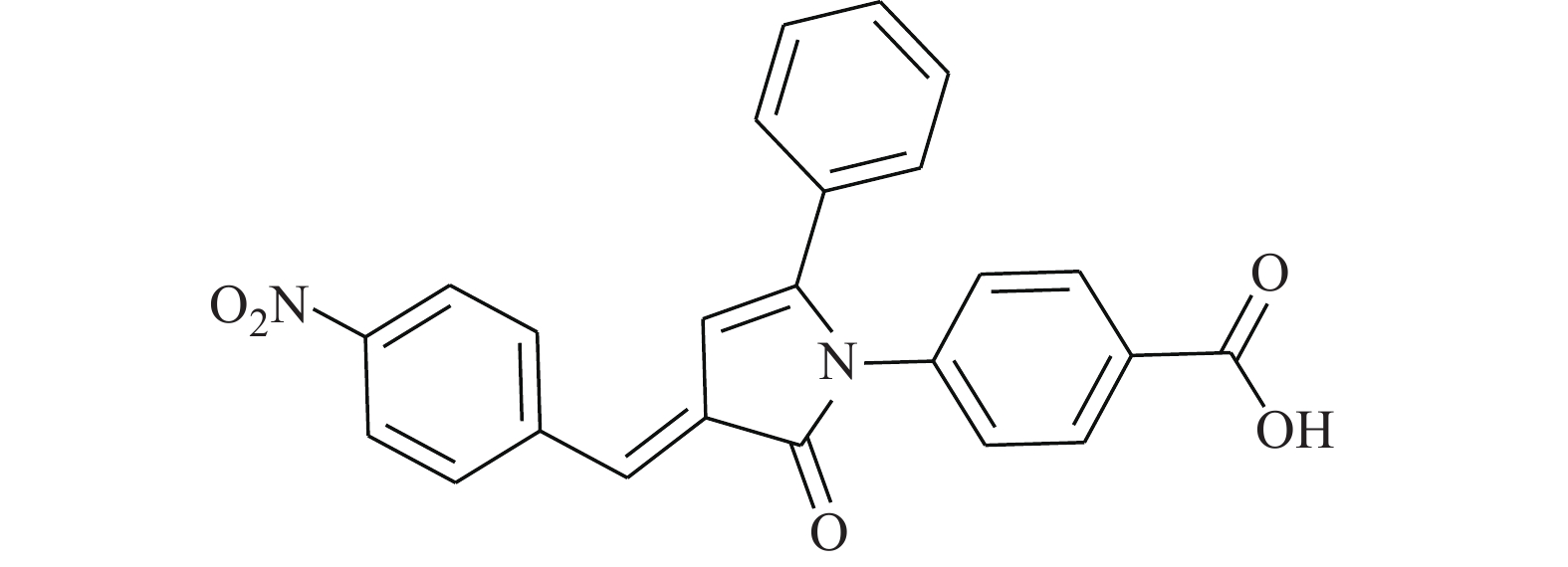
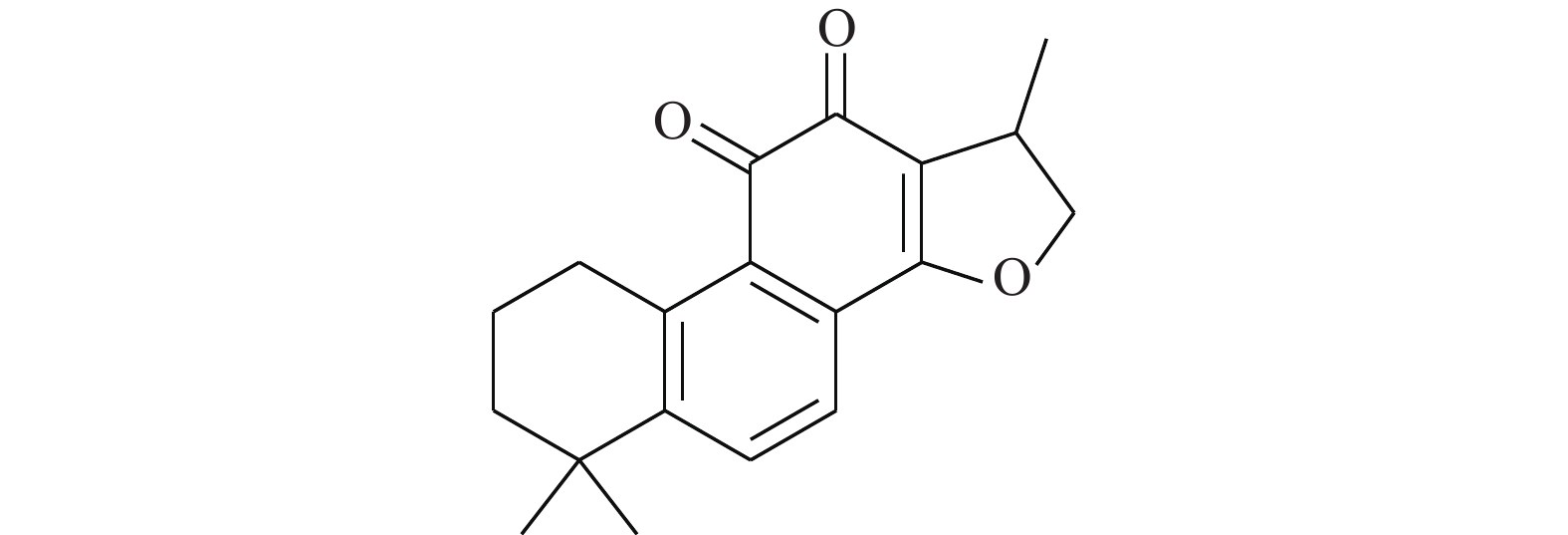
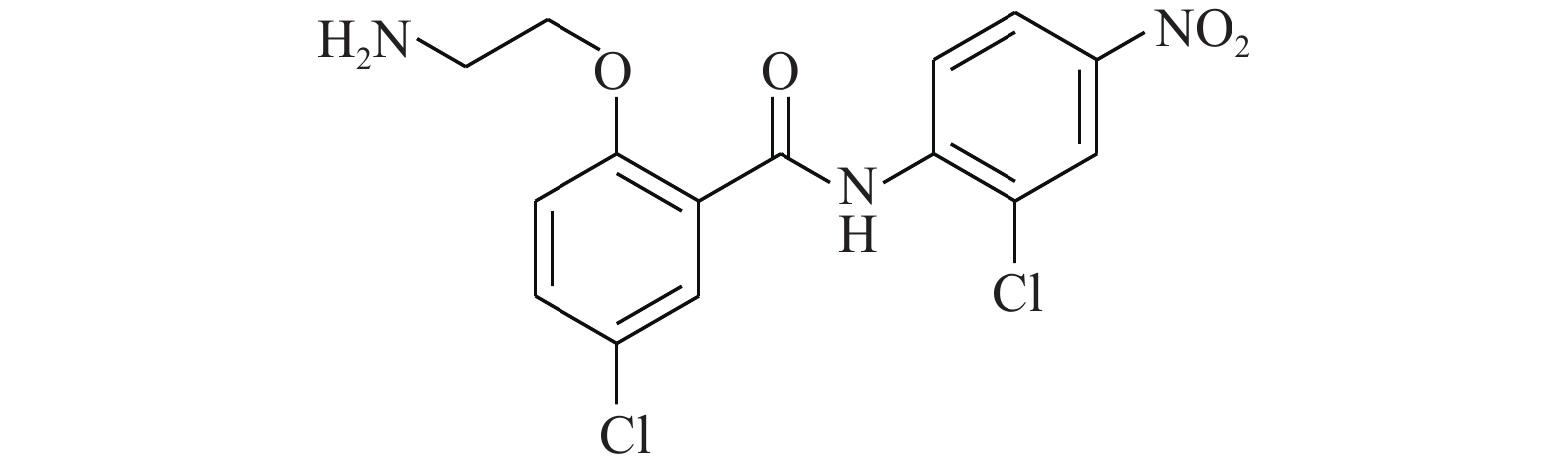
Huang等[15]通过使用改进的虚拟筛选策略靶向STAT3的DNA结合域(DBD),得到了靶向STAT3-DBD的小分子化合物inS3-54(图2)。采用[32P]标记的DNA双链探针及电泳迁移率变动分析表明,inS3-54选择性抑制STAT3与DNA的结合,而对STAT1无影响。与非癌细胞相比,inS3-54优先抑制癌症细胞的增殖,抑制STAT3下游靶基因的表达和STAT3原位结合染色质。因为inS3-54不与SH2结构域相连接,不抑制STAT3二聚化,但可以抑制STAT3与基因组DNA的结合。inS3-54代表了一种新型探针,对于开发靶向STAT3的DBD域特异性抑制剂具有积极意义。
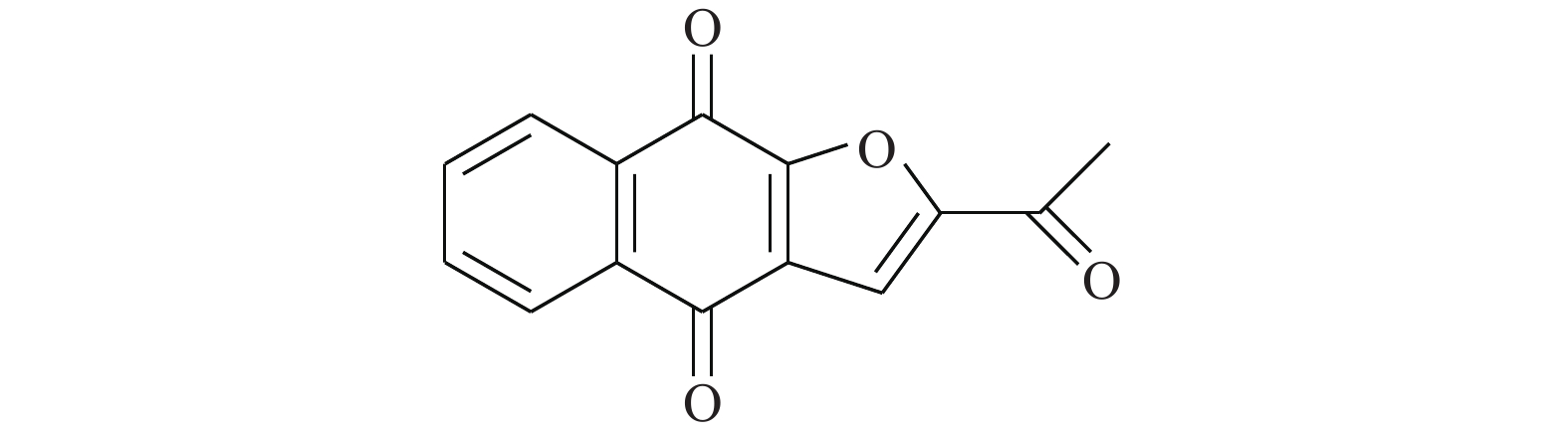
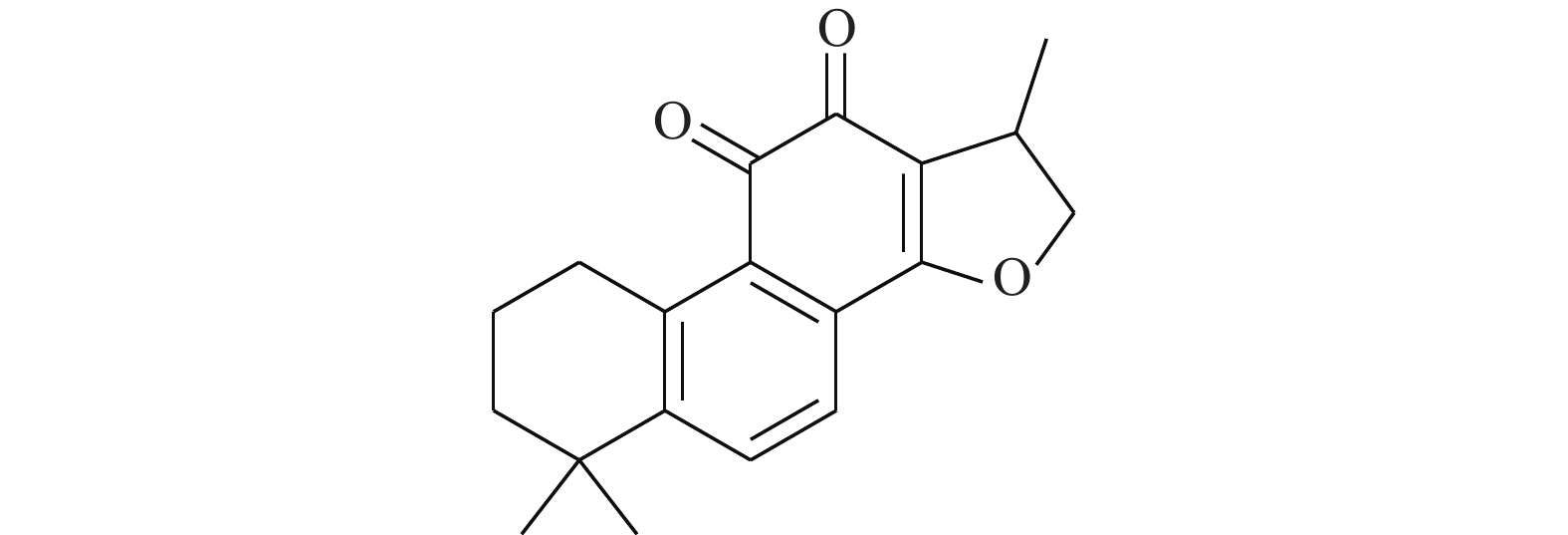
Buettner等[16]为了证明化合物C48(图3)可作为STAT3的选择性抑制剂,使用定点诱变和多种生化技术,探明C48将STAT3中的Cys468烷基化的过程。进一步研究证明,C48会在STAT3过度表达的肿瘤细胞系中阻止STAT3核易位,导致小鼠体内肿瘤生长的显著抑制。这些发现表明,STAT3中的Cys468代表了一个新的治疗干预位点,并推测烷基化有望成为STAT3相关类型癌症的潜在治疗方法。
-
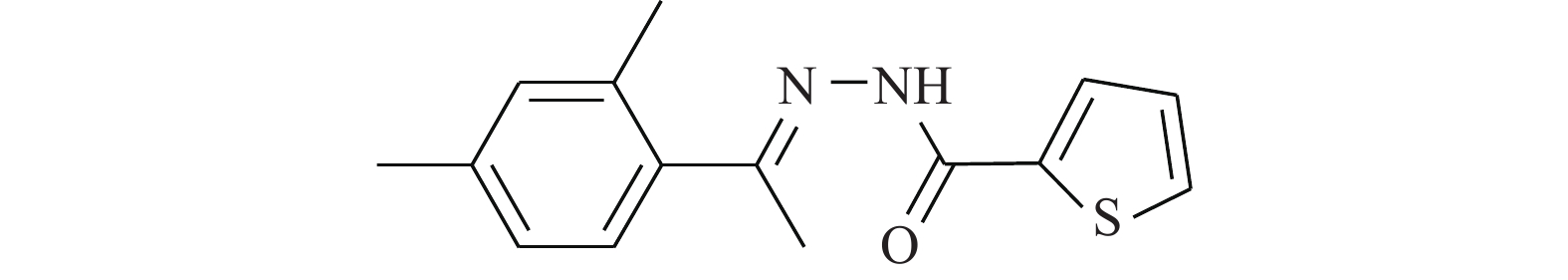
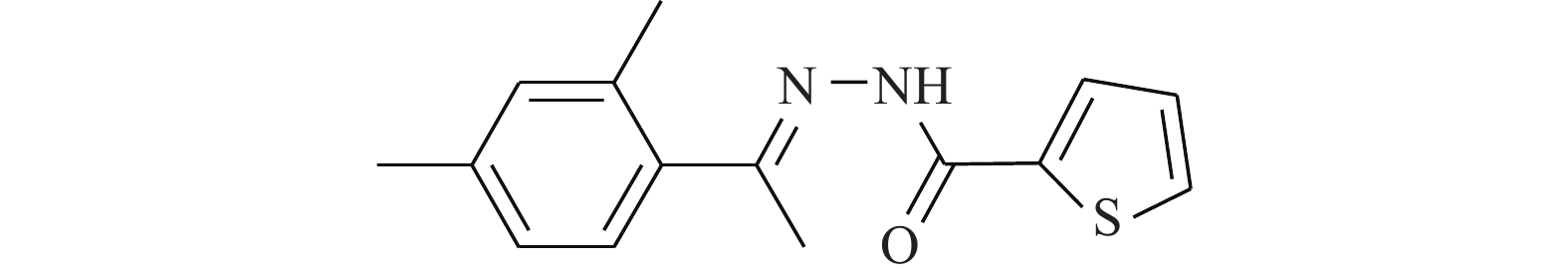
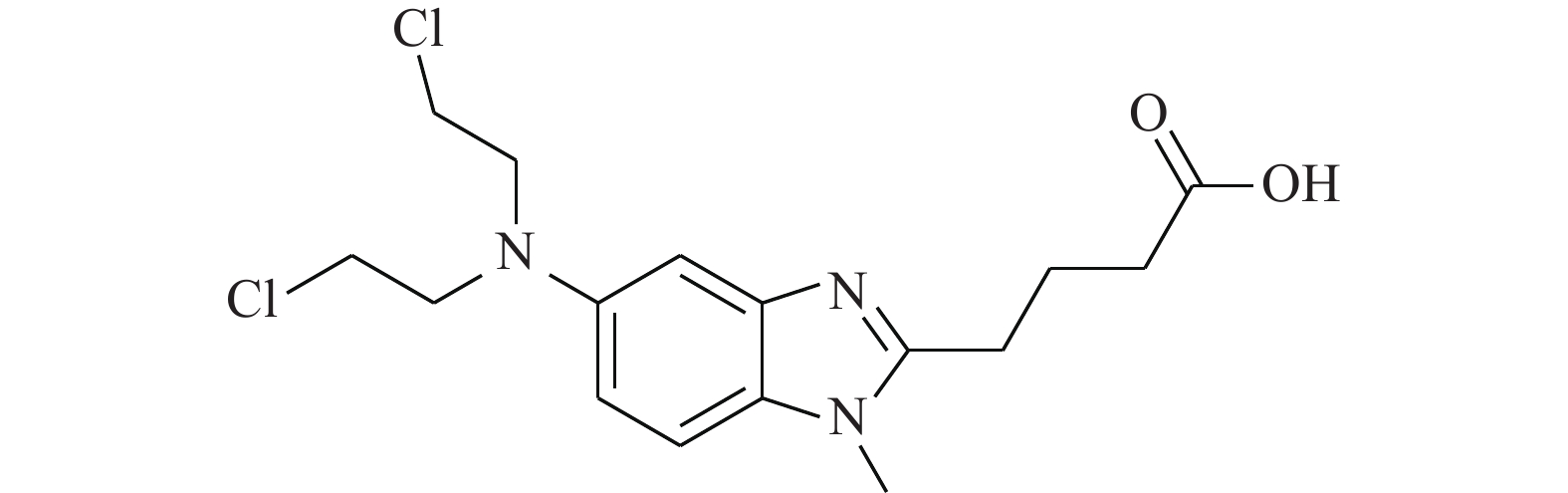
Cheng等[17]研究化合物6-OAP(图4)与肺癌细胞的作用关系,发现该化合物在H1975和A549细胞中以剂量和时间依赖性的方式抑制了STAT3的转录(抑制位点Tyr705),进而抑制由IL-6等细胞因子诱导的STAT3的活化、磷酸化与二聚体的形成。6-OAP在STAT3的SH2结构域与Ser611/Ser613/Arg609形成氢键,阻碍IL-6诱导的STAT3磷酸化,对肺癌细胞和对S期激酶相关蛋白转录有抑制作用。药理实验表明,6-OAP抑制静脉注射肺癌细胞的SCID小鼠的肿瘤生长。6-OAP的效果优异,毒副作用较小,有望进一步挖掘其药用价值。
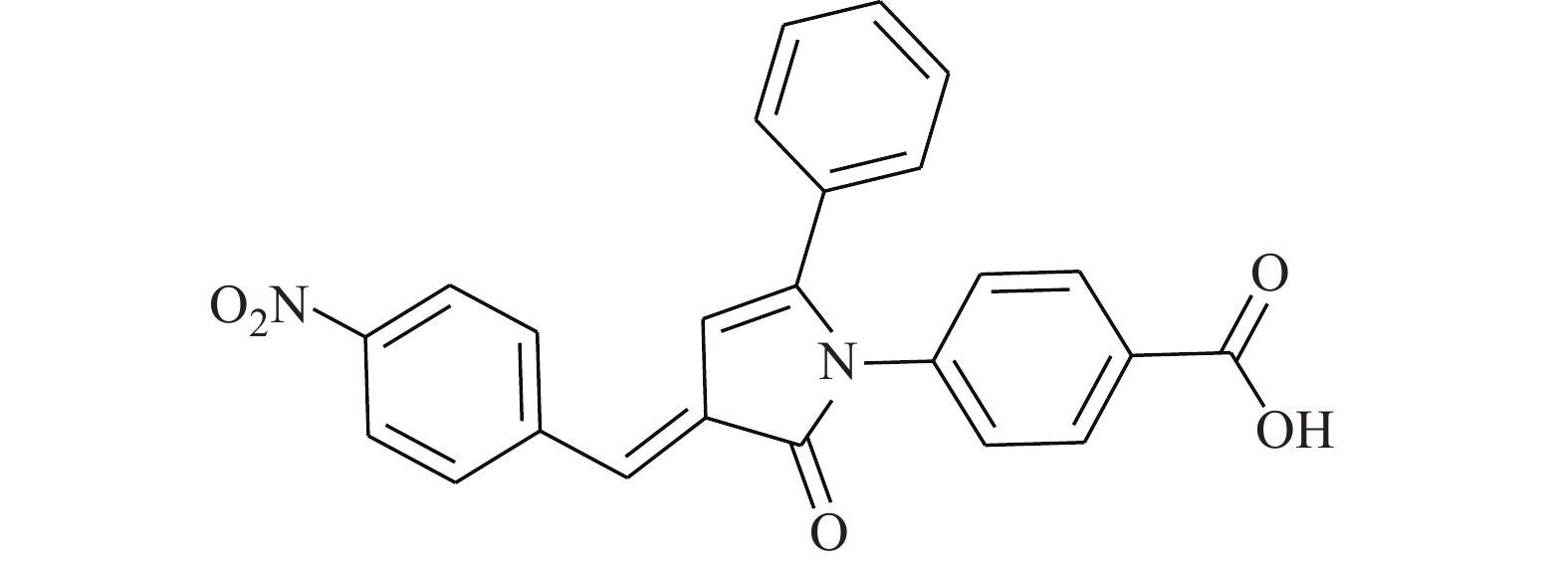
Schust等[18]从化学数据库中通过模拟筛选得到化合物Stattic(图5)。Stattic能有效抑制STAT3的SH2结构域,对STAT3的激活、二聚化和核易位等关键步骤有阻滞作用。将MDA-MB-231和MDA-MB-435S细胞在指定浓度下用Stattic处理2 h,对STAT3、p-STAT3和其他信号分子(JAK1/JAK2等)的全细胞裂解物进行蛋白质印迹分析,证明了Stattic对STAT3的磷酸化有显著的抑制效应,且其特异选择性较高,有潜力成为高效的STAT3抑制剂。
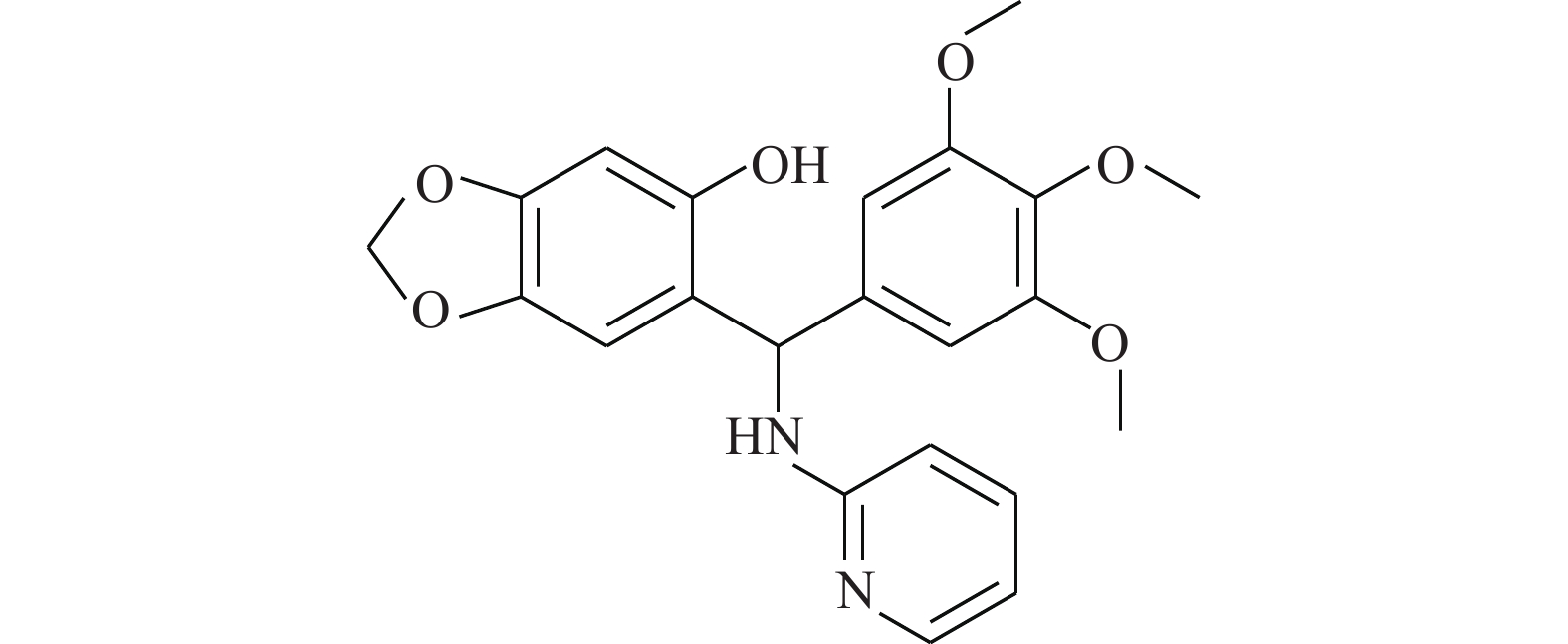
Chen等[19]通过传统的有机合成方法得到了化合物HJC0152(图6),发现其对人乳腺癌和胰腺癌细胞显示出比氯硝柳胺相似或更高的效力。经过结构修饰后(将苯环上的烷氧基改为氨基)的HJC0152显示出优异的水溶性,与氯硝柳胺相比提高了约3 300倍。在光学显微镜的观察下,将MDA-MB-231乳腺癌细胞用化合物HJC0152处理48 h,观察细胞形态变化,发现细胞周期进程被抑制,细胞凋亡变得更加常见。在带有乳腺肿瘤异种移植物的裸鼠中,HJC0152显著抑制了肿瘤的生长。从这些结果中推测,具有更好水溶性的化合物HJC0152有望被开发成用于癌症治疗的口服生物利用剂。
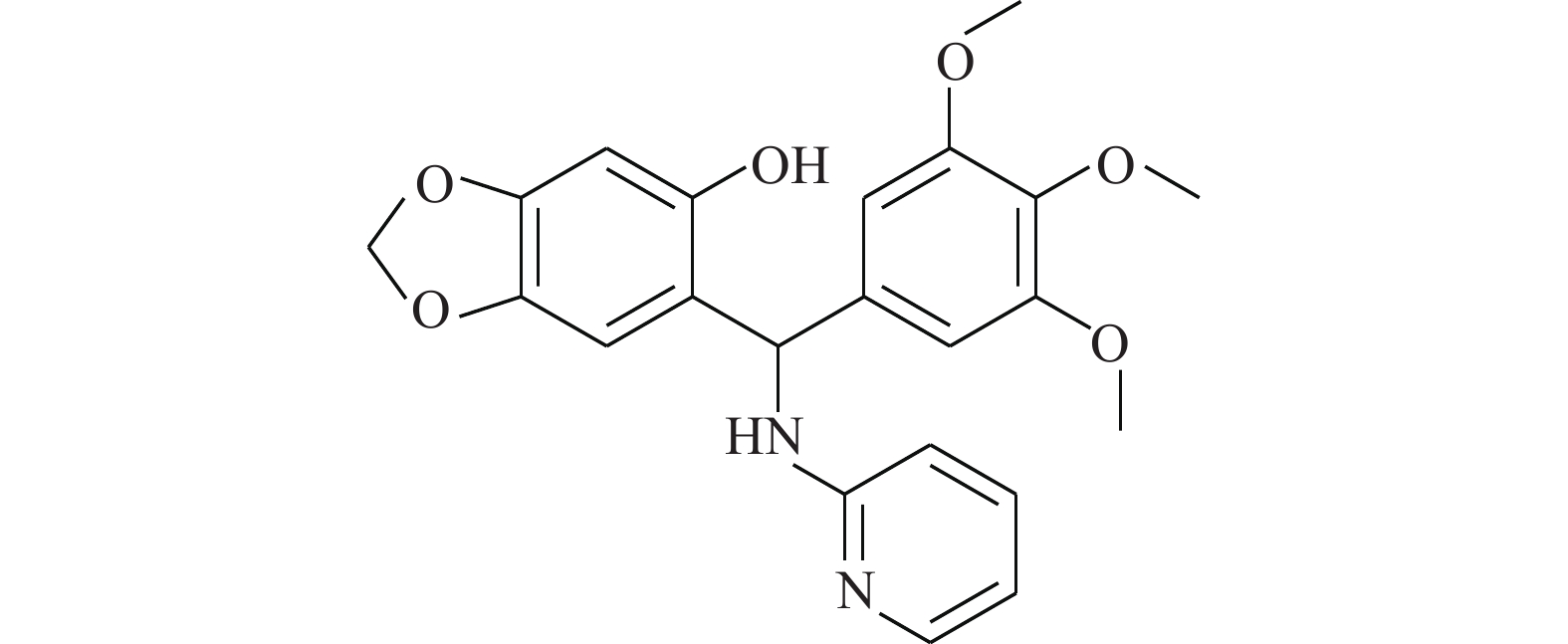
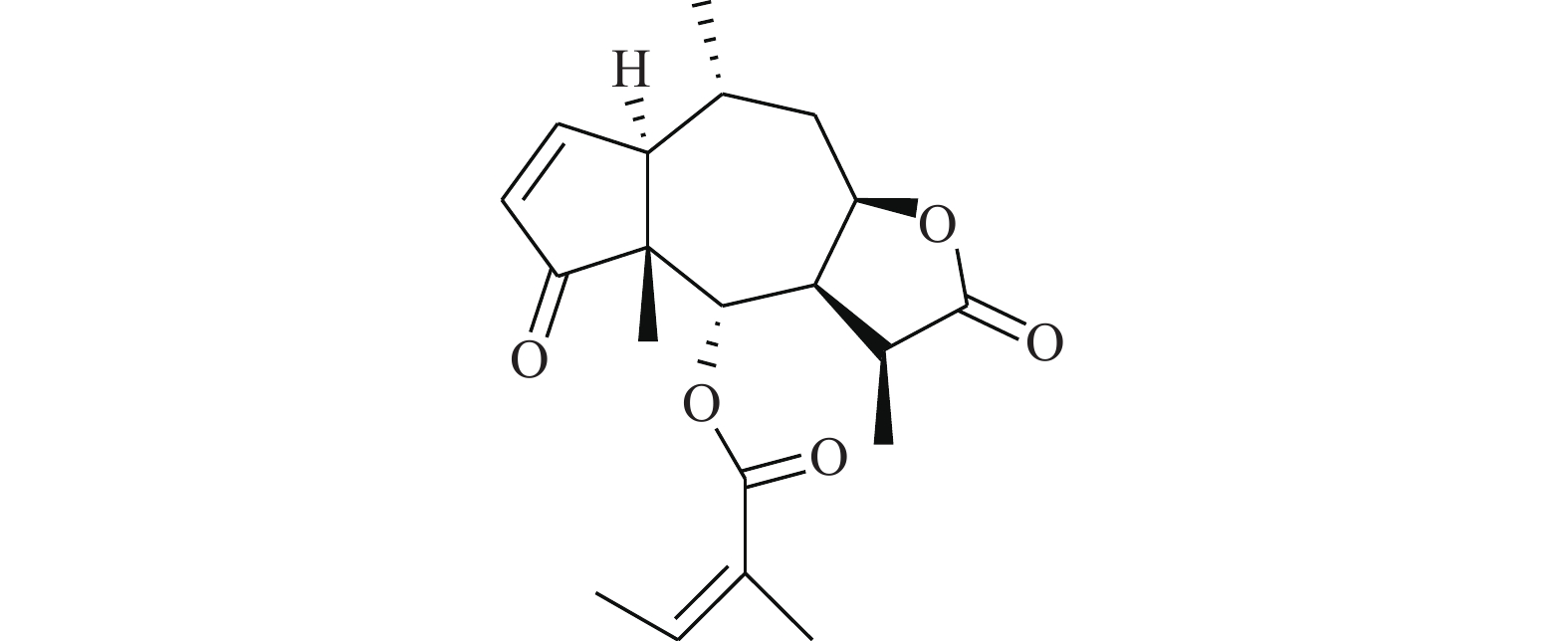
Shin等[20]首次报道了隐丹参酮(图7)抗癌活性是通过抑制STAT3实现的。隐丹参酮可快速抑制DU145人前列腺癌细胞中的STAT3的Tyr705磷酸化,降低STAT3下游靶蛋白的表达。隐丹参酮抑制STAT3磷酸化是由独立于JAK2的机制引起的,且不影响上游酪氨酸激酶。隐丹参酮可直接与STAT3分子结合(STAT3的SH2结构域),抑制其二聚化,并下调细胞周期蛋白D1、Bcl-xL和survivin的表达,使G0-G1期的细胞蓄积,降低STAT3转录调控活性。这些结果表明,隐丹参酮是良好的STAT3靶向抑制剂。
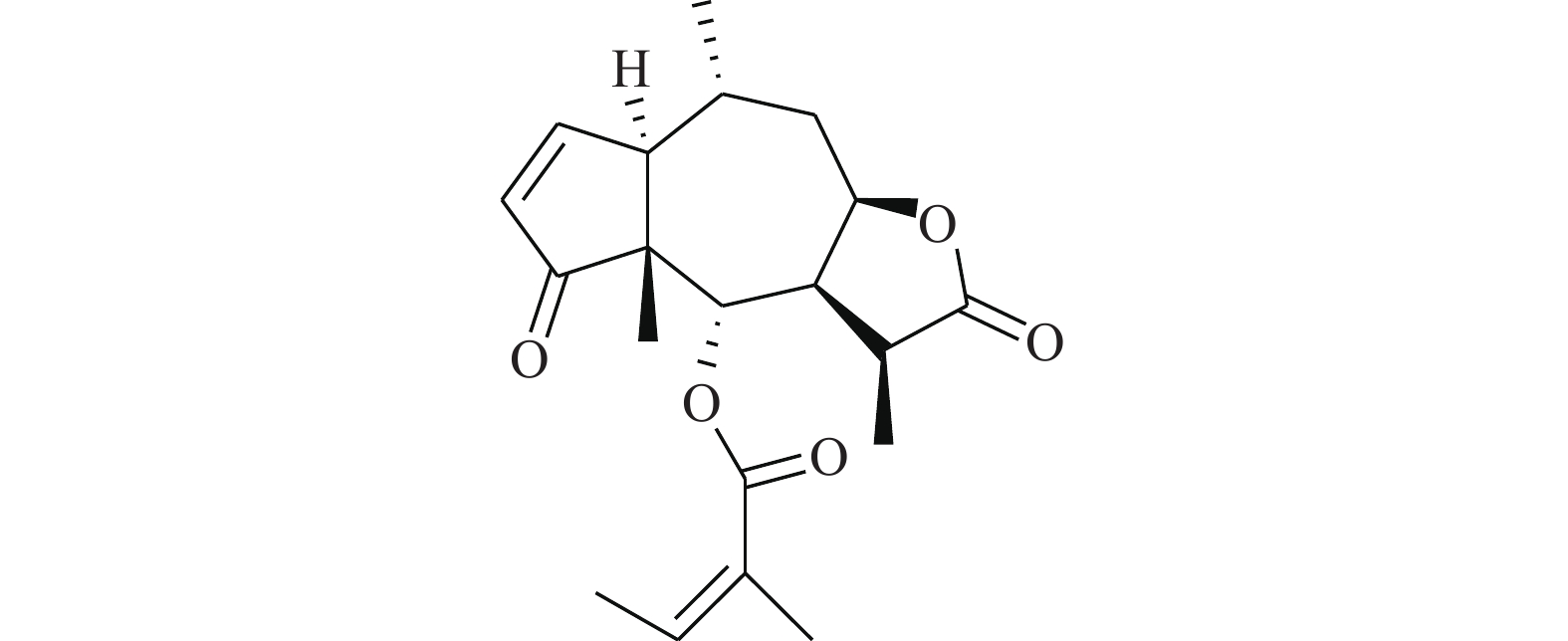
Iwamoto等[21]研究发现,苯达莫司汀(BENDA,图8)作为一种烷化剂,对多种癌症具有临床活性,包括但不限于非霍奇金淋巴瘤、慢性淋巴细胞性白血病和多发性骨髓瘤等。BENDA可以选择性结合细胞中的STAT3并抑制其活性,BENDA在体外选择性地拮抗STAT3-SH2结构域(IC50=7.4 μmol/L),而不是其他含有SH2的蛋白质(拮抗STAT1-SH2的IC50为60 μmol/L)。BENDA结合到STAT3中的半胱氨酸残基Cys550和Cys712位置上,从而抑制SH2与相应的p-Tyr肽的结合。
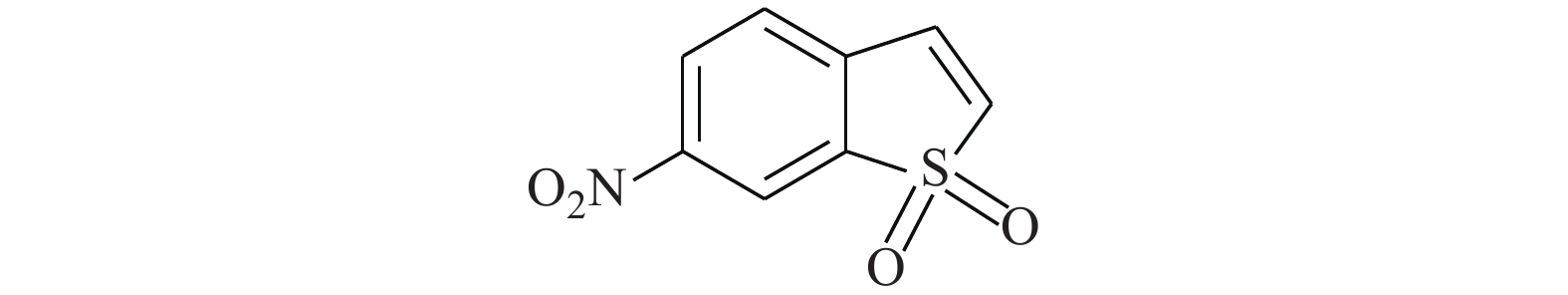
Chang等[22]研究发现,STAT3抑制剂BBI608(图9)是降低EGFR阳性肺癌细胞系细胞活力的潜在药物。BBI608可降低组蛋白甲基转移酶G9a介导的表皮生长因子受体3表达,抑制EGFR阳性肺癌(包括EGFR E746-A750 HCC827、WT-A549和T790 M H1975)的细胞活力。在与阿法替尼的对照实验中,BBI608更为明显地降低了A549和H1975细胞的生存能力,并降低了A549的细胞迁移。因此,BBI608极有潜力成为EGFR阳性肺癌的治疗药物。
研究表明,STAT3在各种类型的癌症中被组成性激活,并且直接参与癌细胞的免疫调节。Shastri等[23]对骨髓增生异常综合征(MDS)和急性髓性白血病(AML)患者的造血干细胞和祖细胞群体进行转录组分析,发现STAT3存在异常激活现象,而敲除STAT3后,体内白血病细胞的生长也受到了抑制,各类癌基因在恶性细胞中的表达也随之下降。
2.1. 靶向N端区域
2.2. 靶向卷曲-螺旋区域
2.3. 靶向DNA结合域
2.4. 靶向SH2结构域
-
STAT3在多种实体瘤和血液性肿瘤中会过度激活,对肿瘤的发生和发展有着重要影响。因此,STAT3作为治疗肿瘤的新靶点已被研究人员所认同;同时,STAT3抑制剂对抗炎免疫有重要作用,在类风湿性关节炎等疾病研究中颇有成效。21世纪以来,STAT3抑制剂的临床前研究不断深入,但进入临床使用的药物却很少。因此,研发高效、低毒的STAT3抑制剂仍将是一种挑战。近年来,研究人员将多种天然产物(如雷公藤红素等)作为先导化合物,合成了更有效的小分子化合物,通过不断筛选、评价和选择活性大、特异性强的STAT3抑制剂,将中西医药物治疗与放疗、化疗结合,这可能是今后的STAT3研究方向之一,为抗肿瘤以及抗炎免疫研究提供新方向。







 DownLoad:
DownLoad: