-
脓毒症作为机体对感染反应失调的器官功能障碍综合征,常累及肾脏,是危重患者发生急性肾损伤最常见的原因之一。脓毒症引起的急性肾损伤不仅使住院死亡率增加6~8倍,还与远期慢性肾脏病的发展和远期死亡风险增加有关[1-3]。通常认为脓毒症相关急性肾损伤的发病过程与过度炎症反应、血流动力学障碍、凝血功能障碍、小管上皮细胞损害等有关[1],然而,脓毒症相关急性肾损伤的机制尚未完全阐明。近年来,代谢组学作为反应疾病内环境与内源性代谢物之间关系的一种方法,被广泛应用于各种疾病,因此,利用代谢组学探究脓毒症相关急性肾损伤中内源性代谢物的变化有助于进一步理解其发病机制。黄连作为常见中药,具有抗炎、抗氧化等功能,被广泛用于各种疾病[4]。既往研究发现黄连可以通过减轻炎症改善脓毒症诱导的急性肝损伤[5],而黄连是否对脓毒症相关急性肾损伤存在保护作用还有待进一步研究。本研究旨在研究黄连对脓毒症相关肾损伤的影响,并利用代谢组学探讨其潜在机制。
HTML
-
C57BL/6小鼠(上海斯莱克实验动物有限责任公司);黄连生药获于安徽亳州;生化指标试剂盒(南京建成生物工程研究所有限公司);Agilent 7890A /5975C气相色谱-质谱联用仪(美国);Agilent J&W Scientific HP-5ms(30 m × 0.25 mm,0.25 μm)毛细管色谱柱。
-
黄连生药由海军军医大学药学院孙连娜教授鉴定;根据《中国药典》(2015年版)准备黄连水提取物。
-
采用盲肠结扎穿孔术(CLP)建立脓毒症相关急性肾损伤模型。将18只小鼠随机分为3组,每组6只。具体分组如下,假手术组(Sham组):仅对小鼠切开缝合,并给予等体积生理盐水灌胃;模型组(CLP组):小鼠行CLP,并给予等体积生理盐水灌胃;给药组(RCE组):小鼠行CLP,并给予黄连提取物100 mg/kg灌胃。
-
干预完成24 h后,对所有小鼠行内眦静脉取血,4 ℃冰箱静置40 min后,以3000 r/min离心5 min,取血清置于−80 ℃冰箱保存,以行生化指标检测。取血后处死小鼠,行心脏灌流,切取肾脏置于−80 ℃冰箱中保存,以行代谢组学分析。
-
利用试剂盒检测血清肌酐(Scr)、尿素氮(BUN)水平。
-
取出−80 ℃冰箱中储存的肾组织,取皮髓交界部分,称取50 mg加入内标甲醇1 ml,再加入碾磨珠,4 ℃,70 Hz碾磨120 s,再置入4 ℃离心机中,以12 000 r/min离心10 min,取上清液200 μl置离心管中,温和氮气吹干。加入15 mg/ml的甲氧胺吡啶溶液50 μl,涡旋30 s,置于70 ℃的烘箱中反应60 min,再加入N-甲基-N-三甲基硅基三氟乙酰胺(含1%的三甲基氯硅烷)50 μl,涡旋1 min,室温反应30 min,再加入100 μl正庚烷,涡旋30 s,4 000 r/min离心5 min,取上清液100 μl上样。余上清液每个取10 μl混合成质量控制样本(QC),涡旋后取100 μl上样。
采用气相色谱-质谱(GC-MS)进行代谢组学分析。仪器参数设定为:进样口温度280 ℃,EI离子源温度230 ℃,四极杆温度150 ℃,高纯氦气(纯度<99.999%)作为载气,不分流进样,进样量1.0 μl。升温程序为:初始温度80 ℃,维持2 min,10 ℃/min的速度升至320 ℃,并维持6 min。采用全扫描模式进行质谱检测,质谱检测范围为50~550 m/z。采用随机顺序进行连续样本分析,避免因仪器信号波动造成的影响。
-
在R软件平台下采用自写的程序代码进行数据预处理,包括基线过滤、峰识别和积分,然后在TagFinder软件下进行保留时间校正、峰对齐和质谱碎片归属等分析,最后在Excel软件中进行后期编辑,包括来自于柱流失和样本制备造成的杂质峰剔除和定量离子选择等,将最终结果组织为二维数据矩阵,包括变量(保留时间及质荷比)、观察量(样本)和积分面积。本项目共得到1 234个物质(每组样本至少存在80%以上的物质)。将中心化和归一化后的数据导入SIMCA-P V11.0进行主成分分析(PCA)和偏最小二乘法-判别式分析(PLS-DA)进行排列测试以评估模型的质量,生成变量重要性投影(VIP),表示对每种代谢物离子的群间区分的贡献。选择VIP 值>1.0的代谢物用于进一步分析。
所有数据以(
$\bar x$ +s)形式表示,使用one-way ANOVA 和 post hoc Tukey’s 检验,通过 SPSS 17.0 软件计算P值,以P<0.05为差异有统计学意义。
1.1. 材料
1.2. 黄连提取物的准备
1.3. 动物模型的建立及分组
1.4. 标本收集
1.5. 生化指标检测
1.6. 代谢组学分析
1.7. 数据处理及统计学分析
-
假手术组、模型组及给药组Scr水平分别为(9.83±1.95)、(50.83±13.53)、(29.67±4.96)μmol/L;BUN水平分别为(8.08±0.84)、(27.67±5.22)、(16.33±2.69)mmol/L。模型组较假手术组Scr水平、BUN水平均上调;而给药组较模型组均下调,差异均有统计学意义(P<0.05,表1),表明黄连提取物在脓毒症相关急性肾损伤中可改善肾功能。
组别 Scr (μmol/L) BUN (mmol/L) 假手术组 9.83±1.95 8.08±0.84 模型组 50.83±13.53* 27.67±5.22* 给药组 29.67±4.96# 16.33±2.69# *P<0.05,与假手术组比较;#P<0.05,与给药组比较。 -
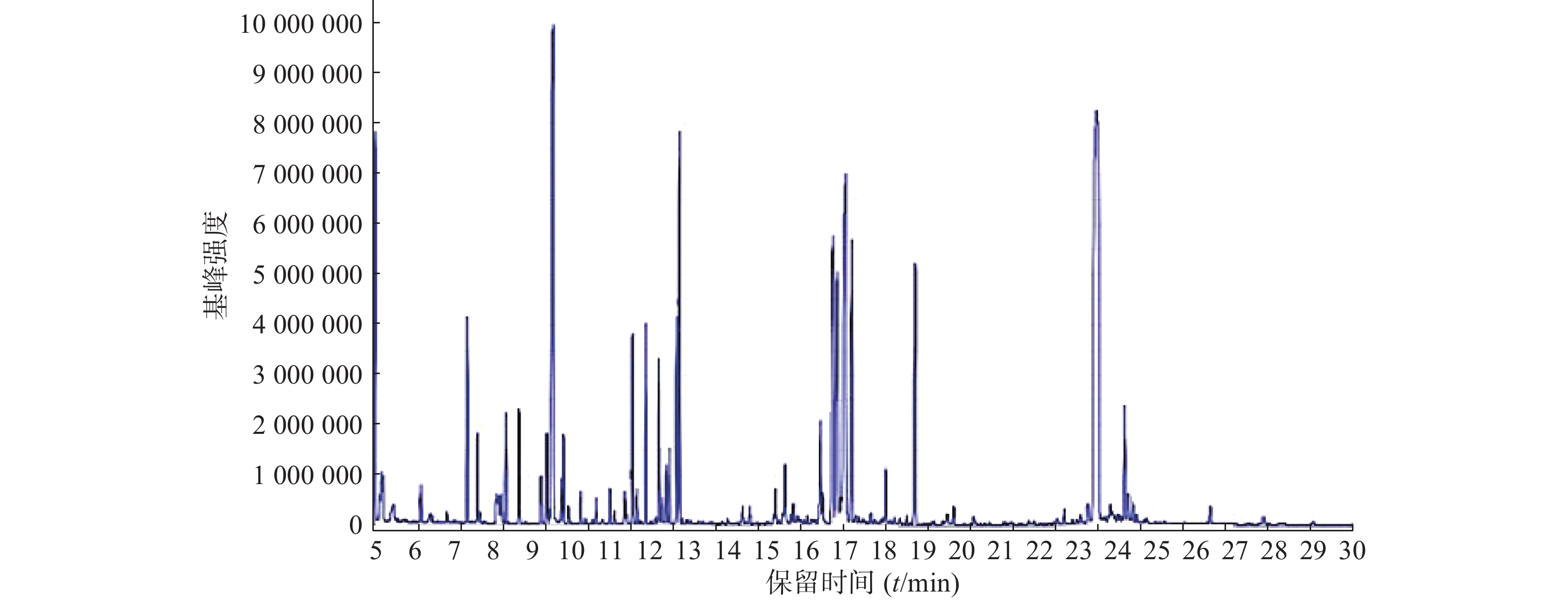
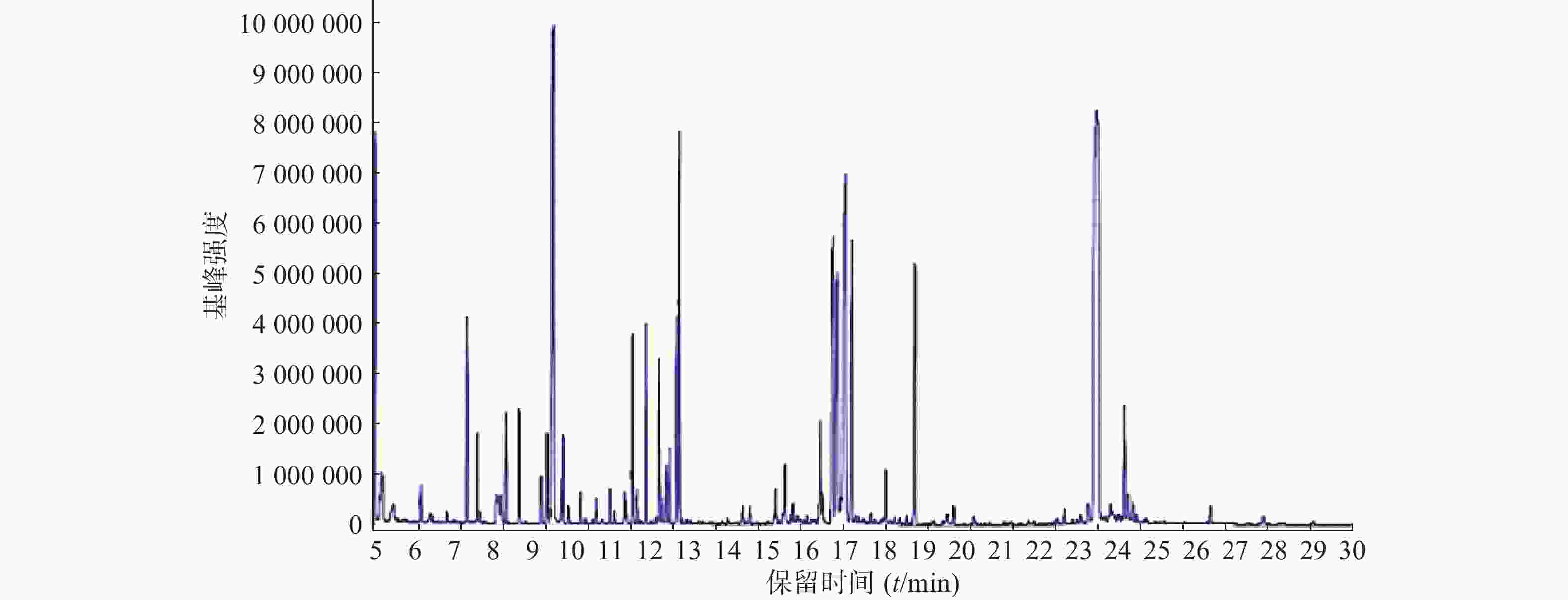
按照上述色谱-质谱条件,分别对各组样品进样分析,得到典型的总离子流图(图1)。
-
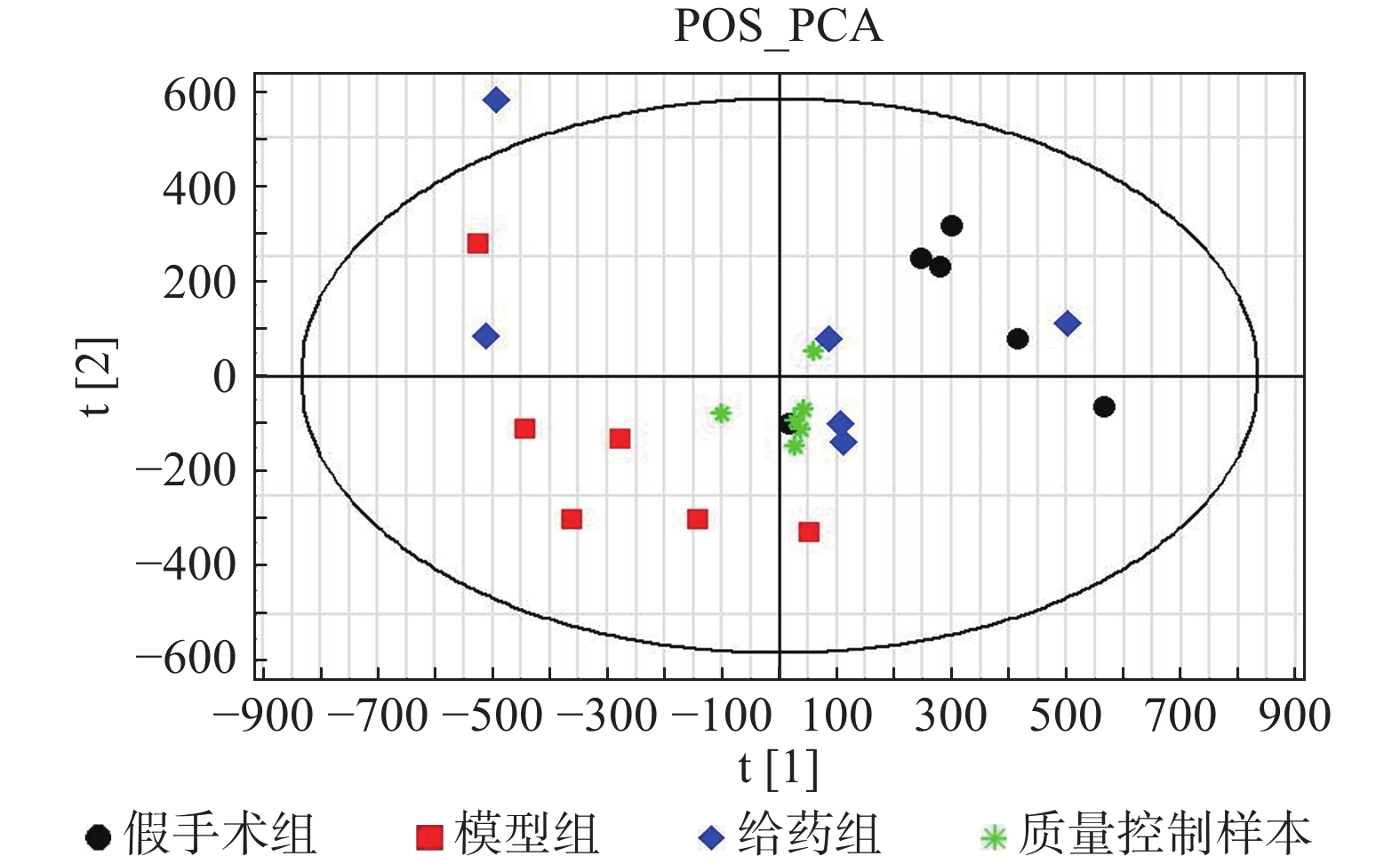
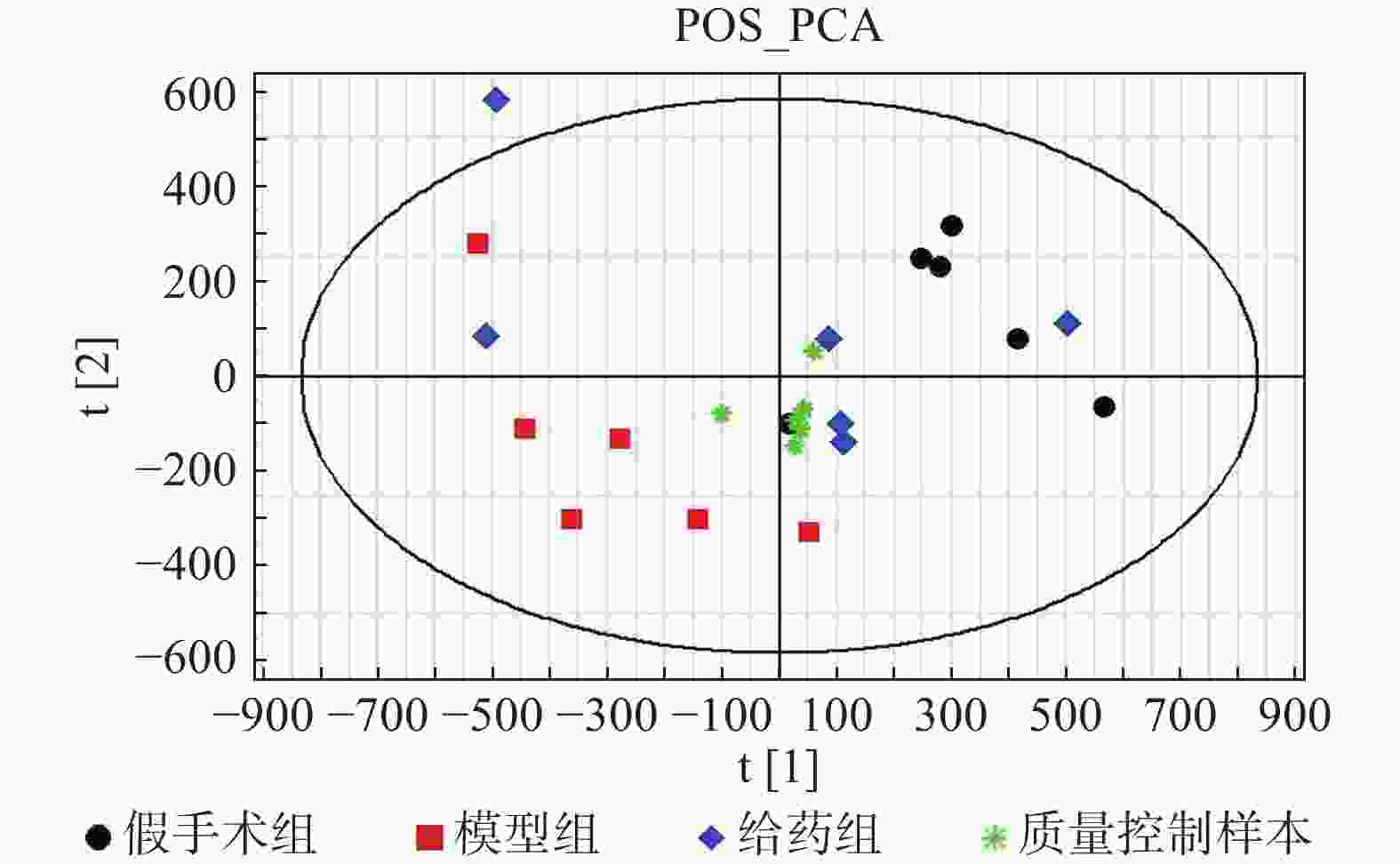
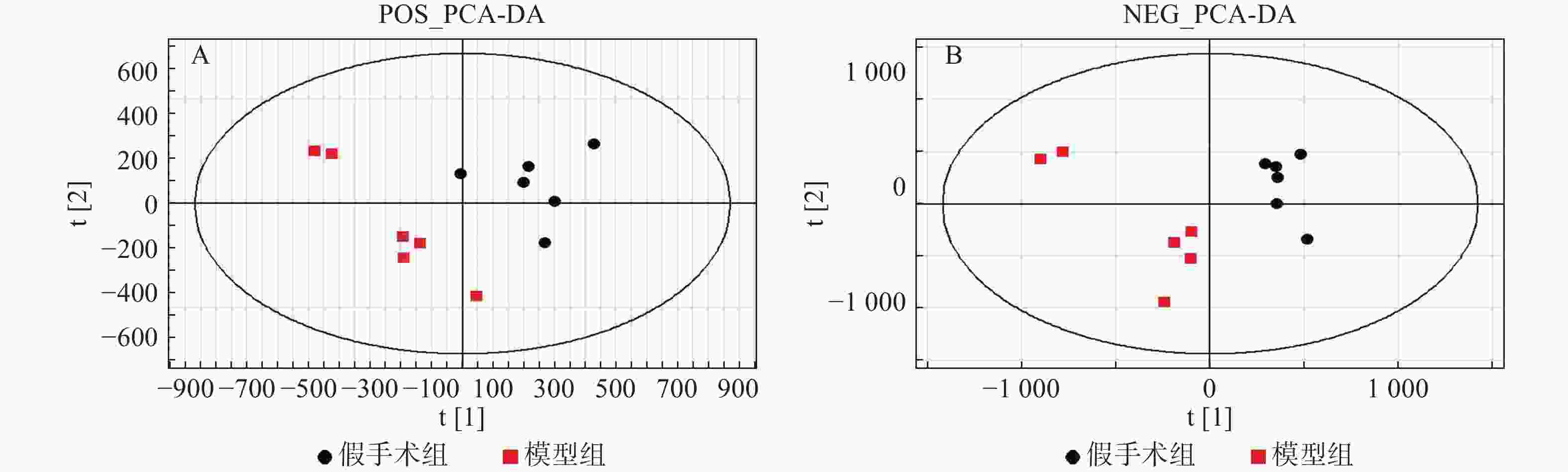
采用PCA方法对各组样本进行整体分析,并通过质量控制样本的聚集程度对系统的稳定性进行考察。根据整体PCA得分图(图2)所示,质量控制样本均聚集良好,其离散度明显低于待分析样本的离散度,表明系统稳定性良好。
-
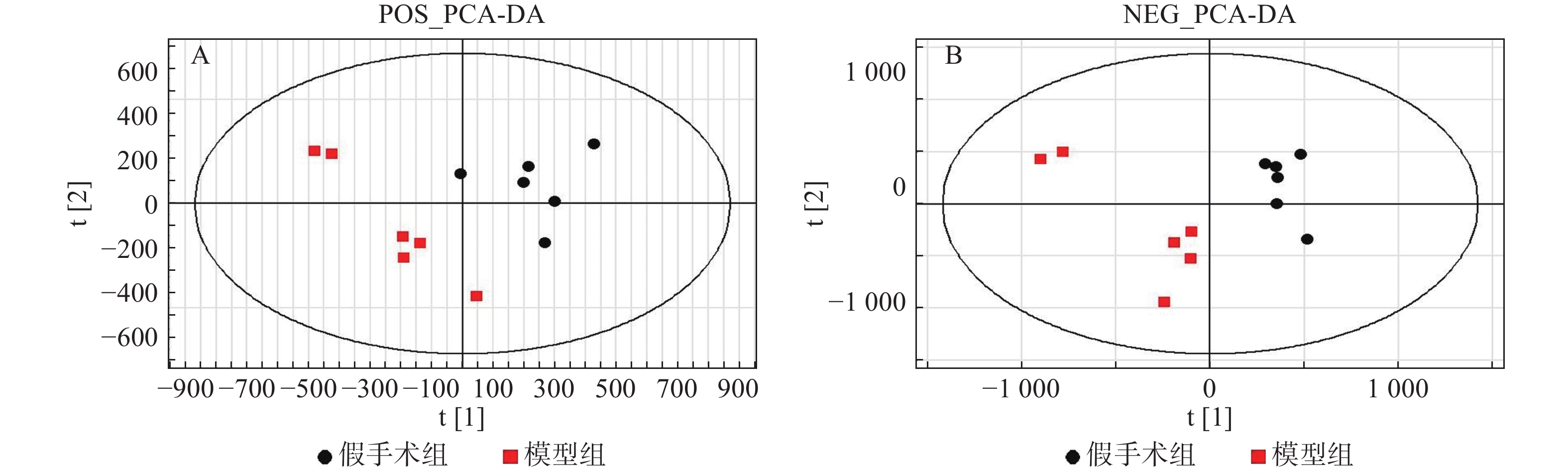
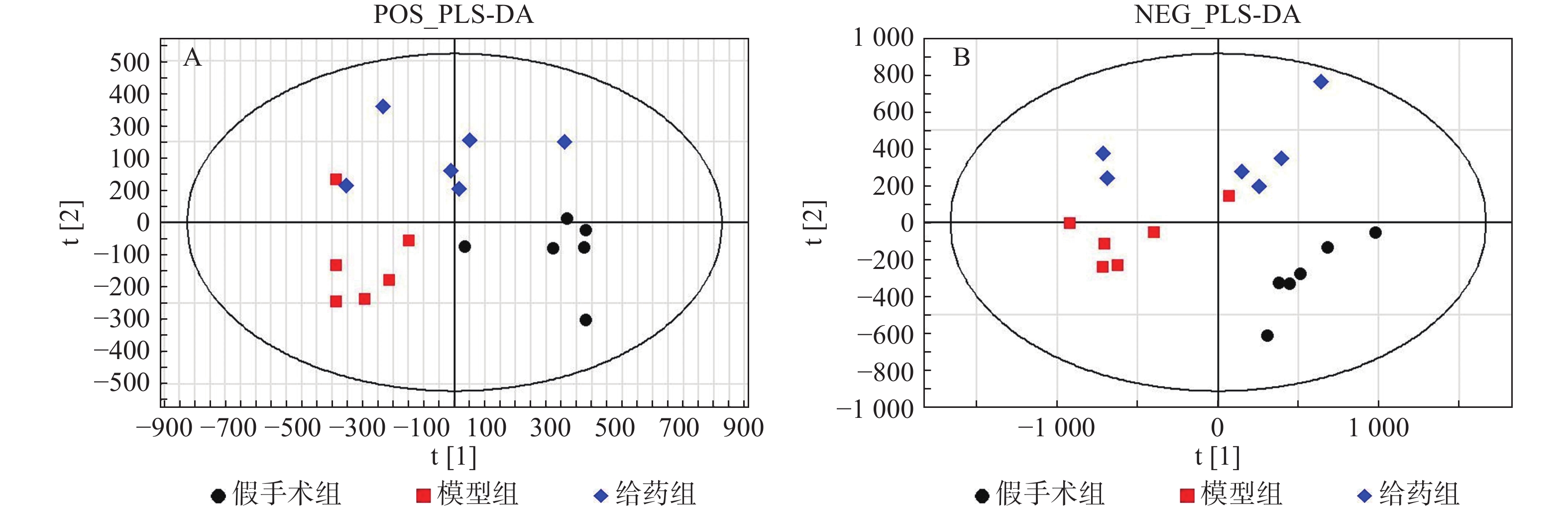
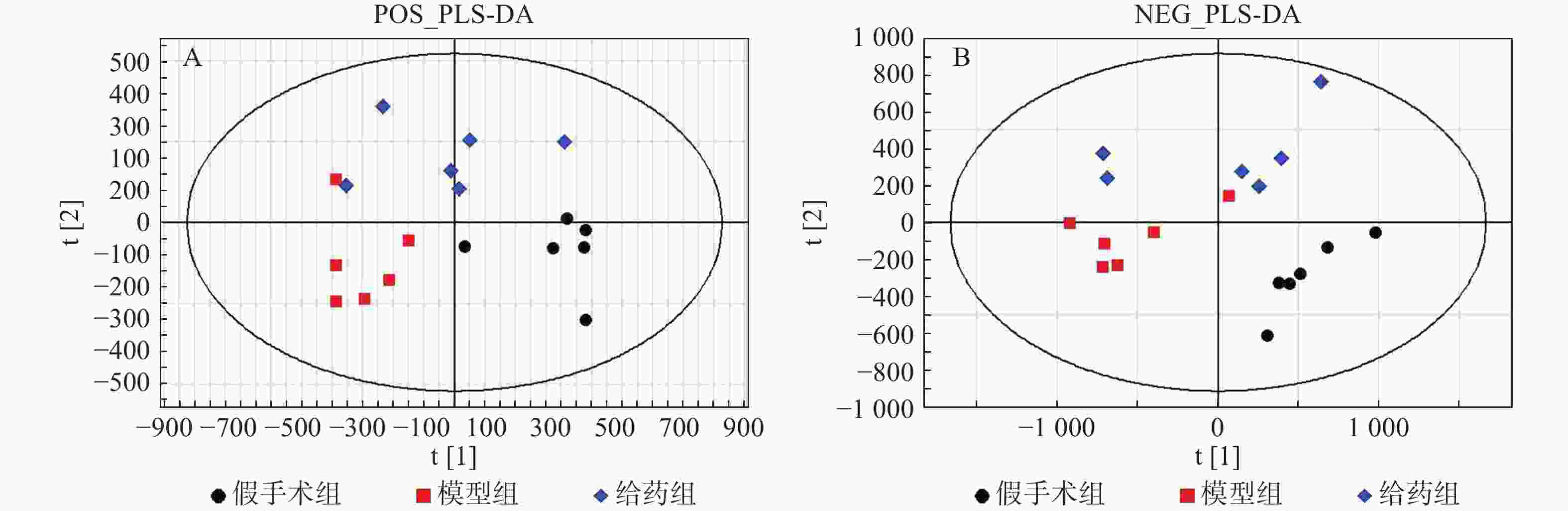
采用PLS-DA方法对假手术组、模型组、给药组样本进行分析。首先对假手术组和模型组单独进行分析,两组在正/负离子模式下的得分图显示,假手术组与模型组区分明显(图3)。进一步对3组样本进行分析,3组在正/负离子模式下的得分图显示,假手术组与模型组有较明显的区分趋势,同时,给药组较模型组有一定程度的回调(图4)。提示脓毒症相关急性肾损伤中,经黄连提取物干预后,代谢物变化发生回调。
-
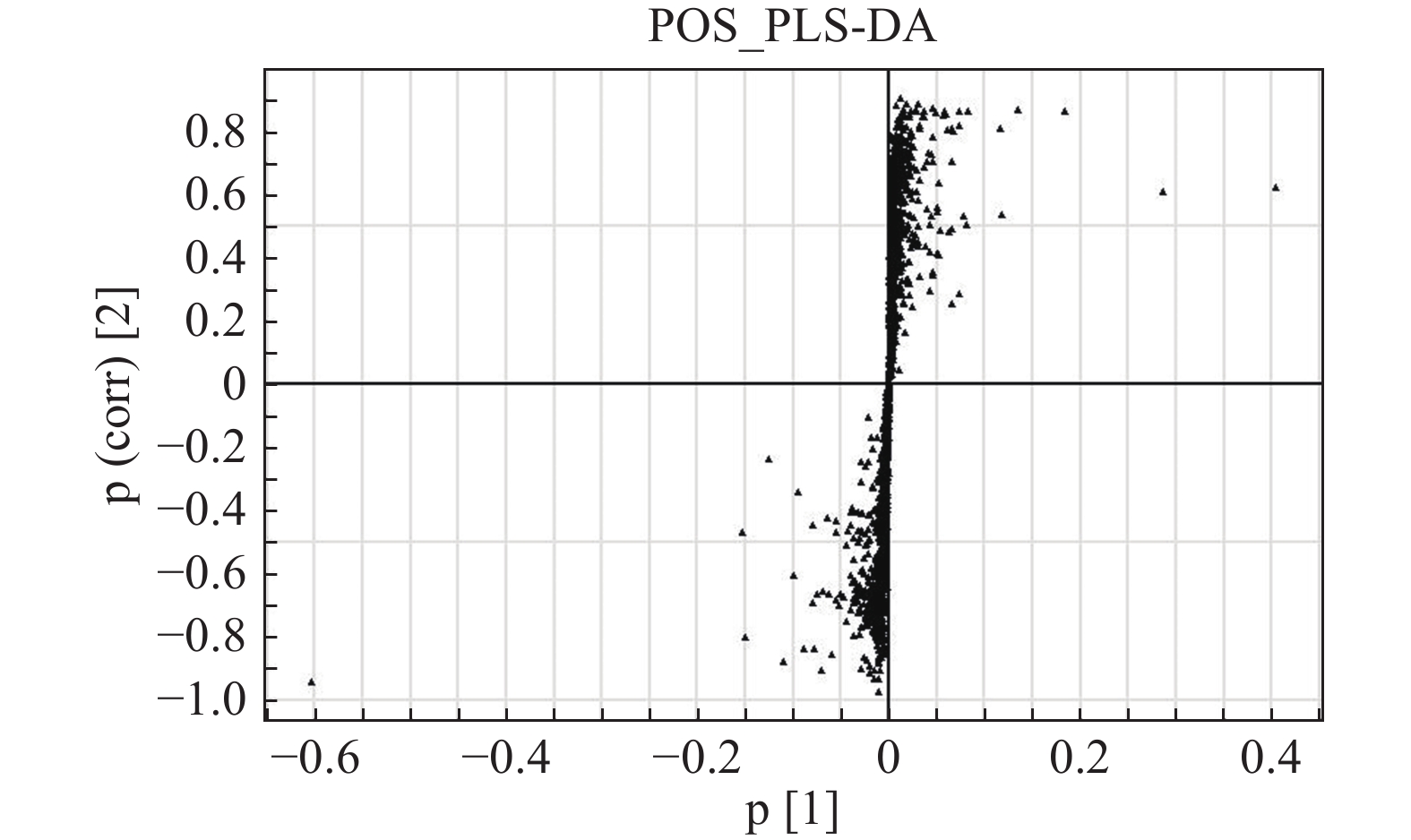
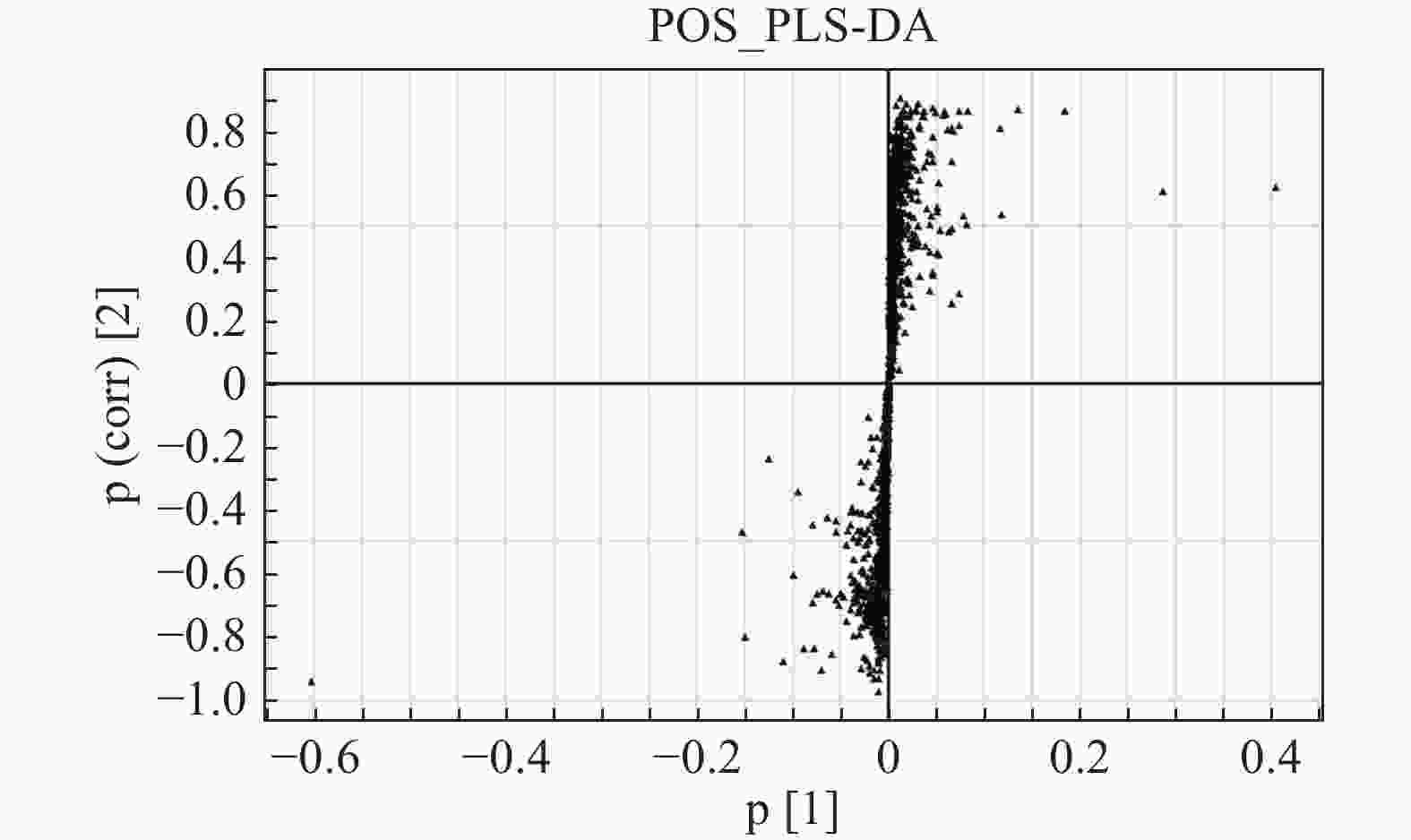
S-plot可以很好地反映各个离子对组间差异的贡献程度,离原点越远的点表明其对组间差异的贡献度越大,其VIP值也越大。正离子模式下对照组和模型组的S-plot显示两组间存在差异代谢物(图5)。
在VIP值>1,且3组ANOVA分析以及Turkey两两分析P值均<0.05的条件下,共筛选并鉴别出16个差异代谢物,包括天冬氨酸、甘氨酸、苏氨酸、脯氨酸、苯丙氨酸、缬氨酸、酪氨酸、色氨酸、磷酸、苹果酸、柠檬酸、果糖、葡萄糖、松二糖、肌醇,主要参与氨基酸代谢和糖代谢(表2)。在这16个代谢物中,其中8个代谢物水平在黄连提取物干预下发生回调,它们是天冬氨酸、甘氨酸、苏氨酸、苯丙氨酸、酪氨酸、柠檬酸、葡萄糖、肌醇。提示黄连提取物可能通过改善脓毒症相关急性肾损伤的代谢物变化从而起到治疗作用。
序号 保留时间(t/min) VIP 代谢途径 代谢物 分子式 倍数变化 模型组/假手术组 给药组/模型组 1 7.37 1.37 氨基酸代谢 L-天冬氨酸(L-aspartic acid) C4H7NO4 0.63 1.56 2 10.99 1.36 L-甘氨酸(glycine) C2H5NO2 1.25 0.78 3 12.65 1.49 L-苏氨酸(L-threonine) C4H9NO3 1.18 0.64 4 14.96 2.71 L-脯氨酸(L-proline) C5H9NO2 0.79 0.38 5 15.64 1.48 L-苯丙氨酸(L-phenylalanine) C9H11NO2 1.45 0.18 6 20.52 1.68 L-缬氨酸(L-valine) C5H11NO2 0.84 0.13 7 21.11 1.07 L-酪氨酸(L-tyrosine) C9H11NO3 1.28 0.12 8 25.58 1.93 色氨酸(tryptophan) C11H12N2O2 0.71 0.61 9 10.63 1.69 糖代谢 磷酸(phosphoric acid) H3PO4 0.7 0.99 10 14.13 1.08 L-苹果酸(L-malic acid) C4H6O5 0.9 0.64 11 17.03 1.56 L-苏糖酸(L-threonic acid) C4H8O5 0.81 0.37 12 20.1 1.63 柠檬酸(citric acid) C6H8O7 0.77 1.99 13 20.91 4.44 D-果糖(D-fructose) C7H15NO6 0.82 0.68 14 21.38 1.34 D-葡萄糖(D-glucose) C6H12O6 1.33 0.68 15 22.3 1.91 松二糖(turanose) C12H22O11 0.81 0.66 16 24.27 2.26 肌醇(inositol) C6H12O6 1.34 0.59
2.1. 黄连提取物对脓毒症相关肾损伤的作用
2.2. 代谢组学分析
2.2.1. 小鼠肾组织代谢轮廓分析
2.2.2. PCA得分图及系统稳定性分析
2.2.3. PLS-DA得分图
2.2.4. 差异代谢物筛选
-
脓毒症是由机体对感染反应失调所引起的威胁生命的多器官系统功能障碍,而急性肾损伤是最常见的情况,多发生在脓毒症早期。约51%的脓毒症患者会发生急性肾损伤,导致病死率增高41%[6]。与非脓毒症性急性肾损伤比较,脓毒症相关急性肾损伤起病更急、肾功能损害程度更严重、系统性炎症反应更重、器官功能衰竭评分也更高[7]。目前,我们对急性肾损伤发病机制的了解有限,肾血管收缩和肾血流减少导致肾缺血,促炎和抗炎反应的早期激活,以及肾小管细胞的凋亡均可导致肾损伤[8]。由于肾脏是排泄代谢终产物的主要器官,故其损伤必然会引起肾脏代谢状况的改变。
近年来,中草药在世界范围内得到越来越多的认可,而黄连以其泻火解毒、清热燥湿的功效被广泛使用。黄连的主要成分包括小檗碱、巴马汀、药根碱等生物碱类[9]。大量研究表明,黄连具有抗菌、消炎、抗高血压、抗氧化、降糖和降胆固醇的作用,具有很强的临床使用意义[10]。Huang等[11]研究发现黄连解毒汤能通过抑制炎症反应延长脓毒症大鼠的生存时间,有效保护心肌细胞。Zhang等[12]证实黄连对慢性肾功能衰竭大鼠的肾功能有一定的改善作用。代谢组学通过考察生物体受刺激后代谢产物的变化,以研究生物体代谢途径,研究对象包括代谢中间产物或终产物等体内小分子代谢物[13]。黄连对脓毒症相关的急性肾损伤有何影响,是否具有保护作用,本研究利用基于GC-MS的代谢组学对此进一步探讨。
本研究通过代谢组学研究,发现共有16个代谢物与脓毒症相关急性肾损伤有关,主要参与氨基酸代谢和糖代谢。在这些代谢物中,有8个代谢物在黄连提取物干预后发生回调。
在氨基酸代谢中,天冬氨酸水平在脓毒症相关急性肾损伤中降低,甘氨酸、苏氨酸、苯丙氨酸、酪氨酸水平升高,这些代谢物在黄连提取物干预后都发生了回调。既往研究提示,脓毒症相关急性肾损伤的肾组织中,天冬氨酸和苏氨酸水平均降低[8],可能是由于防御和修复过程中的蛋白质合成增加了氨基酸的消耗,这与本课题组的结果存在部分差异,可能需要进一步通过血液及尿液样本进行研究及探讨。甘氨酸作为一种抗炎、抗氧化的保护剂,有研究提示甘氨酸衍生物可以通过减轻脂质过氧化从而改善肾缺血/再灌注损伤[14]。有趣的是,另有研究显示甘氨酸通过激活N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体加重氧化应激以及肾缺血/再灌注损伤[15]。因此,课题组推测脓毒症相关急性肾损伤中,甘氨酸水平升高一方面可能起到自我保护作用,而另一方面可能加重肾损伤;黄连提取物可能通过减少甘氨酸从而抑制NMDA受体的激活,减轻脓毒症相关急性肾损伤。苯丙氨酸通过苯丙氨酸羟化酶生成酪氨酸,在慢性肾脏病患者中,苯丙氨酸水平升高,酪氨酸水平降低,这可能与苯丙氨酸羟化酶活性降低相关[16]。而在脓毒症相关急性肾损伤中,苯丙氨酸及酪氨酸水平均升高,提示该过程中苯丙氨酸羟化酶活性可能未发生明显变化,而可能与其他代谢途径相关。对甲酚硫酸盐作为一种尿毒症毒素,为肠道细菌代谢酪氨酸、苯丙氨酸的产物。在脓毒症情况下,肠道微环境收到干扰[17],我们推测苯丙氨酸及酪氨酸水平的升高可能进一步引起对甲酚硫酸盐水平的升高,加重肾损伤。既往有研究提示,黄连可以调节肠道菌群[18],我们推测黄连可能通过联合改善内源代谢变化和调节肠道环境对脓毒症相关急性肾损伤起到保护作用。
在糖代谢中,柠檬酸水平在脓毒症相关急性肾损伤中降低,葡萄糖和肌醇水平升高,这些代谢物在黄连提取物干预后都发生了回调。曾有研究表明,柠檬酸循环是脓毒症中受影响最大的代谢途径[19]。在脓毒症相关急性肾损伤模型中,三羧酸循环/氧化磷酸化过程减弱,糖酵解过程增强,这一代谢重编程现象称为瓦博格效应[20]。柠檬酸水平的降低也验证了这一现象。葡萄糖水平升高的可能原因是糖异生维持内源性葡萄糖生成,以防止低血糖的发展,从而建立脓毒症耐受性[21]。脓毒症时,体内迅速升高的升糖激素和前炎性因子加重了这一现象。但是,糖异生过程增强可能进一步减弱氧化磷酸化过程,我们推测黄连提取物可能通过抑制糖酵解、增强氧化磷酸化,从而增强机体抗炎能力,减轻脓毒症相关急性肾损伤。
本研究尚有一些不足之处,主要在于分析黄连提取物功效时局限于脓毒症的某一时间点,而不能获知脓毒症相关性急性肾损伤全病程中肾损伤的情况,以及黄连提取物对肾脏的保护作用。其次,收集样本的手段比较简单,难以消除潜在的影响因素。总之,黄连提取物可能通过改善脓毒症相关急性肾损伤的代谢物变化从而起到治疗作用,但其中的机制还有待进一步研究。这一研究结果表明,黄连具有成为脓毒症相关急性肾损伤新的治疗手段的潜质,尽管可行性需要更多验证,但为治疗脓毒症相关急性肾损伤提供了新的思路。






 DownLoad:
DownLoad: