-
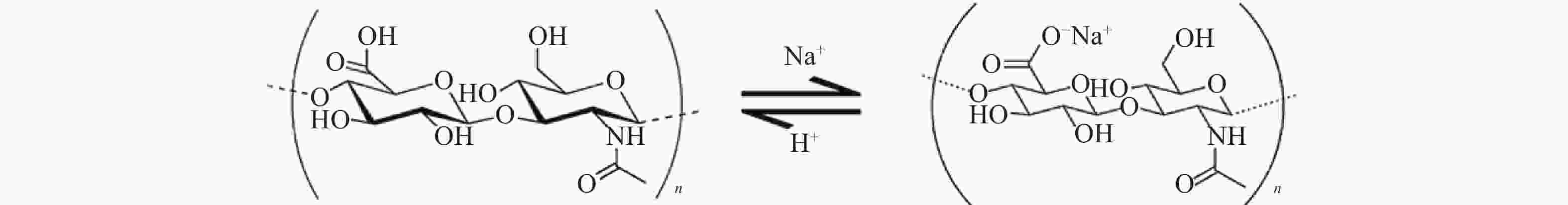
透明质酸钠(图1)又称玻璃酸钠,是由交替的N-乙酰葡糖胺(GlcNAc)和葡糖醛酸(GlcA)单元组成[1]的聚合物,聚合度最大的相对分子质量(Mr)可以达到107。具有高度黏弹性、可塑性、渗透性、独特的流变学特性以及良好的生物相容性等特点[2]。透明质酸钠广泛存在于人体,是构成人体细胞间质、眼玻璃体、关节滑液等结缔组织的主要成分,在体内具有保水、维持细胞外空间、调节渗透压、润滑、促进细胞修复等重要生理功能[3]。医用透明质酸钠凝胶(HA)为无色透明黏稠液体,主要成分为透明质酸钠。HA常用于肿瘤患者术后的抗粘连,其广泛的生理学活性有可能使得肿瘤细胞易于扩增和转移,文献报道内源性的透明质酸能促进肿瘤增殖[4-6]。因此,本研究考察外源性HA是否会促进肿瘤的生长和转移,以明确HA是否可用于肿瘤患者的术后防粘连。为HA用于肿瘤患者腹、盆腔手术术后防粘连提供实验依据。
-
医用透明质酸钠凝胶(HA,10 mg/ml,上海昊海生物科技股份有限公司,批号:18052122,Mr≥1.0×106),氟尿嘧啶注射液(5-Fu,上海旭东海普药业有限公司,批号:FA1800416),胎牛血清(FBS,Gibco,批号:1932595),McCoy’s 5A Medium(Gibco,批号:1967679),RPMI Medium 1640(Gibco,批号:1967664),MEM(Minimum Eagle’s Medium,HyClone,批号:AD20532472),胰酶(Trypsin,上海博光生物科技有限公司),磷酸盐缓冲液(PBS,上海博光生物科技有限公司),MTT(上海博光生物科技有限公司),无水甲醇、二甲基亚砜(DMSO,国药集团化学试剂有限公司),生物胶(批号:217201N2)、小鼠结肠癌细胞(CT26,上海中西医结合医院),人宫颈癌细胞(Hela)、人结肠癌细胞(HCT116,中国科学院上海生命科学研究院)。
-
裸鼠:88只,上海斯莱克实验动物有限公司,SPF级,SCXK(沪)2017-0005;64只,上海灵畅生物科技有限公司,SPF级,SCXK(沪)2018-0003),动物饲养于同济大学沪北校区(SYXK(沪)2018-0034)。所有动物实验过程均符合实验动物伦理学要求。
-
酶标仪1510-00411C(Thermo),坤宏BMB224分析天平(南京伯尼塔科学仪器有限公司),ECLIPSE TE100 显微镜(Nikon),细胞培养箱(Thermo)。
-
将状态良好的肿瘤细胞用胰酶消化后离心,弃上清液,分别用对应培养液重悬成单个肿瘤细胞悬液,显微镜下计数,然后分别稀释成以下浓度:Hela(2×104个/ml),CT26(5×103个/ml),HCT116(104个/ml)。取96孔板,空白对照孔接入100 μl培养液,其余各孔接入肿瘤细胞混悬液,每孔100 μl,将96孔板置于37 ℃、5%CO2培养箱培养。24 h后吸弃培养液,空白对照和阴性对照孔分别加入200 μl培养液,测试孔分别加入100%HA、50%HA+50%培养液、25%HA+75%培养液、12.5%HA+87.5%培养液、6.25%HA+93.75%培养液,每孔200 μl;阳性对照孔分别加入5-Fu浓度为 16、8、4、2、1 μg/ml培养液,每孔200 μl,将加药96孔板放回培养箱培养。分别培养3、5和7 d 后,吸弃上层液体,加入含0.5 mg/ml MTT的培养液100 μl,培养4 h。避光处吸弃上层液体,每孔加入100 μl DMSO,避光反应10 min,振荡1 min,在酶标仪波长570 nm处(630 nm校准)测量各孔的吸光值。细胞存活率=(实验孔吸光值—空白对照孔吸光值)/(阴性对照孔吸光值—空白对照孔吸光值)×100%。
-
将状态良好的肿瘤细胞胰酶消化、离心后,分别用对应空白培养液重悬成单个肿瘤细胞悬液,显微镜下计数,然后分别稀释成以下浓度:Hela(1.5×105 个/ml),HCT116(5×105个/ml)。分别将肿瘤细胞混悬液和HA混匀,配成50%HA+50%肿瘤细胞悬液、25%HA+50%肿瘤细胞悬液+25%空白培养液、12.5%HA+50%肿瘤细胞悬液+37.5%空白培养液、50%肿瘤细胞悬液+50%空白培养液。将肿瘤细胞和HA混合液加入Transwell上层小室中,每个小室200 μl,Transwell下层腔室分别加入含10% FBS 对应培养液 600 μl。将Transwell培养板放入培养箱,培养24 h。取出Transwell小室,轻轻吸弃小室内培养液,用PBS洗1遍,甲醇固定15 min。用棉签轻轻擦去小室内层细胞,PBS洗2遍,加入结晶紫(0.1%)染色,室温放置20 min,PBS洗3遍。显微镜10倍物镜下观察、拍照和记数。
-
PBS重悬HCT116细胞,调浓度至107个/ml,将细胞接种于裸鼠皮下,每只动物0.2 ml,共12只,作为供瘤体。视肿瘤生长情况将裸鼠处死,取出瘤块,选取瘤块实质性部分,用生理盐水冲洗干净,剪成约1 mm×1 mm×1 mm 瘤块备用。
实验动物腹腔麻醉,取腹部正中切口,逐层开腹,找到盲肠位置。假手术组:将盲肠拉出后放回腹腔,逐层缝合伤口。其余组:轻轻划破结肠浆膜,用生物胶将瘤块固定在浆膜破损处。模型组和阳性对照组在瘤块接种处涂抹生理盐水0.07 ml,HA组涂抹HA 0.02 ml。逐层缝合伤口,观察记录裸鼠状态,5-Fu组腹腔注5-Fu 20 mg/kg,隔天给药,持续3周。
瘤块接种4周后将裸鼠处死,打开腹腔,用游标卡尺测量瘤块的长短径,按公式(V=ab2/2,a:瘤体最长直径;b:瘤体最短直径)计算体积,剥离瘤块,瘤块称重。
-
建立裸鼠结肠原位种植结肠癌CT26模型,方法同“2.3”项。瘤块接种4 d后,5-Fu组腹腔注射氟尿嘧啶注射液50 mg/kg,隔3 d给药一次,共4次。
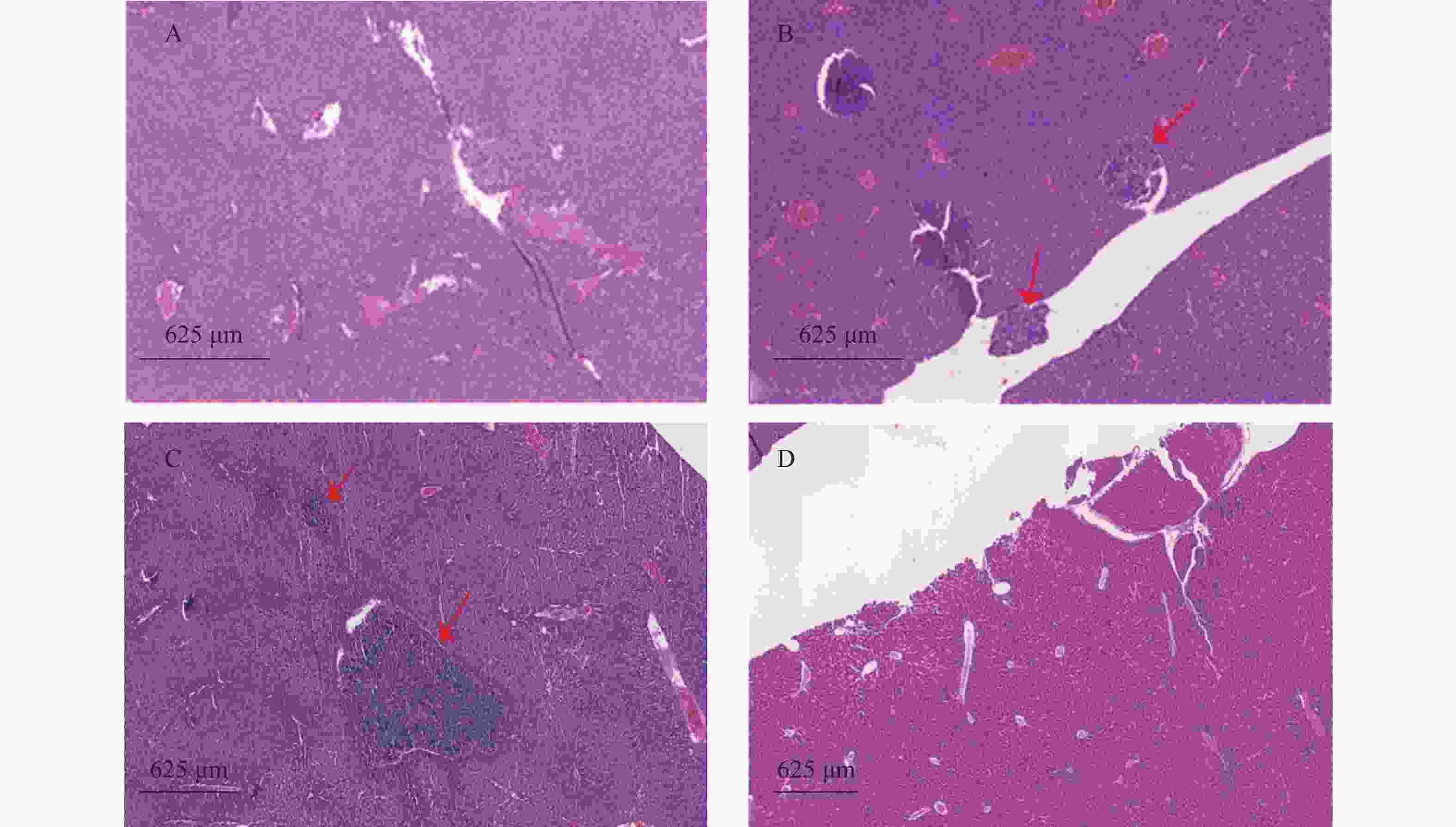
瘤块接种3周后将裸鼠脱颈处死,打开腹腔,观察肿瘤转移情况,取肺和肝脏,4%多聚甲醛固定、切片、HE染色,统计肿瘤转移率和转移病灶数。
-
实验数据用(
${\overline x}\pm s $ )表示,应用SPSS 21.0软件,数据进行正态性检验。符合正态分布采用one-way ANOVA统计方法进行显著性检验;不符合正态分布采用Friedman M 统计方法进行显著性检验。肿瘤转移率采用卡方检验。以P<0.05为差异有统计学意义。 -
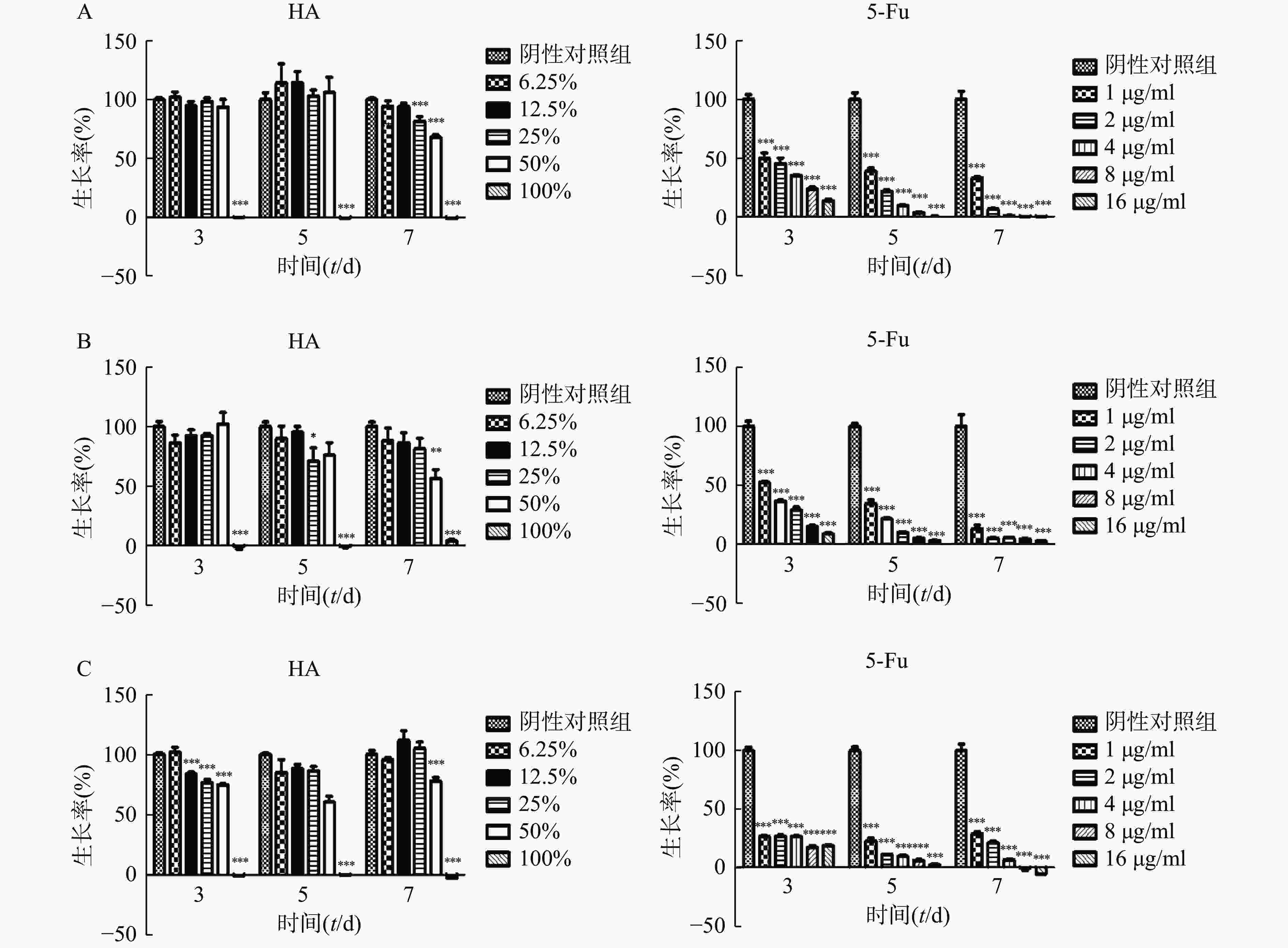
在体外实验中,肿瘤细胞Hela、HCT116和CT26在100% HA中均不能生长(图2)。Hela细胞在培养3 d和5 d时不同含量HA均不影响细胞的生长,7 d时25%HA和50%HA细胞生长率低于阴性对照组(P<0.001)。HCT116细胞培养7 d时,50%HA细胞生长率低于阴性对照组(P<0.01)。CT26细胞培养3 d时12.5%HA、25% HA和50%HA细胞生长率低于阴性对照组(P<0.001);培养5 d和7 d时,50%HA细胞生长率低于阴性对照组(P<0.001)。不同浓度5-Fu,培养3 d、5 d和7 d均抑制肿瘤细胞Hela、HCT116和CT26的生长,呈剂量相关性。
-
Transwell实验结果显示,高浓度HA体外抑制肿瘤细胞迁移。50%HA、25%HA和12.5%HA组Hela细胞穿透数均低于阴性对照组(P<0.01),HA含量越高,Hela细胞穿透数越少;50%HA和12.5%HA组HCT116细胞穿透数均低于阴性对照组(P<0.05),25%HA组HCT116细胞穿透数低于阴性对照组,无统计学差异(图3)。
-
裸鼠结肠原位接种HCT116瘤块后,HA组与模型组成瘤率均为100%,结果无差异。模型组裸鼠的瘤体体积达(339.1±258.0)mm3,5-Fu组裸鼠的瘤体体积为(128.5±111.9)mm3,小于模型组(P<0.01),HA组裸鼠的瘤体体积为(293.2±190.6)mm3,与模型组比较,差异无统计学意义;模型组裸鼠的瘤重为(0.359±0.219)g,5-Fu组裸鼠的瘤重为(0.149±0.105)g,小于模型组(P<0.001),HA组裸鼠的瘤重为(0.330±0.187)g,与模型组比较,差异无统计学意义。使用一定剂量的HA在裸鼠体内不影响HCT116的成瘤率,同时也不影响HCT116肿瘤的生长(表1)。
表 1 HA在裸鼠体内对HCT116肿瘤生长的影响(
$\bar{ x}\pm { s}$ )组别 动物数(只) 成瘤数(只) 成瘤率(%) 瘤体积(V/mm3) 瘤重(m/g) 假手术组 16 0 0 0.0 ± 0.0 0.000 ± 0.000 模型组 16 16 100 339.1 ± 258.0 0.359 ± 0.219 HA组 16 16 100 293.2 ± 190.6 0.330 ± 0.187 5-Fu组 16 14 87.5 128.5 ± 111.9** 0.149 ± 0.105*** **P<0.01、***P<0.001,与模型组比较 -
裸鼠结肠原位接种CT26瘤块,观察16 d后出现动物死亡,第18天处死存活裸鼠。模型组存活率为62.5%,HA组存活率68.8%,5-Fu组存活率100%,体内使用一定剂量的HA不影响裸鼠的存活率。模型组肝脏转移率90%,平均病灶数(2.2±1.7);5-Fu组肝脏转移率0.0%,低于模型组(P<0.001);平均病灶数(0.0±0.0),低于模型组(P<0.001)。HA组肝脏转移率36.4%,低于模型组(P<0.05);平均病灶数(0.6±1.0),低于模型组(P<0.01)。模型组肺转移率为40%,平均病灶数(0.5±0.7);5-Fu肺转移率6.3%,低于模型组(P<0.05);平均病灶数(0.1±0.3),低于模型组(P<0.05)。HA组肺转移率为18.2%,平均病灶数(0.2±0.4),与模型组均无统计学差异,见表2、图4和图5。
表 2 HA在裸鼠体内对CT26肿瘤转移的影响(
$\bar{ x}\pm { s}$ )组别 动物数(只) 成活率(%) 肝转移 肺转移 转移率(%) 病灶数 转移率(%) 病灶数 假手术组 15 100.0 0.0 0.0 ± 0.0 0.0 0.0 ± 0.0 模型组 16 62.5 90.0 2.2 ± 1.7 40.0 0.5 ± 0.7 HA 组 16 68.8 36.4* 0.6 ± 1.0** 18.2 0.2 ± 0.4 5-Fu 16 100.0 0.0*** 0.0 ± 0.0*** 6.3* 0.1 ± 0.3* *P<0.05、**P<0.01、***P<0.001,与模型组比较 -
很多胚胎迁移和增殖速率与胚胎组织中高浓度的透明质酸有关,而肿瘤组织和胚胎发育很相似,几十年前已经提出透明质酸可能对肿瘤生长很重要[7-9]。然而,本研究的HA为外源性高分子量HA,结果与内源性透明质酸结果不一致。在体外实验中,Hela、CT26和HCT116的细胞无法在100% HA中生长,表明HA不能作为肿瘤细胞培养基。此外,细胞生长速率随着HA的增加而不同程度的降低,说明高浓度HA可以抑制肿瘤生长,在低浓度时虽然没有明显的抑制作用,但也未促进肿瘤的增殖。体内结果证明,外源性HA对肿瘤细胞的生长无促进作用。
内源性低分子质量透明质酸(low molecular weight hyaluronan,LMWHA)可诱导细胞运动[10-11],促进血管生成,增加炎症免疫刺激和诱导高尔基体应激的能力[12],从而能促进肿瘤的迁移。而Aikaterini等[13-14]研究显示,透明质酸酶2(Hyal-2)低表达同时透明质酸合成酶(HAS1和HAS2)表达增高,导致产生高分子量透明质酸(high molecular weight hyaluronan,HMWHA)并在HT1080细胞的周围基质中沉积蓄积,结果HT1080细胞迁移能力显著降低,同时外源性HMWHA显著抑制HT1080细胞的迁移,当加入透明质酸酶后,HT1080细胞运动性显著增加。外源性透明质酸会促进透明质酸合成酶高表达[15],促进内源性HA合成作用,使机体合成HMWHA。本研究建立裸鼠原位种植瘤转移模型,结果HA组结肠癌的肝转移率在体内低于模型组(P<0.05)。HA在体内能抑制肿瘤的转移,可能与外源性HA能促使机体合成HMWHA有关。
本研究的主要目的是探讨HA是否会对腹部和盆腔肿瘤患者产生不良影响。结果表明,外源性HA未见对上述肿瘤的增殖有促进作用,在转移模型中HA表现出一定的抑制肿瘤迁移的作用,符合HA在肿瘤患者中应用的要求,但其机制还需进一步研究。
The effects of medical sodium hyaluronate gel on the tumor proliferation and metastasis
-
摘要:
目的 考察医用透明质酸钠凝胶(medical sodium hyaluronate gel,HA)在体外和裸鼠体内对腹、盆腔相关肿瘤生长和转移的影响。 方法 利用Hela、CT26和HCT116等3株肿瘤细胞,通过MTT法和Transwell实验分别考察不同浓度HA体外对肿瘤细胞生长和迁移的影响;建立裸鼠结肠原位种植瘤模型,比较瘤块接种4周后不同实验组的瘤块体积和瘤重,考察HA体内对结肠癌HCT116增殖的影响;通过比较接种3周后不同实验组裸鼠的肺和肝脏的肿瘤转移率和转移病灶数,考察HA对结肠癌CT26体内转移的影响。 结果 不同浓度HA在体外均未促进Hela、CT26和HCT116细胞的生长和转移,且在5 mg/ml HA浓度下,显示出一定的抑制作用。体内结果显示,HA未促进结肠癌HCT116肿瘤的生长,却显示出明显抑制CT26肿瘤的转移。 结论 在本实验条件下,HA在体内、外均未促进腹、盆腔相关肿瘤细胞Hela、CT26和HCT116的生长、迁移和转移。 Abstract:Objective To investigate the effect of medical sodium hyaluronate gel (HA) on the growth and metastasis of abdominal and pelvic tumor cells in vitro and in nude mice. Methods Three tumor cells, Hela, CT26 and HCT116, were used to investigate the effects of different HA concentrations on the growth and migration of tumor cells in vitro by MTT assay and Transwell assay. An orthotopic transplantation model of colonic tumor in nude mice was established to investigate the effect on the proliferation of cell HCT116 by comparing the tumor volume and tumor mass 4 weeks after inoculation. The effects on the metastasis of cell CT26 were investigated by comparing the tumor metastasis rate and the number of metastatic lesions of lung and liver in nude mice among the different experimental groups 3 weeks after inoculation. Results HA did not promote the growth and metastasis of Hela, CT26 and HCT116 cells in vitro at different concentrations. Actually, HA exhibited a certain inhibitory activity at the concentration of 5 mg/ml. In the orthotopic transplantation model of colonic tumor-HCT116, HA did not promote the growth of cell HCT116. In the orthotopic transplantation model of colonic tumor-CT26, HA inhibited CT26 tumor metastasis. Conclusion Under the experimental conditions, HA did not promote the growth, migration or metastasis of abdominal and pelvic related tumor cells including Hela, CT26 and HCT116 in vitro and in vivo. -
表 1 HA在裸鼠体内对HCT116肿瘤生长的影响(
$\bar{ x}\pm { s}$ )组别 动物数(只) 成瘤数(只) 成瘤率(%) 瘤体积(V/mm3) 瘤重(m/g) 假手术组 16 0 0 0.0 ± 0.0 0.000 ± 0.000 模型组 16 16 100 339.1 ± 258.0 0.359 ± 0.219 HA组 16 16 100 293.2 ± 190.6 0.330 ± 0.187 5-Fu组 16 14 87.5 128.5 ± 111.9** 0.149 ± 0.105*** **P<0.01、***P<0.001,与模型组比较 表 2 HA在裸鼠体内对CT26肿瘤转移的影响(
$\bar{ x}\pm { s}$ )组别 动物数(只) 成活率(%) 肝转移 肺转移 转移率(%) 病灶数 转移率(%) 病灶数 假手术组 15 100.0 0.0 0.0 ± 0.0 0.0 0.0 ± 0.0 模型组 16 62.5 90.0 2.2 ± 1.7 40.0 0.5 ± 0.7 HA 组 16 68.8 36.4* 0.6 ± 1.0** 18.2 0.2 ± 0.4 5-Fu 16 100.0 0.0*** 0.0 ± 0.0*** 6.3* 0.1 ± 0.3* *P<0.05、**P<0.01、***P<0.001,与模型组比较 -
[1] EVANKO S P, TAMMI M I, TAMMI R H, et al. Hyaluronan-dependent pericellular matrix[J]. Adv Drug Deliv Rev,2007,59(13):1351-1365. doi: 10.1016/j.addr.2007.08.008 [2] LAURENT T C, FRASER J R. Hyaluronan[J]. FASEB J,1992,6(7):2397-2404. doi: 10.1096/fasebj.6.7.1563592 [3] ABBRUZZESE F, BASOLI F, COSTANTINI M, et al. Hyaluronan: an overview[J]. J Biol Regul Homeost Agents,2017,31(4 Suppl 2):9-22. [4] TOOLE B P. Hyaluronan in morphogenesis[J]. Semin Cell Dev Biol,2001,12(2):79-87. doi: 10.1006/scdb.2000.0244 [5] BHARADWAJ A G, RECTOR K, SIMPSON M A. Inducible hyaluronan production reveals differential effects on prostate tumor cell growth and tumor angiogenesis[J]. J Biol Chem,2007,282(28):20561-20572. doi: 10.1074/jbc.M702964200 [6] TAMMI R H, KULTTI A, KOSMA V M, et al. Hyaluronan in human tumors: pathobiological and prognostic messages from cell-associated and stromal hyaluronan[J]. Semin Cancer Biol,2008,18(4):288-295. doi: 10.1016/j.semcancer.2008.03.005 [7] THEOCHARIS A D, VYNIOS D H, PAPAGEORGAKOPOULOU N, et al. Altered content composition and structure of glycosaminoglycans and proteoglycans in gastric carcinoma[J]. Int J Biochem Cell Biol,2003,35(3):376-390. doi: 10.1016/S1357-2725(02)00264-9 [8] GARCÍA I, VIZOSO F, SUÁREZ C, et al. Relationship of tumoral hyaluronic acid and cathepsin D contents with histological type of gastric carcinoma[J]. Int J Biol Markers,2000,15(3):215-218. doi: 10.1177/172460080001500302 [9] LLANEZA A, VIZOSO F, RODRÍGUEZ J C, et al. Hyaluronic acid as prognostic marker in resectable colorectal cancer[J]. Br J Surg,2000,87(12):1690-1696. doi: 10.1046/j.1365-2168.2000.01586.x [10] SUGAHARA K N, MURAI T, NISHINAKAMURA H, et al. Hyaluronan oligosaccharides induce CD44 cleavage and promote cell migration in CD44-expressing tumor cells[J]. J Biol Chem,2003,278(34):32259-32265. doi: 10.1074/jbc.M300347200 [11] SUGAHARA K N, HIRATA T, HAYASAKA H, et al. Tumor cells enhance their own CD44 cleavage and motility by generating hyaluronan fragments[J]. J Biol Chem,2006,281(9):5861-5868. doi: 10.1074/jbc.M506740200 [12] STERN R, ASARI A A, SUGAHARA K N. Hyaluronan fragments: an information-rich system[J]. Eur J Cell Biol,2006,85(8):699-715. doi: 10.1016/j.ejcb.2006.05.009 [13] BERDIAKI A, ZAFIROPOULOS A, FTHENOU E, et al. Regulation of hyaluronan and versican deposition by growth factors in fibrosarcoma cell lines[J]. Biochim Biophys Acta,2008,1780(2):194-202. doi: 10.1016/j.bbagen.2007.10.005 [14] BERDIAKI A, NIKITOVIC D, TSATSAKIS A, et al. bFGF induces changes in hyaluronan synthase and hyaluronidase isoform expression and modulates the migration capacity of fibrosarcoma cells[J]. Biochim Biophys Acta,2009,1790(10):1258-1265. doi: 10.1016/j.bbagen.2009.06.013 [15] 郭群英, 叶任高, 黄文生, 等. 不同分子量透明质酸对人腹膜间皮细胞透明质酸合成酶mRNA表达的影响[J]. 中国中西医结合肾病杂志, 2002, 3(6):320-322. doi: 10.3969/j.issn.1009-587X.2002.06.003 -



 下载:
下载: