-
生脉注射液临床上常用于辅助治疗心肌梗塞、心源性休克、脓毒症和感染性休克。心肌梗塞引起组织产生大量氧自由基,直接损伤心肌细胞并触发细胞凋亡,免疫介导的炎症损伤会加大心梗范围和心梗损伤[1]。心源性休克激活的炎症反应可诱导产生大量NO,促进细胞凋亡[2]。脓毒血症是由细菌引起的全身性炎症,大量致炎因子破坏机体的免疫平衡,从而导致机体代谢紊乱[3],严重者可能引起感染性休克。本研究特选择抗氧化及抗炎能力作为生物效应指标,考察生脉注射液质量与生物效应之间的相关性。
课题组前期对生脉注射液中11种成分[4]进行了指认并进行了定量,均符合药典标准。药理学实验表明,生脉注射液中人参皂苷、木质素和麦冬皂苷等多种化学成分均在细胞及动物模型上表现出良好的抗炎效果[5-8],且临床研究表明其可以通过抗炎通路发挥对器官损伤的保护作用[9-10]。现今生物效应评价在中药材和中成药质量控制研究中有所应用[11-12],2015版《中国药典》收录了生物活性测定法作为质量控制标准,如洋地黄生物测定法和黄体生成素生物测定法,说明通过生物效应控制药品质量是可行的。
抗炎和抗氧化损伤是生脉注射液产生药理作用的重要机制,但现今的质量标准仅对化学成分进行定性定量分析,不能全面体现其整体的药效活性,为此,本研究尝试通过评价其抗氧化能力以及抗炎活性,建立有效的生脉注射液生物学质量控制方法。
-
二苯基苦基苯肼(DPPH,质量分数≥97%,含10%~20%苯,批号:PRPDE-JO,梯希爱(上海)化成工业发展有限公司);水溶性维生素E (Trolox)、DMEM培养基和磷酸盐缓冲液(PBS)均购自北京Solarbio公司;胎牛血清(FBS,德国PAN Seratech公司);N-硝基-L-精氨酸甲酯(L-NAME)、NO检测试剂盒(上海碧云天生物技术有限公司);无水乙醇(北京化工厂);水(屈臣氏)。
9批次生脉注射液分别由5个不同厂家生产,样品详细情况见表1。
表 1 生脉注射液样品来源、批号及有效成分含量(μg/ml)[4]
编号 生产厂家 批号 规格 人参皂苷Rb1 人参皂苷Re 人参皂苷Rg1 五味子醇甲 麦冬皂苷D S1 A 16120401005 10 ml/支 61.16 51.39 84.69 51.43 1.48 S2 B 160502 10 ml/支 101.69 55.61 88.99 73.09 3.42 S3 C 17071014 10 ml/支 56.99 44.87 80.42 36.78 1.68 S4 C 17040423 20 ml/支 63.12 44.51 81.54 39.63 1.28 S5 D 1704252 20 ml/支 77.15 62.10 86.11 29.05 3.62 S6 E 17091302 10 ml/支 85.52 57.74 88.45 33.55 1.40 S7 E 17092903 10 ml/支 80.43 41.52 86.36 37.30 1.33 S8 E 17061103 20 ml/支 74.88 61.06 80.00 35.18 1.72 S9 E 17053005 20 ml/支 79.97 48.54 80.34 44.83 1.59 -
电子分析天平(AB265-S,梅托勒-托利多有限公司);超声波清洗仪(B25-12DT,宁波新芝生物科技股份有限公司);TS-2000A脱色摇床(海门市其林贝尔仪器制造有限公司);96孔板、多功能连续波长酶标仪(InfiniteM1000,TECAN公司);低速离心机(SC-3610,安徽中科中佳科学仪器有限公司);二氧化碳培养箱(MCO-15AC,三洋电机株式会社)。
-
RAW264.7细胞为小鼠单核巨噬细胞,购于中国医学科学院基础医学研究所细胞中心。培养条件:完全培养基为含10%FBS的DMEM培养基,在37℃含5% CO2的培养箱中培养。每天换液,细胞生长达对数生长期时,传代(传代比例为1:6)并开展实验,实验用细胞控制在10代以内。
-
取96孔板,每孔依次加入100 μl初浓度2.0%的受试液、100 μl 0.5 mmol/L DPPH溶液,震荡均匀后避光反应20 min。
测定方法:每孔依次加入100 μl受试液和DPPH溶液,在摇床上振荡均匀,避光反应20 min后,用酶标仪测定波长在517 nm处的吸光度。
-
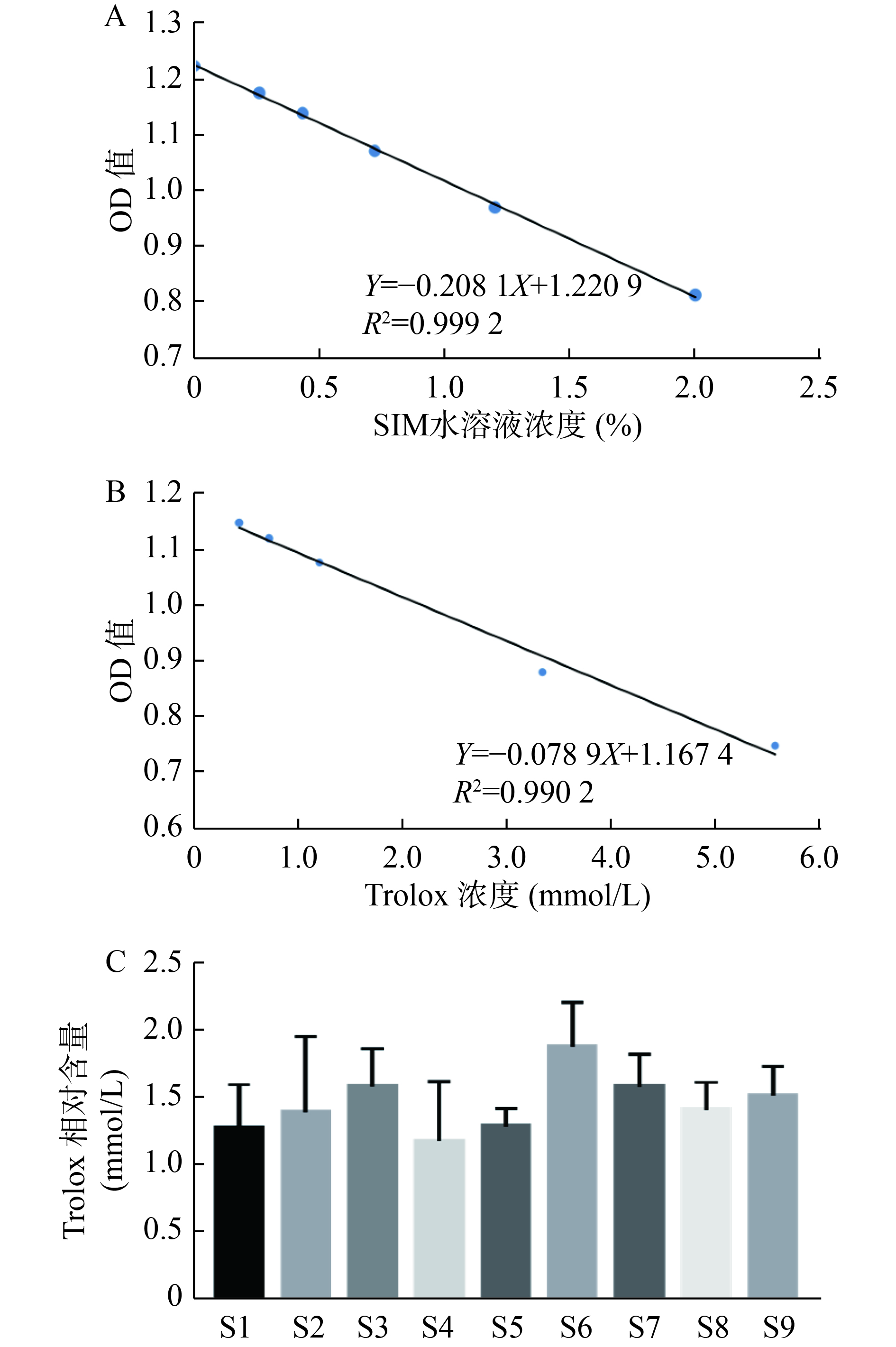
考察内容:①线性关系:分别吸取样品编号为S9的药液,用纯水定容得到浓度为8%的生脉注射液受试液。逐级稀释,测定其吸光度并计算该浓度下的平均吸光度。以终浓度为横坐标(X),平均吸光度为纵坐标(Y),绘制标准曲线,得到的线性关系方程为Y=-0.2081X+1.2209(r=0.9996)(图1-A),表明生脉注射液具有较强的DPPH自由基清除能力且具有浓度依赖性,体积浓度和平均吸光度具有良好的线性关系,在0%~2.0%范围内线性关系良好。②精密度:取样品S9,配制得到浓度2.0%的受试液,设置平行复孔,按照“2.1.1”项下操作测定吸光度,计算其吸光度的RSD值为2.25%(见表2),表明该方法满足方法学精密度要求。③重复性:取样品S9,配制得到浓度2.0%的受试液,设置平行复孔,按照"2.1.1“项下操作测定吸光度,计算其平均吸光度的RSD值为2.21%(见表2),表明该方法满足方法学重复性要求。④稳定性:取样品S9,分别于0、4、8、24、48和72 h,配制得到浓度2.0%的受试液,设置平行复孔,按照“2.1.1”项下操作测定吸光度,计算其平均吸光度的RSD值为2.47%(见表3),表明该方法在72 h内稳定性良好。
表 2 1.0%生脉注射液对DPPH清除作用的精密度和重复性考察
编号 精密度试验 重复性试验 吸光度 均值 RSD(%) 吸光度 均值 RSD(%) 1 1.063 4 1.087 9 2.25 1.138 9 1.135 6 2.22 2 1.115 6 1.175 6 3 1.098 3 1.135 7 4 1.114 3 1.096 7 5 1.064 9 1.129 2 6 1.070 9 1.137 7 表 3 1.0%生脉注射液对DPPH的清除作用的稳定性
时间 吸光度 均值 RSD(%) 0 1.038 5 1.078 8 2.47 4 1.105 7 8 1.072 2 24 1.080 5 48 1.065 7 72 1.110 0 -
精密称定Trolox,加入100 μl无水乙醇溶解,纯水定容,得到初浓度为15.46 mmol/L的Trolox溶液。将其逐级稀释,按照“2.1.1“项下操作测定并计算平均吸光度,以终浓度为横坐标(X),平均吸光度为纵坐标(Y),绘制标准曲线。得到的线性关系方程为Y=–0.0789X+1.1674(r=0.9951)(见图1-B),表明Trolox清除DPPH能力在作用浓度0.43~5.56 mmol/L范围内具有良好线性关系。
将9批次生脉注射液清除DPPH自由基的结果与Trolox比较,折算得到各批次生脉注射液相当于水溶性Trolox的作用浓度(见图1-C)。结果表明,终浓度1.0%的各批次生脉注射液清除自由基能力相对于Trolox作用浓度范围为1.2~1.9 mmol/L,在清除自由基即抗氧化能力方各批次不存在较大差异。
-
使用完全培养基配制为1.2%的生脉注射液样品溶液,及初浓度100μg/ml的LPS样品溶液。
取对数生长期的RAW264.7细胞,制备成2×106个/ml的细胞悬液,以每孔100 μl注入96孔板。培养24 h后,弃去培养基,每孔加入100 μl样品溶液和100 μl的LPS溶液,孵育24 h后吸取50 μl上清液,按照Griess试剂盒说明书操作,用酶标仪测定波长540 nm处的吸光度。
-
考察内容:①线性关系:精密吸取样品编号为S6的药液,用完全培养基制成浓度为4.0%的溶液。逐级稀释,测定吸光度并计算该浓度下的平均吸光度。以终浓度为横坐标(X),平均吸光度为纵坐标(Y),绘制标准曲线。得到线性方程为Y=–0.033ln(X)+0.243(r=0.9961)(见图2-A),表明生脉注射液具有良好的NO分泌抑制能力并具有浓度依赖性,终浓度和平均吸光度之间具有良好的线性关系,在0.2%~2.0%范围内线性关系良好。②精密度:取样品S6,配制得到浓度为1.2%的受试液,设置平行复孔,按照“2.1.1“项下操作测定吸光度,计算其吸光度的RSD值为1.71%(见表4),表明该法满足方法学精密度要求。③重复性:取样品S6,配制得到浓度为1.2%的受试液,设置平行复孔,按照“2.1.1“项下操作测定吸光度,计算其平均吸光度的RSD值为2.79%(见表4),表明该法满足方法学重复性要求。④稳定性:取样品S6,分别于0、4、8、24和48 h时,配制得到浓度1.2%的溶液,设置平行复孔,按照“2.1.1”项下操作测定吸光度,计算其平均吸光度的RSD值为2.66%(见表5),表明该方法在48 h内稳定性良好。
表 4 1.2%生脉注射液对LPS刺激264.7细胞分泌NO的精密度和重复性考察
编号 精密度试验 重复性试验 吸光度 均值 RSD(%) 吸光度 均值 RSD(%) 1 0.276 0 0.272 9 1.71 0.272 9 0.285 0 2.79 2 0.272 3 0.281 1 3 0.265 0 0.289 0 4 0.276 1 0.291 6 5 0.275 0 0.290 6 表 5 1.2%生脉注射液对LPS刺激264.7细胞分泌NO的稳定性考察
时间 吸光度 均值 RSD(%) 0 0.264 5 0.262 3 2.66 2 0.273 6 4 0.257 4 24 0.257 4 48 0.258 6 -
精密称定eNOS抑制剂L-NAME,逐级稀释,按照“2.1.1“项下操作,测定并计算平均吸光度,以终浓度为横坐标(X),平均吸光度为纵坐标(Y),绘制标准曲线。得到线性关系方程为Y=–0.052ln(X)+0.152(r=0.9957)(见图2-B),表明L-NAME抑制NO分泌能力在0.05~0.55 mmol/L范围内具有良好线性关系。
将9批次生脉注射液抑制NO分泌能力的结果与L-NAME比较,折算得到各批次生脉注射液相对于L-NAME的作用浓度(见图2-C)。
结果显示,除S2和S8样品外,终浓度0.6%的各批次生脉注射液对应的L-NAME浓度范围均在0.06~0.16 mmol/L范围内,表明在抑制NO分泌能力即抗炎能力方面S2和S8与其他样品存在较大差异。其中S2对应的L-NAME浓度远高于其他样品,其抗炎活性远高于其他样品组,推测这可能与化学成分含量差异有关,需要后续的实验加以证实。
-
测定抗氧化活性常用的方法有氧化自由基吸收能力(ORAC)、二苯基苦基苯肼(DPPH)法和总抗氧化能力检测(ABTS)法等,本实验首先采用DPPH法测定抗氧化能力,该方法操作简便,常用于体外评价化合物的抗氧化活性,其中Trolox和维生素C是常用的抗氧化剂对照药[13-14],但相较之下,Trolox可通过清除自由基产生抗氧化机制,且具有剂量依赖性[15],而维生素C稳定性较Trolox差,所以该方法选择了该药作为阳性对照。内皮型一氧化氮合酶(eNOS)诱导产生NO是NO产生的重要途径[16],L-NAME作为eNOS抑制剂,选择其作为对照药可以更加直观地评价药物对细胞产生NO的抑制能力。
-
参考2015版药典生物测定方法,该试验通过测定生脉注射液的抗炎和抗氧化能力,初步建立了生脉注射液的生物效应质量控制方法,该方法不仅能满足方法学要求,而且可以克服现行质量控制方法的局限性,还可以有效的评价中药复方制剂在治疗过程中产生的效应强度,实现“质-量-效”的有效结合[17]。
-
中药复方是一个组分复杂,不仅化学成分复杂,未知组分众多,而且其可能通过不同成分的配伍产生作用机制,即其药理机制不是单一化学成分能够阐明的,因此,仅对中药复方的化学成分进行评价难以对其成分及作用进行全面阐述。生物效应质量控制方法能对中药复方的整体组分药效进行把控,从药理活性方面评价中药复方质量,弥补现有质控方法的不足。在生物效应质控方法建立过程中,应注意以下问题:①质控方法应根据药效及药理机制研究选择合适的生物效应指标,充分反映该药的药理活性特征;②选择的对照药应具有足够的专属性、关联性和可测性,能够充分准确地反映药物的生物效应[18-20]。参考已有的生物质量控制研究[11,21]并对生脉注射液可能的药理活性进行筛选,对此进行考察。重点考察其方法学验证,结果显示该方法可行性高,方法学符合生物效应评价要求,可以反映生脉注射液的整体生物效应。但抗炎活性的测定实验要求较高的实验操作,且该方法对中药复方的整体生物活性进行测定,并未对可能产生药理活性的化学组分和含量进行探究和测定,可能产生药理活性的化学成分及作用机制尚不明确,值得后续的探讨。
Quality control and evaluation of Shengmai injection based on anti-oxidant and anti-inflammatory biological effects
-
摘要:
目的 建立以抗氧化和抗炎效应为指标的生脉注射液质量评价方法。 方法 以水溶性维生素E(Trolox)和N-硝基-L-精氨酸甲酯(L-NAME)作为对照药,采用三硝基苯肼(DPPH)法和一氧化氮(NO)检测试剂盒对其抗氧化效应和对脂多糖(LPS)诱导单核巨噬细胞RAW264.7释放NO的抑制能力进行测定,将样品换算为相应浓度的对照药,对其方法学和生物效应进行控制和评价。 结果 各批次样品均具有较好的抗炎和抗氧化效应,精密度高,重复性好;各批次样品在抗氧化能力方面不存在较大差异,在抗炎能力方面样品2和样品8与其他样品存在较大差异。 结论 建立的方法可以准确评价生脉注射液的抗氧化和抗炎效应。 Abstract:Objective To establish a quality evaluation method for Shengmai injection with antioxidant and anti-inflammatory effects as indicators. Methods Using water-soluble vitamin E (Trolox) and N-nitro-L-arginine methyl ester (L-NAME) as control drugs, using trinitrophenyl-hydrazine (DPPH) method and nitric oxide (NO) detection kit, the anti-oxidation effect and the inhibition ability of lipopolysaccharide (LPS)-induced NO release from mononuclear macrophage RAW264.7 were measured. The sample was converted into the corresponding concentration of the control drug to control and evaluate its methodological and biological effects. Results Each batch of samples had good anti-inflammatory and anti-oxidation effects with high precision and good repeatability. There was no significant difference in the anti-inflammation capacity among batches of. Samples 2 and 8 were significant differences from other samples in anti-inflammatory ability. Conclusion The established method can accurately evaluate the anti-oxidant and anti- inflammatory effects of Shengmai injection. -
Key words:
- Shengmai injection /
- biological effect /
- quality control /
- anti-oxidant /
- anti-inflammatory
-
表 1 生脉注射液样品来源、批号及有效成分含量(μg/ml)[4]
编号 生产厂家 批号 规格 人参皂苷Rb1 人参皂苷Re 人参皂苷Rg1 五味子醇甲 麦冬皂苷D S1 A 16120401005 10 ml/支 61.16 51.39 84.69 51.43 1.48 S2 B 160502 10 ml/支 101.69 55.61 88.99 73.09 3.42 S3 C 17071014 10 ml/支 56.99 44.87 80.42 36.78 1.68 S4 C 17040423 20 ml/支 63.12 44.51 81.54 39.63 1.28 S5 D 1704252 20 ml/支 77.15 62.10 86.11 29.05 3.62 S6 E 17091302 10 ml/支 85.52 57.74 88.45 33.55 1.40 S7 E 17092903 10 ml/支 80.43 41.52 86.36 37.30 1.33 S8 E 17061103 20 ml/支 74.88 61.06 80.00 35.18 1.72 S9 E 17053005 20 ml/支 79.97 48.54 80.34 44.83 1.59 表 2 1.0%生脉注射液对DPPH清除作用的精密度和重复性考察
编号 精密度试验 重复性试验 吸光度 均值 RSD(%) 吸光度 均值 RSD(%) 1 1.063 4 1.087 9 2.25 1.138 9 1.135 6 2.22 2 1.115 6 1.175 6 3 1.098 3 1.135 7 4 1.114 3 1.096 7 5 1.064 9 1.129 2 6 1.070 9 1.137 7 表 3 1.0%生脉注射液对DPPH的清除作用的稳定性
时间 吸光度 均值 RSD(%) 0 1.038 5 1.078 8 2.47 4 1.105 7 8 1.072 2 24 1.080 5 48 1.065 7 72 1.110 0 表 4 1.2%生脉注射液对LPS刺激264.7细胞分泌NO的精密度和重复性考察
编号 精密度试验 重复性试验 吸光度 均值 RSD(%) 吸光度 均值 RSD(%) 1 0.276 0 0.272 9 1.71 0.272 9 0.285 0 2.79 2 0.272 3 0.281 1 3 0.265 0 0.289 0 4 0.276 1 0.291 6 5 0.275 0 0.290 6 表 5 1.2%生脉注射液对LPS刺激264.7细胞分泌NO的稳定性考察
时间 吸光度 均值 RSD(%) 0 0.264 5 0.262 3 2.66 2 0.273 6 4 0.257 4 24 0.257 4 48 0.258 6 -
[1] 杜武勋, 肖学凤, 朱明丹, 等. 心肌梗塞后坏死区炎症、损伤、修复与三七总皂苷的治疗研究[J]. 时珍国医国药, 2010, 21(10):2560-2562. doi: 10.3969/j.issn.1008-0805.2010.10.062 [2] GOWDA R M, FOX J T, KHAN I A. Cardiogenic shock: basics and clinical considerations[J]. Int J Cardiol,2008,123(3):221-228. doi: 10.1016/j.ijcard.2006.03.099 [3] SINGER M, DEUTSCHMAN C S, SEYMOUR C W, et al. The third international consensus definitions for Sepsis and septic shock (Sepsis-3)[J]. JAMA,2016,315(8):801-810. doi: 10.1001/jama.2016.0287 [4] 柴瑞平, 路娟, 陈曦, 等. 生脉注射液UPLC特征指纹图谱及11种成分定量分析[J]. 中国现代中药, 2019, 21(4):498-503. [5] AHN S, SIDDIQI M H, NOH H Y, et al. Anti-inflammatory activity of ginsenosides in LPS-stimulated RAW 264.7 cells[J]. Sci Bull,2015,60(8):773-784. doi: 10.1007/s11434-015-0773-4 [6] CHOI J H, JANG M, NAH S Y, et al. Multitarget effects of Korean Red Ginseng in animal model of Parkinson's disease: antiapoptosis, antioxidant, antiinflammation, and maintenance of blood-brain barrier integrity[J]. J Ginseng Res,2018,42(3):379-388. doi: 10.1016/j.jgr.2018.01.002 [7] BAEK K S, YI Y S, SON Y J, et al. In vitro and in vivo anti-inflammatory activities of Korean Red Ginseng-derived components[J]. J Ginseng Res,2016,40(4):437-444. doi: 10.1016/j.jgr.2016.08.003 [8] XU J J, LU C J, LIU Z J, et al. Schizandrin B protects LPS-induced Sepsis via TLR4/NF-κB/MyD88 signaling pathway[J]. Am J Transl Res,2018,10(4):1155-1163. [9] 常青燕, 李玲, 张棚达. 甘草酸二铵注射液联合生脉注射液治疗慢性乙型肝炎的疗效观察[J]. 中国现代药物应用, 2014, 8(1):3-4. [10] 王齐兵, 李德忠. 生脉注射液对急性肺挫伤患者炎性细胞因子的影响[J]. 中国中医急症, 2015, 24(9):1660-1661. doi: 10.3969/j.issn.1004-745X.2015.09.058 [11] 孙万阳, 佟玲, 李东翔, 等. 基于指标基因评价复方丹参滴丸生物活性一致性[J]. 药学学报, 2016, 51(8):1290-1296. [12] 曹俊岭, 杨文华, 史志龙, 等. 基于高内涵分析的山药增强巨噬细胞吞噬活性及质量评价研究[J]. 中国药学杂志, 2018, 53(8):608-613. [13] LUCAS-ABELLÁN C, MERCADER-ROS M T, ZAFRILLA M P, et al. Comparative study of different methods to measure antioxidant activity of resveratrol in the presence of cyclodextrins[J]. Food Chem Toxicol,2011,49(6):1255-1260. doi: 10.1016/j.fct.2011.03.004 [14] SCHAICH K M, TIAN X, XIE J. Hurdles and pitfalls in measuring antioxidant efficacy: A critical evaluation of ABTS, DPPH, and ORAC assays[J]. J Funct Foods,2015,14:111-125. doi: 10.1016/j.jff.2015.01.043 [15] APAYDIN F G, BAŞ H, KALENDER S, et al. Bendiocarb induced histopathological and biochemical alterations in rat liver and preventive role of vitamins C and E[J]. Environ Toxicol Pharmacol,2017,49:148-155. doi: 10.1016/j.etap.2016.11.018 [16] ZHAO Y Z, VANHOUTTE P M, LEUNG S W. Vascular nitric oxide: Beyond eNOS[J]. J Pharmacol Sci,2015,129(2):83-94. doi: 10.1016/j.jphs.2015.09.002 [17] 张旭, 任晓航, 王慧, 等. 生物效应评价在中药质量控制研究中的应用进展[J]. 中草药, 2018, 49(11):2686-2691. doi: 10.7501/j.issn.0253-2670.2018.11.030 [18] 郭倩, 田成旺, 任涛, 等. 中药药效物质基础研究进展[J]. 世界科学技术-中医药现代化, 2015, 17(3):648-654. doi: 10.11842/wst.2015.03.039 [19] 张铁军, 白钢, 刘昌孝. 中药质量标志物的概念、核心理论与研究方法[J]. 药学学报, 2019, 54(2):187-196. [20] 许海玉, 侯文彬, 李珂, 等. 基于整合药理学的中药质量标志物发现与应用[J]. 中国实验方剂学杂志, 2019, 25(6):1-8. [21] 姚艺新, 华芳, 洪远林, 等. 川芎药材、饮片及其中成药抗血小板聚集活性的生物检定方法学研究[J]. 中草药, 2017, 48(11):2249-2254. -





 下载:
下载: