-
高脂血症是指血液中脂质水平异常,通常表现为总胆固醇(TC)和/或甘油三酯(TG)升高,高密度脂蛋白胆固醇(HDL-C)降低[1]。高脂血症是心脑血管疾病的重要危险因素,可诱发动脉粥样硬化,导致冠心病、脑卒中、心肌梗死,增加心脑血管疾病的发病率和病死率。因此,预防和控制高脂血症具有重要意义[2]。国内外研究和临床实践证明,血脂异常是可以预防和控制的。胆固醇水平降低可显著减少心肌梗死、缺血性卒中事件、心血管死亡,提高心血管病患者的生活质量,有效减轻疾病带来的负担[3]。据统计全球每年约有3000万人死于高脂血症等脂代谢紊乱疾病,且呈逐年增长趋势[4]。
姜黄素是从姜科植物姜黄的干燥根茎中提取的一种多酚类物质[5]。它被认为是姜黄中最重要一类活性成分,具有一系列药理活性,如抗氧化、抗癌、抗炎、细胞保护和降低血脂等[6]。有研究表明,姜黄素对氧化应激、抑制癌症和炎症的进展有显著疗效[7]。此外,姜黄素的降脂作用也被广泛研究。综上所述,姜黄素可作为一种潜在的候选药物用于控制高脂血症所诱导的疾病,如动脉粥样硬化。众所周知,他汀类药物是一种临床常用的治疗高胆固醇血症和相关动脉粥样硬化疾病的处方药,而目前姜黄素已被证明在降低血浆总胆固醇和甘油三酯方面与他汀类药物疗效相当。然而姜黄素存在溶解度低和渗透差的问题,从而导致其口服给药时药物生物利用度低,对于高脂血、动脉粥样硬化等需要达到一定血药浓度为疗效前提的病症来说,姜黄素的传统剂型与市售剂型均无法达到理想的治疗效果。
本研究前期成功构建了姜黄素纳米乳口服给药系统,改善了姜黄素水溶性差的特性。基于此,本文继续探究了姜黄素纳米乳在大鼠体内的药动学特性,观察其对高脂血症模型大鼠的治疗作用,为姜黄素的临床应用提供更多的理论依据。
-
101A-2型干燥箱(上海实验仪器总厂);AG285十万分之一电子分析天平(瑞士MettlerToledo公司);SB100D超声波清洗器(宁波新芝生物科技股份有限公司);Agilent 1100高效液相色谱仪(美国安捷伦科技有限公司);EPPENDORF5804R 高速冷冻离心机(德国Eppendorf有限公司);DF-101S 集热式恒温加热磁力搅拌器(巩义市英峪予华仪器厂);Agilent 6410 Triple Quad LC/MS(美国Agilent科技有限公司);全自动生化分析仪Chemray 240 (深圳雷杜生命科技有限公司);微型旋涡混合器(上海沪西分析仪器厂有限公司)。
-
姜黄素原料药(批号XC20190521,西安小草植物科技有限公司);姜黄素对照品(批号1108135-201412,纯度>99.8 %,中国食品药品检定研究院);1,2-丙二醇(批号20190418,上海凌峰化学试剂有限公司);Tween-80(批号2018161,上海凌峰化学试剂有限公司);丙二醇单辛酸酯(Capryol 90,批号18139,上海嘉法狮贸易有限公司);高脂饲料(批号20036219,常州鼠一鼠二生物科技有限公司);姜黄素片(批号20190925,美国自然之宝®股份有限公司);辛伐他汀片(SV,批号J20190011,舒降之®杭州默沙东制药公司);TG试剂盒(批号2020012)、TC试剂盒(批号2020006)、HDL-c试剂盒(批号2020003)、LDL-c试剂盒(批号2020010,长春汇力生物技术有限公司);SOD试剂盒(批号20200617);MDA试剂盒(批号20200720);肝脏匀浆TG试剂盒(批号20200810);肝脏匀浆TC试剂盒(批号20200411,南京建成有限公司);乌来糖(国药集团化学试剂有限公司);甲醇、乙腈(色谱纯,美国 TEDIA 有限公司);水为重蒸水。
-
雄性SD大鼠,SPF级,体重(180±20)g,海军军医大学实验动物中心提供,动物合格证号:SCXK(沪)2019-0004。温度:20~25 ℃;相对湿度:40 %~70 %;饮用水:高压灭菌,符合SPF级动物饮用水标准;光照条件:人工光线,12 h照射,12 h黑暗。
-
姜黄素纳米乳的处方如下:油相Capryol 90在体系中占比为33.10 %,表面活性剂Tween-80为 34.16 %,助表面活性剂1,2-丙二醇为17.21 %,水相占比为15.52 %。制备方法为:精密称取处方量油相Capryol 90、表面活性剂Tween-80和助表面活性剂1,2-丙二醇,混合置于锥形瓶中,于45 ℃ 恒温搅拌至全溶,称取适量姜黄素原料药,搅拌至原料药完全溶解于上述体系中,冷却至室温后向体系中缓慢滴加蒸馏水至体系变为透明均匀的液体,即得姜黄素纳米乳,测得载药量为0.919 mg/g。对姜黄素纳米乳进行特性表征,结果表明所制备的纳米乳粒径分布范围窄且呈正态分布,平均粒径为(123.5±1.2)nm,PDI为(0.204±0.07),表明该制剂的粒径分布及均匀性均符合纳米乳制剂要求。最优处方制备的纳米乳的透射电镜如图1所示。结果表明,纳米乳呈圆整均一的球体或类球体,具明显层状结构,粒径大小约为123.5 nm。
-
色谱条件:色谱柱:Dikma Inspire C18柱(2.1 mm×100 mm,3 μm);流动相:乙腈-0.1 %(V/V)甲酸水溶液(70∶30);流速:0.3 ml/min;进样量:5 μl;柱温:35 ℃。
质谱条件:ESI离子源,正离子化模式,扫描方式为多反应监测(MRM模式),干燥气温度:350 ℃,干燥气流速:10 L/min,雾化压力:35 psi,裂解电压145eV,碰撞能量30 eV,定量离子对为m/z=369.3→286.4和m/z=369.3→177.0。
-
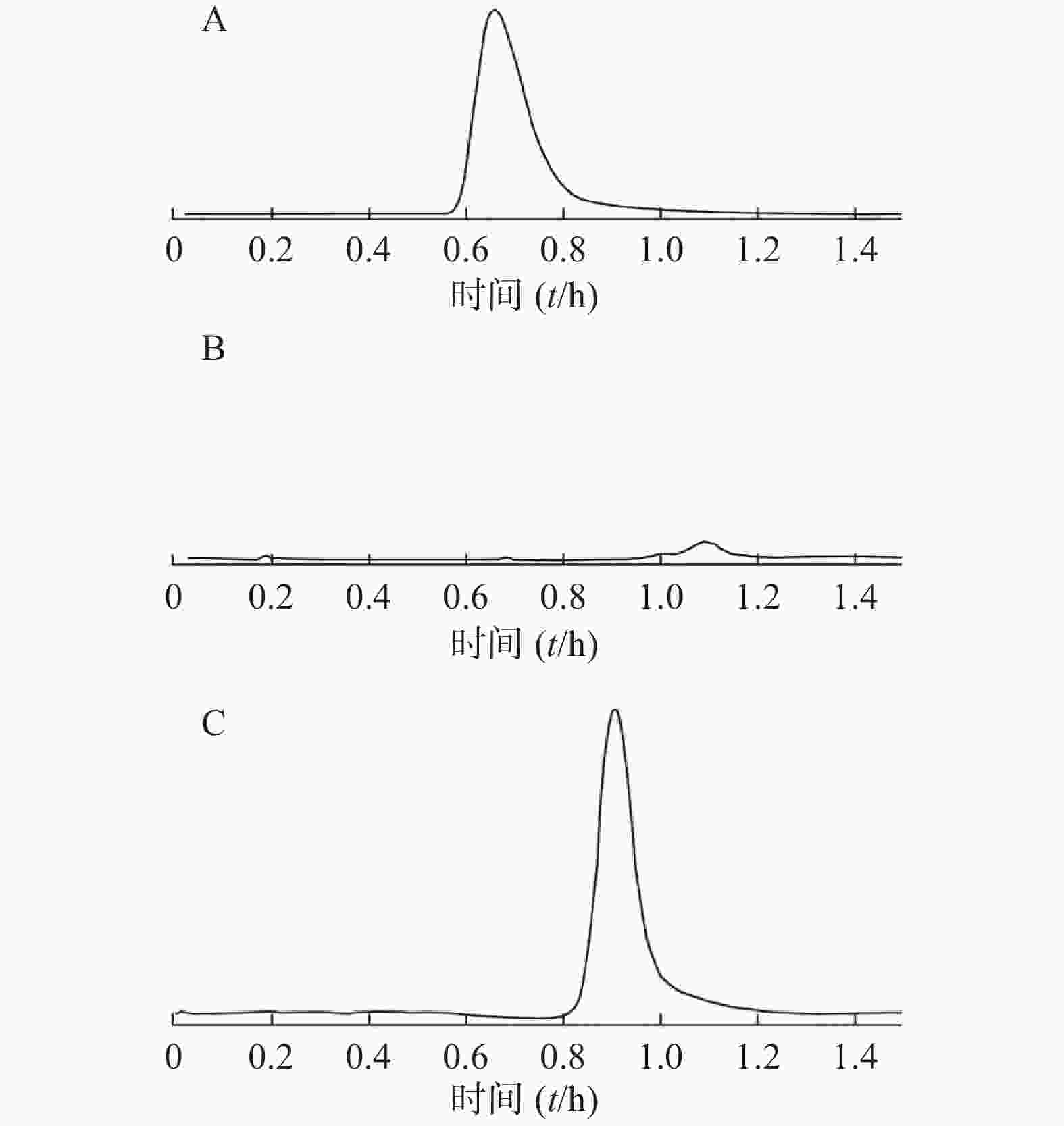
取7份大鼠空白血浆,每份600 μl,分别加入各浓度姜黄素标准品溶液 600 μl,涡旋震荡2 min,再加入1 000 μl甲醇及2 000 μl乙腈沉淀蛋白,涡旋震荡5 min,于4 ℃ 12 000 r/min离心15 min。上清液用氮气吹干,1 000 μl甲醇复溶,过0.22 μm针式微孔滤膜,所得滤液即加药血浆样品。同法处理空白血浆。按2.2.1项下条件进样测定,记录色谱图及峰面积。方法学考察表明,血浆中姜黄素在2.00~500.00 ng/ml浓度范围内线性关系良好,回归方程为:Y = 411.32 X+2071.88(r= 0.999 9)。专属性考察结果表明,血浆内源物质对姜黄素的含量测定没有干扰,方法专属性良好(结果如图2)。低、中、高3个浓度的姜黄素-血浆溶液的日内精密度分别为0.54 %、1.21 %、0.93 %,日间精密度分别为0.91 %、0.76 %、0.42 %。3个浓度血浆中的姜黄素提取回收率分别为72.9.2%、78.3%、80.2%,表明该方法可用于血浆中姜黄素的含量测定。
-
18只大鼠随机分为3组(姜黄素原料药组、姜黄素片剂组、姜黄素纳米乳组),每组6只,适应性饲养3 d后,禁食不禁水12 h。3组大鼠分别给予姜黄素原料药混悬液(62.8 mg/kg,以姜黄素含量计算)、姜黄素片剂粉末混悬液(62.8 mg/kg,以姜黄素含量计算)各1 ml,姜黄素纳米乳(31.4 mg/kg,以姜黄素含量计算)2 ml。于灌胃给药后的0、1、2、4、8、12、16、24、30、36 h时眼球后静脉丛取血1 ml,置预肝素化离心管中,上下颠倒混匀后3 000 r/min离心15 min,上清液即为含药血浆样品。吸取含药血浆样品600 μl,照“2.2.2”项下方法处理,上清液照“2.2.1”项下色谱条件进样测定。
-
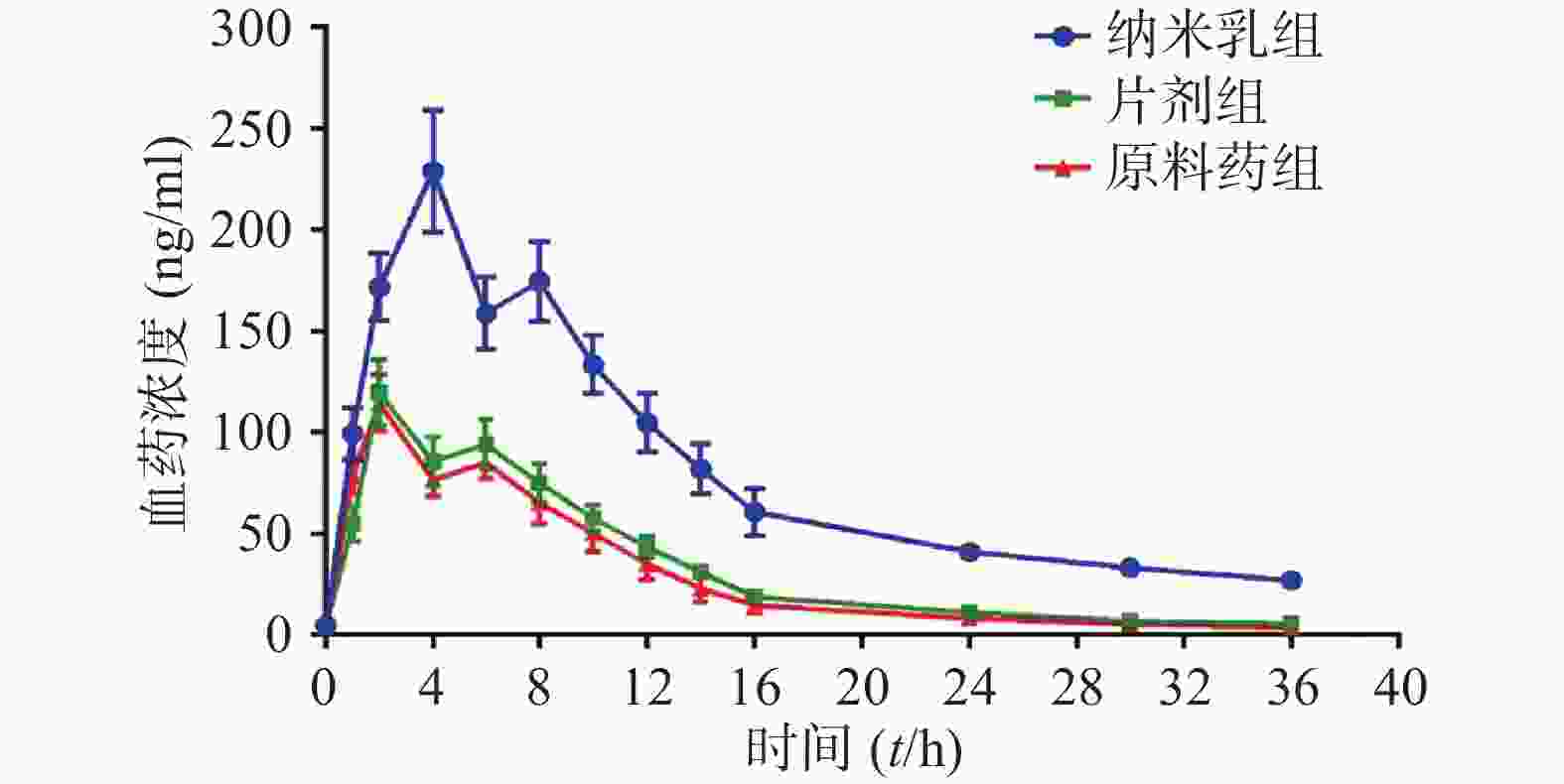
药动学参数计算通过软件Kinetica 5.0对数据进行分析处理得到,计算结果如图3及表1所示。结果表明,与原料药相比,片剂的相对生物利用度为112.10 %,纳米乳的相对生物利用度为313.47 %。与纳米乳组相比,原料药组的cmax为201.48 %,片剂组的cmax为193.02 %,且平均滞留时间(MRT)比原料药组及片剂组更高(为原料药组的183.52 %,是片剂组的154.21 %),表明纳米乳组具有延缓药物吸收的效果,从而在更大程度上发挥稳定血药浓度,提高药物生物利用度的作用。
表 1 各给药组姜黄素的药动学参数(
$\bar x $ ±s,n=6)原料药组 片剂组 纳米乳组 cmax (ng/ml) 116.18±11.33 121.27±12.12 234.08±17.55 Tmax (t/h) 2.00±0.00 2.00±0.00 4.00±0.00 AUC0→36(ng·h/ml) 1151.12±125.77 1341.34±103.59 2914.42±323.15 AUC0→∞(ng·h/ml) 1202.71±115.28 1348.77±131.39 3770.15±333.28 t1/2 (t/h) 6.66±0.33 7.52±0.51 12.17±0.35 MRT(t/h) 9.89±0.59 11.77±0.31 18.15±0.38 -
取SD大鼠56只,进行为期一周的适应性饲养后随机分为空白对照组(n=8)和模型组(n=48),空白组饲喂正常饲料,模型组饲喂定制高脂饲料(饲料含2-硫氧嘧啶0.2 %,可可脂17.18 %,胆固醇1.25%,蔗糖12.5 %,胆盐0.22 %)。整个造模周期为16 d,造模期间每日观察各组大鼠的精神、活动、食量、排便量变化等。结束造模后,所有大鼠禁食不禁水12 h,于眼球后静脉丛取血1 ml,室温静置30 min,3 000 r/min离心20 min,取上层血清检测各项生化指标(TC、TG、HDL-c、LDL-c)[9,10]。
造模成功后将上述模型组大鼠再随机分为模型组、姜黄素片剂组、阳性药(SV)组和姜黄素纳米乳低、中、高剂量组,每组8只。空白组(A组)及模型组(B组)给予生理盐水5 ml/ (kg·d);阳性药组(C组)给与辛伐他汀20 mg/ (kg·d)(以辛伐他汀含量计);姜黄素片剂组(D组)给与姜黄素片 62.8 mg/ (kg·d)(以姜黄素的含量计);姜黄素纳米乳低(E组)、中(F组)、高(G组)3组给药剂量分别为15、30、60 mg/ (kg·d)(以姜黄素的含量计),连续21天灌胃给药。第21天给药结束后,各组大鼠禁食不禁水12 h,于第22天眼球后静脉丛取血1 ml离心取血清待测。
-
实验所得数据采用SPSS Statistics 22.0统计软件进行处理,方差齐性检验后,采用单因素方差分析,其中组间比较采用LSD法,两两比较采用独立样本t检验;若方差不齐,采用非参数检验。实验结果均以(
$\bar x $ ±s)表示,P<0.01表示具极显著性差异,P<0.05表示具显著性差异。采用 GraphPad Prism 6 绘制图表。 -
大鼠颈椎脱臼处死,称定体重后解剖取肝脏,冰PBS洗净血迹,称定肝脏湿重并记录,计算肝脏指数;肝脏指数=肝脏湿重/体重×100 %。
图4为给药前后各组大鼠的体重变化。结果表明,给药3周后,与空白组相比,各组均存在极显著性差异(P<0.001)。给药的前2周纳米乳组的体重均表现出正向增长趋势,而模型组、阳性药组以及姜黄素片剂组体重则呈现负增长情况;给药第3周时,仅姜黄素纳米乳高剂量组的体重出现正向增长,阳性药组以及姜黄素纳米乳低、中剂量组大鼠体重降低幅度略有缩小但仍呈下降趋势。
实验结束后剖取大鼠肝脏,肉眼观察到空白组大鼠的肝脏呈现出鲜红色且有光泽,边缘清晰锐利,质地软,与周围组织无明显黏连;模型组大鼠的肝脏肥大,色泽偏黄,边缘圆钝,质地稍硬,且表面的白色沉积明显,与周围组织黏连明显。各给药组大鼠的肝脏比空白组略大,颜色呈不同程度的泛黄白带红,其中以姜黄素纳米乳中剂量组肝脏的颜色与空白组最为接近。
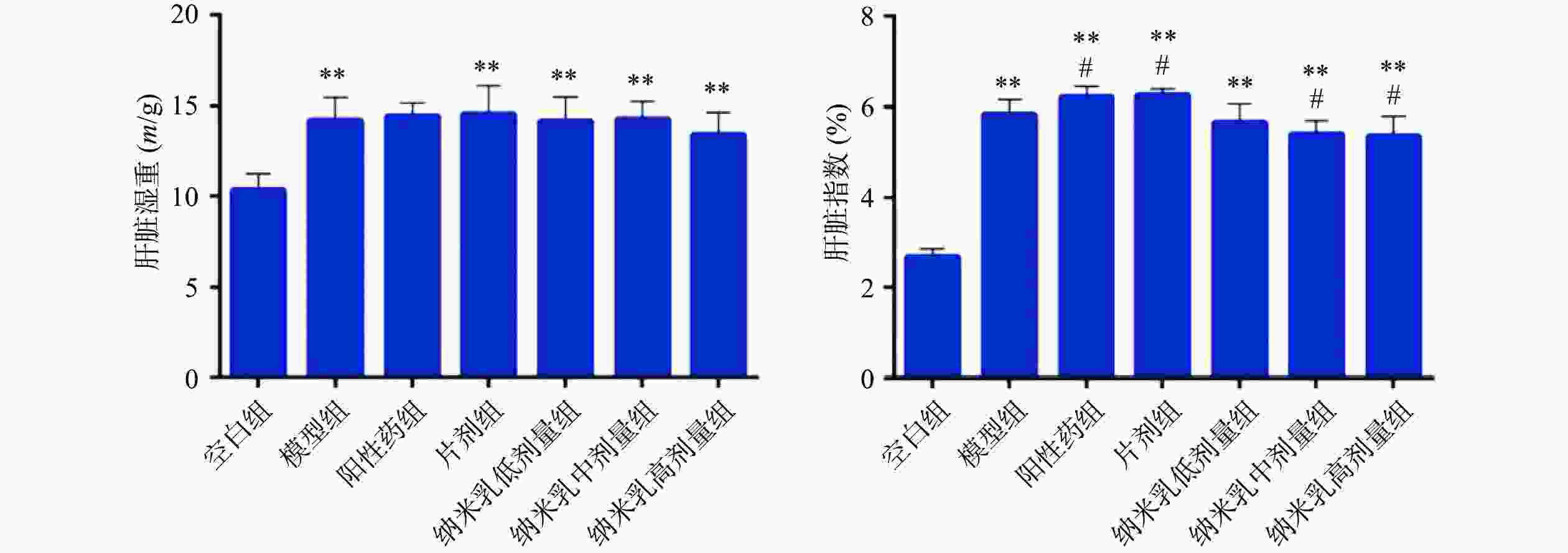
肝脏湿重:如图5所示,除空白组外,各给药组与模型组间均无显著差异,但各给药组肝脏湿重与空白组均具极显著性差异(P<0.001);
肝脏指数:如图5所示,除姜黄素纳米乳低剂量组外,其他各给药组与模型组之间均存在显著性差异,表明肝脏指数的降低与药物剂量间存在依赖性。阳性药组和片剂组肝脏指数尚未恢复到正常水平,推测原因可能是阳性药和片剂的给药周期还不能完全抵消造模导致的肝脏增重所致。
-
取肝脏左、右外叶上端分别于多聚甲醛中固定,脱水,切片,染色后置于光镜下观察。图6为肝脏的HE染色切片。其中A组肝细胞排列整齐,呈索状,内壁边界清晰,无中性粒细胞浸润,仅有零星小泡性脂肪病变;B组视野内可见明显的弥漫性大泡性脂肪病变,肝细胞肿胀,胞浆基质疏松,淡染,存在严重的气球样病变,可见Mallory小体,肝小叶边界不清,汇管区肿大,呈现中性粒细胞浸润,存在重度的肝细胞脂变率;C组和D组以中轻度脂肪病变为主,脂肪细胞占比显著减少;E组汇管区细胞排列比C、D两组更为整齐,肝细胞整体肿胀程度减轻,大泡性脂肪病变仅存在于Ⅲ带,炎性浸润程度减轻,水样病变减轻;F组和G组以小泡性脂变为主,少见大泡性脂变。
图7为油红O染色切片。A组大鼠肝细胞结构完整,细胞核颜色明显;B组肝细胞存在大片鲜艳脂滴,细胞核萎缩、色浅,存在重度脂肪病变;C组和D组仍存在大片连续脂滴,但汇管区附近脂滴颜色明显变淡;E组Ⅲ带脂滴色浅且小;F组和G组视野内所见均为浅色小脂滴,细胞核体积趋向空白组细胞核体积。
-
第21天给药结束后,所有大鼠禁食不禁水12 h,于第22天眼球后静脉丛取血1ml,室温静置2 h后3 000 r/min离心15 min取血清,按试剂盒操作说明检测血清中TC、TG、HDL-c、LDL-c的表达水平。
给药3周后,大鼠血清中各生化指标变化如表2所示。与模型组相比,姜黄素纳米乳低、中、高3个剂量组对TC降低效果均有统计学意义(P<0.001),其中,以中剂量组为佳,低剂量组对LDL-c的改善效果更为明显。对于血清中TG、TC的改善情况,与阳性药组相比,纳米乳低、中、高3个剂量组之间差异无统计学意义(P<0.05);中、高剂量组TC与HDL比值的降低具有统计学意义(P<0.05),表明血脂比存在纳米乳剂量依赖性。
表 2 大鼠血清中TG、TC、HDL-c、LDL-c的表达水平及TC/HDL-C的变化趋势(
$\bar x $ ±s,n=8)组别 TG(mmol/L) TC(mmol/L) HDL-c(mmol/L) LDL-c(mmol/L) TC/HDL 空白组 1.34±0.09 2.90±0.44 0.31±0.10 1.88±0.17 9.35±0.41 模型组 2.88±0.51 12.45±0.13 1.84±0.10 3.56±0.66 6.77±1.14 阳性药组 1.41±0.25## 10.81±0.36## 3.03±0.53# 2.87±0.20## 3.57±0.47 姜黄素片剂组 1.79±0.22## 11.24±1.21 3.42±0.42# 4.08±0.32 3.29±0.89 姜黄素纳米乳低剂量组 1.29±0.20## 8.88±0.73## 2.39±0.62## 2.85±0.33# 3.72±0.57# 姜黄素纳米乳中剂量组 1.44±0.04## 7.68±0.34## 1.94±0.78## 2.57±0.82 3.96±0.36# 姜黄素纳米乳高剂量组 1.38±0.28## 8.89±0.64## 1.83±0.34## 2.85±0.67 4.86±0.49## *P<0.05, **P<0.001,与空白组比较;#P<0.05,##P<0.001,与模型组比较 -
将肝脏分为4份,一份置于−80 ℃冷冻保存,一份按如下步骤处理后待测:冰PBS冲洗肝组织表面血迹→研磨后制成10 %匀浆→离心→取上清液→测定各生化指标。
给药3周后大鼠肝脏匀浆中各生化指标表达水平如表3所示。结果表明,模型组肝脏匀浆中TG、TC表达水平的增幅与空白组相比具有统计学意义(P<0.001);给药3周后,阳性药组和纳米乳低、中剂量组的TG、TC表达水平与模型组相比均有统计学差异(P<0.001),姜黄素纳米乳低、中、高3个剂量对大鼠肝脏中TG、TC表达水平的降低均具有统计学意义(P<0.05),其中,低剂量组效果最佳,这也与血清中TC水平变化趋势相一致。
表 3 大鼠肝脏匀浆中TG、TC、SOD以及MDA的变化趋势(
$\bar x $ ±s,n=8)组别 TG(mmol/L) TC(mmol/L) SOD(U/mgprot) MDA(nmol/mgprot) 空白组 0.42±0.16 0.11±0.03 956.31±142.64 0.47±0.06 模型组 0.69±0.05** 0.09±0.02** 769.26±141.64**## 1.98±0.26** 阳性药组 0.50±0.11*## 0.7±0.01*## 988.25±168.90## 0.64±0.15*## 姜黄素片剂组 0.66±0.10**# 0.04±0.01*## 933.99±103.39# 0.79±0.11** 姜黄素纳米乳低剂量组 0.64±0.07**## 0.06±0.02*## 972.23±142.10## 0.80±0.03**# 姜黄素纳米乳中剂量组 0.58±0.05**## 0.07±0.02**## 916.55±117.32# 0.59±0.09## 姜黄素纳米乳高剂量组 0.54±0.13## 0.10±0.03** 799.81±121.85** 0.70±0.23*## *P<0.05, **P<0.001,与空白组比较;#P<0.05,##P<0.001,与模型组比较 超氧化物歧化酶(SOD)是机体内重要的抗氧化酶,能催化自由基清除反应,保护细胞免受自由基的攻击,明显改善肝肾等组织的氧化损伤,能直观的反映体内抗氧化酶的活性[11]。MDA是脂质过氧化反应的产物,反映了自由基的活跃程度,可用于评价机体内脂质过氧化的程度[12]。因此,选择SOD和MDA作为评价高脂血症大鼠肝功能损伤程度的指标。
给药3周后,与模型组相比,阳性药组及姜黄素纳米乳低剂量组均能够上调大鼠肝脏中SOD的表达水平(P<0.001),姜黄素纳米乳中剂量组对其表达水平也有正向影响(P<0.05);此外,实验中发现,与姜黄素纳米乳低、中剂量组相比,高剂量组对体内SOD的表达呈现出抑制,推测此现象与姜黄素的双向调节机制有关;对于MDA的表达水平,与模型组相比,阳性药组和姜黄素纳米乳各剂量组对其表达的抑制作用均具有统计学意义(P<0.001),但效果仍以中剂量组为佳。
-
姜黄素是一种被广泛研究的中药多酚类物质,具有抗氧化、抗炎和降血脂的药理活性。已有报道将他汀类与姜黄素对于改善血脂的功效进行了比较。他汀类药物是治疗高胆固醇血症和高脂血症的一线药物。研究表明,姜黄素在降低甘油三酯(TG)方面最有效,而他汀类药物在降低低密度脂蛋白胆固醇(LDL-C)方面最有效。姜黄素影响血浆脂质改变的途径与他汀类药物相似[13]。几乎所有胆固醇运输的途径都会受到药物制剂的影响,包括胃肠道对膳食中胆固醇的吸收、肝细胞对血浆胆固醇的清除、胆固醇逆向运输的介质以及从外周组织中清除胆固醇。此外,姜黄素的活性氧(ROS)清除能力降低了脂质过氧化的风险,而脂质过氧化会引发炎症反应,导致心血管疾病(CVD)和动脉粥样硬化[14]。综上所述,姜黄素或可作为一种安全且耐受性良好的他汀类药物辅助药物,更有效控制高脂血症。
Preparation, pharmacokinetics and pharmacodynamics of curcumin nano emulsion
-
摘要:
目的 探究姜黄素纳米乳在大鼠体内的药动学特性和对大鼠高脂血症的药效作用。 方法 建立大鼠血浆中姜黄素的高效液相色谱-质谱联用(HPLC-MS)含量测定方法,考察纳米乳的体内药动学过程。建立SD大鼠高脂血症动物模型,初步考察姜黄素纳米乳对高脂饮食诱导的大鼠高脂血症的药效作用。 结果 体内药动学研究结果表明,以姜黄素原料药为参比制剂,姜黄素纳米乳的相对生物利用度为313.47 %;以市售片剂为参比制剂,姜黄素纳米乳的相对生物利用度为279.52 %。纳米乳组的Cmax为原料药组的201.48 %,为片剂组的193.02 %,且比原料药组及片剂组具有更高的MRT值(为原料药组的183.52 %,是片剂组的154.21 %)。药效学研究结果表明姜黄素纳米乳口服给药系统能显著降低模型大鼠的血清总胆固醇(TC)、低密度脂蛋白(LDLc),缓解高脂饮食给模型大鼠造成的肝脏脂质沉积及肝损伤。 结论 姜黄素纳米乳口服给药系统能够有效改善姜黄素的生物利用度,具有良好的降血脂作用,并能够控制高脂血症大鼠体重增长和改善由脂质代谢紊乱造成的肝脏系数变化。 Abstract:Objective To explore the pharmacokinetic properties of curcumin nano emulsion and its pharmacodynamic effects on hyperlipidemia in rats. Methods The method for determination of curcumin was established by HPLC-MS. The pharmacokinetics characteristics of curcumin nano emulsion oral administration system were investigated. SD rats were used as model animals to establish hyperlipidemia animal models, and the pharmacodynamic effects of curcumin nano emulsion on hyperlipidemia induced by high fat diet was preliminarily investigated. Results The results of pharmacokinetic studies in vivo showed that the relative bioavailability of curcumin nano emulsion was 313.47% with bulk drug group as the reference preparation. The relative bioavailability of curcumin nano emulsion was 279.52 % with tablets as reference preparation. Cmax of curcumin nano emulsion group was 201.48 % of that of bulk drug group and 193.02 % of that of tablet group, and had higher MRT value (183.52 % of that of bulk drug group and 154.21 % of that of tablet group) than bulk drug group and tablet group. Pharmacodynamics research results showed that curcumin nano emulsion oral administration system could significantly reduce the levels of triglyceride and LDL-c in serum of model rats, and relieve liver lipid deposition and liver injury caused by high-fat diet in model animals. Conclusion The oral administration system of curcumin nano emulsion could effectively improve the bioavailability of curcumin, which has a good hypolipidemic effect. It also could control the weight gain of hyperlipidemia rats and improve the changes of liver coefficient caused by lipid metabolism disorder. -
Key words:
- Curcumin /
- Nano emulsion /
- Hyperlipidemia /
- Pharmacokinetics /
- Pharmacodynamics
-
表 1 各给药组姜黄素的药动学参数(
$\bar x $ ±s,n=6)原料药组 片剂组 纳米乳组 cmax (ng/ml) 116.18±11.33 121.27±12.12 234.08±17.55 Tmax (t/h) 2.00±0.00 2.00±0.00 4.00±0.00 AUC0→36(ng·h/ml) 1151.12±125.77 1341.34±103.59 2914.42±323.15 AUC0→∞(ng·h/ml) 1202.71±115.28 1348.77±131.39 3770.15±333.28 t1/2 (t/h) 6.66±0.33 7.52±0.51 12.17±0.35 MRT(t/h) 9.89±0.59 11.77±0.31 18.15±0.38 表 2 大鼠血清中TG、TC、HDL-c、LDL-c的表达水平及TC/HDL-C的变化趋势(
$\bar x $ ±s,n=8)组别 TG(mmol/L) TC(mmol/L) HDL-c(mmol/L) LDL-c(mmol/L) TC/HDL 空白组 1.34±0.09 2.90±0.44 0.31±0.10 1.88±0.17 9.35±0.41 模型组 2.88±0.51 12.45±0.13 1.84±0.10 3.56±0.66 6.77±1.14 阳性药组 1.41±0.25## 10.81±0.36## 3.03±0.53# 2.87±0.20## 3.57±0.47 姜黄素片剂组 1.79±0.22## 11.24±1.21 3.42±0.42# 4.08±0.32 3.29±0.89 姜黄素纳米乳低剂量组 1.29±0.20## 8.88±0.73## 2.39±0.62## 2.85±0.33# 3.72±0.57# 姜黄素纳米乳中剂量组 1.44±0.04## 7.68±0.34## 1.94±0.78## 2.57±0.82 3.96±0.36# 姜黄素纳米乳高剂量组 1.38±0.28## 8.89±0.64## 1.83±0.34## 2.85±0.67 4.86±0.49## *P<0.05, **P<0.001,与空白组比较;#P<0.05,##P<0.001,与模型组比较 表 3 大鼠肝脏匀浆中TG、TC、SOD以及MDA的变化趋势(
$\bar x $ ±s,n=8)组别 TG(mmol/L) TC(mmol/L) SOD(U/mgprot) MDA(nmol/mgprot) 空白组 0.42±0.16 0.11±0.03 956.31±142.64 0.47±0.06 模型组 0.69±0.05** 0.09±0.02** 769.26±141.64**## 1.98±0.26** 阳性药组 0.50±0.11*## 0.7±0.01*## 988.25±168.90## 0.64±0.15*## 姜黄素片剂组 0.66±0.10**# 0.04±0.01*## 933.99±103.39# 0.79±0.11** 姜黄素纳米乳低剂量组 0.64±0.07**## 0.06±0.02*## 972.23±142.10## 0.80±0.03**# 姜黄素纳米乳中剂量组 0.58±0.05**## 0.07±0.02**## 916.55±117.32# 0.59±0.09## 姜黄素纳米乳高剂量组 0.54±0.13## 0.10±0.03** 799.81±121.85** 0.70±0.23*## *P<0.05, **P<0.001,与空白组比较;#P<0.05,##P<0.001,与模型组比较 -
[1] ZORRILLA E, DELPILAR VALENCIA M, SERRANOP A Evaluation of a screening test for hyperlipidemia[J]. JAMA1974 228 5 589 590 .[2] KARR S. Epidemiology and management of hyperlipidemia[J]. Am J Manag Care, 2017, 23(9 Suppl): S139-S148. [3] STONEN J, ROBINSONJ G, LICHTENSTEINA H, et al. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J]. Circulation, 2014, 129(25 Suppl2): S1-S45. [4] LI G, HAN R X, CAO W C, et al Outcome reporting variability in trials of Chinese medicine for hyperlipidemia: asystematic review for developing a core outcome set[J]. Evid BasedComplementAlternat Med2021 2021 8822215 .[5] GOEL A, KUNNUMAKKARAA B, AGGARWALB B Curcumin as “Curecumin”: from kitchen to clinic[J]. Biochem Pharmacol2008 75 4 787 809 .[6] NAGANUMA M, SARUWATARI A, OKAMURA S, et al Turmeric and curcumin modulate the conjugation of 1-naphthol in Caco-2 cells[J]. Biol Pharm Bull2006 29 7 1476 1479 .[7] TAKEMOTO M, LIAOJ K Pleiotropic effects of 3-hydroxy-3-methylglutaryl coenzyme a reductase inhibitors[J]. Arterioscler Thromb Vasc Biol2001 21 11 1712 1719 .[8] 李占彬, 杨昌彪, 谭红, 等 高效液相色谱仪串联三重四级杆质谱法快速测定姜茶中的姜黄素[J]. 分析仪器2014 2 65 68 .[9] 翁路安, 苏洁, 吴雯琰, 等 三七细粉与破壁粉对高脂血症模型大鼠药效对比研究[J]. 中药药理与临床2021 37 2 86 92 .[10] 沙子珺, 黎彩凤, 唐仕欢, 等 新资源药材辣木叶抗高脂血症的药效与作用机制探析[J]. 中国中药杂志2021 46 14 3465 3477 .[11] 延琪瑶, 闫朝阳, 王浩峰, 等 两种莪术类药用植物姜黄素提取物对小鼠抗氧化活性研究[J]. 基因组学与应用生物学2020 39 1 225 231 .[12] 周燕红, 刘毅飞 姜黄素对溃疡性结肠炎脂质过氧化损伤大鼠的保护作用[J]. 咸宁学院学报(医学版)2005 19 4 280 282 .[13] 姚国贤, 傅静波, 韩刚 姜黄素与辛伐他汀降血脂及抗氧化作用比较[J]. 中国医院药学杂志2010 30 3 204 206 .[14] 高丽芳, 郜文 番茄红素与姜黄素联用对急性乙醇氧化损伤小鼠的抗氧化作用[J]. 首都医科大学学报2021 42 1 89 93 . -





 下载:
下载: