-
河豚毒素(TTX)是一种海洋生物毒素。TTX首次在河豚中提取得到,而后在多个海洋动植物和陆地部分动物中发现。TTX是一种电压门控钠通道(VGSCs)的阻滞剂,能够选择性地与VGSCs外前庭上的α-亚基结合,阻止钠离子进入通道,从而产生药理活性。TTX具有镇痛、戒毒、抗心律失常等作用,此外,还有降低心血管药物不良反应的作用。目前已经有许多TTX在研制剂,研究者也正在针对TTX的剂型进行研究。本文就TTX的来源、结构性质、作用机制、药理活性、在研剂型进行综述,旨在为下一步TTX的药用开发提供参考。
-
1894年,日本学者田原良纯在日本药物学会的月度会议上介绍了从河豚卵巢水提取物中分离出的毒素,这是TTX的首次面世。1909年他提出河豚只含有1种有毒物质,并将其命名为河豚毒素[1]。1950-1957年间,横尾晃、津田藤介等人首先从红鳍东方鲀、紫色东方鲀卵巢中分离得到结晶态的TTX [2-4]。目前河豚毒素的实验室合成已经实现[5],但尚未实现产业化。
起初,人们认为TTX只存在于河豚科的河豚中,但自不同纲属的两栖动物中发现TTX,打破了以往认为它仅存在于鲀科鱼类中的学说[6]。此后,在多个种类的海洋动植物和陆地动植物中都发现了TTX的存在,如甲藻、红色石灰质藻类、节肢动物、棘皮动物、软体动物、蝾螈和青蛙等。在海洋和淡水环境的沉积物中也发现了TTX[7],进而产生了生物体内发现的TTX到底是内源性的(由河豚自身产生)还是外源性的(从外部获取并积累)争议。
对于TTX的来源,目前有两种理论:外因说和内因说。日本的清水、松居是最早提出“外因说”的学者。他们用含有TTX的饲料来喂养人工养殖的无毒河鲀,结果河鲀由无毒转变为有毒,由此推论河豚体内的TTX可能是外源性的[8]。2005年,Cheng和Wu 等[9-10]提出TTX是由外界细菌产生的,他们从河豚体内提取出36种细菌,包括弧菌、芽孢杆菌、假单胞菌等。Simidu等[11]通过实验发现溶藻弧菌和互生单胞菌属产TTX较多,但细菌能否产生TTX取决于菌株。Noguchi等[12]的研究表明河豚内的TTX可能来源于其体内的共生细菌,产生TTX的是这些共生细菌而非河豚本身。
内因说认为河豚鱼体内的TTX来源于河豚体内的微生物或是某些生理过程的产物。1998年,Matsumura等[13]以星点东方鲀成熟的卵细胞进行人工授精及胚胎培育,发现胚胎中TTX含量在孵化过程中有所增加,由此认为TTX是河豚胚胎发育的产物。有报道认为河豚体内的TTX可能不是直接来自细菌,也有可能是河鲀鱼与共生细菌共同的产物,并随生长发育逐渐积累[14]。目前大多数研究者认为河豚体内的TTX是由食物链累积和体内微生物产生这两种方式共同形成的。
-
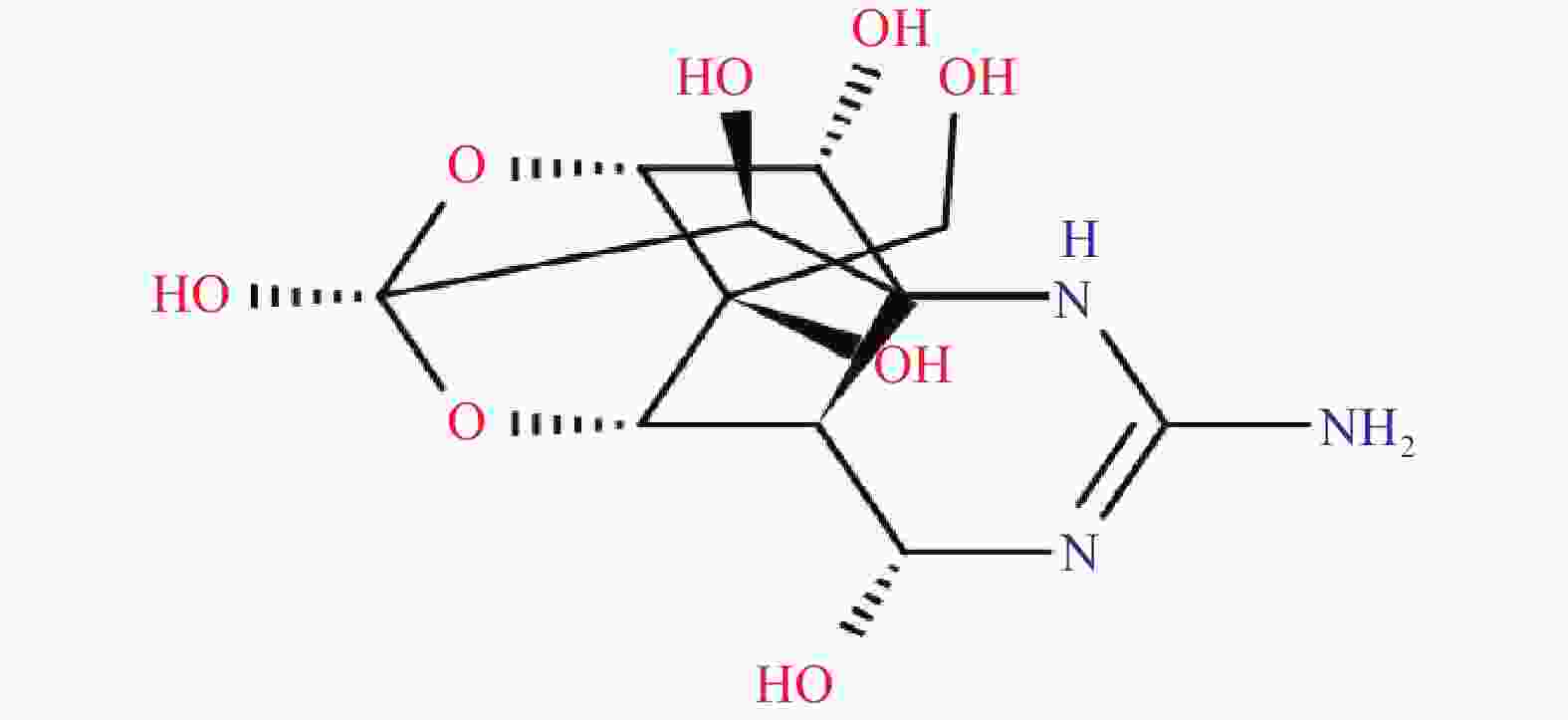
河豚毒素(TTX)的分子式为C11H17O8N3,分子量为319.27,为氨基全氢化喹唑啉型化合物,呈独特的笼形结构(见图1),杂环含2个氮母核,含有1个碳环、1个胍基、6个羟基,在C-5和C-10位有1个与半醛糖内酯连接的分开的环[15]。热性质稳定,在碱性溶液中易降解,微溶于水、无水乙醇、乙醚,几乎不溶于其他有机溶剂,易溶于有机酸和无机酸水溶液,log Kow=−6.21(est),25 ℃时的比旋度为−8.64°(在8.55%稀醋酸中),其pKa在水中为8.76,在50%乙醇中为9.4[16]。
TTX毒性很强,经腹腔注射对小鼠的LD50为8 μg/kg,目前没有特效解毒剂。常温下,提取获得的TTX为无色晶状固体,固体状态很稳定,但其水溶液易水解,温度越高分解速度越快;当助溶剂为pH 4.05醋酸溶液时,放置30 天的常规TTX注射液含量由99.20%下降到93.88%(25 ℃)或65.57%(40 ℃)[17]。
-
TTX是一种电压门控钠通道(VGSCs)的阻滞剂,它能够选择性地结合到VGSCs外前庭上的α-亚基,阻止钠离子进入通道,从而产生抑制兴奋的作用[18]。从结构上看,TTX的胍基与钠离子通道内受体蛋白的羰基相互作用,阻滞离子进入通道,继而产生神经、肌肉的麻痹。TTX与钠离子通道是1∶1的结合,即1分子毒素结合1个钠通道,其结合是可逆的,并且与K+、Mg2+、Ca2+等带正电荷的离子竞争受体。根据对河豚毒素的敏感性,VGSCs可分为 TTX 敏感型(TTX-s)和 TTX 耐受型(TTX-r)[19],分别介导激活电压较低、失活较快的快钠电流和激活电压高、失活较慢的慢钠电流。
研究表明,TTX对钠离子通道的影响可能是其镇痛的机制。在 VGSC家族中有6个 TTX-s 钠离子通道成员(Nav 1.1 ~1.4,1.6,1.7)可以被 TTX阻断,而其他的钠离子通道亚型是 TTX-r 钠离子通道,不能被TTX阻断[20]。TTX可以选择性抑制膜电压,使通道难以打开,从而抑制神经冲动的发生和传导,造成神经肌肉丧失传递兴奋的能力。有基因研究表明,在河豚体内有非芳香族氨基酸(Asn)和Cys残基存在于河豚Nav1.4通道的域I,这与河豚的TTX抗性相关,将这2个残基引入到对TTXs敏感的大鼠Nav1.4通道后,大鼠也具有了抗性[21]。
-
镇痛是目前TTX在临床应用上研究最多的方向。作为典型的钠离子通道阻滞剂,TTX可以与吗啡等多种镇痛药联用,以发挥出比单一镇痛药更好的效果。陈学军等[22]进行了TTX和吗啡单独或联用对腹腔注射醋酸小鼠的扭体实验,考察其镇痛效果。结果显示当TTX剂量范围在0.0312~4 μg/kg时能剂量依赖性地抑制醋酸扭体小鼠的疼痛;固定TTX用量在0.125 μg/kg,联合使用剂量范围在1.95~31.2 μg/kg的吗啡,各剂量组与TTX和吗啡单一使用比较,扭体抑制率差异均有统计学意义(P<0.01)。这说明两者联用使得低剂量吗啡镇痛效应增强,降低了其不良反应,比单一使用具有更好的镇痛效果。TTX与因得克(indoxacarb)联用证明了TTX能够抑制甲醛引起的炎症性疼痛和水肿[23]。TTX在临床上使用也效果显著,以它为主药用于癌症晚期患者镇痛的注射剂曾于加拿大进行了24例志愿者实验,通过单盲实验确定TTX与阿片类药物相比具有良好的镇痛作用,且在停止注射后有长效镇痛的作用。这个附加的镇痛作用在第10天左右达到峰值,随后开始减小[24]。后来他们进行了Ⅱ期临床试验,通过对更大样本量的志愿者群体进行更详细的实验,对不同分组给予不同给药方案,结果表明肌内注射TTX的一般耐受性良好,在每日30 mg、分2次给药时,4 天内是安全的[25]。
-
将TTX应用于戒毒和药物成瘾性戒断的治疗中,在临床上也有良好的表现。中等成瘾程度的戒毒者每日1次注射10 μgTTX,5~7天为1个疗程就能很好地控制毒瘾,并大大减轻了常规戒毒方法中常出现的戒毒综合征[26]。随后还出现了喷雾剂型的TTX戒毒制剂,改善了毒瘾患者用药时的便携度和及时性[27]。
-
相比较于常用的抗心律失常药,TTX能够选择性地阻断Na+通道而不影响其他离子通道,减少了引起不良反应的概率,降低了用药风险。朱成华等[28]通过建立小鼠BaCl2心律失常模型和大鼠乌头碱心律失常模型,将微量TTX与心得安、利多卡因等抗心律失常药合用,TTX可增强抗心律失常药的疗效而不产生毒性影响。现国内已有以TTX为主药制成的抗心律失常药[29]。
对于心血管疾病,由于TTX的毒性反应中存在低血压反应,实验显示5×10−4 μg/g剂量就有明显的降压反应[30]。有研究者对多种动物进行了在体或离体实验,静脉注射一定剂量TTX后发现它对各种动物均有不同程度的降压作用。TTX没有直接扩张血管的作用,但可抑制心脏,其降压作用与抑制心脏有关[31]。
-
①预防肾功能衰竭。Bergman等[32]建立了单侧大鼠肾切除模型,对大鼠进行60 min缺血处理后再灌注,肌内注射不同剂量TTX。结果显示,2~4 μg/kg的TTX对急性缺血性肾衰具有保护作用,分组实验则证明肾衰前后注射TTX都具有同样作用,但作用机制尚不明确。②用作皮肤瘙痒症状的止痒剂,能止痒并促进恢复。③治疗前列腺病症。TTX对多种细菌都有抑制作用,能够有效缓解细菌感染引起的前列腺炎症[33]。④对肺癌具有一定治疗作用。将河豚肝脏加水煎煮2~2.5 h,收集上层河豚肝油,将TTX溶于河豚肝油并加入香叶油、白术油和鸦胆子油等辅料制备成药,通过构建免疫缺陷型模型鼠来验证其对肿瘤生长的影响,结果与对照组相比该药物抑制肿瘤细胞生长效果明显,但起作用的具体成分难以判断[34]。
-
根据TTX不同药理作用,可将它制备成多种剂型以发挥或提高其有效性,目前已报道的包括口服制剂、喷雾剂、气雾剂、注射剂、可植入式渗透微泵或栓剂等。
-
口服制剂是最常见的给药剂型之一,但对TTX而言,液态口服制剂需要达到注射剂数十倍的剂量才能起到相同的效果。研究证实TTX在小肠液中稳定,故可将其制成胶囊剂或片剂,根据情况填充液体或半固体,成药辅料以乳糖、硬脂酸盐、微晶纤维素、交联羧甲纤维素等为优选[35]。口服制剂不仅增加了患者服用便捷性,而且患者无需住院就可安全使用,也更利于药物的储藏和运输[36]。有研究者制备了载河豚毒素的微囊[37],使用挤出滚圆(Ex-Sp)和流化床处理制得,样品在2~12 h持续释放,累计释放率达80%,在40 μg/kg剂量取得最优镇痛效果。研究者测得河豚毒素注射液6 μg/kg静脉注射的t1/2为0.92 h,载药微囊150 µg/kg灌胃给药,测得cmax为0.88 ng/ml,t1/2约14.5 h,tmax约为5 h。
-
呼吸道给药途径包括鼻腔、口腔和舌下黏膜等部位,其吸收率也不低于肌内或静脉注射,现有气雾剂、喷雾剂和粉末吸入剂等形式。通过混合稀释剂、抛射剂、稳定剂、皮肤助渗剂等多种药用辅料使TTX在喷射装置内保持稳定,制成喷雾剂形式的戒毒、镇痛用TTX制剂,使用十分方便[27]。
-
国外早以TTX注射剂作为局麻剂和戒毒剂,如TTX与吗啡联用作为手术所需局麻剂。加拿大WEX制药公司研制了TTX注射剂,其申请的专利中虽未公开特定溶剂,但最有可能为极性溶剂,如氢氧化物和醇化物。该TTX注射剂用于缓解化疗和晚期癌症患者的剧烈疼痛,临床试验效果良好,在每日不超过30 μg的剂量条件下表现出非常好的镇痛效果。在30 μg给药剂量时,其cmax为0.58 ng/ml,tmax约为1.5 h,t1/2约为4.5 h[38],现已进入Ⅲ期临床试验[39]。该公司在国内申请的专利中也列出了其对于TTX可能的剂型制备方法,包括片剂、颗粒剂、胶囊剂、贴剂、乳膏剂等多种剂型,同时TTX与多种药物联合使用有协同治疗作用,如抗癌药顺铂、卡铂、奥沙利铂和长春新碱等[40]。
TTX水溶液对温度敏感,可将其制成冻干制剂,以获得稳定的可注射制剂,但其用于临床的剂量均为微克级。微量的TTX冻干脱水后无法形成所需要的固态残留物,因此需要添加必需的赋形剂,作为TTX附着的支架以形成固态物。已有的解决办法有采用等渗调节剂氯化钠,以甘露醇为成型骨架辅料,以海藻糖作稳定剂并在冷冻干燥前调节pH值至3.5~4.5,可获得质量稳定性好、安全性高的冻干粉针制剂[41]。
-
TTX极具开发潜力,尤其在医药领域。它作为典型的钠离子通道阻断剂在很多方面都表现出药用功效,但可能仍有许多作用未被发现。在已知的一些功效中尚未明确其作用机制,作用于人体的给药途径也仍需探索以获得更好的给药形式和治疗效果,需要多个领域的合作研究才能进一步挖掘TTX对人类的有益作用。
Advances in medicinal research on tetrodotoxin
-
摘要: 河豚毒素(TTX)是在河豚鱼和其他海洋动物中发现的一种神经毒素。它是一种电压门控钠通道(VGSCs)阻滞剂,能够选择性地与VGSCs外前庭上的α-亚基结合,阻止钠离子进入通道,从而产生药理活性。作为典型的钠离子通道阻滞剂,TTX具有显著的镇痛作用。TTX能够选择性地阻断Na+通道而不影响其他离子通道,减少了常用抗心律失常药物引起不良反应的概率,降低了用药风险。此外,TTX在戒毒等方面亦有显著作用。因此,TTX具有很大的成药潜力。本文对河豚毒素的结构与性质、作用机制、药理活性和在研制剂进行综述,为其成药性评价研究和在药学领域的应用提供概要性支撑。Abstract: Tetrodotoxin (TTX) is a neurotoxin found in puffer fish and other marine organisms. It has been used as an inhibitor of voltage-gated sodium channels (VGSCs), which could selectively bind to the α-subunit on the outer vestibule of VGSCs, preventing sodium ions from entering the channel, resulting in pharmacological activities. As a typical sodium channel blocker, TTX shows a significant analgesic effect. TTX could selectively block Na+ channels without affecting other ion channels, therefore it could reduce the probability of adverse reactions caused by commonly used antiarrhythmic drugs. In addition, TTX has a significant role in detoxification and prevention of renal failure, so TTX has great potential as a medicine. The structure and physicochemical properties, mechanism of action, pharmacological activities and preparations of tetrodotoxin have been reviewed in this paper, so as to provide a general support for the evaluation of its druggability and application in the field of pharmacy.
-
Key words:
- tetrodotoxin /
- neurotoxin /
- analgesic effect /
- pharmacological activity /
- preparation
-
[1] SUEHIRO M. Historical review on chemical and medical studies of globefish toxin before World War II[J]. Yakushigaku Zasshi,1994,29(3):428-434. [2] KALAITZIS J A, CHAU R, KOHLI G S, et al. Biosynthesis of toxic naturally-occurring seafood contaminants[J]. Toxicon,2010,56(2):244-258. doi: 10.1016/j.toxicon.2009.09.001 [3] SATO K, AKAI S, SHOJI H, et al. Stereoselective and efficient total synthesis of optically active tetrodotoxin from D-glucose[J]. J Org Chem,2008,73(4):1234-1242. doi: 10.1021/jo701655v [4] CHAU J, CIUFOLINI M A. The chemical synthesis of tetrodoxin: an ongoing quest[J]. Mar Drugs,2011,9(10):2046-2074. doi: 10.3390/md9102046 [5] MURAKAMI K, TOMA T, FUKUYAMA T, et al. Total synthesis of tetrodotoxin[J]. Angew Chem,2020,132(15):6312-6316. doi: 10.1002/ange.201916611 [6] MOSHER H S, FUHRMAN F A, BUCHWALD H D, et al. Tarichatoxin: tetrodotoxin: a potent neurotoxin[J]. Science,1964,144(3622):1100-1110. doi: 10.1126/science.144.3622.1100 [7] LEHMAN E M, BRODIE E D Jr, BRODIE E D 3rd. No evidence for an endosymbiotic bacterial origin of tetrodotoxin in the newt Taricha granulosa[J]. Toxicon,2004,44(3):243-249. doi: 10.1016/j.toxicon.2004.05.019 [8] NOGUCHI T, ARAKAWA O, TAKATANI T. TTX accumulation in pufferfish[J]. Comp Biochem Physiol D Genom Proteom,2006,1(1):145-152. [9] CHENG C A, HWANG D F, TSAI Y H, et al. Microflora and tetrodotoxin-producing bacteria in a gastropod, niotha clathrata[J]. Food Chem Toxicol,1995,33(11):929-934. doi: 10.1016/0278-6915(95)00061-6 [10] WU Z L, YANG Y, XIE L P, et al. Toxicity and distribution of tetrodotoxin-producing bacteria in puffer fish Fugu rubripes collected from the Bohai Sea of China[J]. Toxicon,2005,46(4):471-476. doi: 10.1016/j.toxicon.2005.06.002 [11] SIMIDU U, KITA-TSUKAMOTO K, YASUMOTO T, et al. Taxonomy of four marine bacterial strains that produce tetrodotoxin[J]. Int J Syst Bacteriol,1990,40(4):331-336. doi: 10.1099/00207713-40-4-331 [12] NOGUCHI T, ARAKAWA O. Tetrodotoxin: distribution and accumulation in aquatic organisms, and cases of human intoxication[J]. Mar Drugs,2008,6(2):220-242. doi: 10.3390/md6020220 [13] MATSUMURA K. Reexamination of tetrodotoxin production by bacteria[J]. Appl Environ Microbiol,1995,61(9):3468-3470. doi: 10.1128/aem.61.9.3468-3470.1995 [14] 黄军, 严美姣, 陈国宏. 河豚毒素的起源及其研究进展[J]. 生物技术通讯, 2006, 17(6):998-1000. doi: 10.3969/j.issn.1009-0002.2006.06.047 [15] CHAU R, KALAITZIS J A, NEILAN B A. On the origins and biosynthesis of tetrodotoxin[J]. Aquat Toxicol,2011,104(1-2):61-72. doi: 10.1016/j.aquatox.2011.04.001 [16] WILLIAMS M. The Merck index: an encyclopedia of chemicals, drugs, and biologicals[J]. Choice Reviews Online,2007,44(10). [17] ZHANG X, HUANG X Y, LIN W Y. Stable pharmaceutical composition of freeze-dried tetrodotoxin powder: US8124608[P]. 2012-02-28. [18] 杨春, 苏秀榕, 李太武, 等. 低毒河豚鱼毒素的提取和检测[J]. 天然产物研究与开发, 2003, 15(5):398-400. doi: 10.3969/j.issn.1001-6880.2003.05.006 [19] HERZOG R I, CUMMINS T R, WAXMAN S G. Persistent TTX-resistant Na+ current affects resting potential and response to depolarization in simulated spinal sensory neurons[J]. J Neurophysiol,2001,86(3):1351-1364. doi: 10.1152/jn.2001.86.3.1351 [20] 殷芹, 刘岩, 宫庆礼. 河豚毒素的理论及应用研究进展[J]. 海洋通报, 2008, 27(6):95-100. doi: 10.3969/j.issn.1001-6392.2008.06.014 [21] VENKATESH B, LU S Q, DANDONA N, et al. Genetic basis of tetrodotoxin resistance in pufferfishes[J]. Curr Biol,2005,15(22):2069-2072. doi: 10.1016/j.cub.2005.10.068 [22] 陈学军, 王陈, 石童, 等. TTX和吗啡对醋酸扭体小鼠联合镇痛效应的研究[C]//中国毒理学会. 中国毒理学会第九次全国毒理学大会论文集. 太原: 中国毒理学会, 2019: 13 [23] 张凤云, 库宝善, 姚海燕, 等. 河豚毒素单用及与indoxacarb联合应用的镇痛抗炎作用[J]. 中国临床康复, 2006, 10(34):115-118. [24] HAGEN N A, DU SOUICH P, LAPOINTE B, et al. Tetrodotoxin for moderate to severe cancer pain: a randomized, double blind, parallel design multicenter study[J]. J Pain Symptom Manag,2008,35(4):420-429. doi: 10.1016/j.jpainsymman.2007.05.011 [25] HAGEN N A, FISHER K M, LAPOINTE B, et al. An open-label, multi-dose efficacy and safety study of intramuscular tetrodotoxin in patients with severe cancer-related pain[J]. J Pain Symptom Manage,2007,34(2):171-182. doi: 10.1016/j.jpainsymman.2006.11.008 [26] 王开业. 一种用于戒毒、镇痛的河豚毒素制剂: CN101317846A[P]. 2010-11-10. [27] 潘心富, 刘助国, 黄致强. 用于戒毒, 镇痛的河豚毒素呼吸道给药制剂: CN1459286A[P]. 2003-12-03. [28] 朱成华, 王桂兰, 李蕴山, 等. 河鲀毒素(TTX)对抗心律失常药疗效和毒性的影响[J]. 河北渔业, 1985(2):46-48. [29] 洪碧红, 易瑞灶, 陈永强, 等. 具有抗心律失常作用的河豚毒素复方制剂及其制备方法: CN105030782A[P]. 2019-11-08. [30] BOWER D J, HART R J, MATTHEWS P A, et al. Nonprotein neurotoxins[J]. Clin Toxicol,1981,18(7):813-863. doi: 10.3109/15563658108990310 [31] 蔡志基, 李密, 王越, 等. 国产河豚毒素的药理研究(摘要)[J]. 河北水产科技, 1983(1):1-3. [32] LI W J, BERGMAN S M, HOLMES R P, et al. Tetrodotoxin protects against acute ischemic renal failure in the rat[J]. J Urol,1992,147(2):519-522. doi: 10.1016/S0022-5347(17)37292-0 [33] 刘皓, 刘延东. 河豚毒素在制备治疗前列腺病症药物组合物中的应用、药物组合物及制备方法: CN107308166A[P].2017-11-03. [34] 徐跑, 赵继红, 蒋火金, 等. 河豚毒素在制备抑制肺癌细胞或肿瘤增长的药物中的应用: CN108524521A[P]. 2018-09-14 [35] W·林, 克劳德·卡迪纳尔, F·H·沈. 河豚毒素的固体口服制剂: CN1972689A[P]. 2007-05-30. [36] KAVOOSI M, O'REILLY T E, KAVOOSI M, et al. Safety, tolerability, pharmacokinetics, and concentration-QTc analysis of tetrodotoxin: a randomized, dose escalation study in healthy adults[J]. Toxins (Basel),2020,12(8):E511. doi: 10.3390/toxins12080511 [37] 赵继红, 汤波澜. 一种河豚毒素口服液态制剂及其制备方法: CN102784102A[P]. 2015-01-21. [38] HAGEN N A, CANTIN L, CONSTANT J, et al. Tetrodotoxin for moderate to severe cancer-related pain: a multicentre, randomized, double-blind, placebo-controlled, parallel-design trial[J]. Pain Res Manag,2017,2017:7212713. [39] HONG B, HE J, SUN J, et al. Analgesia effect of enteric sustained-release tetrodotoxin pellets in the rat[J]. Pharmaceutics,2020,12(1):E32. doi: 10.3390/pharmaceutics12010032 [40] H·H·布希曼, J·M·维拉·赫尔南德斯, J·M·贝扬斯. 钠通道阻滞剂治疗由于化疗而产生的神经病理性疼痛的用途: CN 101563079 A[P]. 2013-09-04. [41] 易瑞灶, 陈晖, 洪碧红, 等. 河豚毒素冻干粉针制剂及其制备方法: CN101352422A[P]. 2009-01-28. -



 下载:
下载:


