-
结直肠癌,又称大肠癌,好发于大肠黏膜,是常见消化系统恶性肿瘤,早期症状不明显不易发现,晚期则表现贫血、体重减轻等。由于现代生活节奏加快及各种不良饮食、作息、环境和遗传等因素的影响,使得我国的发病率逐年增加[1]。据《中国肿瘤登记年报》内容显示:2015年我国肿瘤登记地区结直肠癌发病率和病死率分别为17.1/10万和7.9/10万,发病率男女性别比和城乡比分别为1.5和1.4,病死率分别为1.6和1.4。与年报数据接近的《中国死因监测数据集》显示,2017年我国结直肠癌病死率为6.9/10万[2]。虽然,目前已有各种化疗、外科手术、中医治疗等诊治方法,但是仍然存在早期诊查率低、预后差等问题,患者术后5年的生存率仍没有得到较大的改善,故针对结直肠癌的诊疗研究亦成为现在的热点[3]。
卡培他滨(Cap)是结直肠癌辅助化疗及一线治疗药物,通常与多西他赛、奥沙利铂、爱必妥等联合应用,常见结直肠癌化疗方案是联合奥沙利铂。Cap是前体药,体内转化成氟尿嘧啶,并在肿瘤组织中代谢为5-氟尿嘧啶,从而抑制核苷酸的合成,发挥抗肿瘤作用。肿瘤组织中5-氟尿嘧啶的浓度是血液中的100倍以上,靶向性好,不良反应轻微,且大部分患者都可耐受[4]。手足综合征(HFS)是服用Cap后出现的常见药物不良反应,多为1~2级,少数达到3级。临床主要表现为进展性症状变化,早期症状主要发生在手掌和足底,出现不同程度的瘙痒,指尖、手掌和足底充血,之后会持续发展为手掌和足底的暗红和肿胀,随后产生水泡,最终发展为脱皮,极大影响患者用药依从性及生存质量,成为后期持续治疗效果不佳的严重因素之一[5]。Cap导致HFS的发病机制尚不清楚,但病理特征表现为不同程度的细胞点片坏死、轻度的海绵状水肿、血管扩张、表皮与真皮交界处有炎性渗出。有研究表明[6-8],显微镜镜下观察到血管舒张和水肿,类似于炎症反应,而炎症发生时,活跃的炎症因子主要有白介素类中的IL-1β、IL-6、IL-10、IL-12、IL-17、IL-23,肿瘤坏死因子(TNF-α)、干扰素(IFN-γ)、C-反应蛋白(CPR)以及趋化性细胞因子(CCL-5)。因此,本研究对出现HFS的结直肠癌患者血浆中的主要炎症因子进行考察,推测其中涉及到的炎症因子,建立炎症因子含量变化与HFS发生的相关性,为Cap发生HFS的防治提供一定参考。
-
选取2018年9月至2019年2月海军军医大学附属长征医院普外科接受卡培他滨化疗方案的35例结直肠癌患者作为本次研究对象。纳入标准:①年龄≥18周岁;②经临床确诊为结直肠癌的患者;③接受了以Cap为基础的化疗;④预计生存期≥3个月,无主要器官的功能障碍;⑤有化疗指证,包括心肝肾等脏器功能正常,骨髓造血功能正常;⑥治疗前病情评估应有完整的体格检查和实验室检查,包括全血细胞计数、生化功能检查等;⑦生活质量:首次出现先写中文名(KPS)评分≥60分;⑧自愿签署知情同意书。排除标准:①孕、哺乳期患者;②5年内患过其他恶性肿瘤者;③经临床确定,对FU类药物过敏或严重代谢不良的患者;④有严重感染的患者;⑤经临床确定,患有其他会影响实验结果的恶性疾病;⑥不符合纳入标准,未按规定用药,无法判断疗效,或资料不全等影响疗效或安全性判断者。HFS事件评价标准:根据美国卫生及公共服务部2009年出版的常见不良反应事件评价标准4.0(CTCAE v4.0)分级,1级:轻微皮肤改变或皮肤炎(红斑、水肿、角化过度、不痛);2级:皮肤改变(剥落、水泡、出血、肿胀、角化过度),疼痛,影响工具性日常生活活动;3级:重度皮肤改变(剥落、水泡、出血、水肿、角化过度),疼痛,个人自理能力受限。自患者服用Cap后进行临床观察,直到患者出现HFS后停止,收集患者出现HFS时的血液样本,采用EDTA-3K抗凝管采集血样,储存于−80 ℃冰箱冻存。本研究经过海军军医大学附属长征医院伦理委员会批准,35例患者基本信息及HFS信息见表1。
表 1 患者一般资料及HFS分级情况
例数 性别 年龄(岁) 肿瘤部位 HFS分级 男 女 均值 中位数 直肠 结肠 未发生 1级 2级 3级 35 23 12 55.9 61 14 21 12 16 3 4 (65.7%) (34.3%) — — (29.9%) (70.1%) (34.2%) (45.7%) (8.5%) (11.4%) -
Human IL-6 ELISA kit试剂盒、 Human IL-1β ELISA kit试剂盒、Human IL-10 ELISA kit试剂盒、Human IL-12p70 ELISA kit试剂盒、Human IL-17/IL-17A ELISA kit试剂盒、Human IL-23 ELISA kit试剂盒、Human IFN-γ ELISA kit试剂盒、Human CRP ELISA kit试剂盒、Human TNF-α ELISA kit试剂盒以及Human RANTES ELISA kit试剂盒均购自国润医疗供应链服务(上海)有限公司。酶标仪(Biotek,型号:800TSI)购自美国伯腾仪器(北京代表处)有限公司。37 ℃孵箱(型号:FYL-YS-151L,温度:0 ℃~100 ℃)由北京福意电器有限公司提供。
-
参照试剂盒说明书测定35例结直肠癌患者服用卡培他滨后血浆中各炎症因子包括白介素类中的IL-1β、IL-6、IL-10、IL-12、IL-17、IL-23, TNF-α,IFN-γ,CPR和CCL-5含量水平。将血液样本4 000 r/min离心15 min, 收集血浆样本,按照试剂盒说明书测定各炎症因子的含量。
-
使用 Microsoft Excel 软件进行统计结果分析,采用Graphpad Prism 8.3.0作图。
-
IL-23标准曲线的浓度为2 000、1 000、500、250、125、62.5、31.25 pg/ml;IFN-γ、IL-17、TNF-α、IL-12标准曲线的浓度为1 000、500、250、125、62.5、31.25、15.6 pg/ml;CCL-5、IL-1β的标准曲线的浓度为500、250、125、62.5、31.25、15.6、7.8 pg/ml;IL-6、CRP的标准曲线的标准品浓度为200、150、50、25、12.5、6.25、3.125 pg/ml;IL-10的标准曲线的浓度为50、25、12.5、6.25、3.125、1.56、0.78 pg/ml。各炎症因子标准曲线呈现良好线性关系,可为样本的检测提供阳性对照,见表2。
表 2 炎症因子线性范围及标准曲线
炎症因子 线性范围pg/ml 标准曲线 r IL-23 0~2 000 Y=594.66X−23.268 0.994 8 IFN-γ 0~1 000 Y=384.31X+7.9709 0.999 3 IL-17 Y=1379X−12.849 0.997 9 TNF-α Y=352.02X+5.7229 0.999 7 IL-12 Y=448.55X+8.5172 0.994 6 CCL-5 0~500 Y=168.42X−12.215 0.997 2 IL-1β Y=206.82X−4.5823 0.999 6 IL-6 0~200 Y=67.278X−6.6851 0.996 7 CRP Y=90.523X -3.228 0.990 5 IL-10 0~50 Y=27.541X−0.403 0.997 5 -
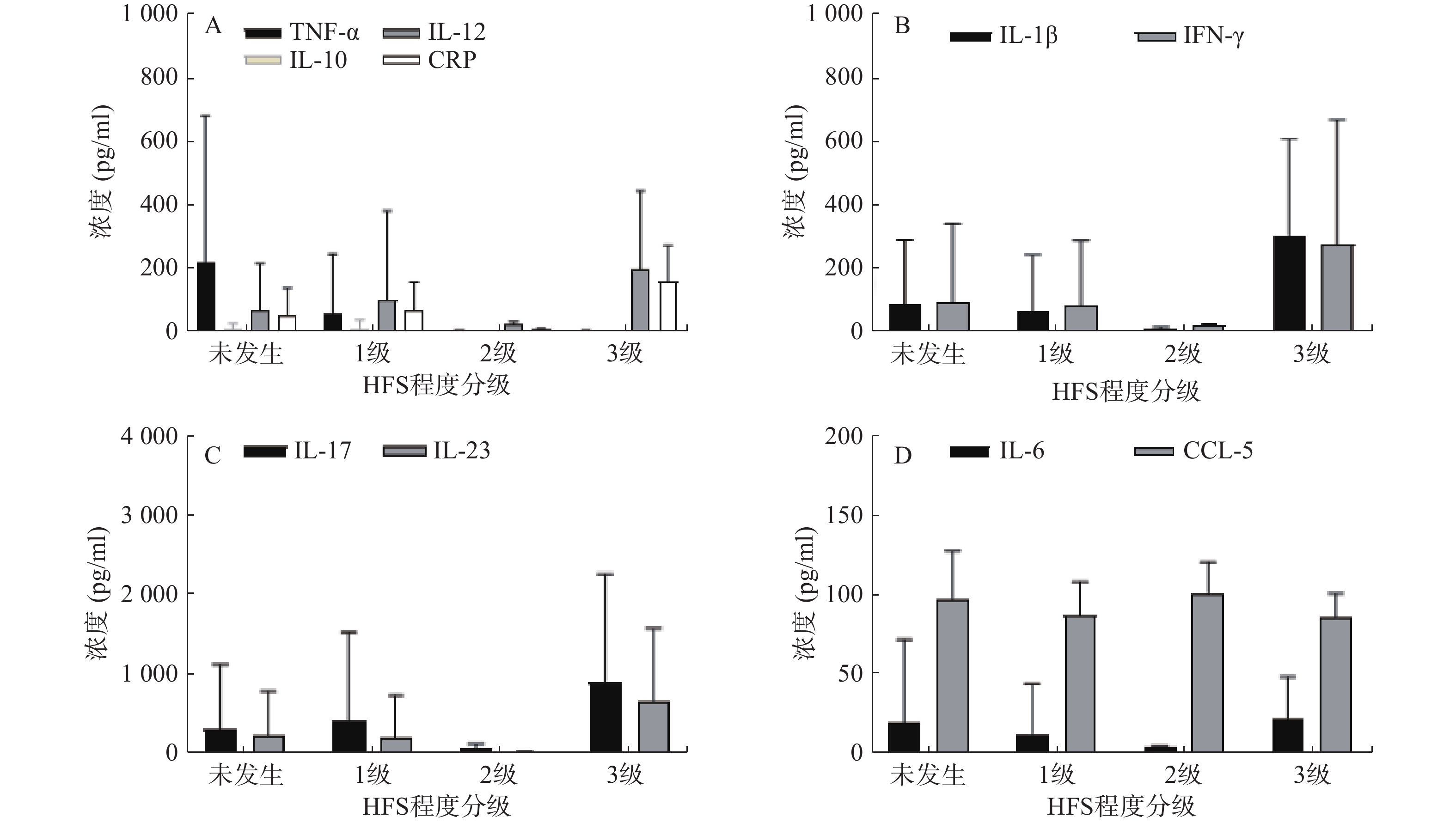
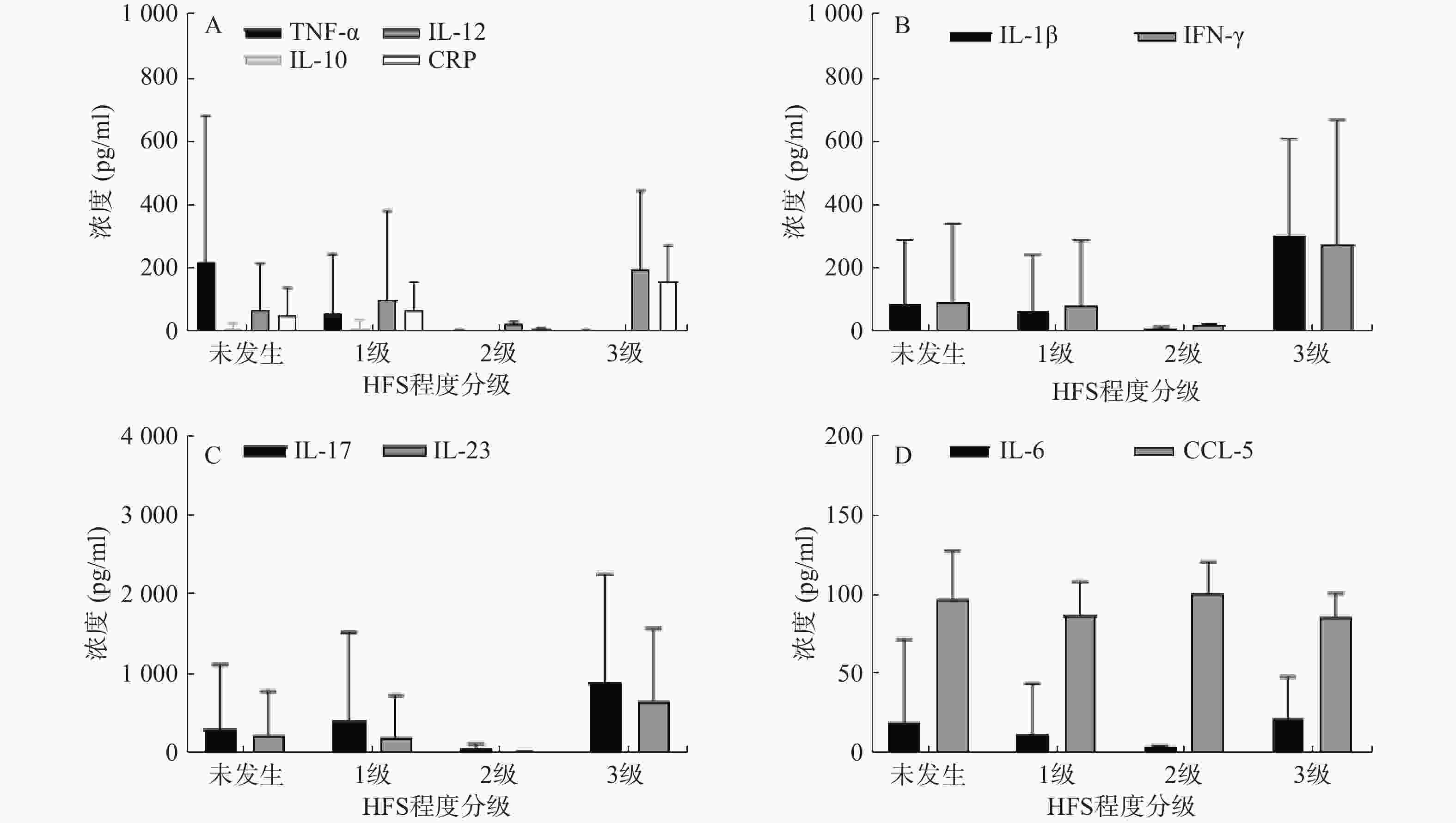
35例服用Cap后未发生与发生各级HFS的两类结直肠癌患者,其血浆中各炎症因子含量水平见表3。结果显示,不同级别的HFS各炎症因子含量存在一定的差异性,提示Cap诱发HFS会导致血浆中不同炎症因子相互作用发生级联反应。其中,TNF-α 的含量水平在发生HPS呈整体下调状态,且明显低于未发生者的含量水平。其余炎症因子含量水平变化则无规律可循(图1)。
表 3 不同分级HFS患者中的各炎症因子含量测定结果(pg/ml,
$\bar x $ ±s)炎症因子 未发生 1级 2级 3级 浓度平均值 标准差 浓度平均值 标准差 浓度平均值 标准差 浓度平均值 标准差 IL-1β 83.64 203.67 60.98 180.17 8.96 5.03 303.17 303.50 IL-6 19.57 52.35 12.29 31.84 4.68 0.34 22.60 25.96 IL-10 8.280 17.19 10.53 26.67 0.17 0.11 0.10 0.03 IL-12 67.80 148.40 99.40 282.18 22.87 9.42 195.11 250.89 IL-17 316.96 807.82 413.09 1118.61 76.79 46.93 905.52 1361.64 IL-23 218.06 566.46 190.55 542.33 12.11 5.95 663.67 911.80 IFN-γ 89.87 248.25 77.82 209.39 17.36 5.01 274.05 392.16 CRP 52.99 85.03 65.77 91.81 6.91 3.49 157.98 114.55 TNF-α 221.01 461.14 58.98 186.95 2.67 2.51 2.64 1.54 CCL-5 98.11 30.01 87.84 20.60 101.78 19.20 85.93 15.49 注:未发生HFS 12例;1级HFS 16例;2级HFS 3例;3级HFS 4例 -
随着结直肠癌发病率的上升,Cap的临床应用越来越广泛,其带来的不良反应也急剧增加,其中,HFS严重影响患者生活质量以及用药依从性,更甚者则终止治疗,故必须对Cap诱发HFS进行药学监护[9-10]。临床常见的监护策略主要有减少给药剂量、中断药物治疗以及使用其他药物(如塞来昔布胶囊200 mg,po,bid +尿素乳膏涂抹患处,tid)干预HFS严重程度等方法。肿瘤坏死因子(TNF-α)是机体重要的炎性细胞因子之一,具有多生物学效应及生理病理性功能,且TNF-α在HFS发生的不同程度时血浆中含量有显著变化,推测TNF-α 血浆中含量水平越低发生HFS的程度越严重,并在进行药学监护时具有一定参考价值。
本实验以HFS为主要研究方向,对患者血浆中炎症因子进行检测,结果发现Cap诱发不同程度HFS血浆中的炎症因子含量有一定的差异性。由于临床化疗治疗医生很少让患者的HFS进展到2、3级再进行处理,所以患者例数较少,数据不能支撑比较。但对未发生与1级HFS比较发现,1级HFS患者血浆中IL-1β、IL-6、IL-23、IFN-γ、TNF-α、CCL-5的含量明显低于未发生HFS患者;而IL-10、IL-12、IL-17、CRP血浆中含量明显高于未发生HFS患者,且TNF-α浓度水平变化较为明显。目前,Cap诱发HFS的发生机制尚不清楚,可能是多途径炎症因子相互作用的结果。因此,关注定血浆炎症因子含量水平变化,在一定程度上可以反应Cap诱导HFS的严重程度,通过测定血浆中炎症因子含量的变化,有利于防治Cap诱发HFS情况,并对临床有重要的指导意义。
Analysis of association between severity of capecitabine-induced hand-foot syndrome and inflammatory factors
-
摘要:
目的 检测并分析服用卡培他滨后出现手足综合征的结直肠癌患者血浆中主要炎症因子(IL-1β、IL-6、IL-10、IL-12、IL-17、IL-23、TNF-α、IFN-γ、CPR和CCL-5)与手足综合征之间的相关性。 方法 收集35例服用卡培他滨的结直肠癌患者血浆样本,根据手足综合征分级诊断标准对其轻重程度进行划分,用ELISA试剂盒检测血浆中各炎症因子的含量。 结果 所有炎症因子的标准曲线呈线性(r>0.9900),并测定了不同结直肠癌患者血浆中炎症因子的含量,其中,TNF-α 含量水平变化较为明显,且具有参考价值。 结论 不同的炎症因子在不同分级的手足综合征患者血浆中浓度存在一定差异,且TNF-α 炎症因子含量水平与其发生手足综合症的轻重程度密切相关。 Abstract:Objective To investigate the correlation between plasma inflammatory factors [IL-1β, IL-6, IL-10, IL-12, IL-17, IL-23, TNF-α, TGF-β, IFN-γ, C-reactive protein (CPR) CCL-5] and hand-foot syndrome in colorectal cancer patients after taking capecitabine. Methods 35 colorectal cancer patients treated with capecitabine were collected and the degree of severity was divided according to the hand-foot syndrome grading diagnostic criteria. The concentrations of inflammatory factors in plasma were determined by ELISA kits. Results The standard curve of all inflammatory cytokines were linear (r>0.9900), and plasma concentrations of inflammatory cytokines in patients with colorectal cancer were determined. The concentration of TNF-α changed obviously, which had reference value. Conclusion The concentrations of different inflammatory factors were different and the concentration of TNF-α was closely correlated with the severity of hand-foot syndrome. -
Key words:
- colorectal cancer /
- capecitabine /
- hand-foot syndrome /
- inflammatory factors
-
表 1 患者一般资料及HFS分级情况
例数 性别 年龄(岁) 肿瘤部位 HFS分级 男 女 均值 中位数 直肠 结肠 未发生 1级 2级 3级 35 23 12 55.9 61 14 21 12 16 3 4 (65.7%) (34.3%) — — (29.9%) (70.1%) (34.2%) (45.7%) (8.5%) (11.4%) 表 2 炎症因子线性范围及标准曲线
炎症因子 线性范围pg/ml 标准曲线 r IL-23 0~2 000 Y=594.66X−23.268 0.994 8 IFN-γ 0~1 000 Y=384.31X+7.9709 0.999 3 IL-17 Y=1379X−12.849 0.997 9 TNF-α Y=352.02X+5.7229 0.999 7 IL-12 Y=448.55X+8.5172 0.994 6 CCL-5 0~500 Y=168.42X−12.215 0.997 2 IL-1β Y=206.82X−4.5823 0.999 6 IL-6 0~200 Y=67.278X−6.6851 0.996 7 CRP Y=90.523X -3.228 0.990 5 IL-10 0~50 Y=27.541X−0.403 0.997 5 表 3 不同分级HFS患者中的各炎症因子含量测定结果(pg/ml,
$\bar x $ ±s)炎症因子 未发生 1级 2级 3级 浓度平均值 标准差 浓度平均值 标准差 浓度平均值 标准差 浓度平均值 标准差 IL-1β 83.64 203.67 60.98 180.17 8.96 5.03 303.17 303.50 IL-6 19.57 52.35 12.29 31.84 4.68 0.34 22.60 25.96 IL-10 8.280 17.19 10.53 26.67 0.17 0.11 0.10 0.03 IL-12 67.80 148.40 99.40 282.18 22.87 9.42 195.11 250.89 IL-17 316.96 807.82 413.09 1118.61 76.79 46.93 905.52 1361.64 IL-23 218.06 566.46 190.55 542.33 12.11 5.95 663.67 911.80 IFN-γ 89.87 248.25 77.82 209.39 17.36 5.01 274.05 392.16 CRP 52.99 85.03 65.77 91.81 6.91 3.49 157.98 114.55 TNF-α 221.01 461.14 58.98 186.95 2.67 2.51 2.64 1.54 CCL-5 98.11 30.01 87.84 20.60 101.78 19.20 85.93 15.49 注:未发生HFS 12例;1级HFS 16例;2级HFS 3例;3级HFS 4例 -
[1] 付卫, 黄坤蓉, 付敏, 等. CD73在结直肠癌组织中的表达及其与临床病理参数的关系[J]. 现代肿瘤医学, 2019, 27(10):1753-1757. doi: 10.3969/j.issn.1672-4992.2019.10.022 [2] 王红, 曹梦迪, 刘成成, 等. 中国人群结直肠癌疾病负担: 近年是否有变?[J]. 中华流行病学杂志, 2020, 41(10):1633-1642. doi: 10.3760/cma.j.cn112338-20200306-00273 [3] 陈诚, 熊亚立, 张敬, 等. 转移性结直肠癌一线化疗控制后卡培他滨维持的临床疗效评价[J]. 重庆医学, 2019, 48(8):1416-1419. doi: 10.3969/j.issn.1671-8348.2019.08.037 [4] 彭雪, 杨文博, 张寒, 等. 抗肿瘤药物诱导的手足综合征的诊疗进展[J]. 现代肿瘤医学, 2019, 27(8):1461-1464. doi: 10.3969/j.issn.1672-4992.2019.08.043 [5] NG C Y, CHEN C B, WU M Y, et al. Anticancer drugs induced severe adverse cutaneous drug reactions: an updated review on the risks associated with anticancer targeted therapy or immunotherapies[J]. J Immunol Res, 2018, 2018:5376476. [6] 张丽, 姚希. 血清肿瘤标志物及炎症因子在结直肠癌中的表达及意义[J]. 川北医学院学报, 2018, 33(5):766-769. doi: 10.3969/j.issn.1005-3697.2018.05.034 [7] 李鸿飞, 黄客增, 吴向华. 原发性胃肠道肿瘤合并轻型地中海贫血患者外周血白细胞介素6、肿瘤坏死因子α、干扰素γ及铁调素25水平及其临床意义[J]. 广西医学, 2018, 40(18):2156-2158. [8] 朱聪聪, 潘会君, 朱全刚. Th2相关炎症因子在湿疹发病中的作用机制[J]. 药学实践杂志, 2019, 37(1):9-13. [9] 漆婷婷, 胡志强, 马雪, 等. 1例卡培他滨致晚期结肠癌患者手足综合征循证干预与药学监护[J]. 中国药业, 2021, 30(17):119-123. doi: 10.3969/j.issn.1006-4931.2021.17.032 [10] CHEN J X, WANG Z. How to conduct integrated pharmaceutical care for patients with hand-foot syndrome associated with chemotherapeutic agents and targeted drugs[J]. J Oncol Pharm Pract, 2021, 27(4):919-929. doi: 10.1177/10781552211009291 -
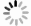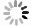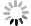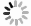



 下载:
下载: