-
分泌蛋白在机体生理及疾病的生物学途径中起着不可或缺的作用,新分泌蛋白的发现与研究对疾病的诊断和治疗具有重要意义[1-4]。CRELD2是一种富含半胱氨酸的表皮生长因子样结构域,属于表皮细胞生长因子(EGF)超家族中与CRELD1同源的新型分泌蛋白。CRELD2基因最早因参与调节内质网应激被认识[5-9],即参与内质网应激信号传导反应和未折叠蛋白反应[6, 9-10];同时参与乙酰胆碱受体α4和β2亚基的细胞内转运[7]。在骨髓间充质干细胞中,CRELD2具有增强骨形态发生蛋白-9诱导的成骨和基质矿化的作用[11],与软骨基质蛋白-3结合,在软骨发育中发挥基础性作用[12]。另外,CRELD2是PERK-ROCK通路中肿瘤相关成纤维细胞的旁分泌因子,参与肿瘤微环境的形成[13];也有研究表明,CRELD2在肝脏代谢稳态的维持和调节中发挥重要作用[14]。此外,CRELD2具有作为诊断人工关节感染和术后急性肾损伤早期预测的生物标志物潜质[15-16]。因此,阐明CRELD2的组织表达情况及组织特异性,将有助于更有指向性地研究其生物学功能及其相关作用机制。
-
SPF级10周龄C57BL/6小鼠,体重为(24.53±3.61) g,购于上海西普尔-必凯实验动物有限公司。实验动物的饲养条件为具有IVC系统的动物房:人工照明时间12 h;温度为(23±2) ℃;相对湿度40%~60%;噪音<60 dB,动物自由饮食进水。本实验方案设计及实验操作均遵守“3R”(Reduction, Replace-ment, Refinement)原则等动物福利相关规定。
-
75%乙醇、无水乙醇、甲醇、三氯甲烷、异丙醇、盐酸胍(国药集团);吐温20(DC25BA00); 5×PrimeScript RT Master Mix(AJ90851A)、DNA标记物(AJ50972A)、裂解液(Trizol)购自宝日医生物技术;小鼠-GAPDH-引物(上海生工);BCA蛋白定量试剂盒、20×PBS缓冲液、20×TBS 缓冲液(碧云天);抗体A:抗CRELD2 抗体(51148-T56,义翘神州);抗体B:抗CRELD2 抗体(bs-8185R, 博奥森);抗体C:鼠CRELD2 抗体(AF3686,R&D Systems);蛋白酶抑制剂、磷酸酶抑制剂、苯甲基磺酰氟(PMSF, 上海康成);氨基丁三醇(Tris)、甘氨酸、30%聚丙烯酰胺溶液、Tris(pH6.8)、Tris(pH8.8)、四甲基乙二胺(TEMED)、过硫酸铵、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE, 上海博光);SYBR green 反应混合物(默克生命科学)。
-
7500荧光定量PCR仪(赛默飞);离心管、EP管、组织冻存管;TP600 PCR仪(宝日医生物技术);Wonbio-48P高通量组织研磨仪(上海万柏);Tanon5200化学发光图像分析系统(上海天能);恒温振荡器(上海鼎国);漩涡混合仪(大连竞迈);Fresco21冷冻高速离心机(赛默飞);超微量分光光度计(GE Healthcare,默克);VE-60蛋白电泳槽(天能);NC膜(D105872,沃特曼);STS-3脱色摇床(琪特仪器)。
-
在NCBI数据库中查找CRELD2基因序列,根据引物设计原则(GC占比:40%~60%;引物长度:15~30 bp;Tm:58~62 ℃;上下游引物的Tm差值<2;扩增片段长度:60~150 bp)应用PrimerBank与Primer-Blast数据库,设计得到CRELD2基因的引物序列,引物设计完成后由上海生工合成。之后通过PCR扩增曲线与溶解曲线对于引物的特异性与扩增效率进行评价,获得CRELD2基因特异性引物序列。
-
⑴肝、胃、肺等组织通用型RNA提取方法:小鼠称重麻醉后取仰卧位固定,取适量肝、胃、肺等组织(针对不同动物个体,于各组织器官同一位置进行取材)置研磨管中,加入1 ml Trizol Reagent及钢珠,充分混匀后使用高通量组织研磨仪研磨(60 Hz,30 s,5次)至无块状组织;高速冷冻离心机离心(4 ℃,12000 r/min,15 min)后取上层红色液体,室温静置;加入200 μl氯仿,用小型涡旋仪剧烈震荡15 s,室温静置10 min自然分层;离心(4 ℃,12000 r/min,15 min)后溶液为三层(上层无色透明为RNA、中层白色为DNA、下层为裂解液和蛋白质混合物),取上层加入等体积的异丙醇混匀后室温静置10 min;离心(4 ℃,12000 r/min,15 min),弃上清得白色RNA沉淀;加入1 ml 75%乙醇重悬RNA沉淀;离心(4 ℃,7500 r/min,15 min),弃上清得RNA沉淀,静置挥发去除乙醇,加入适量DEPC水溶解RNA沉淀,使用超微量分光光度计检测RNA浓度及纯度,调整RNA终浓度(范围:400~500 ng/ μl)以便于逆转录,样品于−80 ℃保存。
⑵胰腺组织特异性RNA提取方法:小鼠称重麻醉后,迅速轻柔地分离出胰腺组织(减少胰酶的自身消化),放入装有液氮的研钵中研磨成粉后装入EP管,加入1 ml Trizol混匀。按照Trizol法步骤继续操作得到RNA沉淀,对其中残留的RNA酶进行清除(3~4次):加入原体积1/2的6 mol/L盐酸胍(含β-巯基乙醇)使沉淀溶解,按照1∶15加入1 mol/L冰乙酸与无水乙醇的混合溶液,于−20 ℃静置15 min,之后离心(4 ℃,12000 r/min,15 min)得到RNA沉淀,经75%乙醇洗涤晾干后溶于DEPC水,即获得胰腺组织总RNA。
-
cDNA的稳定性较RNA好,不易降解,为保证逆转录效率,选择纯度良好的RNA(A260 nm/280 nm:1.8~2.0)配制逆转录10 μl体系(5×Primer Script RT Master Mix:2 μl;RNA:500 ng/浓度;RNase free H2O加至10 μl),得到稳定的cDNA。
-
使用获得的各组织cDNA样品配制20 μl体系(SYBR Green Master:10 μl;CRELD2基因引物:1 μl;cDNA:2 μl;ddH2O:7 μl),通过检测SYBR荧光染料与DNA双链非特异性结合的荧光信号强度,结合内参基因(GAPDH)的荧光信号强度获得各组织中CRELD2的相对含量,各样品均设置双复孔检测,PCR程序如图1。
-
分别取适量小鼠的肝、胰腺、胃、肺等组织(针对不同动物个体,于各组织器官同一位置进行取材)置研磨管中,加入400 μl冷的蛋白裂解液,使用高通量组织研磨仪研磨(60 Hz×30 s×5次)至无块状;冰上孵育30 min后离心(12000 r/min,15 min,4 ℃)获得上清即为蛋白样品。除用于双金鸡纳酸测定法(Bicinchoninic Acid Assay,BCA)定量所需量,向其余样品中加入其体积1/4的5×上样缓冲液后混匀,放置在恒温器(97 ℃)上变性10 min,自然冷却后获得总蛋白样品。
-
从未变性的各总蛋白样品中各取10 μl,使用碧云天Bradford蛋白浓度测定试剂盒进行蛋白浓度测定:按需根据步骤配制蛋白标准品及BCA工作液,在96孔板中加入梯度稀释后的蛋白标准品,每孔定量至20 μl;同时设置样品检测孔:取各待测蛋白样品1 μl分别加入到 96孔板中定量至20 μl;各孔中均加入200 μl BCA工作液,37 ℃孵育30 min后使用Infinite M200多功能酶标仪检测在570 nm波长下的吸光度值,计算获得蛋白样品的浓度。
-
⑴制胶:根据CRELD2的分子量及预实验结果选定分离胶浓度为12 %,按成分比例表配制分离胶加入制胶槽的玻璃板之间,用适量异丙醇去除气泡并保持胶面平整至其完全凝固;之后配制积层胶:待各成分混匀加入制胶槽的玻璃板之间,插入梳子待其自然凝固加样电泳。
⑵加样及电泳:将胶板与电泳电极连接好装入电泳槽内,加1×电泳缓冲液,依顺序将蛋白样品与Marker加入梳孔中(加样量:20~50 μg)。电泳的电压设置:80 V,30 min,之后120 V继续电泳至分离胶中Marker分离完全即停止电泳。
⑶电转膜:选用NC膜并裁剪至合适大小,采用湿转法,电转在冰水混合物的环境中进行,条件设置为:100 V,1 h。
⑷封闭:使用脱脂奶粉对NC膜进行封闭(室温摇床上封闭3 h,也可4℃过夜),封闭结束后用1×PBS洗膜(5 min,3次)。
⑸抗体孵育:根据各抗体的稀释比例配制抗体溶液,于孵育盒中对NC膜进行一抗孵育(室温,摇床3~4 h;或 4 ℃静置过夜)。孵育结束后用1×PBST洗膜(5 min,6次),之后进行孵育二抗(室温静置1 h)。
⑹成像分析:1×PBST洗膜(5 min,3次)后,使用Tanon5200化学发光图像分析系统成像并分析结果。
-
本实验数据均采用(Mean±SEM)的方式作图;两组之间比较时,满足方差齐性和正态分布的连续型计量资料数据采用t检验进行比较;仅方差不齐时采用Satterthwaite近似t检验;若两者均不满足则采用秩和检验。使用SPSS 11.0对数据进行统计分析,当P<0.05时,差异具有统计学意义。分析结果用GraphPad Prism 8.0软件作图。
-
根据对溶解曲线及扩增曲线的筛选标准:①在相同温度条件下,扩增曲线拟合度一致性好且曲线的定点斜率较大;②溶解曲线拟合度一致性好且其溶解温度稳定,溶解曲线的峰值高,表明引物能够较好地与扩增片段解链并完成结合扩增[17],我们使用3种候选引物序列(表1)分别扩增了同一肝脏组织来源的CRELD2 cDNA样品,结果如图2。扩增曲线拟合度一致性排序:引物2>引物3>引物1;溶解曲线峰值:引物1与引物3较引物2低。因此,引物2序列被用于本实验研究。
表 1 CRELD2基因候选引物序列
CRELD2 引物 序列(5' to 3') 上游引物1 ACTTTGAGTGCAACCAACTCTT 下游引物1 CCGCTGCAATAGCCGTTTC 上游引物2 GCCAGGAAGAATTTCGGTGG 下游引物2 CATGATCTCCAGAAGCCGGAT 上游引物3 TTGCAGAGGAACGAGACCCA 下游引物3 GCCGTTGACATTCTCACAGTA -
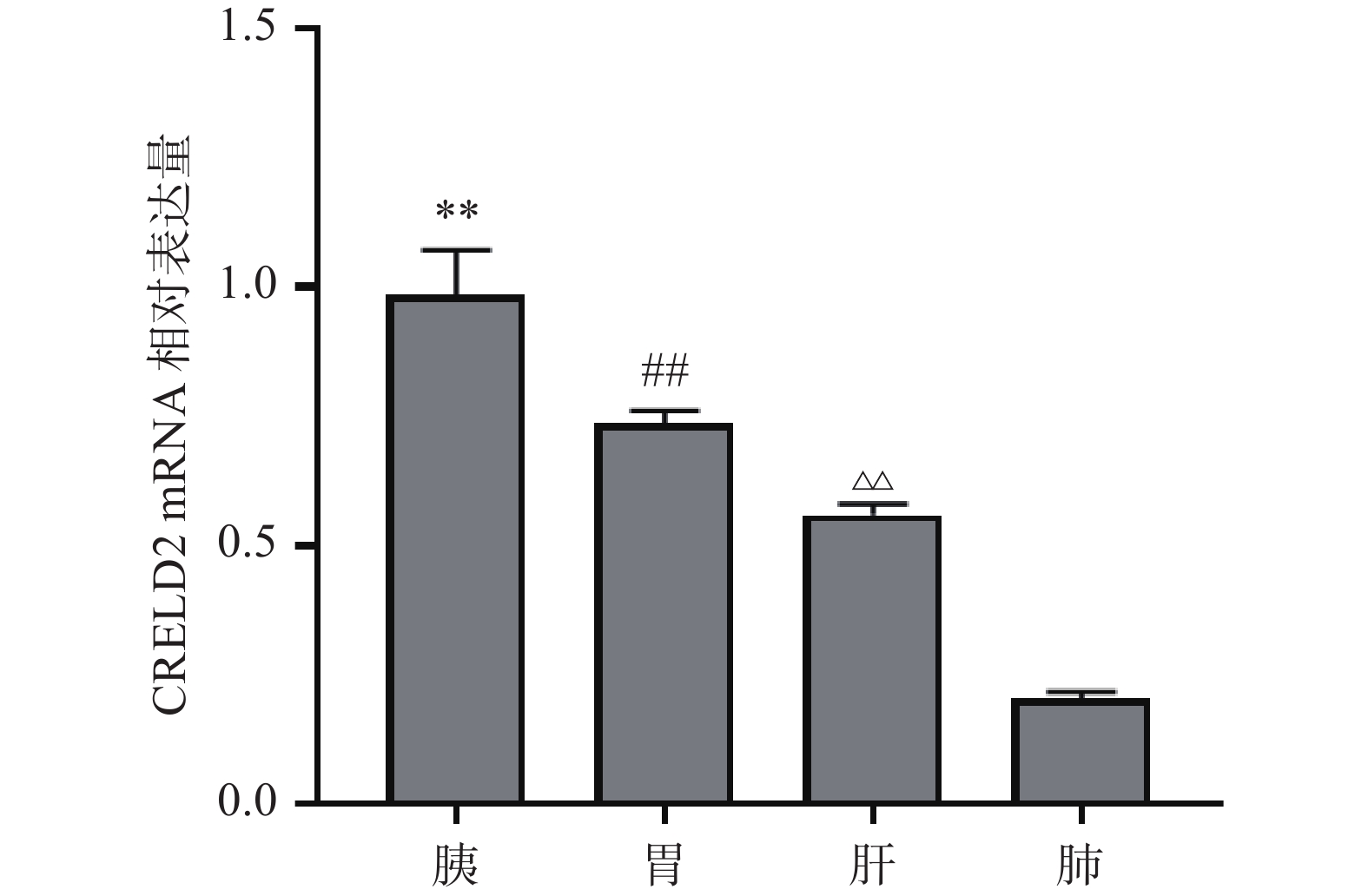
选用CRELD2-引物 2通过RT-PCR对小鼠的肝、胰腺、胃、肺组织中的CRELD2 mRNA水平进行测定,并以小鼠GAPDH特异性引物作为内参对照,比较各组织中CRELD2 mRNA的相对表达水平,结果如图3所示:在肝、胰腺、胃、肺组织中均可检测到CRELD2的基因表达;且CRELD2在不同组织中的表达水平有差异(以胰腺组织为基准,对其余各组织中的相对表达量进行标化),组织间相对表达量为:胰腺>胃>肝>肺,提示在4种组织中以胰腺中的表达水平最高、肺中表达水平最低。需要注意的是,无论是组织通用型RNA提取法还是胰腺组织特异性RNA提取法,胰腺中的表达水平在4种组织中均居首位(结果未显示),实验结果图3采用的是后一提取方法。
-
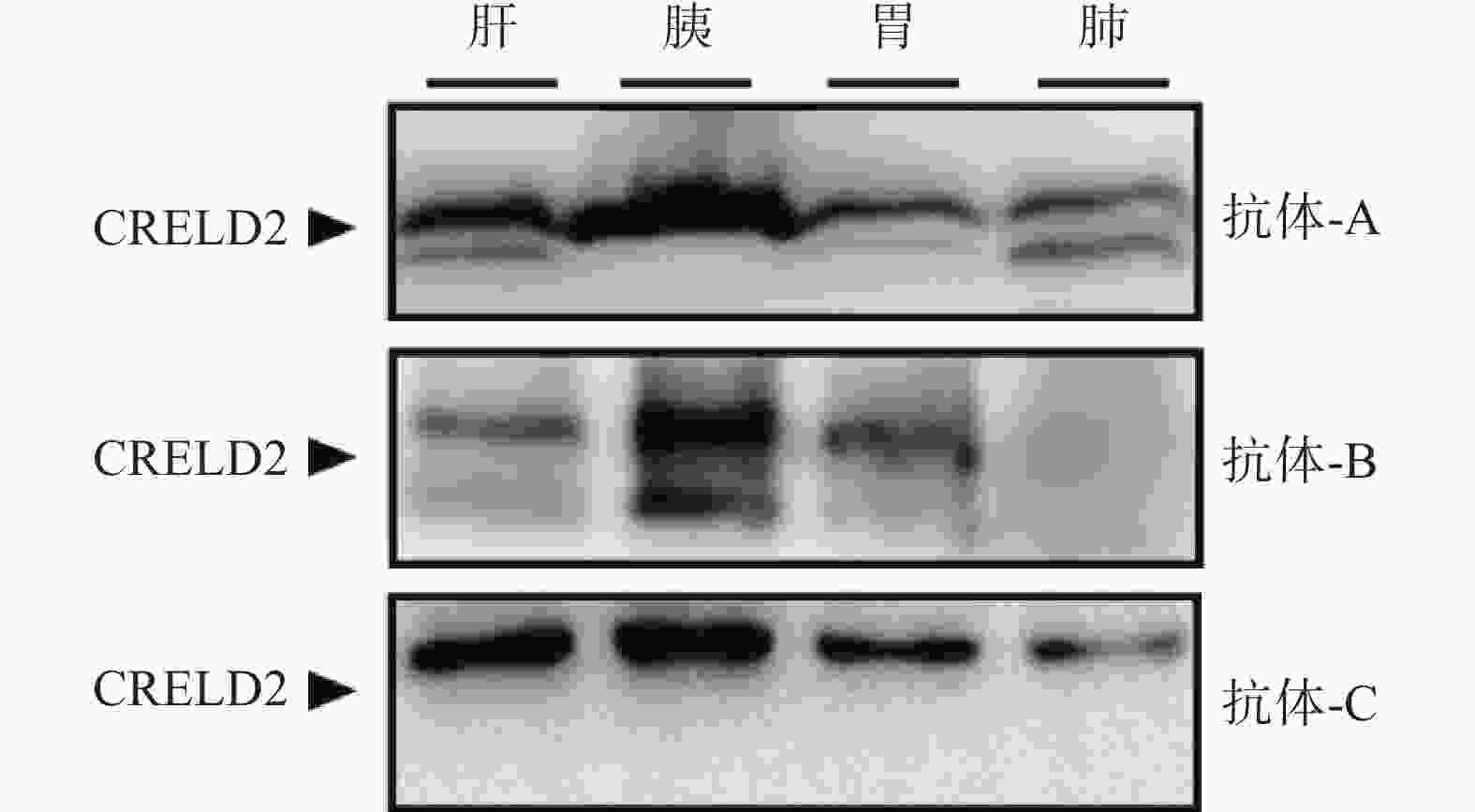
为确保WB检测小鼠各组织中CRELD2蛋白的表达水平的结果准确可靠,我们从市面上可购买到的抗CRELD2抗体中,根据其产品说明标注的应用范围选择了3种适用于WB的不同品牌抗体,按照各自的使用说明对同批次的组织蛋白样品进行WB测定,结果如图4:抗体A在非目的条带所在位置出现条带,存在双条带;抗体B出现非特异性条带,且与抗体A或C相比,其目的条带普遍较淡;与抗体A或B相比,抗体C目的条带较清晰、无杂带。考虑到不同品牌抗体的使用条件各异,所以不同抗体的产品说明虽然在应用范围上有重合,但仍有各自较为适用的应用范围。根据本实验的操作条件与抗体WB条带结果,抗体C被用于进一步的蛋白水平检测。
-
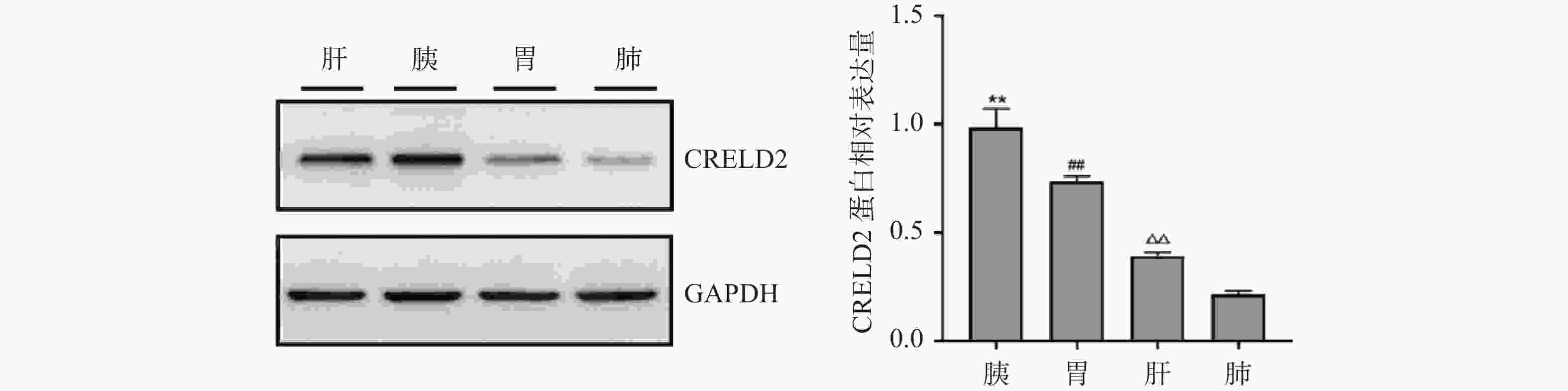
由WB检测小鼠各组织中CRELD2蛋白的表达水平,如图5所示:对于肝、胰腺、胃、肺等不同组织来源的蛋白样品,均可见CRELD2蛋白条带且其灰度值之间存在差异,相对表达量由高至低分别为:胰腺>肝>胃>肺。由此可见,CRELD2蛋白在胰腺、肝、胃、肺4种组织中均有表达,且在4种组织中表达水平不同,以胰腺表达水平最高、肺的表达水平最低。
-
在获得小鼠胰腺、肝、肺、胃4种组织样本的基础上,对于同种组织样品进行同批次提取总蛋白及总RNA,对同批次样品进行RT-PCR及WB测定CRELD2的表达情况,如上述结果显示(图3、图5):在基因与蛋白质水平,CRELD2在小鼠胰腺、肝、肺、胃4种组织中均有表达,且无论在基因还是蛋白质水平,4种组织中胰腺组织中的表达量最高、肺组织中表达水平最低;但4种组织中,CRELD2的基因和蛋白质水平并不完全一致,如RT-PCR结果显示,在胃组织中CRELD2基因的相对表达量高于肝脏组织,而WB结果显示,肝脏组织中CRELD2蛋白的相对表达量高于胃组织,对于个别组织间的相对表达量排序在不同水平上有差异,但整体趋势保持一致。因此,无论在基因还是蛋白质水平,CRELD2在小鼠各组织中均有表达,但在不同表达水平上各组织中CRELD2的相对表达量略有不同。
-
CRELD2与CRELD1共同构成CRELD蛋白家族,是EGF超家族的新成员[5]。目前CRELD2相关研究主要围绕内质网应激展开,研究方向尚不集中,而与之同源的CRELD1现已明确与心脏房室间隔缺损密切相关[18-19]。本研究通过不同方法在基因及蛋白质水平探究CRELD2在各组织中的表达水平,对CRELD2的组织特异性研究具有重要意义。
准确有效地阐明靶标蛋白在基因和蛋白水平的表达情况是生物学研究的重要内容,不同的检测方法具有各自的特点,通常采取多种方法综合验证以获得目的基因及蛋白质在不同类型组织或细胞中的确切表达情况[20-21]。在本实验中,在基因表达水平,我们针对CRELD2基因设计并筛选出用于扩增的引物序列;在蛋白表达水平,结合预选的蛋白条带结果选出了可用于WB的适用性抗体。本实验所需抗体主要用于WB测定,采取的验证与比较的方式比较单一,因此对于抗体综合效果的验证结果仅供参考。此外,我们改进优化了胰腺组织总RNA提取的方法,胰腺组织所处解剖学位置特殊且富含RNA酶,对其总RNA提取存在着取材困难、组织易自身消化、RNA易降解等问题。有研究报道可通过胰腺组织原位灌注RNA酶抑制剂来获得高质量的RNA,但操作困难且成本较高[22-23],由此我们做出了改进:①取材迅速结合液氮冷冻研磨,可减少冻融及胰酶对胰腺组织的自身消化;②增加Trizol用量,有效抑制RNA酶的活性;③使用盐酸胍(含β-巯基乙醇)溶解RNA沉淀并清除其中残留的RNA酶,减少降解,由此分离获得较高质量的胰腺组织总RNA。
本实验通过RT-PCR及WB,在基因及蛋白水平检测了CRELD2在各组织器官中的表达水平,旨在综合不同方法的优势明确各组织中的表达情况,有指向性地研究CRELD2的生物学功能。由结果可见,采用上述2种方法探究CRELD2在不同组织中的表达水平是可行的,其相对表达量在组织间的差异整体趋势相符,可作为相互验证的依据以提高准确度。同时,我们也发现个别组织间的相对表达量排序在基因与蛋白质的不同水平上不完全平行,但差异不影响整体趋势的一致性,考虑CRELD2在个别组织中可能存在转录后的修饰与调节,由此造成差异。同时,后续将通过免疫组织化学、免疫荧光及酶联免疫吸附试验等方法阐明CRELD2在具体细胞内亚结构中的定位以及在其他水平上各组织中的表达情况,更好地为CRELD2生物学功能研究奠定基础。
Expression of CRELD2 in mouse tissues
-
摘要:
目的 通过不同方法在基因及蛋白质水平探究CRELD2在小鼠各组织中的表达水平,为研究CRELD2在各组织中的生物学功能提供依据。 方法 通过实时荧光定量聚合酶链式反应(RT-PCR)及蛋白质印迹法(Western Blot,WB)测定C57BL/6J小鼠的肝、胰腺、胃、肺等组织中CRELD2 mRNA与CRELD2蛋白的含量,实现在不同水平上探究CRELD2在各组织中的表达情况。 结果 RT-PCR及WB测定结果显示,CRELD2在小鼠的肝、胰腺、胃、肺组织中均有表达,表达量在各组织间存在差异;基因水平的相对表达量排序为:胰腺>胃>肝>肺;蛋白水平的相对表达量排序为:胰腺>肝>胃>肺。检测结果表明CRELD2在各组织中普遍存在,但组织间相对表达量的排序并不完全一致,推测与转录调控相关。 结论 CRELD2在小鼠的肝、胰腺、胃、肺组织中均有表达,且相对表达量在基因与蛋白质水平不完全平行。 Abstract:Objective To explore the expression of CRELD2 at the gene and protein levels of mouse tissues, and to provide a reference for studying the biological function of CRELD2 in various tissues. Methods The expression level of CRELD2 in the liver, pancreas, stomach, and lung of C57BL/6J mice was determined by real-time PCR and Western Blot. Results RT-PCR and WB showed that CRELD2 was expressed in mouse liver, pancreas, stomach, and lung. The relative expression levels of CRELD2 from high to low were pancreas, stomach, liver, and lung at the gene level, and pancreas, liver, stomach, and lung at protein level respectively. The result suggested that the relative expression levels of the CRELD2 gene and protein in different tissues were not completely consistent, suggesting that it is related to transcriptional regulation. Conclusion CRELD2 is expressed in mouse liver, pancreas, stomach, and lung, and the relative expression levels of CRELD2 are not completely parallel at the gene and protein level. -
Key words:
- CRELD2 /
- tissue specificity /
- secreted protein.
-
表 1 CRELD2基因候选引物序列
CRELD2 引物 序列(5' to 3') 上游引物1 ACTTTGAGTGCAACCAACTCTT 下游引物1 CCGCTGCAATAGCCGTTTC 上游引物2 GCCAGGAAGAATTTCGGTGG 下游引物2 CATGATCTCCAGAAGCCGGAT 上游引物3 TTGCAGAGGAACGAGACCCA 下游引物3 GCCGTTGACATTCTCACAGTA -
[1] MIAO Z W, HU W J, LI Z Y, et al. Involvement of the secreted protein Metrnl in human diseases[J]. Acta Pharmacol Sin,2020,41(12):1525-1530. doi: 10.1038/s41401-020-00529-9 [2] 王治, 王淑娜, 徐添颖, 等. 烟酰胺磷酸核糖转移酶基因编辑对人胚胎干细胞生长影响的研究[J]. 药学实践杂志, 2019, 37(3):237-240. doi: 10.3969/j.issn.1006-0111.2019.03.009 [3] WANG S N, XU T Y, LI W L, et al. Targeting nicotinamide phosphoribosyltransferase as a potential therapeutic strategy to restore adult neurogenesis[J]. CNS Neurosci Ther,2016,22(6):431-439. doi: 10.1111/cns.12539 [4] 李安, 周小青, 孙阔, 等. 药物分子与靶蛋白相互作用的研究进展[J]. 药学实践杂志, 2019, 37(1):1-4,31. doi: 10.3969/j.issn.1006-0111.2019.01.001 [5] MASLEN C L, BABCOCK D, REDIG J K, et al. CRELD2: gene mapping, alternate splicing, and comparative genomic identification of the promoter region[J]. Gene,2006,382:111-120. doi: 10.1016/j.gene.2006.06.016 [6] OH-HASHI K, KOGA H, IKEDA S, et al. Role of an ER stress response element in regulating the bidirectional promoter of the mouse CRELD2 - ALG12 gene pair[J]. BMC Genomics,2010,11:664. doi: 10.1186/1471-2164-11-664 [7] ORTIZ J A, CASTILLO M, DEL TORO E D, et al. The cysteine-rich with EGF-like domains 2 (CRELD2) protein interacts with the large cytoplasmic domain of human neuronal nicotinic acetylcholine receptor alpha4 and beta2 subunits[J]. J Neurochem,2005,95(6):1585-1596. doi: 10.1111/j.1471-4159.2005.03473.x [8] OH-HASHI K, KOGA H, IKEDA S, et al. CRELD2 is a novel endoplasmic Reticulum stress-inducible gene[J]. Biochem Biophys Res Commun,2009,387(3):504-510. doi: 10.1016/j.bbrc.2009.07.047 [9] HARTLEY C L, EDWARDS S, MULLAN L, et al. Armet/Manf and Creld2 are components of a specialized ER stress response provoked by the inappropriate formation of disulfide bonds: implications for genetic skeletal diseases[J]. Hum Mol Genet,2013,22(25):5262-5275. doi: 10.1093/hmg/ddt383 [10] OH-HASHI K, NORISADA J, HIRATA Y, et al. Characterization of the role of MANF in regulating the secretion of CRELD2[J]. Biol Pharm Bull,2015,38(5):722-731. doi: 10.1248/bpb.b14-00825 [11] ZHANG J Y, WENG Y G, LIU X, et al. Endoplasmic Reticulum (ER) stress-inducible factor cysteine-rich with EGF-like domains 2 (Creld2) is an important mediator of BMP9-regulated osteogenic differentiation of mesenchymal stem cells[J]. PLoS One,2013,8(9):e73086. doi: 10.1371/journal.pone.0073086 [12] NUNDLALL S, RAJPAR M H, BELL P A, et al. An unfolded protein response is the initial cellular response to the expression of mutant matriline-3 in a mouse model of multiple epiphyseal dysplasias[J]. Cell Stress Chaperones,2010,15(6):835-849. doi: 10.1007/s12192-010-0193-y [13] BOYLE S T, POLTAVETS V, KULAR J, et al. ROCK-mediated selective activation of PERK signaling causes fibroblast reprogramming and tumor progression through a CRELD2-dependent mechanism[J]. Nat Cell Biol,2020,22(7):882-895. doi: 10.1038/s41556-020-0523-y [14] KERN P, BALZER N R, BLANK N, et al. Creld2 function during unfolded protein response is essential for liver metabolism homeostasis[J]. FASEB J,2021,35(10):e21939. [15] CHEN M F, CHANG C H, YANG L Y, et al. Synovial fluid interleukin-16, interleukin-18, and CRELD2 as novel biomarkers of prosthetic joint infections[J]. Bone Joint Res,2019,8(4):179-188. doi: 10.1302/2046-3758.84.BJR-2018-0291.R1 [16] KIM Y, PARK S J, MANSON SR, et al. Elevated urinary CRELD2 is associated with endoplasmic Reticulum stress-mediated kidney disease[J]. JCI Insight,2017,2(23):92896. doi: 10.1172/jci.insight.92896 [17] CANAVES J M, MORSE A, WEST B. PCR primer selection tool optimized for high-throughput proteomics and structural genomics[J]. BioTechniques,2004,36(6):1040-1042. doi: 10.2144/04366BC01 [18] ASIM A, AGARWAL S, PANIGRAHI I, et al. CRELD1 gene variants and atrioventricular septal defects in Down syndrome[J]. Gene,2018,641:180-185. doi: 10.1016/j.gene.2017.10.044 [19] BECKERT V, RASSMANN S, KAYVANJOO AH, et al. Creld1 regulates myocardial development and function[J]. J Mol Cell Cardiol,2021,156:45-56. doi: 10.1016/j.yjmcc.2021.03.008 [20] CLARK H F, GURNEY A L, ABAYA E, et al. The secreted protein discovery initiative (SPDI), a large-scale effort to identify novel human secreted and transmembrane proteins: a bioinformatics assessment[J]. Genome Res,2003,13(10):2265-2270. doi: 10.1101/gr.1293003 [21] CLARKE R, RESSOM H W, WANG A T, et al. The properties of high-dimensional data spaces: implications for exploring gene and protein expression data[J]. Nat Rev Cancer,2008,8(1):37-49. doi: 10.1038/nrc2294 [22] GRIFFIN M, ABU-EL-HAIJA M, ABU-EL-HAIJA M, et al. Simplified and versatile method for isolation of high-quality RNA from the pancreas[J]. Biotechniques,2012,52(5):332-334. doi: 10.2144/0000113862 [23] AZEVEDO-POULY A C P, ELGAMAL O A, SCHMITTGEN T D. RNA isolation from mouse pancreas: a ribonuclease-rich tissue[J]. J Vis Exp,2014(90):e51779. -





 下载:
下载: