-
三阴性乳腺癌(triple-negative breast cancer,TNBC)临床特点表现为转移能力强、复发率高和患者预后差,是目前威胁女性健康常见的恶性肿瘤之一[1-3]。由于其细胞表面不表达孕酮受体、雌激素受体以及表皮生长因子受体,使得常规靶向疗法对TNBC收效甚微,目前临床治疗手段仍以传统的化疗为主。然而TNBC除了不表达多种激素受体外,往往也伴随着乳腺癌基因(breast cancer gene,BRCA)等多种基因的突变[4-6],导致其成为一种高度异质性的肿瘤类型,易对化疗药物产生抗性,进一步增加了治疗难度。
代谢旺盛的肿瘤细胞能量供应高度依赖有氧糖酵解产生的ATP,越来越多的研究表明,线粒体氧化磷酸化(oxidative phosphorylation,OXPHOS)对肿瘤细胞糖类、脂类及蛋白质类三大营养物质的相互转化和氧化还原反应的平衡有着重要的作用[7-8]。在多种流行病学、临床和实验室研究中证实,糖代谢抑制剂、线粒体呼吸链阻滞剂等具有显著的抗肿瘤作用[9]。因此,在正常细胞可承受范围内,靶向破坏肿瘤细胞的糖代谢以及干扰呼吸链的电子传递,是目前肿瘤治疗的新策略。
二甲双胍以其良好的安全性和耐受性,在糖尿病临床治疗中被广泛应用[10]。越来越多的研究表明,以二甲双胍为代表的双胍类药物对多种肿瘤具有抑制作用[11-12]。苯乙双胍是比二甲双胍作用强50倍的线粒体复合物I抑制剂[13]。然而,苯乙双胍作为一种抗肿瘤药物却难以获得各国药品管理部门的批准,主要原因是其副作用会产生大量的乳酸,易引起严重的乳酸性酸血症[14-16]。因此,联用其他辅助药物以降低苯乙双胍的使用剂量,在可控的不良反应内达到有效的抗肿瘤作用,是目前肿瘤临床治疗研究的新策略。
笔者将以肿瘤细胞能量代谢为突破点,研究低剂量的苯乙双胍联合己糖激酶抑制剂2-DG对TNBC的治疗作用,为将来针对TNBC的耐药和复发而进行的临床治疗提供新的策略。
-
40只SPF级雌性6周龄BALB/c小鼠,体质量(20±2)g,购自浙江省实验动物中心,许可证号:SCXK(浙)2016-0002。小鼠三阴性乳腺癌细胞系4T1和人三阴性乳腺癌细胞系MBA-MD-231(中国医学科学院基础医学研究所细胞资源中心)。
-
苯乙双胍(Selleck公司);2-脱氧葡萄糖(Sigma公司);RNA反转录试剂盒(ABI公司);FITC-annexin Ⅴ/PI凋亡染色试剂盒(BD公司);葡萄糖含量检测试剂盒、乳酸含量(LA)检测试剂盒(北京索莱宝科技有限公司);海马细胞线粒体压力检测试剂盒(Agilent公司)。
-
分别将1×105个4T1或MDA-MB-231细胞接种到6孔板中,每组设3个复孔。实验分为空白对照组、苯乙双胍(100 μmol/L)组、2-DG(2 mmol/L)组和联用组(苯乙双胍:10 μmol/L;2-DG:200 μmol/L)。作用48 h后,用0.25%的胰蛋白酶消化细胞,获得单细胞悬液,用于后续的细胞增殖和凋亡检测。
-
药物处理细胞48 h后,收集各组细胞悬液,4℃ 500×g离心5 min。弃上清液,每管加入1 ml冷PBS重悬细胞,离心后弃上清液,清洗细胞。加入100 μl 1×偶联缓冲液重悬细胞,然后每管分别加入2 μl annexin Ⅴ和PI,4℃避光孵育30 min。加入400 μl PBS重悬细胞,流式细胞仪检测各组细胞凋亡的情况。
-
各组细胞处理48 h后,收集细胞培养上清液,分别用葡萄糖含量检测试剂盒和乳酸含量检测试剂盒测定葡萄糖和乳酸浓度,同时收集细胞并计数。
-
用海马细胞线粒体压力检测试剂盒测定4T1或MDA-MB-231细胞的线粒体OCR。细胞用药物预处理24 h,在评估前8 h,以6×105个细胞/孔的最佳培养密度将细胞转移到XF微板上,使细胞贴壁。用调节好pH 7.4的培养基对细胞进行清洗,在无CO2培养箱中平衡1 h。ABC孔分别加入寡霉素、线粒体解偶联剂(FCCP)、鱼藤酮和抗霉素A后,上机检测。
-
分为空白(PBS)组、苯乙双胍(1 mg/kg)组、2-DG(5 mg/kg)组和联用组(苯乙双胍:0.1 mg/kg;2-DG:0.5 mg/kg),每组10只小鼠。1×105个 4T1细胞原位接种到BALB/c小鼠乳腺脂肪垫内,待肿瘤生长至5 mm×5 mm左右时,荷瘤小鼠开始给药治疗,并每天测量肿瘤的大小。各给药组小鼠按50 μl体积瘤内注射给予,对照组给予等体积的PBS,每2 d给药1次。连续给药10次后,观察荷瘤小鼠的肿瘤大小并记录各组小鼠的死亡时间。
-
采用SPSS 22.0软件进行统计学分析。实验数据用(
$\bar x $ ±s )表示,两组间比较用t检验,多组的组间比较采用单因素方差分析,动物生存时间比较采用Kaplan-Meier法。 -
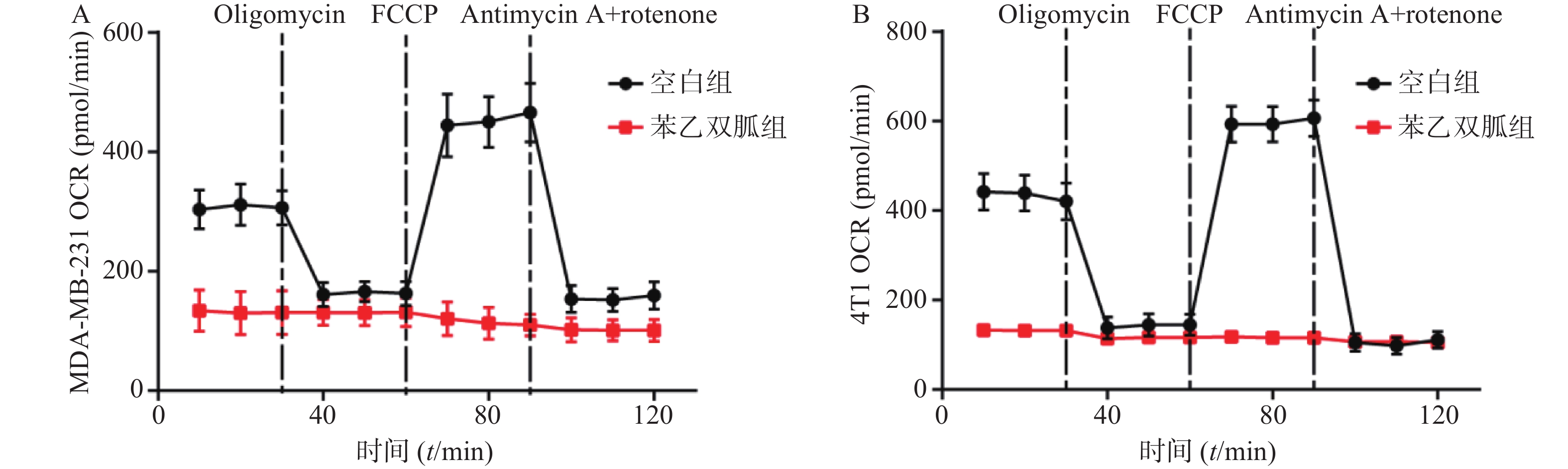
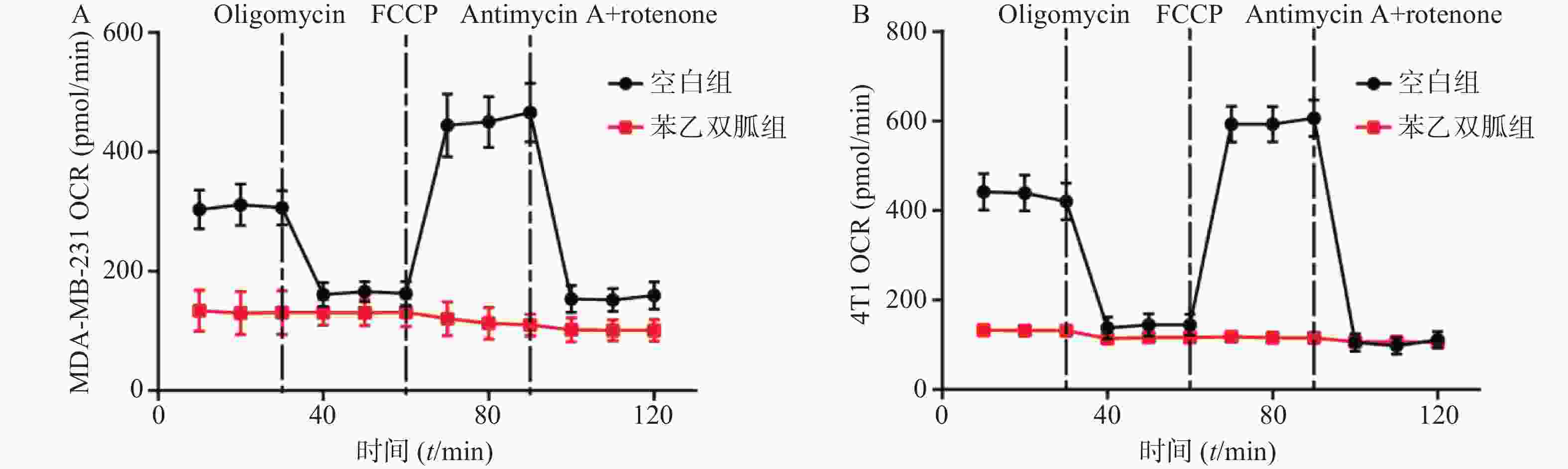
为检测苯乙双胍对线粒体呼吸的影响,将100 μmol/L苯乙双胍分别作用于4T1和MDA-MB-231细胞,24 h后收获细胞,海马生物能量分析仪检测细胞OCR水平。结果表明,苯乙双胍孵育24 h后,MDA-MB-231或4T1细胞线粒体OCR与空白组相比显著降低(图1)。
-
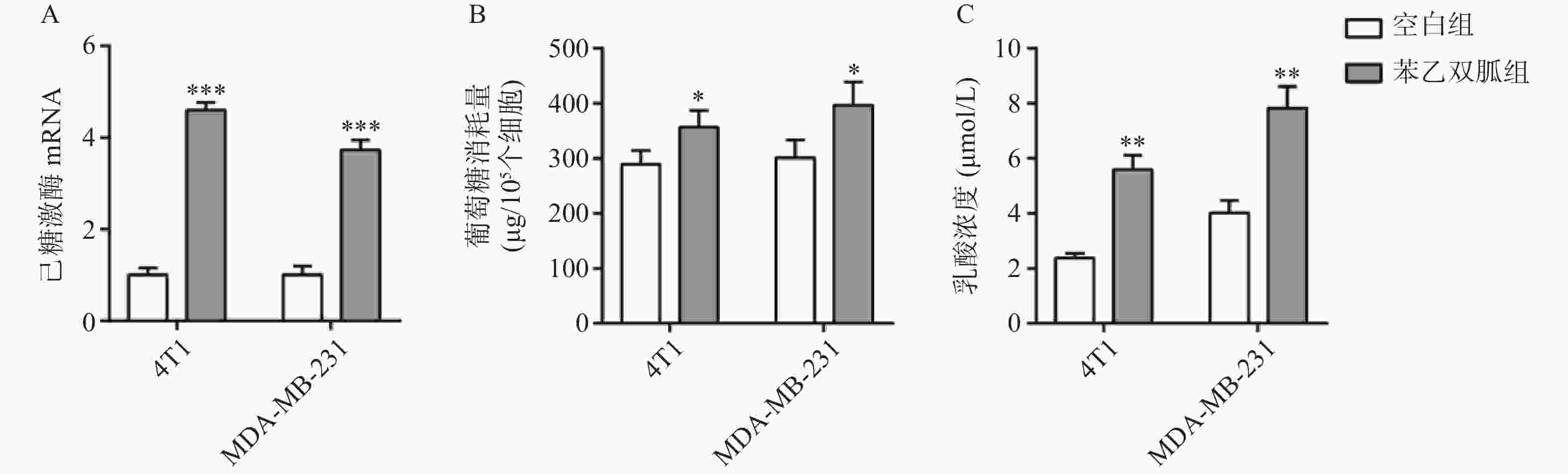
100 μmol/L苯乙双胍处理4T1和MDA-MB-231细胞48 h后,检测细胞上清液中己糖激酶表达量、葡萄糖以及乳酸浓度。结果显示,4T1和MDA-MB-231细胞上清液中己糖激酶表达量,苯乙双胍给药组(4.6±0.17,3.73±0.21,n=3)明显高于空白组(1±0.15,1±0.12, n=3),组间有显著性差异(P<0. 001),表明苯乙双胍可在基因水平显著上调己糖激酶的表达(图2A);4T1和MDA-MB-231细胞上清中葡萄糖消耗量,苯乙双胍给药组(356±31,397±42,n=3)μg/105个细胞明显高于空白组(289±25,301±32,n=3)μg/105细胞,组间有显著性差异(P < 0. 05),表明苯乙双胍能促进细胞摄取更多的葡萄糖,致使培养基中葡萄糖含量显著增加(图2B);4T1和MDA-MB-231细胞上清中乳酸浓度,苯乙双胍给药组(5.59±0.52, 7.83±0.78, n=3)μmol/L明显高于空白组(2.37±0.18,4.01±0.45,n=3)μmol/L,组间有显著性差异(P < 0.01),表明苯乙双胍能显著促进培养上清液中乳酸的产生(图2C)。
-
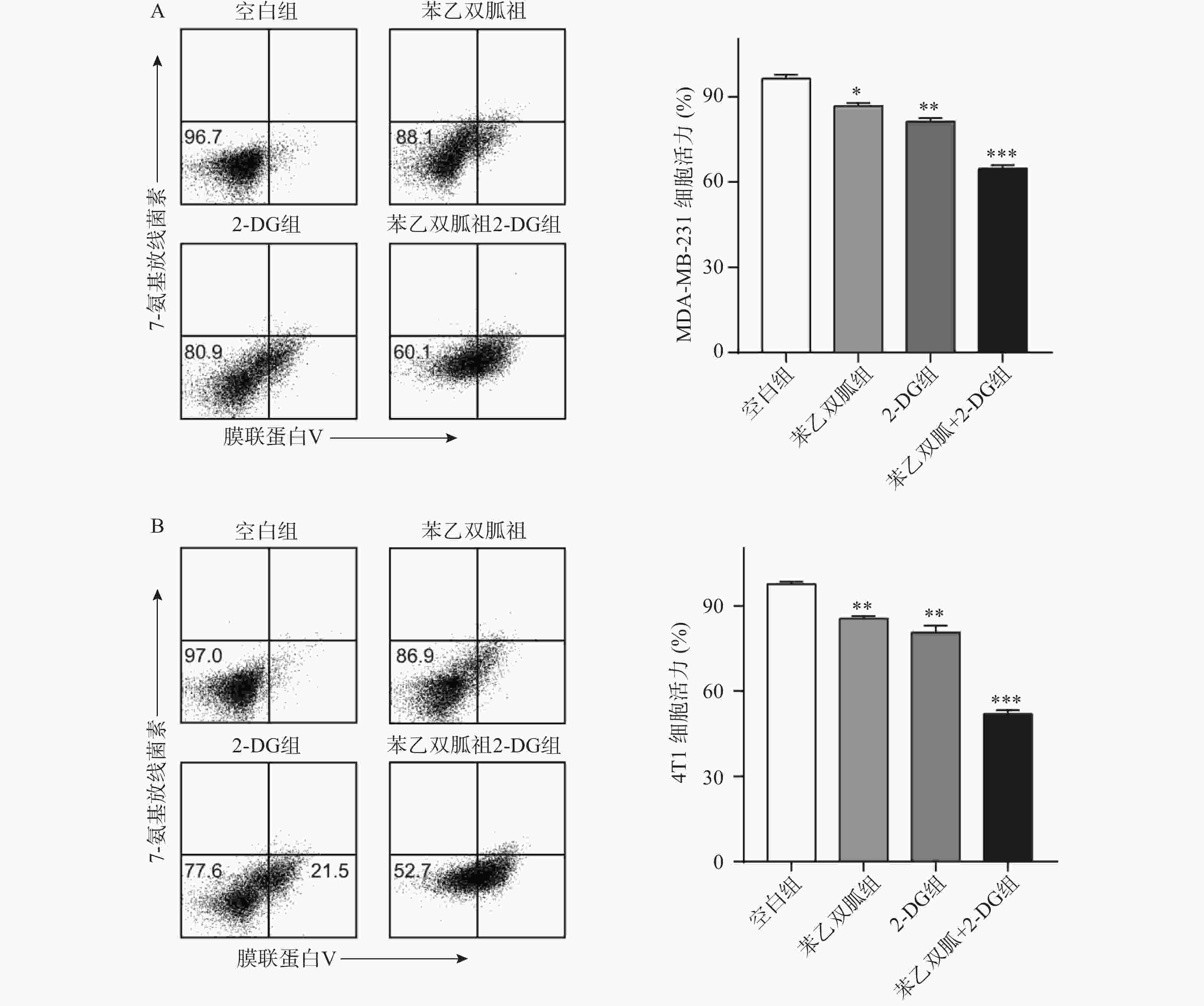
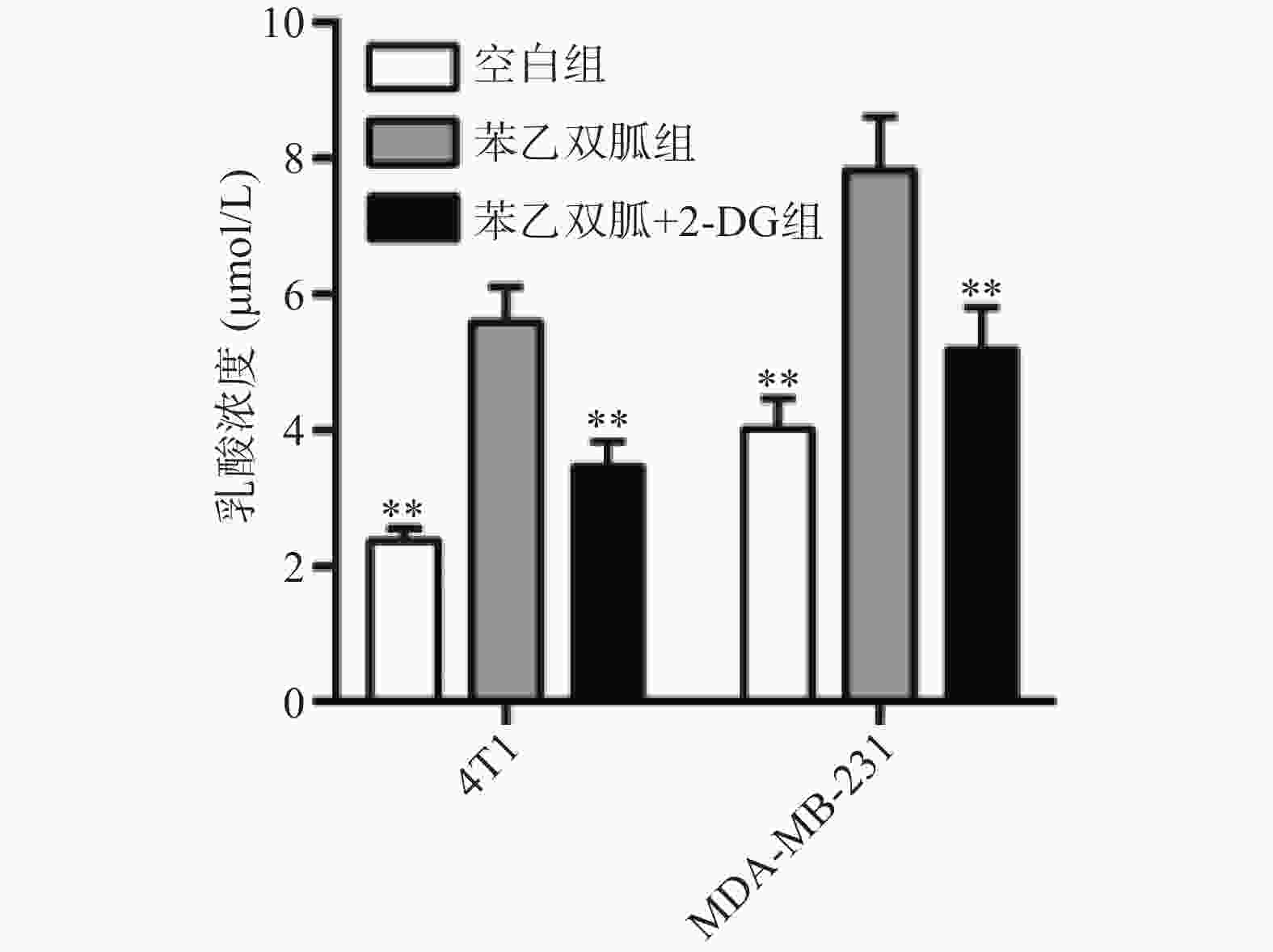
由于苯乙双胍可上调4T1和MDA-MB-231细胞的有氧糖酵解,因此当我们联用低剂量的己糖激酶抑制剂2-DG时,三阴性乳腺癌细胞会发生什么变化呢?结果显示,与空白组相比,单用苯乙双胍或2-DG均能显著降低4T1与MDA-MB-231细胞存活率(P<0.01)(表1,图3);与苯乙双胍或2-DG单药组相比,苯乙双胍联用2-DG,即使降低90%剂量,仍然可以显著降低4T1与MDA-MB-231细胞的存活率(P<0.001)(表1,图3),以上结果表明,苯乙双胍联用2-DG能显著促进三阴性乳腺癌细胞的凋亡。与此同时,检测细胞上清液中的乳酸含量,相比苯乙双胍组(5.59±0.52,7.83±0.78,n=3)μmol/L,苯乙双胍与2-DG联用组(3.46±0.37,5.18±0.62,n=3)μmol/L细胞的乳酸产量也大幅下降(P < 0.01)(图4)。
表 1 苯乙双胍联合2-DG对三阴性乳腺癌细胞凋亡的影响[`x±s , n = 3,存活率(%)]
组别 4T1 MDA-MB-231 空白组(PBS) 96.37±2.31 97.63±1.46 苯乙双胍组(100 μmol/L) 86.70±1.83 * 85.53±1.46 ** 2-DG(2 mmol/L) 81.27±2.16** 80.67±4.07** 苯乙双胍+2-DG组(苯乙双胍:
10 μmol/L,2-DG: 200 μmol/L)64.63±2.28*** 51.97±2.29*** *P<0. 05,**P<0.01,***P<0.001,与空白组比较 -
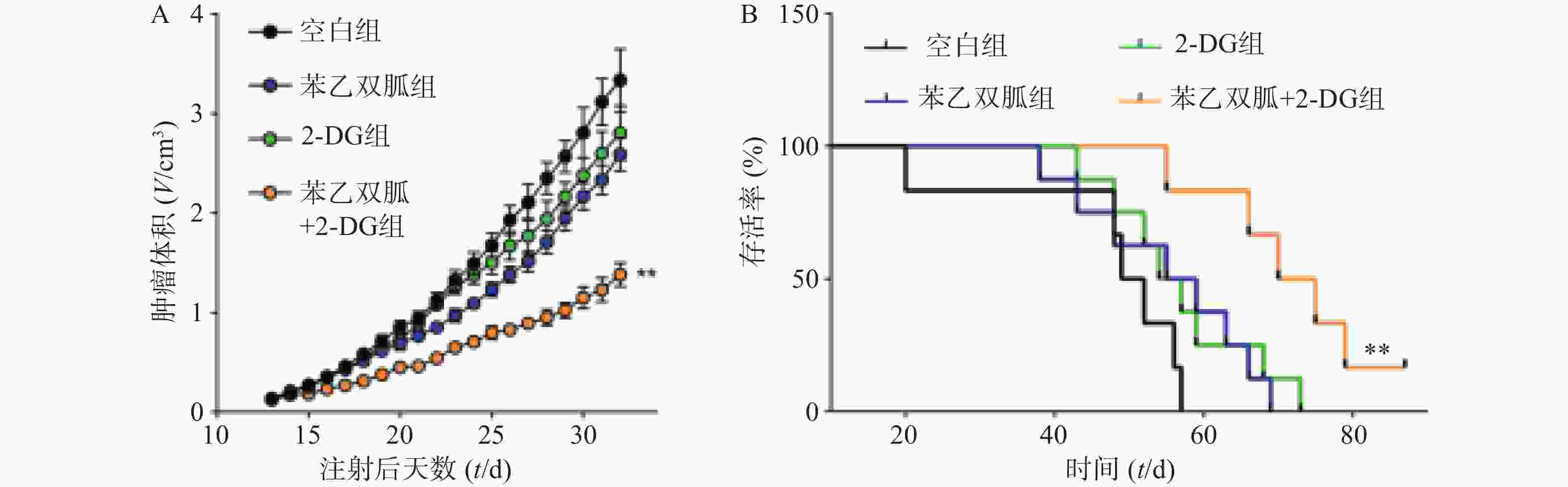
为了进一步验证苯乙双胍联合2-DG在体内抗肿瘤的效果,我们将4T1细胞原位接种到小鼠乳腺脂肪垫中,并分别给予单药治疗或联合治疗,观察肿瘤的生长速度以及荷瘤小鼠的生存时间。结果显示,与苯乙双胍或2-DG单药组相比,苯乙双胍联合2-DG组可显著抑制荷瘤小鼠体内肿瘤的生长速度(P<0.01)(图5A)。此外,苯乙双胍联合2-DG组荷瘤小鼠中位生存时间为72.5 d,高于苯乙双胍组(57 d)、2-DG组(55.5 d)、空白组组(50.5 d),差异有统计学意义(P<0.01)(图5B),表明苯乙双胍联合2-DG可以延长荷瘤小鼠生存时间。
-
二甲双胍等双胍类糖尿病治疗药物,能够通过抑制线粒体复合物I来降低细胞内ATP水平。线粒体复合物I的损伤会降低NADH氧化为NAD+,这是维持TCA循环功能的关键反应,并最终导致抑制氧化磷酸化。前期研究表明,二甲双胍表现出显著的抗肿瘤作用。苯乙双胍与二甲双胍具有非常相似的代谢特征,而苯乙双胍的效力更强[17-18]。由于乳酸性酸中毒病死率高,2型糖尿病临床治疗不再使用苯乙双胍作为一线药物[19]。 然而作为一种抗癌药物,因其较低的有效剂量和较短的疗程,与糖尿病临床治疗大有不同,苯乙双胍被认为最有希望替代二甲双胍的双胍类药物[20-22]。
本研究采用小鼠三阴性乳腺癌细胞系4T1和人三阴性乳腺癌细胞系MBA-MD-231作为研究对象,发现苯乙双胍可显著抑制其线粒体氧化磷酸化,并上调肿瘤细胞的糖酵解。当加入己糖激酶抑制剂2-DG时,糖酵解途径被阻断,肿瘤细胞被迫使用氧化磷酸化来获取ATP,在此情况下,细胞对苯乙双胍更加敏感。基于该项发现,采用苯乙双胍联用2-DG治疗三阴性乳腺癌细胞。动物体内外结果表明,苯乙双胍联用2-DG可显著增加4T1细胞和MBA-MD-231细胞的死亡率,并延长荷瘤小鼠的生存时间。除了对这两种糖代谢方式双重抑制作用外,联用2-DG带来的另一个优势是可大大降低苯乙双胍的使用剂量,从而减轻苯乙双胍代谢产生的乳酸对机体的不良作用。
综上所述,通过苯乙双胍联用2-DG,可显著增强苯乙双胍对三阴性乳腺癌的凋亡作用,并降低其使用剂量,减轻不良反应,这一发现为三阴性乳腺癌的临床治疗提供新的策略。
Hexokinase inhibitor 2-deoxyglucose combined with phenformin induces cell apoptosis of triple-negative breast cancer
-
摘要:
目的 探讨降糖药物苯乙双胍联合己糖激酶抑制剂2-脱氧葡萄糖(2-DG)对三阴性乳腺癌细胞4T1和MDA-MB-231凋亡作用的影响。 方法 苯乙双胍单独或联合2-DG处理4T1与MDA-MB-231细胞48 h,用SRB法检测细胞的增殖,流式细胞术检测细胞凋亡,试剂盒检测培养上清液中葡萄糖消耗量和乳酸含量,多功能化学发光仪检测线粒体呼吸链复合物I活性,海马能量检测仪测定细胞线粒体耗氧量(OCR)。 结果 苯乙双胍组的4T1与MDA-MB-231细胞上清液己糖激酶表达量(4.6±0.17,3.73±0.21),葡萄糖消耗量(356±31,397±42)μg/105个细胞,乳酸浓度(5.59±0.52,7.83±0.78)μmol/L均高于空白组的已糖激酶表达量(1±0.15,1±0.12),葡萄糖消耗量(289±25,301±32)μg/105个细胞,乳酸浓度(2.37±0.18,4.01±0.45)μmol/L(P < 0.01);苯乙双胍联用2-DG组的细胞存活率(64.63±2.28,51.97±2.29)% ,即使降低90%剂量,仍高于苯乙双胍组(86.70±1.83,85.53±1.46)%(P<0.001),两药联用极大地促进了4T1与MDA-MB-231细胞的凋亡,此外,相比于苯乙双胍组(5.59±0.52,7.83±0.78)μmol/L,苯乙双胍与2-DG联用组(3.46±0.37,5.18±0.62)μmol/L细胞的乳酸产量也大大下降(P<0.01);与苯乙双胍或2-DG单药组相比,苯乙双胍联合2-DG组可显著抑制荷瘤小鼠体内肿瘤的生长速度(P<0.01);苯乙双胍联合2-DG组荷瘤小鼠中位生存时间72.5 d,高于苯乙双胍组57 d、2-DG组55.5 d(P<0.01),苯乙双胍联合2-DG可以延长荷瘤小鼠生存时间。 结论 己糖激酶抑制剂2-DG显著增强了苯乙双胍对三阴性乳腺癌细胞的治疗作用。 Abstract:Objective To investigate the effect of phenformin combined with hexokinase inhibitor 2-deoxyglucose (2-DG) on the treatment of triple-negative breast cancer cell lines 4T1 and MDA-MB-231. Methods Following treatment with phenformin, 2-DG or phenformin combined with 2-DG on 4T1 and MDA-MB-231 cells for 48 h, the cell proliferation in each group was detected by SRB and the apoptosis of cells was detected by flow cytometry. The concentration of glucose and lactic acid in cell culture supernatant was detected by ELISA. The activity of mitochondrial respiratory chain complex Ⅰ was detected by FlexStation3 and the mitochondrial oxygen consumption (OCR) was assayed with the Seahorse X Fe Analyzer. Results The hexokinase expression (4.6±0.17,3.73±0.21), glucose consumption (356±31, 397±42) μg/105 cells , Lactic acid concentration (5.59±0.52, 7.83±0.78) μmol/L in the supernatant of 4T1 and MDA-MB-231 cells in Phenformin group were higher than that in control group ( 1±0.15, 1±0.12 ) , ( 289±25, 301±32) μg/105cells , ( 2.37±0.18, 4.01±0.45) μmol/L (P < 0.01). Even if the dose was reduced by 90%, the cell viability of phenformin combined with 2-DG group (64.63±2.28, 51.97±2.29) % was still higher than that of phenformin group (86.70±1.83, 85.53±1.46) % (P<0.001). The combination of the two drugs significantly promoted the apoptosis of 4T1 and MDA-MB-231. In addition, compared with the phenformin group (5.59±0.52, 7.83±0.78) μmol/L, the phenformin combined with 2-DG group (3.46±0.37, 5.18±0.62) μmol/L cell lactic acid production also greatly reduced (P<0.01). Compared with the phenformin or 2-DG single-drug group, the phenformin combined with 2-DG group can significantly inhibit the growth rate of tumors in tumor-bearing mice (P<0.01). The median survival time of tumor-bearing mice in the phenformin combined with 2-DG group was 72.5 d, which was higher than that in the phenformin group 57 d and 2-DG group 55.5 d (P<0.01). Conclusion Hexokinase inhibitor 2-DG significantly enhances the therapeutic effects of phenformin on triple-negative breast cancer cells. -
表 1 苯乙双胍联合2-DG对三阴性乳腺癌细胞凋亡的影响[`x±s , n = 3,存活率(%)]
组别 4T1 MDA-MB-231 空白组(PBS) 96.37±2.31 97.63±1.46 苯乙双胍组(100 μmol/L) 86.70±1.83 * 85.53±1.46 ** 2-DG(2 mmol/L) 81.27±2.16** 80.67±4.07** 苯乙双胍+2-DG组(苯乙双胍:
10 μmol/L,2-DG: 200 μmol/L)64.63±2.28*** 51.97±2.29*** *P<0. 05,**P<0.01,***P<0.001,与空白组比较 -
[1] GARRIDO-CASTRO A C, WINER E P. Predicting breast cancer therapeutic response[J]. Nat Med,2018,24(5):535-537. doi: 10.1038/s41591-018-0033-7 [2] KROP I, ISMAILA N, ANDRE F, et al. Use of biomarkers to guide decisions on adjuvant systemic therapy for women with early-stage invasive breast cancer: American Society Of Clinical Oncology Clinical Practice Guideline focused update[J]. J Clin Oncol,2017,35(24):2838-2847. doi: 10.1200/JCO.2017.74.0472 [3] SAVAS P, SALGADO R, DENKERT C, et al. Clinical relevance of host immunity in breast cancer: from TILs to the clinic[J]. Nat Rev Clin Oncol,2016,13(4):228-241. doi: 10.1038/nrclinonc.2015.215 [4] VAN 'T VEER L J, DAI H Y, VAN DE VIJVER M J, et al. Gene expression profiling predicts clinical outcome of breast cancer[J]. Nature,2002,415(6871):530-536. doi: 10.1038/415530a [5] BROWN L C, SALGADO R, LUEN S J, et al. Tumor-infiltrating lymphocyctes in triple-negative breast cancer: update for 2020[J]. Cancer J,2021,27(1):25-31. doi: 10.1097/PPO.0000000000000501 [6] INCORVAIA L, FANALE D, BONO M, et al. BRCA1/2 pathogenic variants in triple-negative versus luminal-like breast cancers: genotype-phenotype correlation in a cohort of 531 patients[J]. Ther Adv Med Oncol, 2020, 12: 1758835920975326. [7] ZACKSENHAUS E, SHRESTHA M, LIU J C, et al. Mitochondrial OXPHOS induced by RB1 deficiency in breast cancer: implications for anabolic metabolism, stemness, and metastasis[J]. Trends Cancer,2017,3(11):768-779. doi: 10.1016/j.trecan.2017.09.002 [8] LORD S R, CHENG W C, LIU D, et al. Integrated pharmacodynamic analysis identifies two metabolic adaption pathways to metformin in breast cancer[J]. Cell Metab,2018,28(5):679-688.e4. doi: 10.1016/j.cmet.2018.08.021 [9] ICARD P, LOI M, WU Z R, et al. Metabolic strategies for inhibiting cancer development[J]. Adv Nutr,2021:nmaa174. [10] FLORY J, LIPSKA K. Metformin for type 2 diabetes-reply[J]. JAMA,2019,322(13):1313. [11] SCHULTEN H J. Pleiotropic effects of metformin on cancer[J]. Int J Mol Sci,2018,19(10):E2850. doi: 10.3390/ijms19102850 [12] CIOCE M, PULITO C, STRANO S, et al. Metformin: metabolic rewiring faces tumor heterogeneity[J]. Cells,2020,9(11):E2439. doi: 10.3390/cells9112439 [13] DYKENS J A, JAMIESON J, MARROQUIN L, et al. Biguanide-induced mitochondrial dysfunction yields increased lactate production and cytotoxicity of aerobically-poised HepG2 cells and human hepatocytes in vitro[J]. Toxicol Appl Pharmacol,2008,233(2):203-210. doi: 10.1016/j.taap.2008.08.013 [14] ENIA G, GAROZZO M, ZOCCALI C. Lactic acidosis induced by phenformin is still a public health problem in Italy[J]. BMJ,1997,315(7120):1466-1467. doi: 10.1136/bmj.315.7120.1466 [15] GARCÍA RUBIÑO M E, CARRILLO E, RUIZ ALCALÁ G, et al. Phenformin as an anticancer agent: challenges and prospects[J]. Int J Mol Sci,2019,20(13):E3316. doi: 10.3390/ijms20133316 [16] BERNIER G M, MILLER M, SPRINGATE C S. Lactic acidosis and phenformin hydrochloride[J]. JAMA,1963,184:43-46. [17] KONG H, RECZEK C R, MCELROY G S, et al. Metabolic determinants of cellular fitness dependent on mitochondrial reactive oxygen species[J]. Sci Adv,2020,6(45):eabb7272. doi: 10.1126/sciadv.abb7272 [18] MASOUD R, REYES-CASTELLANOS G, LAC S, et al. Targeting mitochondrial complex I overcomes chemoresistance in high OXPHOS pancreatic cancer[J]. Cell Rep Med,2020,1(8):100143. doi: 10.1016/j.xcrm.2020.100143 [19] OWEN M R, DORAN E, HALESTRAP A P. Evidence that metformin exerts its anti-diabetic effects through inhibition of complex 1 of the mitochondrial respiratory chain[J]. Biochem J, 2000, 348(Pt 3): 607-614. [20] FEARNLEY G R, CHAKRABARTI R, EVANS J F. Effect of ethyloestrenol combined with phenformin or with metformin on platelet stickiness and serum-cholesterol in patients with occlusive vascular disease[J]. Lancet,1968,2(7576):1004-1007. [21] SHACKELFORD D B, ABT E, GERKEN L, et al. LKB1 inactivation dictates therapeutic response of non-small cell lung cancer to the metabolism drug phenformin[J]. Cancer Cell,2013,23(2):143-158. doi: 10.1016/j.ccr.2012.12.008 [22] DI MAGNO L, MANNI S, DI PASTENA F, et al. Phenformin inhibits hedgehog-dependent tumor growth through a complex I-independent redox/corepressor module[J]. Cell Rep,2020,30(6):1735-1752. doi: 10.1016/j.celrep.2020.01.024 -




 下载:
下载: