-
烟酰胺腺嘌呤二核苷酸(NAD)是一种经典辅酶,对线粒体电子转移反应至关重要,在许多生物学功能中起着关键作用[1]。烟酰胺单核苷酸(NMN)是NAD生物合成的关键中间体。NMN在心脑血管疾病、肝肾功能、血管和内皮功能,以及免疫和炎症、衰老等各类疾病治疗方面都具有相当强的潜力[2],常被人称为“万能药”。NMN能够通过口服、静脉注射、腹腔注射(小鼠)等多种给药途径进入体内,通常具有较高的安全性。在急性毒性实验中,小鼠连续7 d给予最大灌胃剂量和饱和浓度的NMN,每天1次,耐受性良好,除血清丙氨酸氨基转移酶略有升高外,其余生物标志物基本保持不变,而相同处理条件下的比格犬,会有轻度的肌酐和尿酸升高[3];在长期给药实验中,小鼠连续12个月给予100和300 mg/kg的NMN,均未出现不良反应[4]。在出血性休克治疗方面,对出血性休克大鼠模型,术前连续5 d的NMN饮水给药和术后静脉推注NMN均能缩短休克复苏时间和提高复苏后的存活率[5]。据报道[6-9],在炎症治疗方面,NMN及相关代谢产物烟酰胺核糖、烟酰胺都具有一定抗炎作用。
内毒素休克是由感染引起的全身炎症反应综合征,会导致各系统衰竭,包括循环系统、呼吸系统、血液系统,损害肝脏和肾脏功能[10]。相关研究显示,最佳的治疗时间在发病6 h内,能够提高患者的生存率,降低病死率[11]。目前临床内毒素休克以药物治疗为主(如血管活性药物、激素、抗菌素等)[12],同时辅以液体复苏、脑神经保护、吸氧等常规治疗。为便于对内毒素休克开展研究治疗,通常使用LPS进行内毒素休克动物造模,LPS是G-菌细胞壁外膜上的主要成分,也叫内毒素,能引起严重的炎症级联反应,是G-菌的主要致病成分之一[13]。
目前,NMN对内毒素休克的治疗作用尚未知。本研究旨在探究NMN对LPS诱导的内毒素休克小鼠模型的死亡率影响,为阐明NMN在内毒素休克治疗方面的作用提供线索。
-
烟酰胺单核苷酸[NMN,纯度≥95%,−25~−15 ℃保存,邦泰生物工程(深圳)有限公司];烟酰胺单核苷酸[NMN~,纯度≥95%,2~8 ℃保存,尚科生物医药(上海)有限公司];脂多糖(LPS,美国Sigma公司);BT25S精密电子天平[赛多利斯科学仪器(北京)有限公司];独立通风系统(上海鸣励实验室科技发展有限公司)。
-
SPF级8周龄雄性C57BL/6J小鼠(西普尔-必凯实验动物有限公司)。实验前在相对洁净的环境下使用独立通风系统,将动物适应性饲养2周。期间动物自由饮水、进食。笼具内温度22~26 ℃、湿度40%~70%,笼内维持正压20~25 Pa,每小时换气次数60~70次,室内明暗交替12 h(8:00~20:00照明)。
-
根据不同实验目的,将C57BL/6J小鼠随机分为给药组和对照组。腹腔注射LPS(10 mg/kg)进行内毒素休克造模,在造模前或者造模后进行NMN腹腔注射给药,给药方式分为单次给药和两次给药方式。具体分成5个实验:①造模后0.5 h给药,剂量为10、30、100、300 mg/kg;②造模前0.5 h给药,剂量为30、100、300、600 mg/kg;③造模后0.5 h和12 h两次给药,每次300 mg/kg;④造模后0.5 h和12 h分别用2种不同厂家的NMN给药,剂量为300 mg/kg;⑤造模前0.5 h用不同厂家的NMN给药,剂量为300 mg/kg。
-
使用Log-rank检验,对给药组和溶剂对照组的生存曲线进行比较,P<0.05为差异有统计学意义,使用GraphPad Prism8软件对数据进行统计分析。
-
如图1所示,LPS造模后0.5 h给予300 mg/kg NMN组小鼠首次出现死亡的时间比生理盐水组更早,整个观察期间给药组小鼠死亡的总体趋势要稍快于生理盐水组,且在观察末期存活的动物数量略少。但两组生存曲线之间比较无统计学差异(P=0.2161)。因此,LPS造模后0.5 h给予300 mg/kg NMN不具有治疗内毒素休克的作用,甚至有轻微增加内毒素休克死亡率的趋势。
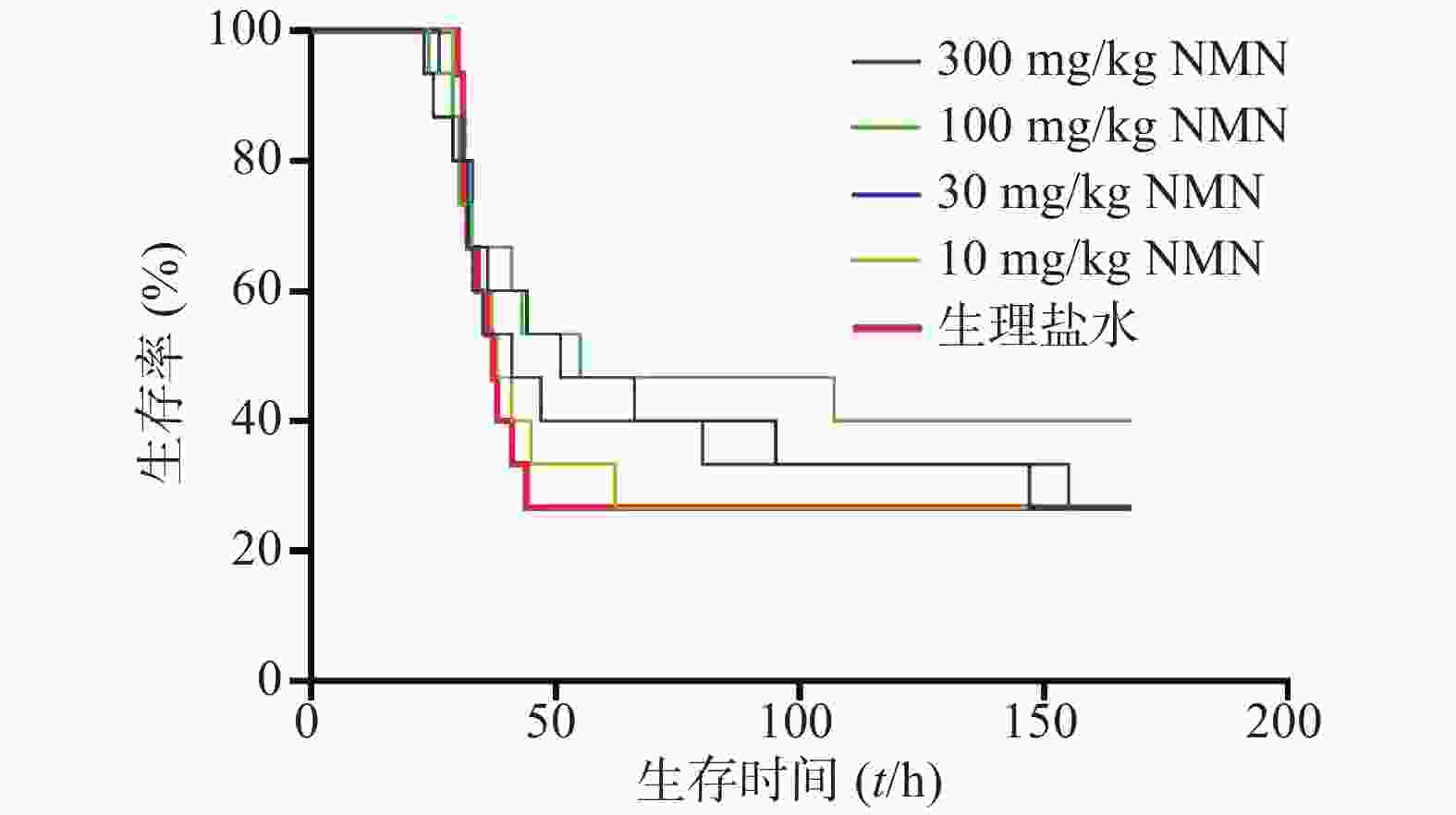
实验进一步考察了LPS造模后0.5 h给予多个不同剂量NMN对内毒素休克死亡率的影响,如图2所示,与生理盐水组相比,10、30、100、300 mg/kg NMN给药组的小鼠首次出现死亡的时间均接近,各组中位生存时间:300、100、30、10 mg/kg给药组分别为51、55、41和38 h,生理盐水组为37 h。整个观察期间NMN给药各组死亡速度较生理盐水组稍缓,其中放缓趋势最明显的是100 mg/kg剂量组,但均不具有统计学意义(P=0.4334),表明小鼠在LPS造模后0.5 h单次给予NMN不能改善内毒素休克死亡率或减缓死亡速度。
-
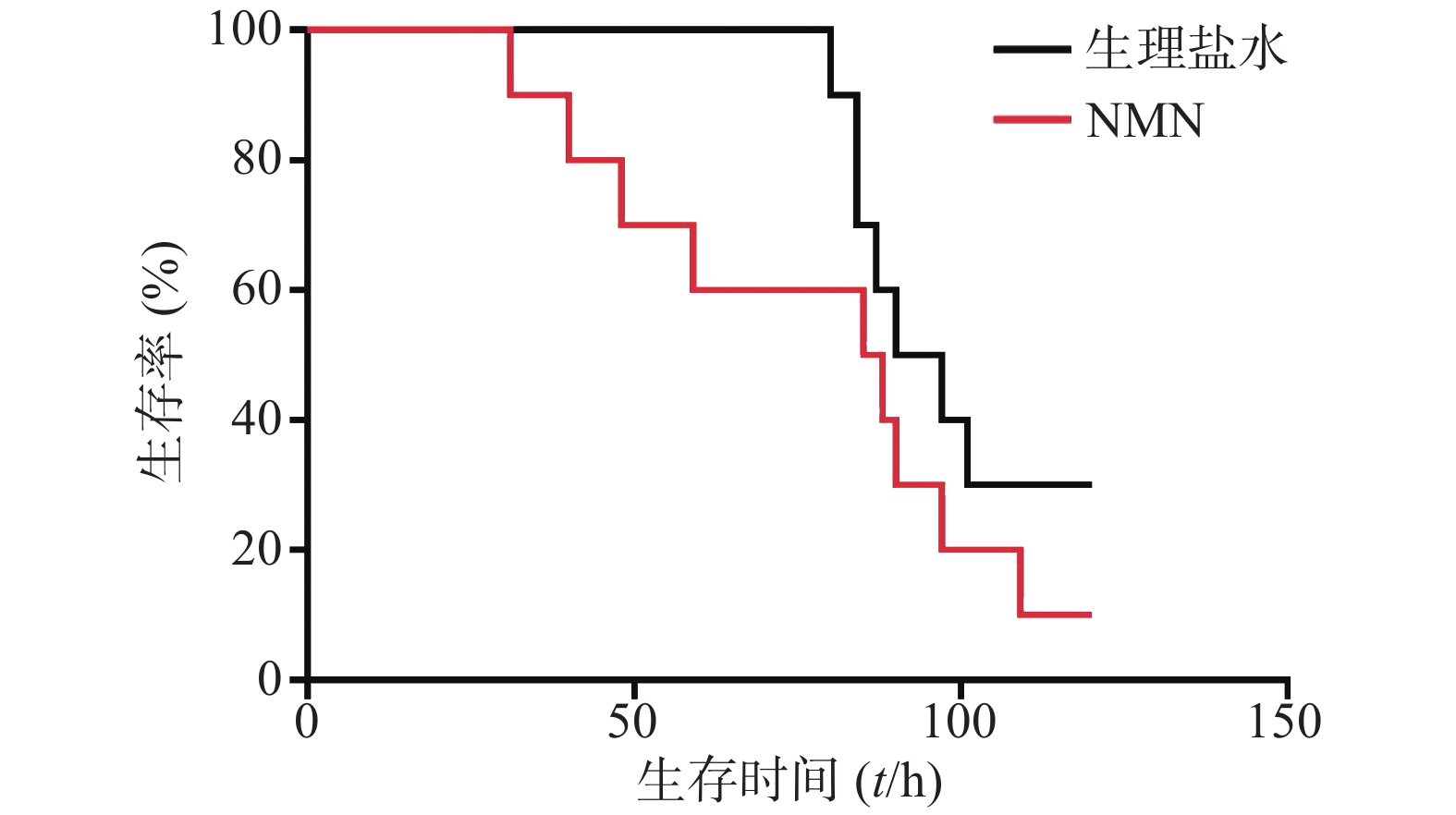
在LPS造模前0.5 h进行NMN给药。如图3所示,300 mg/kg NMN预防给药组小鼠首次出现死亡的时间稍早于生理盐水组,而2组死亡的总体趋势相近,前者的中位生存时间为83 h,后者为91 h,生存曲线比较无统计学差异(P=0.5946),故LPS造模前0.5 h给予300 mg/kg NMN不能改善内毒素休克小鼠的死亡率,不具有防治作用。
随后又进行多个不同剂量NMN单次预给药实验。如图4所示,NMN 30、100、300、600 mg/kg组与生理盐水组小鼠首次出现死亡的时间均相近,之后各组死亡趋势也类似,各组中位生存时间分别是:NMN给药组30 mg/kg为34 h、100 mg/kg为43 h、300 mg/kg为40 h、600 mg/kg为55 h,生理盐水组为37 h,各组生存曲线也无统计学意义。结果表明,在造模前进行NMN单次预给药对于LPS构建的内毒素休克模型无明显改善生存率的作用。
-
考虑到NMN在体内的代谢速度较快,能够迅速入血进入各个组织器官并代谢为活性分子NAD,而NAD被证明在多种炎症性疾病中具有保护作用,因此,观察NMN的2次给药是否对内毒素休克有治疗效果。
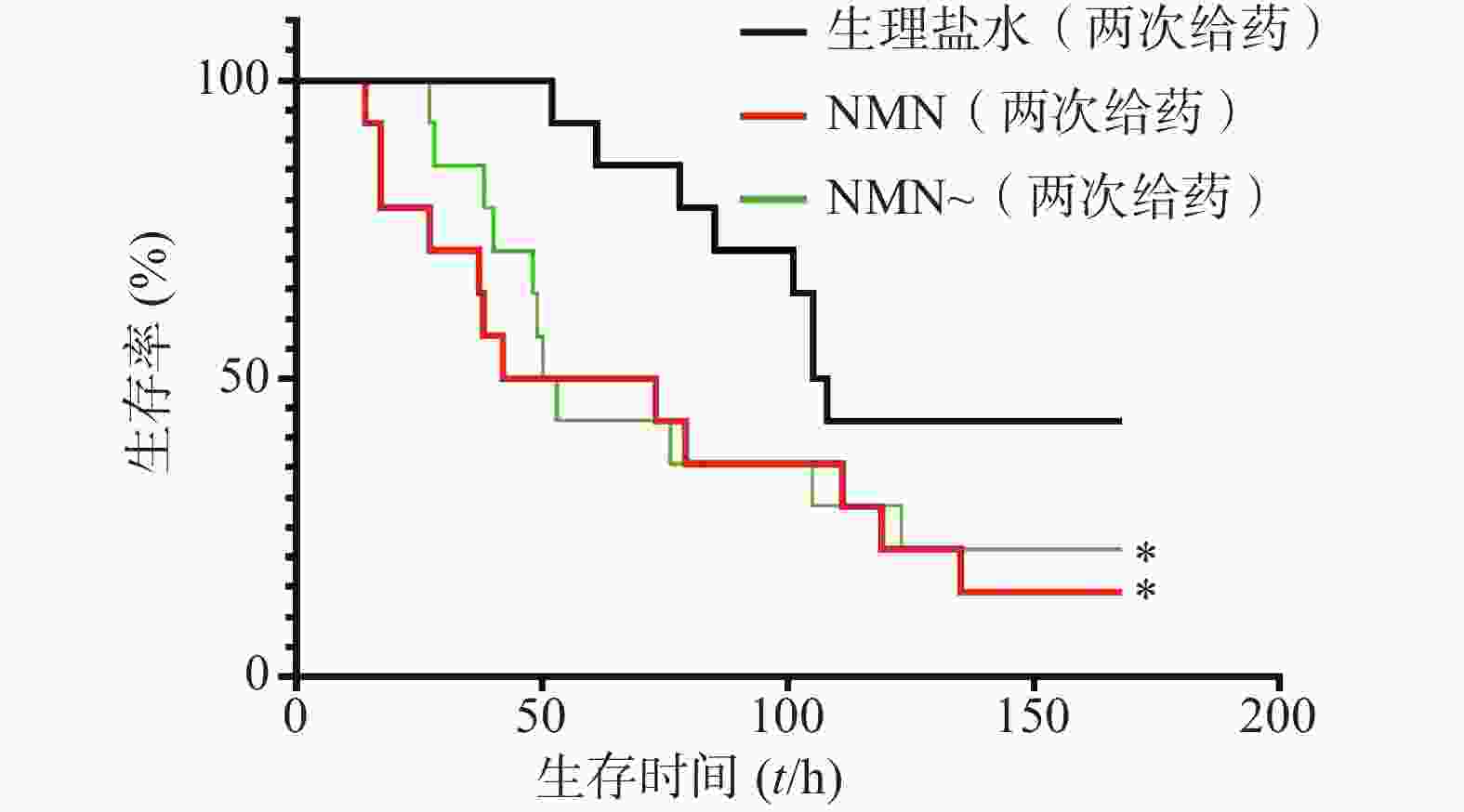
如图5所示,2次重复实验结果均表明,LPS造模后0.5 h和12 h,给予2次NMN(每次300 mg/kg)治疗组小鼠其首次出现死亡的时间早于生理盐水组;之后,NMN治疗组小鼠死亡速度明显快于对照组,且观察末期NMN治疗组小鼠存活率不及对照组一半,2次重复实验的生存曲线间均具有统计学差异(P=0.0404;P=0.0038)。因此,该结果表明,LPS造模后2次NMN给药明显增加小鼠内毒素休克死亡率。
-
不同厂家生产的NMN因药物纯度、杂质成分不同等,可能导致治疗效果有差别。为排除非药物分子本身因素如厂家生产工艺因素,进一步明确上述NMN治疗内毒素休克的作用,接着引入另一厂家生产的NMN(以下均简称NMN~),并同时测试比较两家NMN产品治疗内毒素休克的效果。
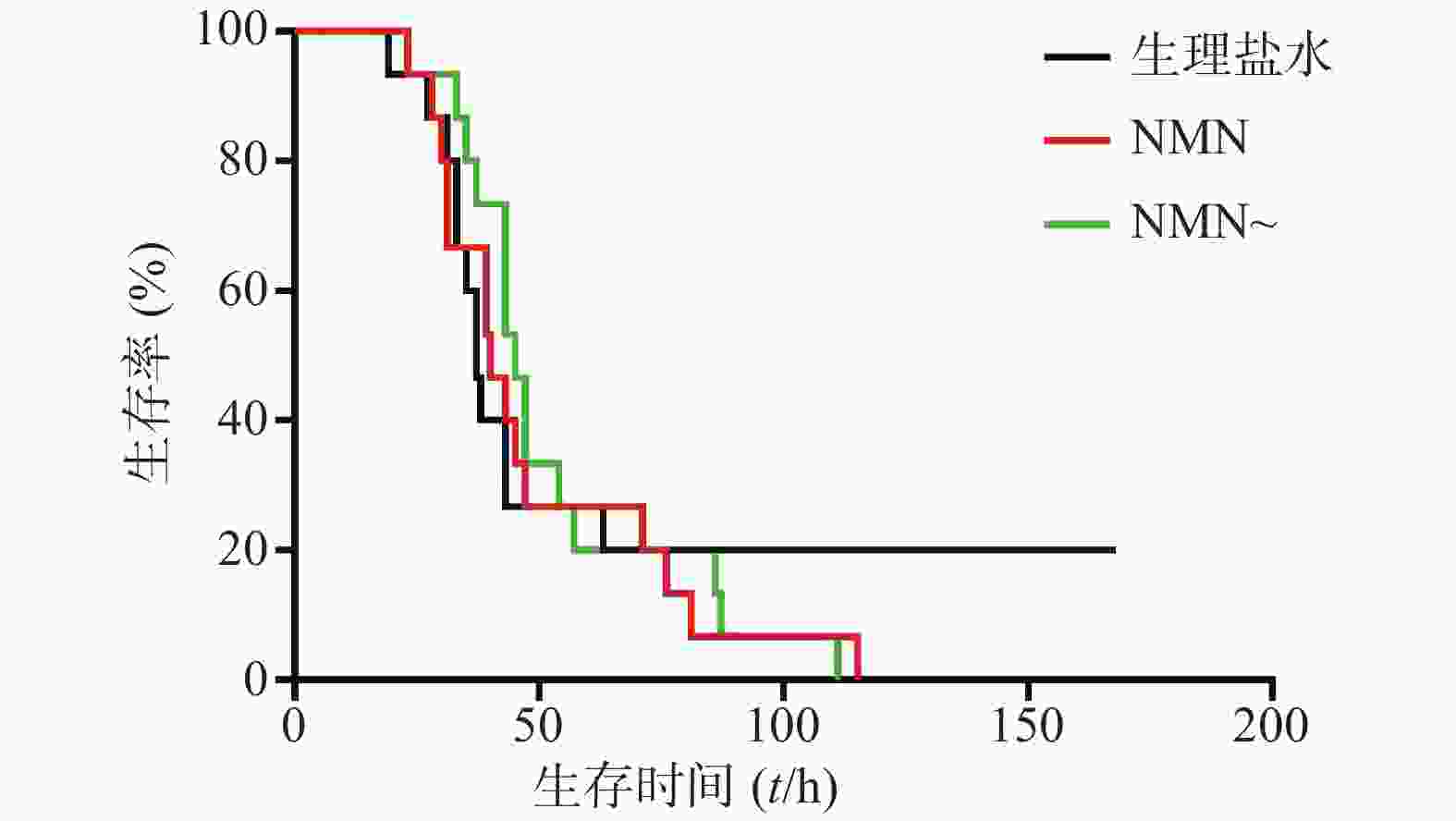
实验首先对LPS造模后0.5 h和12 h的2次给予NMN(每次300 mg/kg)增加内毒素休克死亡率的作用进行了验证。如图6所示,NMN给药组和NMN~给药组这2组小鼠首次出现死亡的时间和观察末期小鼠存活数都接近,整个观察期小鼠死亡趋势非常相似,与生理盐水对照组相比,两组都明显加重内毒素休克小鼠的死亡率,与对照组的生存曲线间均有统计学差异(P=0.0499;P=0.0260)。3组中位生存时间分别是:NMN给药组57.5 h、NMN~给药组51.5 h、生理盐水组106.5 h。此外,该结果与上述单个NMN产品连续2次给药效果类似(图5)。因此,两家NMN产品效果基本相同,也进一步证明了LPS造模后0.5 h和12 h的2次给予NMN(每次300 mg/kg)确实可加重内毒素休克病情,加速小鼠的死亡。
最后,实验又考察了两家NMN产品预防给药效果,即在LPS造模前0.5 h进行NMN或NMN~给药。如图7所示,NMN组、NMN~组、生理盐水组3组小鼠首次出现死亡的时间及之后每组小鼠死亡的速度都相近,直至每组均剩20%小鼠存活(第71小时)。之后,生理盐水组小鼠不再死亡,而NMN组、NMN~组小鼠陆续死亡殆尽。3组中位生存时间分别是:NMN给药组40 h、NMN~给药组45 h、生理盐水组37 h。可见,两家NMN产品作用相似,对LPS所致的内毒素休克无治疗效果,且与生理盐水组比较时均有加重内毒素休克死亡率的趋势,但是均无统计学意义(P=0.6447;P=0.9725)。该结果与上述NMN单次预防给药的实验结果相一致(图3和图4)。
-
目前NMN是保健品领域的开发热点,以抗衰老以及各类疾病治疗作用为目的,在国内外已有不少人开始服用NMN[14]。但是NMN对内毒素休克的作用尚未知,对患有这种疾病的患者能否服用NMN亦不清楚。
根据现有的研究报道,NMN在小鼠疾病模型其腹腔注射给药的有效剂量为10~600 mg/kg[2, 4]。本实验中,我们测试了不同NMN剂量尤其是300 mg/kg时对小鼠内毒素休克的治疗效果,结果显示,小鼠在LPS造模后0.5 h或造模前0.5 h单次给予不同剂量NMN均无明显改善生存率的作用,不具有治疗效果;甚至在LPS造模后两次NMN给药明显增加小鼠内毒素休克死亡率。为排除厂家生产工艺等因素,我们又同时用两个厂家生产的NMN产品进行实验,以重复上述结果,最终再次证明LPS造模后两次给予NMN确实可加速小鼠的死亡,增加死亡率。
因此,本次实验结果表明,NMN在某些疾病尚未证明其安全性的情况下,应谨慎推广,尤其是内毒素休克的患者,应慎用甚至是禁用NMN治疗。
Effect of nicotinamide mononucleotide on mortality of mice with endotoxic shock
-
摘要:
目的 探究烟酰胺单核苷酸(NMN)对脂多糖(LPS)诱导的内毒素休克小鼠死亡率的影响。 方法 将10周龄C57BL/6J雄性小鼠随机分组,均腹腔注射LPS(10 mg/kg)造模。NMN腹腔注射给药,分为3种方式:①造模后0.5 h给药,剂量为10、30、100、300 mg/kg;②造模前0.5 h给药,剂量为30、100、300、600 mg/kg;③造模后0.5 h和12 h两次给药,每次300 mg/kg。观察记录每组小鼠的死亡情况,并绘制生存曲线。 结果 与溶剂对照组相比,造模后0.5 h或造模前0.5 h给予不同剂量NMN,均不能改善小鼠死亡率或延缓死亡时间;造模后0.5 h和12 h两次给予NMN会加速小鼠死亡,增加小鼠死亡率。两个厂家的NMN产品效果类似。 结论 NMN对LPS诱导的内毒素休克小鼠不具有治疗作用,小鼠内毒素休克发生后进行NMN多次给药会增加死亡率。 Abstract:Objective To study the effect of nicotinamide mononucleotide (NMN) on the mortality of the lipopoly-saccharide (LPS)-induced endotoxic shock mouse model. Methods 10-week-old C57BL/6J male mice were randomly divided into groups, and were injected intraperitoneally (i.p.) with LPS (10 mg/kg) to induce endotoxic shock models. NMN was i.p. injected in three ways: (1) 0.5 h after modeling, doses of 10, 30, 100 and 300 mg/kg; (2) 0.5 h before modeling, doses of 30, 100, 300 and 600 mg/kg; or (3) 0.5 and 12 h after modeling, dose of 300 mg/kg each time. The death times of each group were recorded, and the survival curves were drawn. Results Compared with the solvent control group, NMN at different doses given 0.5 h after or before modeling didn’t improve the survival rate or delay the death time of endotoxic shock mice; But when given at 0.5 and 12 h 300 mg/kg after modeling, NMN accelerated the death of mice and increased the mortality of mice. NMN products by two manufacturers showed similar effects. Conclusion NMN has no therapeutic effect on LPS-induced endotoxic shock, and repeated administration of NMN after endotoxic shock will increase the mortality. -
Key words:
- nicotinamide mononucleotide /
- lipopolysaccharide /
- endotoxic shock /
- mortality
-
[1] YOSHINO J, BAUR J A, IMAI S I. NAD+ intermediates: the biology and therapeutic potential of NMN and NR[J]. Cell Metab,2018,27(3):513-528. doi: 10.1016/j.cmet.2017.11.002 [2] HONG W Q, MO F, ZHANG Z Q, et al. Nicotinamide mononucleotide: a promising molecule for therapy of diverse diseases by targeting NAD+ metabolism[J]. Front Cell Dev Biol,2020,8:246. doi: 10.3389/fcell.2020.00246 [3] YOU Y N, GAO Y, WANG H, et al. Subacute toxicity study of nicotinamide mononucleotide via oral administration[J]. Front Pharmacol,2020,11:604404. doi: 10.3389/fphar.2020.604404 [4] MILLS K F, YOSHIDA S, STEIN L R, et al. Long-term administration of nicotinamide mononucleotide mitigates age-associated physiological decline in mice[J]. Cell Metab,2016,24(6):795-806. doi: 10.1016/j.cmet.2016.09.013 [5] SIMS C A, GUAN Y X, MUKHERJEE S, et al. Nicotinamide mononucleotide preserves mitochondrial function and increases survival in hemorrhagic shock[J]. JCI Insight,2018,3(17):120182. doi: 10.1172/jci.insight.120182 [6] MÉNDEZ-LARA K A, LETELIER N, FARRE N, et al. Nicotinamide prevents apolipoprotein B-containing lipoprotein oxidation, inflammation and atherosclerosis in apolipoprotein E-deficient mice[J]. Antioxidants,2020,9(11):1162. doi: 10.3390/antiox9111162 [7] MEHMEL M, JOVANOVIĆ N, SPITZ U. Nicotinamide riboside-the current state of research and therapeutic uses[J]. Nutrients,2020,12(6):1616. doi: 10.3390/nu12061616 [8] KISS T, NYÚL-TÓTH Á, BALASUBRAMANIAN P, et al. Nicotinamide mononucleotide (NMN) supplementation promotes neurovascular rejuvenation in aged mice: transcriptional footprint of SIRT1 activation, mitochondrial protection, anti-inflammatory, and anti-apoptotic effects[J]. Geroscience,2020,42(2):527-546. doi: 10.1007/s11357-020-00165-5 [9] HONG G L, ZHENG D, ZHANG L L, et al. Administration of nicotinamide riboside prevents oxidative stress and organ injury in Sepsis[J]. Free Radic Biol Med,2018,123:125-137. doi: 10.1016/j.freeradbiomed.2018.05.073 [10] 盛杰, 张福琴, 魏萍, 等. 抗菌药物诱导内毒素释放及抗内毒素药物研究进展[J]. 医药导报, 2004, 23(4):252-253. [11] 金泓, 赖旭东, 关信民, 等. 血必净注射液在脓毒血症治疗中的疗效观察[J]. 中医临床研究, 2017, 9(36):71-73. [12] 王洪亮, 章志丹, 黄伟. 拯救脓毒症运动: 脓毒症与感染性休克治疗国际指南(2016)的解读与展望[J]. 中华重症医学电子杂志, 2017, 3(1):26-32. [13] 张含飞, 张金龙, 王振华. 抗内毒素药物的研究进展[J]. 畜牧与饲料科学, 2008, 29(1):57-60. [14] IRIE J, INAGAKI E, FUJITA M, et al. Effect of oral administration of nicotinamide mononucleotide on clinical parameters and nicotinamide metabolite levels in healthy Japanese men[J]. Endocr J,2020,67(2):153-160. doi: 10.1507/endocrj.EJ19-0313 -




 下载:
下载: