-
冠状病毒(coronavirus,CoVs),在电子显微镜下呈“冠状”或冠状形态,因而命名为冠状病毒,可感染人类并容易引起急/慢性呼吸道系统疾病[1]。冠状病毒科分为α、β、γ和δ 4个属[2],已知感染人的冠状病毒共有7种,分别是HCoV-229E、HCoV-OC43、HCoV-NL63、HCoV-HKU1、SARS-CoV,MERS-CoV和SARS-CoV-2,其中,前4种病毒致病性较低,一般仅引起类似普通感冒的轻度感染,后3种对人类健康产生严重威胁,具有较高的致死率,分别是2003年出现的冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)感染的严重急性呼吸道综合征、2012年在中东地区出现高致病性冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)感染的中东呼吸综合征和2019年出现的一种新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染引起的肺炎(Corona Virus Disease 2019,COVID-19)[3]。
-
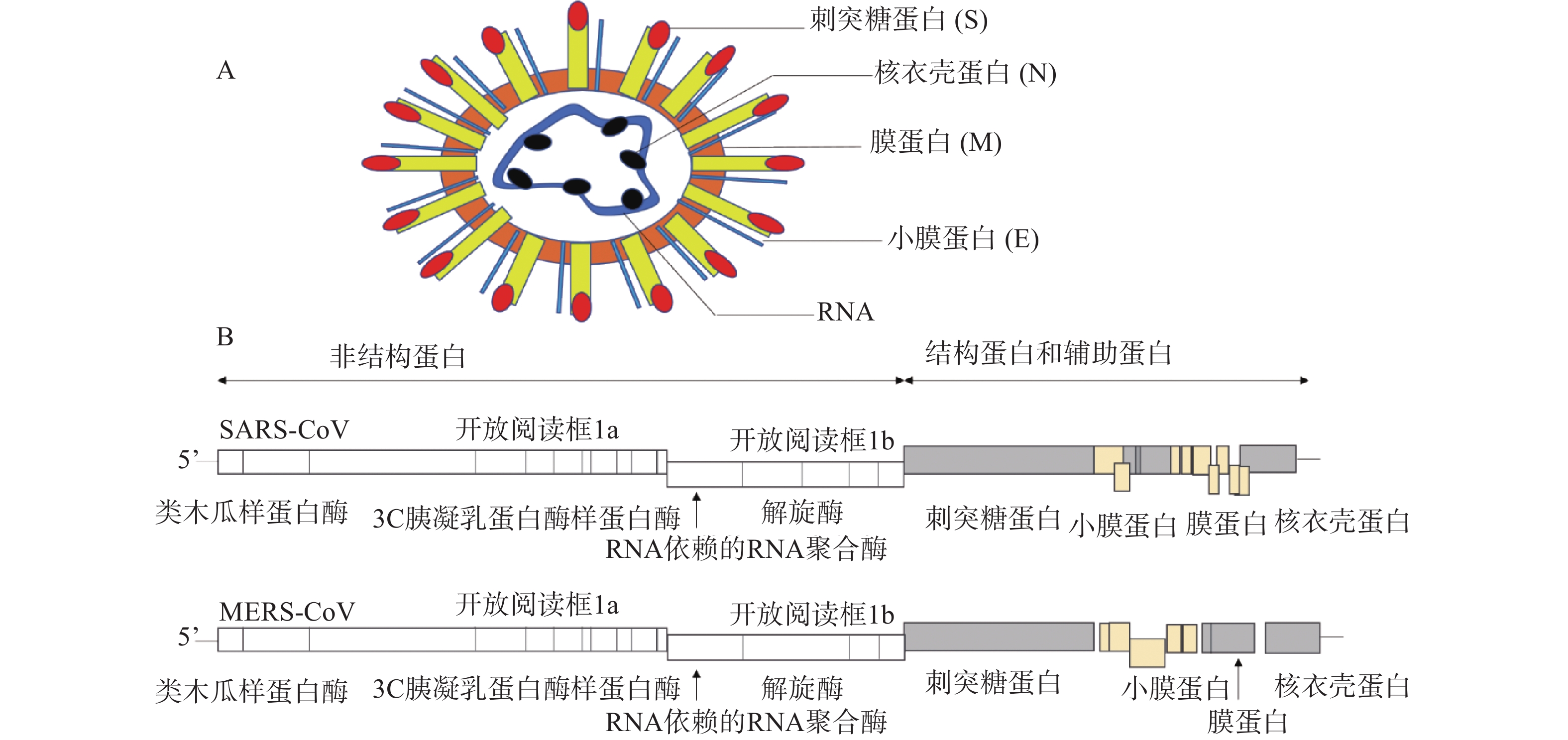
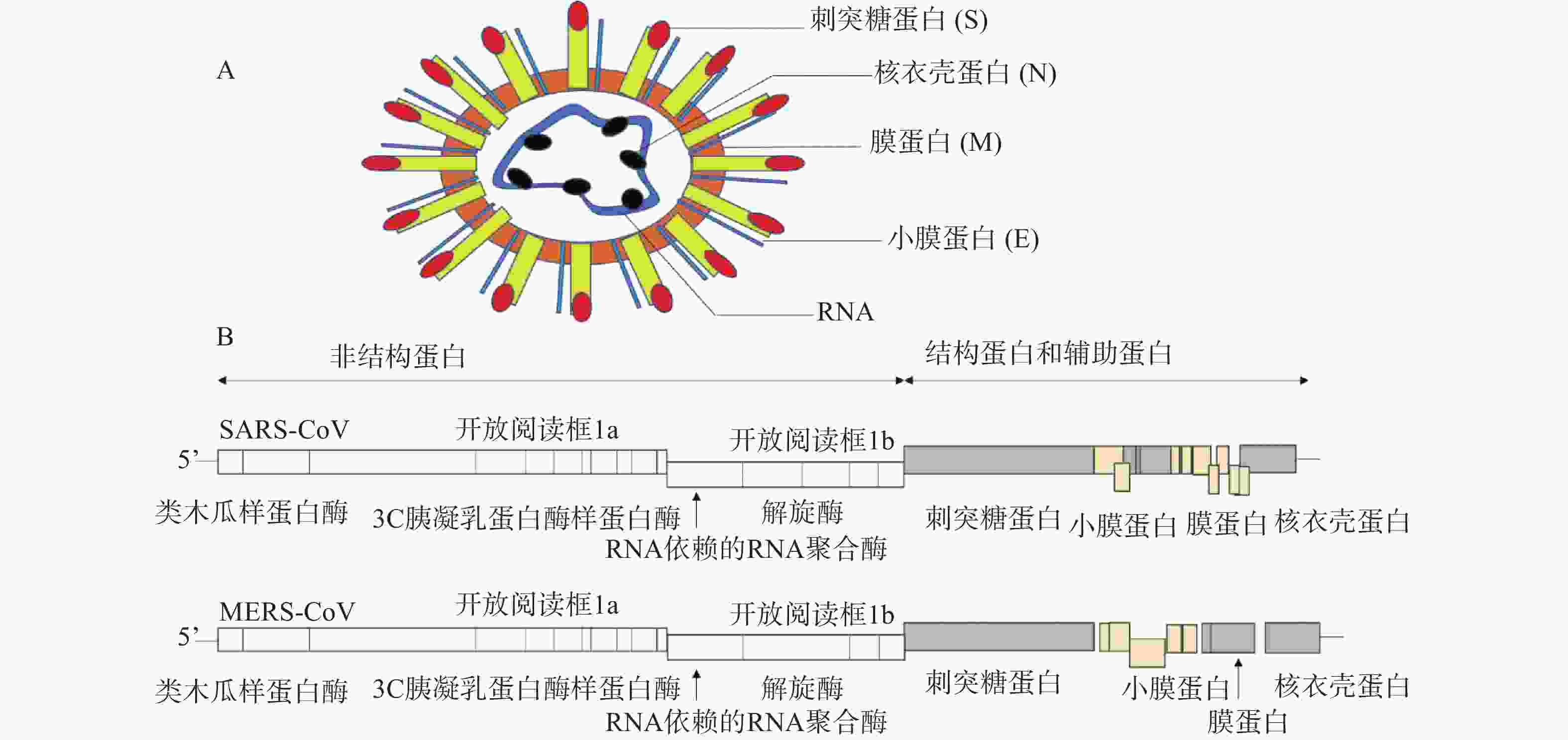
冠状病毒是一种包膜病毒,具有直径为120~160 nm的圆形或椭圆形病毒体[4]。冠状病毒粒子外包裹着脂肪膜,膜表面有3种糖蛋白,分别是刺突糖蛋白(spike glycoprotein,S 蛋白)、膜蛋白(membrane protein,M 蛋白)和小膜蛋白(envelope protein,E 蛋白)。其中,S蛋白是在病毒体表面上形成配体的I型糖蛋白,介导与宿主受体的连接,由S1和S2两个亚基组成;M蛋白是一种前蛋白,主要参与病毒的装配过程;E蛋白是一种高度疏水的蛋白,可促进病毒的组装和释放。病毒的基因组RNA与核衣壳蛋白(nucleocapsid,N蛋白)在病毒膜内复合形成螺旋衣壳(图1A)。
冠状病毒RNA基因组是不分段的单股正链RNA,大小为26~32 kb,是RNA病毒中基因组最大的病毒[5]。冠状病毒的基因顺序一致,为5'-复制酶-S-E-M-N-3',其中,RNA 5'端为被封端,具有甲基化的帽状结构,3'端被聚腺苷酸化,具有poly(A)尾巴,具有传染性。从5'端开始,基因组长度的2/3(长度:20~22 kb)区域由两个重叠的开放阅读框(open reading frame)1a和1b组成,共同起着病毒RNA聚合酶(Pol)的作用,编码翻译成两个多肽,pp1a和pp1ab[6]。这些多聚蛋白酶包括:类木瓜样蛋白酶(papain-like protease,PLpro)、3C胰凝乳蛋白酶样蛋白酶(3C chymotrypsin like protease, 3CLpro,也称为主蛋白酶,Mpro)、RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase, RdRp)和解旋酶(helcase,Hel)等[7]。对于所有冠状病毒,结构蛋白编码在3′端,占基因组的1/3,按S-E-M-N顺序排列(图1B)。
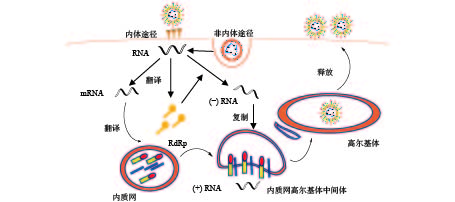
冠状病毒通过S蛋白附着在特定的细胞受体上,S1亚基和同源受体之间的特异性相互作用会触发S2亚基的构象变化,导致病毒包膜和细胞膜融合,并释放核衣壳进入细胞质;病毒在组织蛋白酶介导下与细胞表面受体结合以内体途径或细胞表面非内体途径进入宿主细胞,低pH和pH依赖性的半胱氨酸蛋白酶、组织蛋白酶可以促进冠状病毒通过内体途径进入宿主细胞[8]。病毒进入细胞后,正链RNA翻译产生负链RNA聚合酶前体蛋白,通过蛋白质水解过程产生RNA依赖性RNA聚合酶(RdRp);在RNA聚合酶的作用下,生成全长的反义负链模板。从负链亚基因组模板中合成亚基因组mRNAs;亚基因组mRNAs的翻译会产生病毒结构蛋白,在内质网(endoplasmic reticulum, ER)中进行病毒膜蛋白装配,并形成小泡运出。在内质网高尔基体中间体(ER-Golgi intermediate compartment, ERGIC)中被衣壳蛋白包裹的正链RNA与膜蛋白识别,小泡内卷,包住RNA。病毒通过高尔基体(golgi apparatus, GA)释放囊泡,囊泡与质膜融合释放病毒,病毒继续感染其他细胞(图2)。冠状病毒RNA在复制过程中,因纠正其错误复制的酶活性较低,很容易出现病毒错误复制,导致病毒变异株的出现。
冠状病毒的生命周期是一个复杂、连续、多步的过程,病毒配体S蛋白、与病毒转录复制相关的RdRp、PLpro和3CLpro等多种蛋白质和酶发挥关键作用,是治疗冠状病毒感染疾病的关键药物靶标,以它们为靶点,国内外研究者发现了一系列的小分子抑制剂[9-22],现分述如下。
-
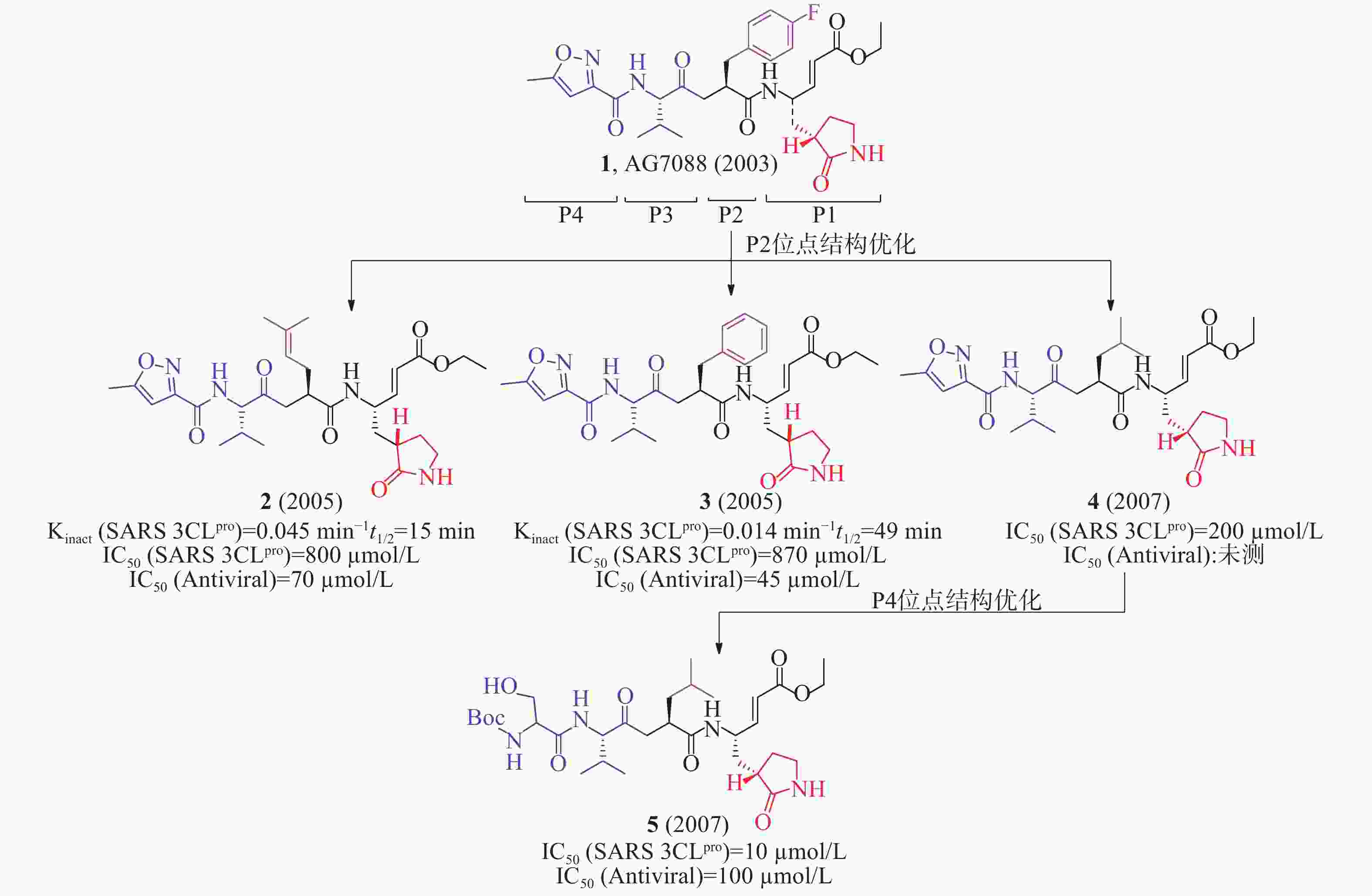
2003年,Hilgenfeld等报道了人冠状病毒(229E株)3CLpro(HCoV 229E 3CLpro)和猪传染性胃肠炎病毒(transmissible gastroenteritis virus, TGEV) 3CLpro的晶体结构,为抗冠状病毒药物研究提供了重要的结构生物学基础。Hilgenfeld等以此同源模建了SARS-CoV 3CLpro的三维结构,通过分子对接发现多肽类似物1(AG7088, rupintrivir,图3)可能对SARS-CoV 3CLpro具有良好的抑制活性[11]。该化合物原是一种鼻病毒3Cpro抑制剂,用于治疗普通感冒,但口服生物利用度低,需鼻腔给药,临床研究已终止[12]。
2005年,Mesecar等确定AG7088与SARS 3CLpro结合的晶体结构,为后续结构优化和构效关系研究提供了重要的结构生物学基础。根据AG7088与SARS-3CLpro的结构模式,AG7088可划分为P1~P4四个区域。以此为模板对P2位点进行改造,合成了一系列多肽类小分子抑制剂。用荧光共振能量转移法(fluorescence resonance energy transfer, FRET)酶水平活性研究表明,含有2-甲基丙烯基基团的化合物2(Kinact= 0.045/min,t1/2= 15 min, 图3)活性优于含有苯基基团的化合物3(Kinact= 0.014/min,t1/2= 49 min),提示P2位点对应SARS 3CLpro的空腔可以容纳较小侧链残基[13]。以此为模板对P4位点再进行改造,又合成了一系列多肽类小分子抑制剂。化合物4的IC50值为200 μmol/L,但抗病毒活性丧失;随后,以化合物4(图3)为先导,在P4位点优化获得的化合物5[IC50=10 μmol/L,IC50(antiviral)=100 μmol/L]比化合物4[IC50= 200 μmol/L,IC50(antiviral):未测]对SARS 3CLpro抑制活性和抗病毒活性更好。该化合物P4位点从原有的5-甲基异恶唑-3-基团变成1-[(叔丁氧羰基)氨基]-2-羟基乙烷-1-基团,易与SARS 3CLpro的谷氨酸(166)残基形成更多的氢键相互作用,有利于提高活性[14]。
2004年,Vederas等合成了一系列在α位带有邻苯二甲酰肼基团的酮-谷氨酰胺类似物,并测试其抑制抗SARS-CoV 3CLpro的活性。在酶水平系统构效关系表明:将三肽(Ac-Val-Thr-Leu)附着在谷氨酰胺上可产生更好的抑制剂6(IC50= 0.60 µmol/L,图4)[15]。2005年,Wong等以1为先导化合物,对其P1~P4位点优化设计,合成了一系列衍生物,其中,化合物7(图4)在酶水平对SARS-CoV 3CLpro的IC50值为1 µmol/L、Ki(inhibition constant)值为0.52 µmol/L,在感染了SARS-CoV的Vero E6细胞中测得的EC50值为0.11 µmol/L和CC50值>200 µmol/L,选择性指数(SI,selectivity index, CC50/EC50)>1 818[16]。
2006年,Hsu等发现了化合物8(Ki= 53 nmol/L,图4),在SARS-CoV感染的Vero E6细胞EC50值为0.6 µmol/L。通过解析化合物8与SARS 3CLpro结合的晶体结构,化合物8 P1位点醛基的羰基基团与SARS 3CLpro的Cys145共价结合形成C-S共价键、与SARS 3CLpro的Gly143和Cys145形成两个N-H氢键、P1位点五元环内酰胺基团与SARS 3CLpro的His163、Phe140、Glu166形成3个氢键,P2和P3位点的N-H键分别与Gln189和Glu166的羰基氧原子形成氢键、P3位点的羰基氧原子与SARS 3CLpro的Glu166的N-H键形成氢键,这些共价键作用和氢键作用使化合物8和SARS 3CLpro紧密结合[17]。
此外,国内外还报道了一系列多肽或多肽类似物作为SARS-CoV 3CLpro抑制剂。2008年,Rao等解析了SARS-CoV 3CLpro的突变体H41A晶体结构,发现了化合物9(Ki= 3.3 µmol/L,图5)在酶水平上对SARS-CoV 3CLpro具有抑制作用,可以作为SARS-CoV 3CLpro小分子抑制剂[18]。2013年,Hua等通过基于片段的药物设计策略设计合成了一系列3CLpro抑制剂,当P1位置为谷氨酰胺,P2位置为亮氨酸,P3位置为萘丙氨酸残基时,化合物10(图5)在酶水平对SARS-CoV 3CLpro的IC50值为0.23 µmol/L [19]。2015年,Simmons等筛选含有2100个化合物库,发现了化合物11(k11777,图5)在酶水平(IC50= 0.68 nmol/L)对SARS-CoV 3CLpro的活性最好,对其优化将哌嗪环上的甲基换成乙基时,在酶水平化合物12(图5)的IC50值为0.04 nmol/L [20]。2011年,Akaji等报道了丝氨酸衍生物13(图5)在酶水平对SARS-CoV 3CLpro的抑制活性较好,IC50值为30 µmol/L [21],进一步优化获得的苯异丝氨酸衍生物14(IC50= 43 µmol/L, 图5)比化合物13(IC50= 30 µmol/L)的活性低[22]。
-
(1)天然产物
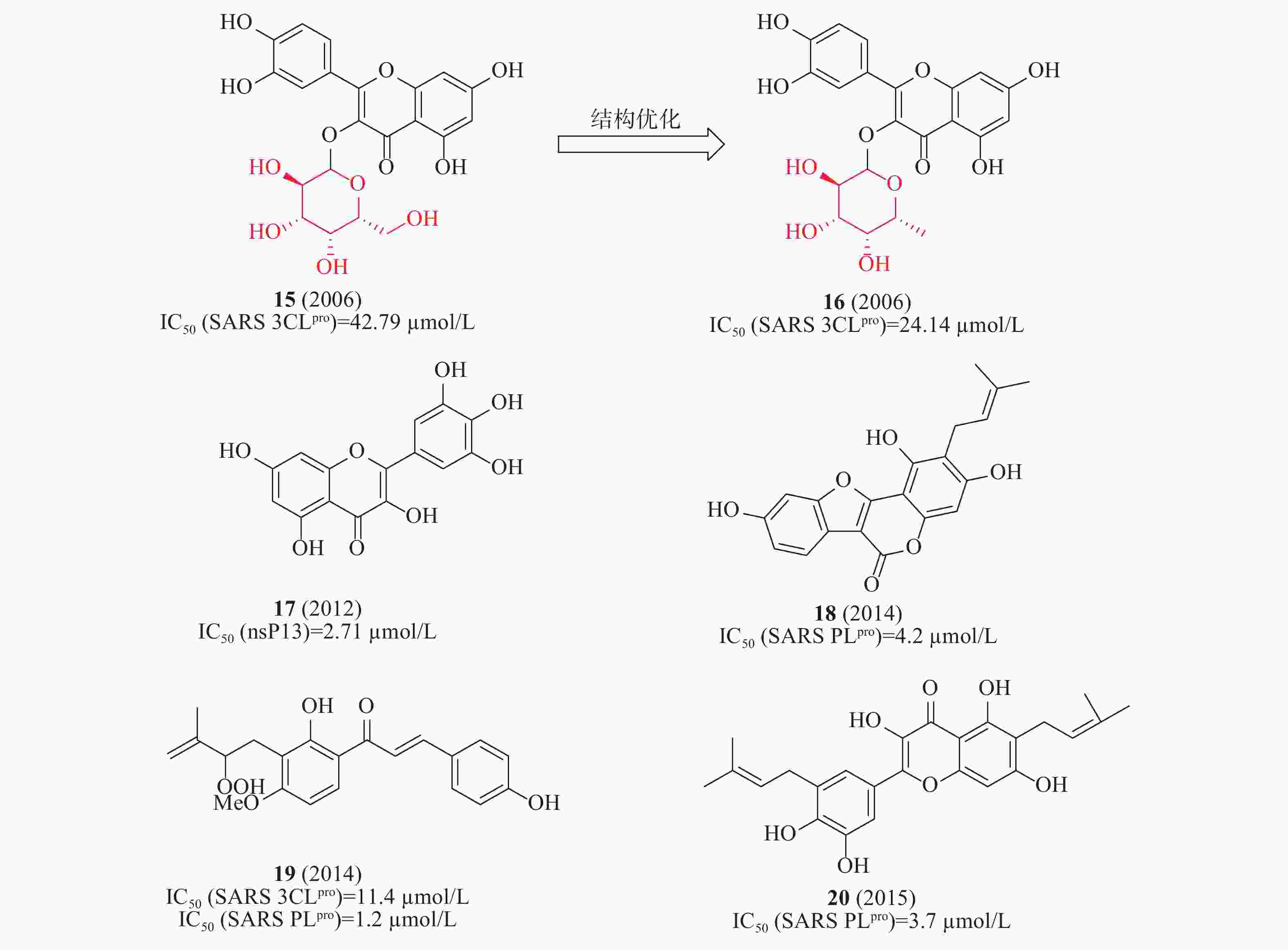
2006年,蒋华良等首次报道一种天然化合物15(槲皮素-3-β-半乳糖苷,图6)具有SARS-CoV 3CLpro抑制活性(IC50=42.79 μmol/L)。在分子对接模拟的基础上,由15为模板设计合成了8种衍生物,构效关系研究发现:①去除了槲皮素部分的7-羟基,活性降低;7-羟基上引入一个大的糖基取代基对活性影响不大;②糖基乙酰化使得活性丧失;③用其他糖取代半乳糖不影响活性。其中,化合物16(图6)活性较好,IC50为24.14 μmol/L[23]。2012年,Jeong等运用FRET法研究了64种天然化合物对SARS解旋酶的抑制作用。化合物17(杨梅素, 图6)通过影响ATP酶活性而非解旋酶活性,间接抑制了SARS-CoV解旋酶蛋白的表达,在酶水平对SARS-CoV病毒活性IC50值为2.71 μmol/L[24]。2014年,Park等发现补骨脂种子的乙醇提取物具有抗SARS-CoV PLpro活性,在酶水平IC50值为15 μmol/L。进一步分离获得6种芳香族化合物,它们均以剂量依赖性方式抑制PLpro,其中化合物18活性最佳(图6)在酶水平对SARS-CoV PLpro的IC50为4.2 μmol/L[25]。2015年,Ryu等发现含有羟基的查尔酮化合物19(图6)对3CLpro和PLpro的抑制IC50值分别为11.4和1.2 μmol/L[26]。2017年,Lee等从布鲁氏假单胞菌提取的多酚类化合物对3CLpro和PLpro具有抑制活性,多酚类化合物对PLpro的活性强于3CLpro;其中,化合物20(图6)对PLpro抑制活性最佳,IC50值为3.7 μmol/L[27]。
(2)三氮唑类
2016年,Wong等采用微滴定板组合反应策略修饰先导化合物,从中发现一类稳定的苯并三唑酯SARS-CoV 3CLpro抑制剂,动力学和质谱分析表明,该类化合物通过酰化修饰3CLpro的活性位点Cys145发挥作用,其中,化合物21(图7)在酶水平活性最佳,Ki为7.5 nmol/L[28]。此前,Stauffer等筛选NIH分子探针库(Molecular Libraries Probe Production Centers Network, MLPCN)发现了类似结构的SARS-CoV 3CLpro抑制剂,化合物22(图7)在酶水平对SARS-CoV 3CLpro的IC50为4.1 μmol/L[29]。
(3)咪唑类
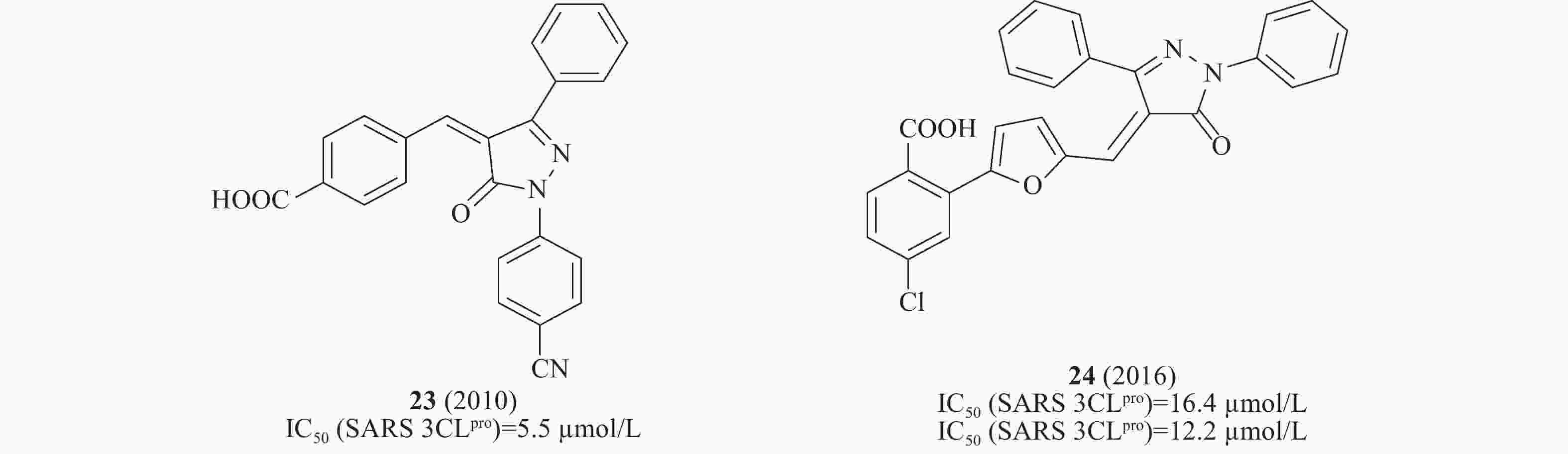
2010年,Liang等设计一系列吡唑啉酮类化合物作为SARS-CoV 3CLpro抑制剂,其中,化合物中23(图8)在酶水平对SARS-CoV 3CLpro表现出了较强的抑制作用,IC50为5.5 μmol/L[30]。2016年,Liang等通过“老药新用”的方法筛选神经氨酸酶(neuraminidase)对SARS-CoV的作用,化合物24(图8)在酶水平对SARS-CoV 3CLpro 的IC50为16.4 μmol/L[31]。
(4)萘环类
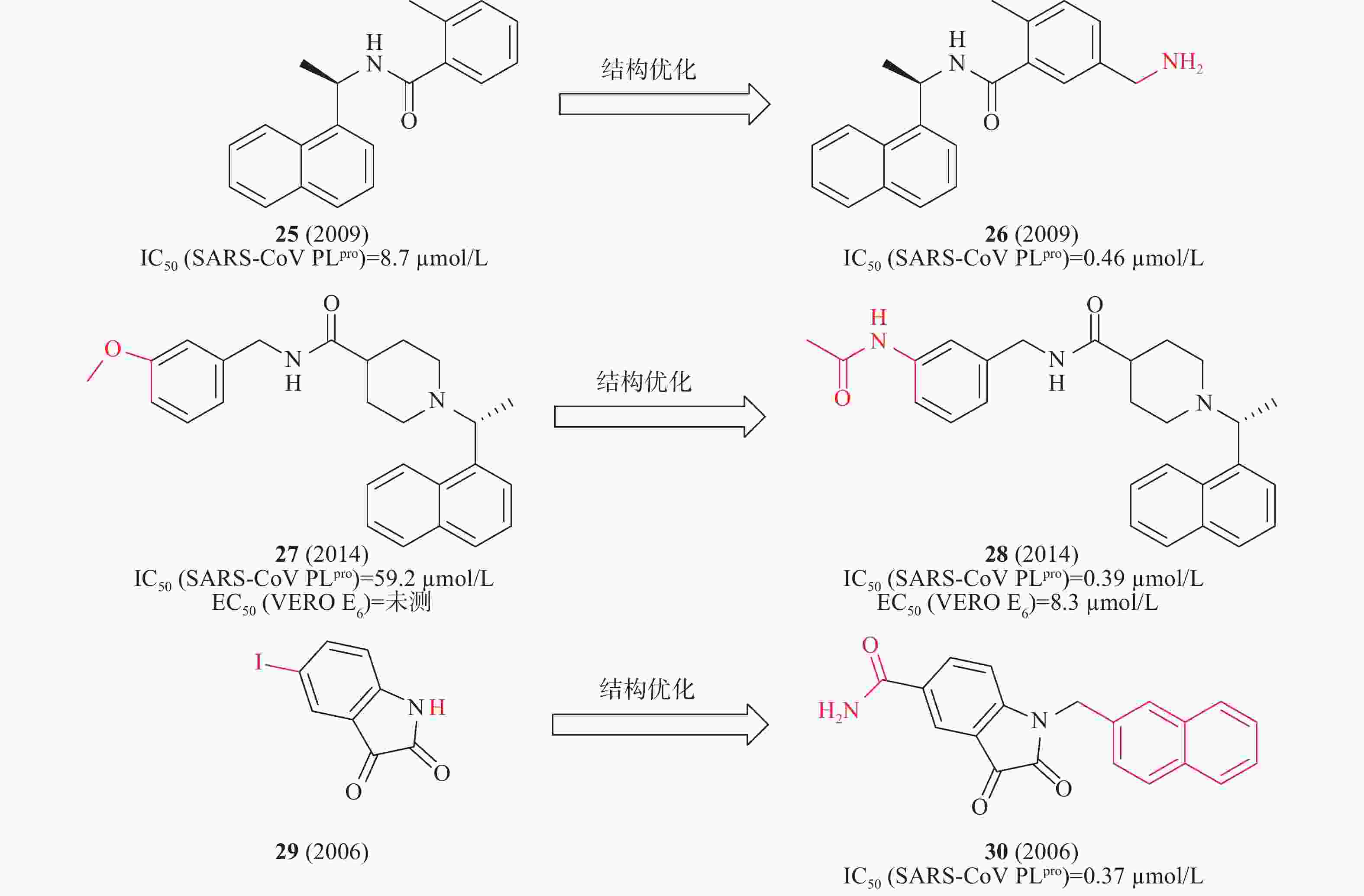
2014年,Mesecar等对多种化学文库的高通量筛选,确定化合物25在酶水平具有SARS-CoV PLpro抑制活性IC50为8.7μmol/L。以此为先导化合物,开展结构优化和构效关系研究,发现化合物26(图9)中引入乙胺基基团与SARS-CoV PLpro的Gln270、Tyr269形成氢键,酶水平提高了20倍(IC50=0.46 μmol/L),对SARS-CoV感染的Vero E6细胞的抗病毒活性为EC50=6 μmol/L[32]。2010年,Mesecar等通过对多种化学文库进行高通量筛选,鉴定了一种新的先导化合物27(图9),在酶水平对SARS-CoV PLpro抑制活性IC50为59.2 μmol/L,在SARS-CoV感染的Vero E6细胞中无抗病毒活性。以27为先导化合物合成一系列类似物和进行构效关系研究,将甲氧基替换为乙酰胺基优化得到化合物28(图9),28中的乙酰胺基基团与SARS-CoV PLpro的Tyr269形成氢键,28与SARS-CoV PLpro结合更加紧密,在酶水平(IC50=0.39 μmol/L)和抑制SARS-CoV感染的Vero E6细胞(EC50=8.3 μmol/L)方面同样有效[33]。2006年,来鲁华等以化合物29(图9)为模板,集中改变N-1和C-5位置取代基合成了一系列靛红类衍生物,研究了其构效关系。当N-1位置为β-萘亚甲基,C-5位置为甲酰胺时,化合物30在酶水平(图9)表现出明显的抑制作用,IC50为0.37 μmol/L[34]。
(5)喹啉类
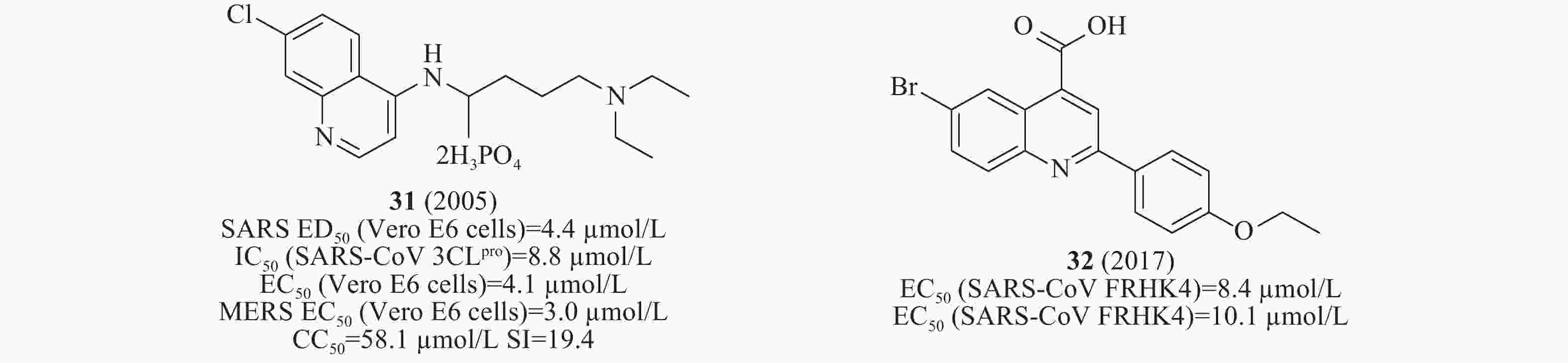
2004年,Keyaerts等检测了抗疟药氯喹对感染SARS-CoV 的Vero E6细胞的抗病毒潜力。结果表明,化合物31(图10)的IC50值为8.8 μmol/L[35]。2005年,Nichol等发现化合物31(氯喹)对SARS-CoV(ED50为4.4 μmol/L)发挥抗病毒作用,提示其可能具有治疗方面的优势[36],2014年,Wilde等检测了氯喹对感染SARS-CoV的Vero E6细胞的抗病毒活性,EC50值为4.1μmol/L,CC50 >128 μmol/L,SI>31[37]。2017年,Kao等对50240种化合物进行筛选SARS-CoV小分子抑制剂,鉴定出喹啉类化合物32(图10),其在感染SARS-CoV的FRHK4细胞中测得的EC50值为8.4 μmol/L,在有效浓度下未观察到明显的细胞毒性[38]。
(6)吡啶类
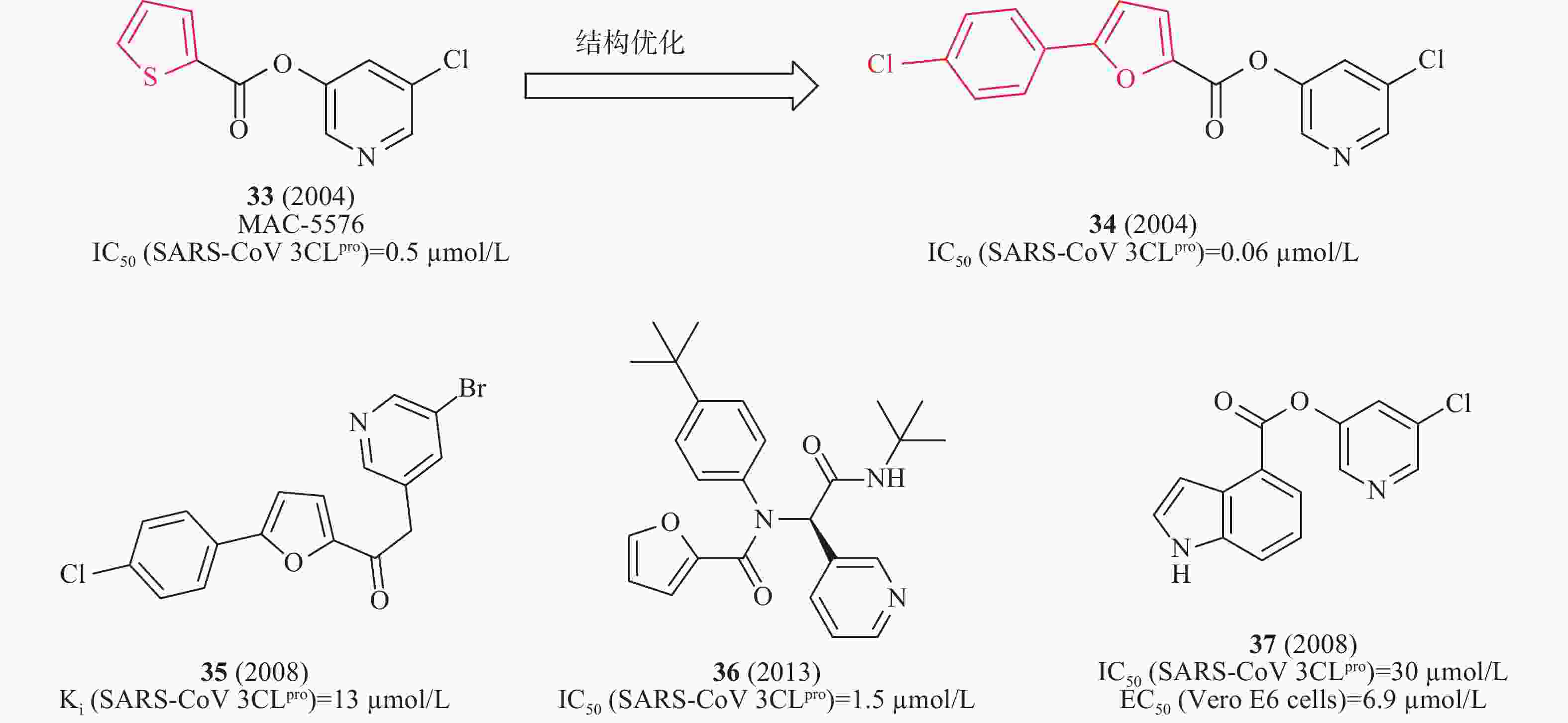
2008年,James等利用高通量筛选发现了化合物33(MAC-5576,图11)对SARS-CoV 3CLpro的酶活性IC50值为0.5 μmol/L;以33为先导化合物,基于分子对接技术设计合成了一系列衍生物,其中,含有氯苯取代的化合物34(图11)对SARS-CoV 3CLpro酶抑制活性提高了10倍(IC50值为0.06 μmol/L),表明SARS-CoV 3CLpro与呋喃一侧结合口袋具有较大疏水空腔,可以容纳苯环等大基团,为进一步结构优化提供了重要依据[39]。2008年,Vederas等制备一系列芳基亚甲基酮类似物,用FRET测试SARS 3CLpro抑制剂的酶活性。构效活性和35(图11)与SARS 3CLpro结合模型研究表明:3个芳香环对SARS-CoV 3CLpro具有良好抑制作用。该类化合物中35(图10)对IC50的抑制作用值为13 μmol/L[40]。2012年,Stauffer等利用NIH分子文库进行高通量筛选SARS-CoV 3CLpro抑制剂,得到探针化合物36(图11),在酶水平对SARS-CoV 3CLpro的IC50值为1.5 μmol/L,对SARS-CoV感染的Vero E6细胞抗病毒活性EC50值为12.9 μmol/L。此外,化合物36在中性PBS缓冲溶液溶解性较好(95 μg/ml)[41]。2008年,Mesecar等设计合成一系列5-氯吡啶酯衍生物,用FRET检测抗SARS-CoV 3CLpro的活性。构效关系表明,吲哚环第4位具有5-氯吡啶基酯的抑制剂37(图11)是最有效的抑制剂,在酶水平对SARS-CoV 3CLpro的IC50值为30 nmol/L,在感染SARS-CoV的Vero E6 细胞中测得EC50值为6.9 μmol/L[42]。
(7)其他类
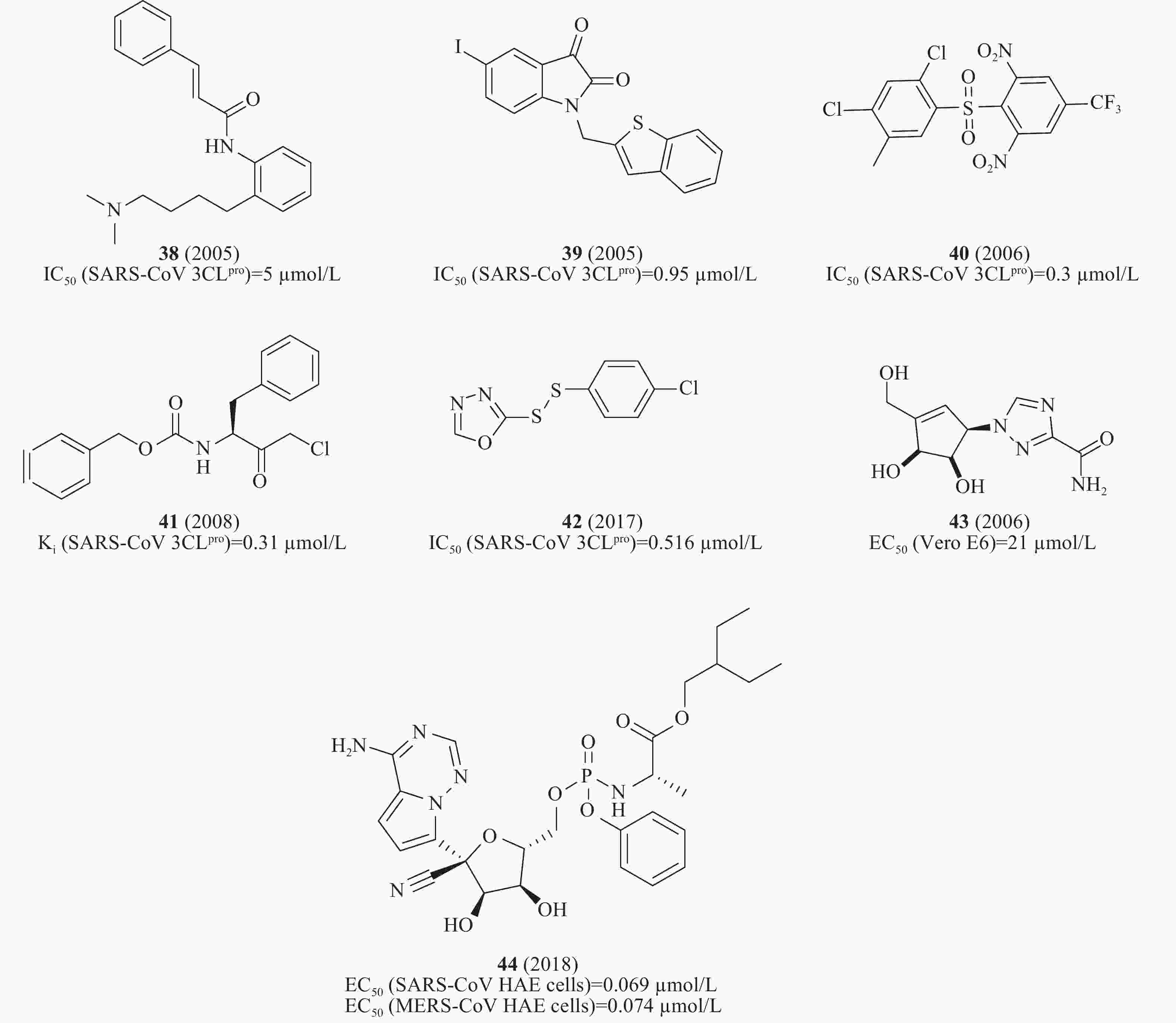
此外,通过虚拟筛选体外酶活性测试还发现一系列SARS-CoV 3CLpro小分子抑制剂,如血清素拮抗剂38(图12)(IC50= 5 μmol/L)[43]、异染色质衍生物39(图12)(IC50= 0.95 μmol/L)[44]、砜类化合物40(图12)(IC50= 0.3 μmol/L)[45]、卤甲基酮抑制剂41(图12)(Ki= 0.31 μmol/L)[46]、不对称的芳香族二硫醚化合物42(图12)(IC50= 0.516 μmol/L)[47]、非天然的五元环杂环碳环核苷1,2,4-三唑类似物43(图12)对SARS-CoV感染的Vero E6细胞EC50为21 μmol/L[48]。2018年,Denison等发现核苷类似物44(图12)(GS-5734,remdesivir)在体外和SARS-CoV小鼠模型中能有效抑制人和人畜共患的冠状病毒。在感染SARS-CoV的人气道上皮细胞(human airway epithelial cells, HAE)原代培养物中评估44的抗病毒活性,显示44的EC50值为0.069 μmol/L[49],通过定量逆转录聚合酶链反应发现,随着44剂量的增加,SARS-CoV感染的细胞内病毒基因组和亚基因组RNA数量均呈剂量依赖性减少,与病毒滴度降低一致[50]。
-
2015年,Radtke等设计一系列双柔性核苷类似物并测试其活性,其中,化合物45(图13)在感染MERS-CoV的Vero E6细胞中显示抗病毒活性EC50值为23 μmol/L[51]。2017年,Grünweller等用双重萤光素酶测定法和病毒感染的原代细胞分析化合物46(图13)对病毒翻译的影响,确定感染MERS-CoV的MRC-5细胞的EC50值为1.3 μmol/L;在MERS-CoV感染的人外周血单核原代细胞(PBMC)证实了化合物46的抗病毒活性[52]。2019年,Johnson等基于SPR和FRET技术,从含有30000种化合物的3种不同化合物库(Prestwick, Maybridge,Chembridge)中筛选出化合物47(图13),对MERS-CoV PLpro酶具有明显抑制活性,IC50值为20.0 μmol/L;为了进一步改善其抑制活性,从352个小片段库得到一个片段48(ZT626+47),48是由47和ZT626之间形成氢键作用结合在一起(图13),IC50值为6.6 μmol/L,比47提高了2倍,后续将通过分子对接研究47和ZT626的具体结合模式[53]。
前面提到的多个SARS-CoV 3CLpro对MERS-CoV也具有明显的抑制活性。例如,2014年De Wilde等对348个药物进行了抗MERS-CoV活性的筛选。研究表明化合物31(氯喹,图10)在体外感染MERS-CoV的Vero E6细胞中测得EC50值为3.0 μmol/L,CC50值为58.1 μmol/L,SI值为19.4[37]。2015年,Simmons等筛选含有2100个化合物的库,发现化合物11(图5)在酶水平上对MERS-CoV 3CLpro的活性最好,IC50值为46.12 μmol/L[20]。2016年,Liang等通过老药新用的方法筛选NA抑制剂对SARS-CoV的作用,发现该类化合物中24在酶水平(图8)对MERS-CoV 3CLpro IC50为12.2 μmol/L[31]。2017年,Kao等对50240种化合物进行筛选MERS-CoV小分子抑制剂,鉴定出化合物32(图10),其在感染MERS-CoV的FRHK4细胞中测得的EC50值为10.1 μmol/L[38]。2018年,Denison等发现核苷类似物44(图13)(GS-5734,remdesivir),研究人员选择在人气道上皮细胞(HAE)原代培养物中评估44对MERS-CoV的抗病毒活性,显示44对MERS-CoV的EC50值为0.074 μmol/L[49]。
-
在当前SARS-CoV-2疫情下,运用“老药新用,一药多用”策略开展科技攻关研发可治疗COVID-19的药物,可大大缩短药物研发时间,进而可以解决新药研发周期长、难以满足当前疫情控制急需用药的难题。多个药物或候选药物(图14)被发现具有显著的抗SARS-CoV-2病毒效能,包括化合物49(利巴韦林,EC50= 109.50 μmol/L、CC50>400 μmol/L、SI>3.65),化合物50(喷昔洛韦,EC50= 95.96 μmol/L、CC50>400 μmol/L、SI> 4.17)、化合物51(硝唑尼特,EC50= 2.12 μmol/L、CC50> 35.53 μmol/L、SI> 16.76)、化合物52(萘莫司他,EC50= 22.50 μmol/L、CC50> 100 μmol/L、SI> 4.44)、化合物31(图10)(氯喹,EC50= 2.71 μmol/L、CC50> 211.70 μmol/L、SI> 100.81)、化合物44(图12)(瑞德西韦,GS-5734)、化合物53(法匹拉韦,T-705,EC50= 61.88 μmol/L、CC50> 400 μmol/L、SI> 6.46)、化合物54(羟氯喹,EC50= 4.51 μmol/L、CC50> 249.49 μmol/L、SI> 55.32)等[54-55]。
Gao等报道了一项多中心临床试验研究氯喹治疗100多例SARS-CoV-2感染的肺炎患者的效果。结果表明,化合物31在抑制肺炎恶化、改善肺部影像及缩短病程方面均优于对照组,且上述患者未见严重的不良反应,且毒性可以接受[56]。
Wang等在体外用非洲绿猴肾Vero E6细胞(ATCC-1586)测试羟氯喹的细胞毒性,结果显示,化合物54在体外可以有效抑制SARS-CoV-2感染,54是一种已知安全有效的抗炎药,预测该药物对COVID-19患者具有良好的抗炎潜力,这种可能性有待临床试验的证实[56]。Patel等2020年5月22日在《柳叶刀》上发表论文指出:COVID-19住院患者单独使用氯喹或羟氯喹或与大环内酯类抗生素联用在治疗新冠肺炎患者时,并未观察到益处;且有可能造成患者生存率降低和室性心律失常的频率增加[57],世卫组织随即宣布暂停相关临床试验,而该文数据的真实性被广泛质疑且未提供原始数据,该文章已被撤稿。世卫组织宣布重启相关临床实验。
化合物44作用于病毒进入细胞的后期阶段,与核苷类药物的作用机制一致。对感染Vero E6细胞的EC90= 1.76 μmol/L,具有较低不良反应,由同情用药过渡到随机双盲的严格III期临床试验(NCT04257656),治疗轻、中和重度感染COVID-19患者。报告显示,在针对237名病患的试验中,158人服用了瑞德西韦,另97人没有服用该药,结果服药患者的病死率为13.9%,没服药者的病死率为12.8%。此外,服用瑞德西韦的患者还出现了明显的副作用,病毒数量及症状却没有明显改善。王辰、曹彬团队得出的结论是:未观察到瑞德西韦联合标准疗法与标准疗法相比有统计学意义上显著的临床获益[58]。另外一项是由美国国立卫生研究院领衔的临床研究,从2020年2月21日开始,共招募1063名患者,随机分为试验组和安慰剂组,评价指标为康复时间。研究结果显示,接受瑞德西韦治疗的试验组患者痊愈中位时间为11 d、安慰剂组为15 d,与安慰剂组相比,接受瑞德西韦的试验组患者痊愈时间缩短31%,P<0.001,结果有显著统计学差异。但是,试验组患者病死率为8.0%,安慰剂组为11.6%,P= 0.059,病死率无显著的统计学差异[59]。
Zhou等发现,SARS-CoV-2与SARS-CoV基因组有79.5%的相似性[60]。基于二者序列同源性高,通过与相同受体ACE2(angiotensin converting enzyme 2)结合后进入细胞,且已有文献报道证实[61],55(洛匹那韦/利托那韦, lopinavir/ritonavir)在SARS的治疗中显示出良好的效果,提示可能对SARS-CoV-2的治疗有效。在重症COVID-19成人住院患者中,与常规治疗相比,未观察到化合物55对治疗有益 (临床试验注册号:ChiCTR2000029308)。试验结果表明,使用洛匹那韦/利托那韦组合与标准护理相比,并没有使严重COVID-19成人患者症状得到显著改善[62]。
化合物56(阿比多尔, arbidol)是一种具有免疫增强的非核苷类广谱抗病毒药物,用于治疗甲、乙型流感病毒等引起的上呼吸道感染。体外细胞实验显示:与药物未处理的对照组相比,阿比多尔在10~30 μmol/L浓度下,有效抑制SARS-CoV-2达60倍,并能显著抑制病毒对细胞的病变效应。目前已注册有盐酸阿比多尔片治疗COVID-19的临床研究(ChiCTR2000029621)。
-
到目前为止,冠状病毒没有特效的抗病毒药物或疫苗。新药研发通常需要大量的人力、物力、财力和时间;在当前COVID-19疫情急需药物的情况下,按照常规研发思路开展药物研发,显然“远水解不了近渴”。“老药新用”策略的优势就是可以节约资源和时间,化合物的安全性已经过验证,可直接进入临床药效研究。从战略药物储备角度长远考虑,我们还可以利用计算机辅助药物设计技术开展药物设计及化合物库筛选,发现新骨架、结构多样的苗头化合物,进而通过构效关系研究、结构优化及成药性评价,发现先导化合物、候选药物及临床有效药物,可丰富抗病毒药物的“储备库”。
Research progress on small molecule inhibitors of coronaviruses
-
摘要: 冠状病毒感染严重威胁着人类健康,目前尚无特异性治疗药物或疫苗。近年来,针对SARS-CoV、MERS-CoV、SARS-CoV-2这3种高致病性冠状病毒的配体S蛋白、RdRp、PLpro和3CLpro等靶点,国内外研究者已经开发了多种小分子抑制剂。综述这些冠状病毒的特点、作用靶点、小分子抑制剂及其构效关系。
-
关键词:
- 冠状病毒 /
- 严重急性呼吸系统综合征冠状病毒 /
- 中东呼吸综合征冠状病毒 /
- 新型冠状病毒 /
- 靶点 /
- 抑制剂
Abstract: Coronavirus infection seriously threatens human health. There is no specific medication or vaccine so far. In recent years, domestic and foreign researchers have developed a variety of small-molecule inhibitors against the ligand S protein, RdRp, PLpro and 3CLpro of three highly pathogenic coronavirus, SARS-CoV, MERS-CoV, SARS-CoV-2. This article reviews the characteristics of these coronaviruses, action targets, small molecule inhibitors, and structure-activity relationships.-
Key words:
- coronavirus /
- SARS-CoV /
- MERS-CoV /
- SARS-CoV-2 /
- targets /
- inhibitors
-
[1] PERLMAN S, NETLAND J. Coronaviruses post-SARS: update on replication and pathogenesis[J]. Nat Rev Microbiol,2009,7(6):439-450. doi: 10.1038/nrmicro2147 [2] 刘昌孝, 王玉丽, 闫凤英. 认识新型冠状病毒肺炎, 关注疫情防控药物研发[J]. 中国抗生素杂志, 2020, 45(2):93-102. doi: 10.3969/j.issn.1001-8689.2020.02.001 [3] HUANG C L, WANG Y M, LI X W, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet,2020,395(10223):497-506. doi: 10.1016/S0140-6736(20)30183-5 [4] CUI J, LI F, SHI Z L. Origin and evolution of pathogenic coronaviruses[J]. Nat Rev Microbiol,2019,17(3):181-192. doi: 10.1038/s41579-018-0118-9 [5] 刘昌孝, 伊秀林, 王玉丽, 等. 认识新冠病毒(SARS-CoV-2), 探讨抗病毒药物研发策略[J]. 药物评价研究, 2020, 43(3):361-371. [6] GORBALENYA A E, SNIJDER E J, SPAAN W J. Severe acute respiratory syndrome coronavirus phylogeny: toward consensus[J]. J Virol,2004,78(15):7863-7866. doi: 10.1128/JVI.78.15.7863-7866.2004 [7] ZIEBUHR J, THIEL V, GORBALENYA A E. The autocatalytic release of a putative RNA virus transcription factor from its polyprotein precursor involves two paralogous papain-like proteases that cleave the same peptide bond[J]. J Biol Chem,2001,276(35):33220-33232. doi: 10.1074/jbc.M104097200 [8] ZUMLA A, CHAN J F W, AZHAR E I, et al. Coronaviruses: drug discovery and therapeutic options[J]. Nat Rev Drug Discov,2016,15(5):327-347. doi: 10.1038/nrd.2015.37 [9] DU L Y, HE Y X, ZHOU Y S, et al. The spike protein of SARS-CoV: a target for vaccine and therapeutic development[J]. Nat Rev Microbiol,2009,7(3):226-236. doi: 10.1038/nrmicro2090 [10] PILLAIYAR T, MANICKAM M, NAMASIVAYAM V, et al. An overview of severe acute respiratory syndrome-coronavirus (SARS-CoV) 3CL protease inhibitors: peptidomimetics and small molecule chemotherapy[J]. J Med Chem,2016,59(14):6595-6628. doi: 10.1021/acs.jmedchem.5b01461 [11] ANAND K, ZIEBUHR J, WADHWANI P, et al. Coronavirus main proteinase (3CLpro) structure: basis for design of anti-SARS drugs[J]. Science,2003,300(5626):1763-1767. doi: 10.1126/science.1085658 [12] PATICK A K, BINFORD S L, BROTHERS M A, et al. <italic>In vitro</italic> antiviral activity of AG7088, a potent inhibitor of human rhinovirus 3C protease[J]. Antimicrob Agents Chemother,1999,43(10):2444-2450. doi: 10.1128/AAC.43.10.2444 [13] GHOSH A K, XI K, RATIA K, et al. Design and synthesis of peptidomimetic severe acute respiratory syndrome chymotrypsin-like protease inhibitors[J]. J Med Chem,2005,48(22):6767-6771. doi: 10.1021/jm050548m [14] GHOSH A K, XI K, GRUM-TOKARS V, et al. Structure-based design, synthesis, and biological evaluation of peptidomimetic SARS-CoV 3CLpro inhibitors[J]. Bioorg Med Chem Lett,2007,17(21):5876-5880. doi: 10.1016/j.bmcl.2007.08.031 [15] JAIN R P, PETTERSSON H I, ZHANG J M, et al. Synthesis and evaluation of keto-glutamine analogues as potent inhibitors of severe acute respiratory syndrome 3CLpro[J]. J Med Chem,2004,47(25):6113-6116. doi: 10.1021/jm0494873 [16] SHIE J J, FANG J M, KUO T H, et al. Inhibition of the severe acute respiratory syndrome 3CL protease by peptidomimetic alpha, beta-unsaturated esters[J]. Bioorg Med Chem,2005,13(17):5240-5252. doi: 10.1016/j.bmc.2005.05.065 [17] YANG S, CHEN S J, HSU M F, et al. Synthesis, crystal structure, structure-activity relationships, and antiviral activity of a potent SARS coronavirus 3CL protease inhibitor[J]. J Med Chem,2006,49(16):4971-4980. doi: 10.1021/jm0603926 [18] XUE X Y, YU H W, YANG H T, et al. Structures of two coronavirus main proteases: implications for substrate binding and antiviral drug design[J]. J Virol,2008,82(5):2515-2527. doi: 10.1128/JVI.02114-07 [19] PRIOR A M, KIM Y, WEERASEKARA S, et al. Design, synthesis, and bioevaluation of viral 3C and 3C-like protease inhibitors[J]. Bioorg Med Chem Lett,2013,23(23):6317-6320. doi: 10.1016/j.bmcl.2013.09.070 [20] ZHOU Y C, VEDANTHAM P, LU K, et al. Protease inhibitors targeting coronavirus and filovirus entry[J]. Antiviral Res,2015,116:76-84. doi: 10.1016/j.antiviral.2015.01.011 [21] KONNO H, WAKABAYASHI M, TAKANUMA D, et al. Design and synthesis of a series of serine derivatives as small molecule inhibitors of the SARS coronavirus 3CL protease[J]. Bioorg Med Chem,2016,24(6):1241-1254. doi: 10.1016/j.bmc.2016.01.052 [22] KONNO H, ONUMA T, NITANAI I, et al. Synthesis and evaluation of phenylisoserine derivatives for the SARS-CoV 3CL protease inhibitor[J]. Bioorg Med Chem Lett,2017,27(12):2746-2751. doi: 10.1016/j.bmcl.2017.04.056 [23] CHEN L L, LI J, LUO C, et al. Binding interaction of quercetin-3-beta-galactoside and its synthetic derivatives with SARS-CoV 3CL(pro): structure-activity relationship studies reveal salient pharmacophore features[J]. Bioorg Med Chem,2006,14(24):8295-8306. doi: 10.1016/j.bmc.2006.09.014 [24] YU M S, LEE J, LEE J M, et al. Identification of myricetin and scutellarein as novel chemical inhibitors of the SARS coronavirus helicase, nsP13[J]. Bioorg Med Chem Lett,2012,22(12):4049-4054. doi: 10.1016/j.bmcl.2012.04.081 [25] KIM D W, SEO K H, CURTIS-LONG M J, et al. Phenolic phytochemical displaying SARS-CoV papain-like protease inhibition from the seeds of <italic>Psoralea</italic> corylifolia[J]. J Enzyme Inhib Med Chem,2014,29(1):59-63. doi: 10.3109/14756366.2012.753591 [26] PARK J Y, KO J A, KIM D W, et al. Chalcones isolated from <italic>Angelica keiskei</italic> inhibit cysteine proteases of SARS-CoV[J]. J Enzyme Inhib Med Chem,2016,31(1):23-30. doi: 10.3109/14756366.2014.1003215 [27] PARK J Y, YUK H J, RYU H W, et al. Evaluation of polyphenols from <italic>Broussonetia papyrifera</italic> as coronavirus protease inhibitors[J]. J Enzyme Inhib Med Chem,2017,32(1):504-515. doi: 10.1080/14756366.2016.1265519 [28] WU C Y, KING K Y, KUO C J, et al. Stable benzotriazole esters as mechanism-based inactivators of the severe acute respiratory syndrome 3CL protease[J]. Chem Biol,2006,13(3):261-268. doi: 10.1016/j.chembiol.2005.12.008 [29] TURLINGTON M, CHUN A, TOMAR S, et al. Discovery of N-benzo[J]. Bioorg Med Chem Lett,2013,23(22):6172-6177. doi: 10.1016/j.bmcl.2013.08.112 [30] RAMAJAYAM R, TAN K P, LIU H G, et al. Synthesis and evaluation of pyrazolone compounds as SARS-coronavirus 3C-like protease inhibitors[J]. Bioorg Med Chem,2010,18(22):7849-7854. doi: 10.1016/j.bmc.2010.09.050 [31] KUMAR V, TAN K P, WANG Y M, et al. Identification, synthesis and evaluation of SARS-CoV and MERS-CoV 3C-like protease inhibitors[J]. Bioorg Med Chem,2016,24(13):3035-3042. doi: 10.1016/j.bmc.2016.05.013 [32] GHOSH A K, TAKAYAMA J, AUBIN Y, et al. Structure-based design, synthesis, and biological evaluation of a series of novel and reversible inhibitors for the severe acute respiratory syndrome-coronavirus papain-like protease[J]. J Med Chem,2009,52(16):5228-5240. doi: 10.1021/jm900611t [33] BÁEZ-SANTOS Y M, BARRAZA S J, WILSON M W, et al. X-ray structural and biological evaluation of a series of potent and highly selective inhibitors of human coronavirus papain-like proteases[J]. J Med Chem,2014,57(6):2393-2412. doi: 10.1021/jm401712t [34] ZHOU L, LIU Y, ZHANG W L, et al. Isatin compounds as noncovalent SARS coronavirus 3C-like protease inhibitors[J]. J Med Chem,2006,49(12):3440-3443. doi: 10.1021/jm0602357 [35] KEYAERTS E, VIJGEN L, MAES P, et al. In vitro inhibition of severe acute respiratory syndrome coronavirus by chloroquine[J]. Biochem Biophys Res Commun,2004,323(1):264-268. doi: 10.1016/j.bbrc.2004.08.085 [36] VINCENT M J, BERGERON E, BENJANNET S, et al. Chloroquine is a potent inhibitor of SARS coronavirus infection and spread[J]. Virol J,2005,2:69. doi: 10.1186/1743-422X-2-69 [37] DE WILDE A H, JOCHMANS D, POSTHUMA C C, et al. Screening of an FDA-approved compound library identifies four small-molecule inhibitors of Middle East respiratory syndrome coronavirus replication in cell culture[J]. Antimicrob Agents Chemother,2014,58(8):4875-4884. doi: 10.1128/AAC.03011-14 [38] CHEUNG N N, LAI K K, DAI J, et al. Broad-spectrum inhibition of common respiratory RNA viruses by a pyrimidine synthesis inhibitor with involvement of the host antiviral response[J]. J Gen Virol,2017,98(5):946-954. doi: 10.1099/jgv.0.000758 [39] NIU C Y, YIN J, ZHANG J M, et al. Molecular docking identifies the binding of 3-chloropyridine moieties specifically to the S1 pocket of SARS-CoV Mpro[J]. Bioorg Med Chem,2008,16(1):293-302. doi: 10.1016/j.bmc.2007.09.034 [40] ZHANG J M, HUITEMA C, NIU C Y, et al. Aryl methylene ketones and fluorinated methylene ketones as reversible inhibitors for severe acute respiratory syndrome (SARS) 3C-like proteinase[J]. Bioorg Chem,2008,36(5):229-240. doi: 10.1016/j.bioorg.2008.01.001 [41] JACOBS J, GRUM-TOKARS V, ZHOU Y, et al. Discovery, synthesis, and structure-based optimization of a series of N-(tert-butyl)-2-(N-arylamido)-2-(pyridin-3-yl) acetamides (ML188) as potent noncovalent small molecule inhibitors of the severe acute respiratory syndrome coronavirus (SARS-CoV) 3CL protease[J]. J Med Chem,2013,56(2):534-546. doi: 10.1021/jm301580n [42] GHOSH A K, GONG G L, GRUM-TOKARS V, et al. Design, synthesis and antiviral efficacy of a series of potent chloropyridyl ester-derived SARS-CoV 3CLpro inhibitors[J]. Bioorg Med Chem Lett,2008,18(20):5684-5688. doi: 10.1016/j.bmcl.2008.08.082 [43] CHEN L L, GUI C S, LUO X M, et al. Cinanserin is an inhibitor of the 3C-like proteinase of severe acute respiratory syndrome coronavirus and strongly reduces virus replication <italic>in vitro</italic>[J]. J Virol,2005,79(11):7095-7103. doi: 10.1128/JVI.79.11.7095-7103.2005 [44] CHEN L R, WANG Y C, LIN Y W, et al. Synthesis and evaluation of isatin derivatives as effective SARS coronavirus 3CL protease inhibitors[J]. Bioorg Med Chem Lett,2005,15(12):3058-3062. doi: 10.1016/j.bmcl.2005.04.027 [45] LU I L, MAHINDROO N, LIANG P H, et al. Structure-based drug design and structural biology study of novel nonpeptide inhibitors of severe acute respiratory syndrome coronavirus main protease[J]. J Med Chem,2006,49(17):5154-5161. doi: 10.1021/jm060207o [46] BACHA U, BARRILA J, GABELLI S B, et al. Development of broad-spectrum halomethyl ketone inhibitors against coronavirus main protease 3CL(pro)[J]. Chem Biol Drug Des,2008,72(1):34-49. doi: 10.1111/j.1747-0285.2008.00679.x [47] WANG L, BAO B B, SONG G Q, et al. Discovery of unsymmetrical aromatic disulfides as novel inhibitors of SARS-CoV main protease: Chemical synthesis, biological evaluation, molecular docking and 3D-QSAR study[J]. Eur J Med Chem,2017,137:450-461. doi: 10.1016/j.ejmech.2017.05.045 [48] CHO J H, BERNARD D L, SIDWELL R W, et al. Synthesis of cyclopentenyl carbocyclic nucleosides as potential antiviral agents against orthopoxviruses and SARS[J]. J Med Chem,2006,49(3):1140-1148. doi: 10.1021/jm0509750 [49] AGOSTINI M L, ANDRES E L, SIMS A C, et al. Coronavirus susceptibility to the antiviral remdesivir (GS-5734) is mediated by the viral polymerase and the proofreading exoribonuclease[J]. mBio,2018,9(2):e00221-e00218. [50] 乔欢, 孙超. 潜在抗冠状病毒药物瑞德西韦研究进展[J]. 中国新药与临床杂志, 2020, 39(3):141-145. [51] PETERS H L, JOCHMANS D, DE WILDE A H, et al. Design, synthesis and evaluation of a series of acyclic fleximer nucleoside analogues with anti-coronavirus activity[J]. Bioorg Med Chem Lett,2015,25(15):2923-2926. doi: 10.1016/j.bmcl.2015.05.039 [52] MÜLLER C, SCHULTE F W, LANGE-GRÜNWELLER K, et al. Broad-spectrum antiviral activity of the eIF4A inhibitor silvestrol against <italic>Corona</italic>- and picornaviruses[J]. Antiviral Res,2018,150:123-129. doi: 10.1016/j.antiviral.2017.12.010 [53] LEE H, REN J H, PESAVENTO R P, et al. Identification and design of novel small molecule inhibitors against MERS-CoV papain-like protease via high-throughput screening and molecular modeling[J]. Bioorg Med Chem,2019,27(10):1981-1989. doi: 10.1016/j.bmc.2019.03.050 [54] WANG M L, CAO R Y, ZHANG L K, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) <italic>in vitro</italic>[J]. Cell Res,2020,30(3):269-271. doi: 10.1038/s41422-020-0282-0 [55] LIU J, CAO R Y, XU M Y, et al. Hydroxychloroquine, a less toxic derivative of chloroquine, is effective in inhibiting SARS-CoV-2 infection <italic>in vitro</italic>[J]. Cell Discov,2020,6:16. [56] GAO J J, TIAN Z X, YANG X. Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies[J]. Biosci Trends,2020,14(1):72-73. doi: 10.5582/bst.2020.01047 [57] MEHRA M R, DESAI S S, RUSCHITZKA F, et al. Hydroxychloroquine or chloroquine with or without a macrolide for treatment of COVID-19: a multinational registry analysis[J]. The Lancet,2020. doi: 10.1016/S0140-6736(20)31180-6 [58] WANG Y M, ZHANG D Y, DU G H, et al. Remdesivir in adults with severe COVID-19: a randomized, double-blind, placebo-controlled, multicentre trial[J]. Lancet,2020(20):31022-31029. [59] National Institute of Allergy and Infectious Diseases. NIH clinical trial shows Remdesivir accelerates recovery from advanced COVID-19[EB/OL]. (2020-04-29)[2020-05-10]. https://www.nih.gov/news-events/news-releases/nih-clinical-trial-shows-remdesivir-accelerates-recovery-advanced-covid-19. [60] ZHOU P, YANG X L, WANG X G, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature,2020,579(7798):270-273. doi: 10.1038/s41586-020-2012-7 [61] CHU C M, CHENG V C, HUNG I F, et al. Role of lopinavir/ritonavir in the treatment of SARS: initial virological and clinical findings[J]. Thorax,2004,59(3):252-256. doi: 10.1136/thorax.2003.012658 [62] CAO B, WANG Y M, WEN D N, et al. A trial of lopinavir-ritonavir in adults hospitalized with severe covid-19[J]. N Engl J Med,2020,382(19):1787-1799. doi: 10.1056/NEJMoa2001282 -




 下载:
下载: