-
成纤维细胞的增殖和活化引起的细胞外基质(extracellular matrix,ECM)的累积是肺纤维化的主要病理基础[1]。肺纤维化治疗难度大,且发展到晚期纤维化过程不可逆转,而一些药物的长期使用会提高肺纤维化的发生风险,对于这临床的一类并发症应格外重视。来氟米特(leflunomide,LEF)是治疗类风湿性关节炎的常用药物,但是有临床报道称,长期服用LEF可能提高肺纤维化的发生风险,但是也有研究认为LEF对肺纤维化影响不大[2]。微小RNA(microRNA,miRNA)长度约为18~22个核苷酸,虽然不具备编码功能,但是可通过识别和碱基配对的方式与靶基因信使RNA(message RNA,mRNA)的3'非翻译区(3'UTR)结合,从而参与基因表达的调控[3]。miR-449a具有抑制肿瘤细胞的增殖并诱导凋亡的作用[4],并且最新研究发现miR-449a可能与肺纤维化有关,在二氧化硅诱导的肺纤维化模型中,miR-449a可通过调节自噬缓解纤维化[5]。c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)是调节细胞增殖、凋亡和分化的重要蛋白,其磷酸化后可通过信号转导调控细胞生物学行为[6]。本文发现了miR-449a的过表达会显著缓解由LEF引起的肺成纤维细胞的增殖,而沉默miR-449a对细胞的影响相反,这可能是LEF引起肺纤维化的机制之一,报道如下。
-
人肺成纤维细胞MRC-5购自美国ATCC;LEF(苏州长征-欣凯制药有限公司,国药准字H20000550);RPMI-1640培养基以及血清购自美国Gibco公司;miR-449a mimic和inhibitor质粒由Genepharma公司构建;
LipofectamineTM 2000(美国Invitrogen公司);荧光显微镜(Olympus BX51);Model 680酶标仪(Bio-Rad,美国);流式细胞仪(BD FACScanto II,Becton Dickinson,美国)。CCK-8试剂盒(武汉华美公司);凋亡试剂盒(美国Thermo Fisher);PVDF膜(美国Bio-Rad公司);抗体购自美国Abcam公司,逆转录试剂盒TaKaRa和SYBR Prellix Ex TaqTM实时PCR试剂盒购自TaKaRa(日本)。
-
MRC-5细胞在RPMI-1640培养基中培养,温度为37 ℃,CO2浓度为5%。细胞被分为6组,即对照组、LEF组、LEF+mimic组、mimic组、LEF+inhibitor组和inhibitor组。其中LEF+mimic组和mimic组通过转染miR-449a mimic质粒过表达miR-449a的水平,LEF+inhibitor组和inhibitor组通过转染miR-449a inhibitor质粒使miR-449a的水平降低。对照组转染空载质粒。LEF组、LEF+mimic组和LEF+inhibitor组分别在5 mg/L LEF的条件下培养48 h。
-
将细胞裂解后收集总RNA并检测纯度,通过逆转录试剂盒合成cDNA,然后进行PCR反应,步骤如下:95 ℃下2 min,95 ℃下15 s,60 ℃下25 s和72 ℃下60 s,共进行40个循环。以U6作为内参,使用2-ΔΔCT法分析miR-449a水平。引物序列如下(5′-3′),miR-449a上游引物:TGCGGTGGCAGTGTATTGTTAGC,下游引物:CCAGTGCAGGGTCCGAGGT;U6上游引物:GGGCAGGAAGAGGGCCTAT,下游引物:TATGGCTAGCATGACTGGT。
-
将细胞调节至2×104个细胞/ml的密度,接种于96孔板中,100 μl/孔。再培养24、48和72 h后将10 μl的CCK-8试剂加入至每孔中,37 ℃下培养2 h。在酶标仪上测量450 nm处的吸光度(A),计算相对细胞活力。
-
分别将各组细胞200个细胞在6孔板中培养,每3天补充一次培养基,培养2周。用PBS洗涤细胞并加入甲醇固定15 min,加入使用结晶紫染色30 min,在显微镜下观察克隆形成的数目,≥50个细胞的集落为一个克隆形成。
-
将细胞洗涤后重悬于结合缓冲液中,使细胞浓度为2.5×105个/ml。根据试剂盒说明书将试剂加入细胞中,并通过流式细胞术分析细胞凋亡情况。
-
通过免疫荧光染色检测α平滑肌肌动蛋白(α smooth muscle actin,α-SMA)和胶质蛋白I(collagen I,Col I)的表达情况分析细胞的表型和细胞外基质。然后将细胞在4 ℃下使用α-SMA的抗体染色过夜,用异硫氰酸四甲基罗丹明的山羊抗兔抗体染色30 min。然后再于避光条件下利用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)对细胞核染色10 min,通过荧光显微镜观察。
-
通过Western blot检测JNK和磷酸化JNK(p-JNK)蛋白的水平。将细胞裂解、离心收集总蛋白并检测蛋白浓度。使用10%的SDS-PAGE凝胶用于电泳分离蛋白,电泳后使用PVDF膜转膜并在室温下用5%无脂牛奶封闭2 h。分别加入一抗(稀释1:1 000)室温震荡2 h,后在4 ℃孵育过夜,加入二抗(稀释1:5 000),孵育3 h。通过Quantity One软件分析条带的灰度值并以GAPDH为参照计算目标蛋白质的表达量。
-
实验数据采用SPSS 19软件进行处理,实验结果以平均值±标准偏差(SD)表示,组间比较采用单因素方差分析和t检验,统计学显著性表示为P<0.05。
-
使用qPCR检测各组细胞中miR-449a表达水平。结果显示mimic组miR-449a水平显著高于对照组,inhibitor组的miR-449a表达水平显著低于对照组(P<0.05),说明转染实验成功。LEF组的miR-449a水平显著低于对照组(P<0.05),并且LEF+mimic组的miR-449a的表达水平显著高于LEF组,LEF+inhibitor组的miR-449a显著低于LEF组(P<0.05)。表明LEF可抑制人成纤维细胞中miR-449a的表达,见表1。
表 1 各组miR-449a表达水平比较
组别 miR-449a 对照组 1.16±0.08 LEF组 0.58±0.05* LEF+mimic组 2.04±0.16# mimic组 6.32±0.63* LEF+inhibitor组 0.41±0.06# inhibitor组 0.77±0.07* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 -
使用CCK-8法检测各组细胞的相对细胞活力。结果显示在第48小时和第72小时,LEF组和inhibitor组的细胞活力显著高于对照组(P<0.05),而mimic组的细胞活力显著低于对照组(P<0.05)。此外,LEF+mimic组的细胞活力显著低于LEF组,LEF+inhibitor组的细胞活力显著高于LEF组(P<0.05),过表达miR-449a可部分逆转LEF对促进人成纤维细胞的细胞活力的作用,而降低miR-449a的水平会进一步促进细胞活力,见表2。
表 2 各组细胞的相对细胞活力比较(%)
组别 24 h 48 h 72 h 对照组 100.07±1.83 100.76±2.07 100.16±1.96 LEF组 103.67±2.06 110.83±2.15* 121.17±2.65* LEF+mimic组 99.98±2.14 98.57±2.11# 97.37±2.01# mimic组 97.54±1.97 91.79±2.35* 81.77±1.78* LEF+inhibitor组 107.68±2.08 118.67±3.07# 132.84±2.07# inhibitor组 104.31±1.79 111.38±2.67* 119.35±2.18* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 -
LEF组和inhibitor组的克隆形成数目显著高于对照组而细胞凋亡率低于对照组(P<0.05),mimic组的克隆形成数目显著低于对照组而细胞凋亡率显著高于对照组(P<0.05)。此外,LEF+mimic组的克隆形成数目显著低于LEF组而细胞凋亡率显著高于LEF组(P<0.05),LEF+inhibitor组的克隆形成数目在LEF的基础上进一步升高而细胞凋亡率进一步降低(P<0.05)。过表达miR-449a可逆转LEF促进肺成纤维细胞增殖和抑制凋亡的作用,而低表达miR-449a会加剧LEF的作用,见表3。
表 3 各组细胞增殖和凋亡情况比较
组别 克隆形成数目(个) 细胞凋亡率(%) 对照组 54.32±4.36 5.53±0.94 LEF组 87.66±7.24* 3.11±0.76* LEF+mimic组 60.82±6.06# 6.73±1.26# mimic组 31.12±3.78* 17.32±3.28* LEF+inhibitor组 119.35±5.08# 2.14±0.62# inhibitor组 92.71±7.89* 3.45±0.83* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 -
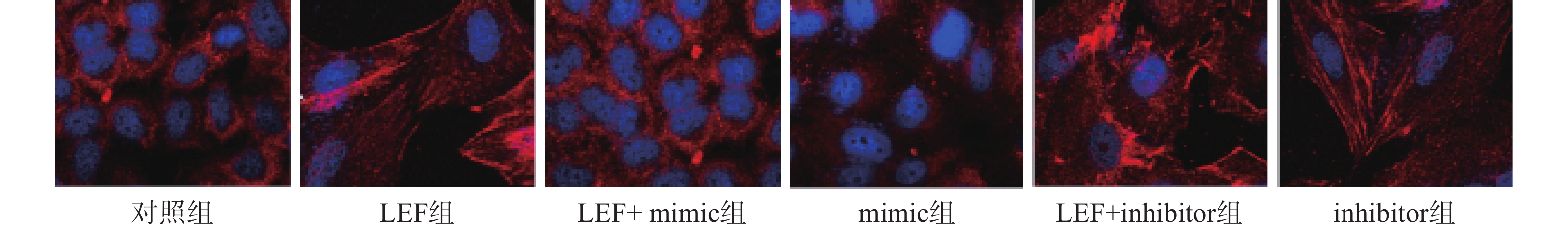
本次研究通过免疫荧光技术检测了各组α-SMA的水平来分析细胞向肌细胞转化情况,检测Col I的水平来分析ECM水平。其中蓝色荧光为细胞核,红色荧光为α-SMA或Col I蛋白。LEF组和inhibitor组的荧光强度显著高于对照组(P<0.05),而mimic组的相对荧光强度低于对照组(P<0.05)。此外,LEF+mimic组的相对荧光强度显著低于LEF组(P<0.05),LEF+inhibitor组的相对荧光强度显著高于LEF组(P<0.05)。过表达miR-449a可部分逆转LEF对促进人成纤维细胞α-SMA和Col I表达的促进作用,见图1、图2和表4。
表 4 各组细胞α-SMA相对荧光强度比较
组别 α-SMA Col I 对照组 1.02±0.11 1.24±0.14 LEF组 2.36±0.47* 2.57±0.38* LEF+mimic组 1.53±0.34# 1.89±0.25# mimic组 0.47±0.05* 0.45±0.06* LEF+inhibitor组 3.25±0.18# 4.13±0.54# inhibitor组 2.48±0.15* 3.11±0.39* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 -
LEF组和inhibitor组的p-JNK/JNK水平高于对照组,mimic组的p-JNK/JNK水平显著低于对照组(P<0.05),并且LEF+mimic组中p-JNK/JNK水平显著低于LEF组(P<0.05),LEF+inhibitor组中p-JNK/JNK水平显著高于LEF组(P<0.05)。过表达miR-449a可逆转LEF促进JNK蛋白磷酸化的作用,见表5。
表 5 各组p-JNK/JNK相对水平比较
组别 p-JNK JNK p-JNK/JNK 对照组 2.04±0.18 2.16±0.16 0.94±0.09 LEF组 2.87±0.31 1.05±0.10 2.73±0.18* LEF+mimic组 1.67±0.19 2.24±0.21 0.75±0.07# mimic组 0.96±0.11 3.11±0.28 0.31±0.04* LEF+inhibitor组 3.04±0.24 1.10±0.10 2.76±0.25# inhibitor组 3.78±0.34 1.02±0.09 3.71±0.31* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 -
肺纤维化是一种慢性进行性肺部疾病,但是临床上尚无治疗肺纤维化的特效方法和药物,目前用于进行性肺纤维化的唯一有效治疗方法是肺移植[7],若患者未接受肺移植,通常在诊断后的3至5年内出现肺功能丧失导致呼吸衰竭和死亡。肺纤维化的病理特征包括纤维增生和ECM沉积过多,但是这个过程较为漫长,并且在早期症状不明显,也缺乏相应的诊断手段,在患者确诊为肺纤维化时再采取治疗效果有限。因此虽然LEF是否会引起肺纤维化尚无定论,但是由于肺纤维化的恶性预后和致死率,LEF治疗过程中的肺纤维化风险仍是临床重点关注的问题。研究LEF促进肺纤维化的机制是寻找诊断和治疗肺纤维化新方法的重要途径。
LEF是一种调节免疫的药物,其作用机制通过抑制二氢乳清酸脱氢酶来抑制T淋巴细胞和其他类型细胞的细胞周期进程[8]。LEF引起的肺纤维化并导致患者死亡的病例随着LEF使用时间的增加而升高[9]。一项长期的调查随访报告指出,在5911例使用LEF治疗的患者中,共出现了80例间质性肺病,其中有27例患者死亡,并且结果判定其中有18例患者的死亡是由于LEF直接导致[10-11]。在肺纤维化的过程中,成纤维细胞向成肌纤维细胞转化和ECM的累积是两大特点[12]。因此本文主要分析了LEF对人肺成纤维细胞的影响,结果显示LEF可显著促进成纤维细胞的细胞活力和增殖,抑制其凋亡,并诱导细胞表达大量的α-SMA蛋白和ECM累积。α-SMA是上皮细胞向间质细胞转化的检测指标之一,也是体外研究肺纤维化的最常用指标,而Col I是ECM的主要成分[13]。作者提示了LEF可通过活化成纤维细胞和促进其增殖参与肺纤维化。
为进一步分析LEF调节肺成纤维细胞增殖和表达α-SMA的机制,我们检测了miR-449a在其中的作用。miR-449a是近年来新发现的一种miRNA,研究已经证实了其可通过靶向并诱导靶基因mRNA降解,抑制肺癌细胞的增殖、上皮间充质转化[14-15]。本次研究结果显示LEF可抑制miR-449a的表达水平,并且过表达miR-449a可抑制成纤维细胞的细胞活力、细胞增殖能力,抑制α-SMA和Col I蛋白的表达,并促进其凋亡。过表达miR-449a会逆转由LEF引起的细胞活化、增殖以及α-SMA和Col I蛋白的表达,而抑制miR-449a的水平会进一步加剧LEF的促纤维化作用。Zhang等[16]的研究结果也显示miR-449a具有调节α-SMA蛋白表达的作用。通过进一步的研究我们还发现LEF可促进JNK的磷酸化,过表达miR-449a会抑制JNK磷酸化水平并显著逆转LEF促进JNK磷酸化的作用。JNK的活化在促进肺癌发生和发展中的作用已经被广泛证实,此外,JNK可活化可能通过活化肝星状细胞引起肝纤维化[17]。Yang等[18]的研究结果显示阻断JNK途径可抑制成纤维细胞样滑膜细胞的活性,并抑制迁移和侵袭。Shingyochi等[19]的研究结果也显示了激活JNK通路会促进成纤维细胞的增殖和迁移。这提示LEF可能通过miR-499a促进JNK蛋白的磷酸化,从而促进肺成纤维细胞的活化和增殖,并促进细胞向肌纤维细胞转化和ECM的累积,进而引起肺纤维化。
综上所述,LEF可能通过抑制肺成纤维细胞中miR-449a的表达激活JNK途径,促进α-SMA的表达和ECM的累积,从而诱导成纤维细胞的活化和增殖,抑制其凋亡,从而引起肺纤维化。但是,关于LEF调节miR-449a的机制和miR-449a在JNK途径中的作用仍需要进一步的研究。
Mechanism of leflunomide in regulating pulmonary fibrosis by regulating miR-449a
-
摘要:
目的 探究来氟米特(leflunomide,LEF)通过调节微小RNA(microRNA,miR)-449a在肺纤维化中的机制研究。 方法 将人肺成纤维细胞MRC-5分为6组,即对照组、LEF组、LEF+mimic组、mimic组、LEF+inhibitor组和inhibitor组。通过质粒转染miR-449a mimic或inhibitor来过表达或沉默miR-449a,在5 mg/L LEF的条件下培养48 h。分别通过CCK-8法、克隆形成实验和流式细胞术检测各组细胞活力、细胞增殖能力和凋亡率。使用免疫荧光染色检测α平滑肌肌动蛋白(α smooth muscle actin,α-SMA)胶质蛋白I(collagen I,col I)。分别使用qPCR和Western blot检测miRNA和蛋白的水平。 结果 mimic组miR-449a水平显著高于对照组(P<0.05)。LEF组和inhibitor组的miR-449a水平显著低于对照组(P<0.05)。LEF+mimic组的miR-449a的表达水平显著高于LEF组,LEF+inhibitor组的miR-449a水平显著低于LEF组(P<0.05)。LEF组和inhibitor组的细胞活力和细胞增殖能力显著高于对照组(P<0.05)。mimic组的细胞活力和细胞增殖能力显著低于对照组(P<0.05)。LEF+mimic组的细胞活力和细胞增殖能力显著低于LEF组而LEF+inhibitor组的细胞活力显著高于LEF组(P<0.05)。LEF组和inhibitor组的细胞凋亡率低于对照组(P<0.05),mimic组的细胞凋亡率显著高于对照组(P<0.05)。LEF+mimic组的细胞凋亡率显著高于LEF组而LEF+inhibitor组的凋亡率显著低于LEF组(P<0.05)。LEF组和inhibitor组的α-SMA和Col I蛋白的荧光强度显著高于对照组(P<0.05),mimic组的相对荧光强度低于对照组(P<0.05)。LEF+mimic组的α-SMA和Col I蛋白相对荧光强度显著低于LEF组,LEF+inhibitor组的α-SMA和Col I蛋白相对荧光强度显著高于LEF组(P<0.05)。LEF组和inhibitor组的p-JNK/JNK水平高于对照组(P<0.05),mimic组的p-JNK/JNK水平显著低于对照组(P<0.05),LEF+mimic组中p-JNK/JNK水平显著低于LEF组而LEF+inhibitor组的p-JNK/JNK水平显著高于LEF组(P<0.05)。 结论 LEF可能通过抑制肺成纤维细胞中miR-449a的表达激活JNK途径,从而诱导成纤维细胞的活化和增殖,抑制其凋亡,从而引起肺纤维化。 -
关键词:
- 来氟米特 /
- 肺纤维化 /
- 成纤维细胞 /
- α平滑肌肌动蛋白 /
- 微小RNA-449a /
- c-Jun氨基末端激酶
Abstract:Objective To investigate the mechanism of leflunomide (LEF) in regulating pulmonary fibrosis by regulating microRNA (miR)-449a. Methods Human lung fibroblasts MRC-5 were divided into 6 groups: control group, LEF group, LEF+mimic group, mimic group, LEF+inhibitor group and inhibitor group. MiR-449a was overexpressed or silenced by plasmid transfection with miR-449a mimic or inhibitor and ncubate for 48 h at 5 mg / L LEF. The cell viability, cell proliferation ability and apoptotic rate of each group were measured by CCK-8 method, clone formation experiment and flow cytometry. Immunofluorescent staining was used to detect α smooth muscle actin (α-SMA) and collagen I (col I). The levels of miRNA and protein were detected using qPCR and Western blot, respectively. Results The miR-449a level in the mimic group was significantly higher than that in the control group (P<0.05). The level of miR-449a in LEF group and inhibitor group was significantly lower than that in control group (P<0.05). The expression level of miR-449a in LEF+mimic group was significantly higher than that in LEF group, and the level of miR-449a in LEF+inhibitor group was significantly lower than that in LEF group (P<0.05). The cell viability and cell proliferation ability of the LEF group and inhibitor group were significantly higher than those of the control group (P<0.05). The cell viability and cell proliferation ability of the mimic group were significantly lower than those of the control group (P<0.05). The cell viability and cell proliferation ability of the LEF+mimic group were significantly lower than those of the LEF group, while the cell viability of the LEF+inhibitor group was significantly higher than that of the LEF group (P<0.05). The apoptosis rate of LEF group and inhibitor group was lower than that of control group (P<0.05). The apoptosis rate of mimic group was significantly higher than that of control group (P<0.05). The apoptosis rate of LEF+mimic group was significantly higher than that of LEF group, while the apoptosis rate of LEF+inhibitor group was significantly lower than that of LEF group (P<0.05). The fluorescence intensity of α-SMA and Col I proteins in LEF group and inhibitor group were significantly higher than those in control group (P<0.05). The relative fluorescence intensity of mimic group was lower than that of control group (P<0.05). The relative fluorescence intensities of α-SMA and Col I proteins in LEF+mimic group were significantly lower than those in LEF group, while the relative fluorescence intensities of α-SMA and Col I protein in LEF+inhibitor group were significantly higher than those in LEF group (P<0.05). The levels of p-JNK / JNK in LEF group and inhibitor group were higher than those in control group (P<0.05). The p-JNK / JNK level in the mimic group was significantly lower than that in the control group (P<0.05). The level of p-JNK / JNK in LEF+mimic group was significantly lower than that in LEF group, while the level of p-JNK / JNK in LEF+inhibitor group was significantly higher than that in LEF group (P<0.05). Conclusion LEF may activate the JNK pathway by inhibiting the expression of miR-449a in lung fibroblasts, thereby inducing fibroblast activation and proliferation, inhibiting apoptosis, and causing pulmonary fibrosis. -
Key words:
- leflunomide /
- pulmonary fibrosis /
- fibroblasts /
- alpha smooth muscle actin /
- microRNA-449a /
- c-Jun N-terminal kinase
-
表 1 各组miR-449a表达水平比较
组别 miR-449a 对照组 1.16±0.08 LEF组 0.58±0.05* LEF+mimic组 2.04±0.16# mimic组 6.32±0.63* LEF+inhibitor组 0.41±0.06# inhibitor组 0.77±0.07* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 表 2 各组细胞的相对细胞活力比较(%)
组别 24 h 48 h 72 h 对照组 100.07±1.83 100.76±2.07 100.16±1.96 LEF组 103.67±2.06 110.83±2.15* 121.17±2.65* LEF+mimic组 99.98±2.14 98.57±2.11# 97.37±2.01# mimic组 97.54±1.97 91.79±2.35* 81.77±1.78* LEF+inhibitor组 107.68±2.08 118.67±3.07# 132.84±2.07# inhibitor组 104.31±1.79 111.38±2.67* 119.35±2.18* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 表 3 各组细胞增殖和凋亡情况比较
组别 克隆形成数目(个) 细胞凋亡率(%) 对照组 54.32±4.36 5.53±0.94 LEF组 87.66±7.24* 3.11±0.76* LEF+mimic组 60.82±6.06# 6.73±1.26# mimic组 31.12±3.78* 17.32±3.28* LEF+inhibitor组 119.35±5.08# 2.14±0.62# inhibitor组 92.71±7.89* 3.45±0.83* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 表 4 各组细胞α-SMA相对荧光强度比较
组别 α-SMA Col I 对照组 1.02±0.11 1.24±0.14 LEF组 2.36±0.47* 2.57±0.38* LEF+mimic组 1.53±0.34# 1.89±0.25# mimic组 0.47±0.05* 0.45±0.06* LEF+inhibitor组 3.25±0.18# 4.13±0.54# inhibitor组 2.48±0.15* 3.11±0.39* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 表 5 各组p-JNK/JNK相对水平比较
组别 p-JNK JNK p-JNK/JNK 对照组 2.04±0.18 2.16±0.16 0.94±0.09 LEF组 2.87±0.31 1.05±0.10 2.73±0.18* LEF+mimic组 1.67±0.19 2.24±0.21 0.75±0.07# mimic组 0.96±0.11 3.11±0.28 0.31±0.04* LEF+inhibitor组 3.04±0.24 1.10±0.10 2.76±0.25# inhibitor组 3.78±0.34 1.02±0.09 3.71±0.31* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 -
[1] JOSHI S, SINGH A R, WONG S S, et al. Rac2 is required for alternative macrophage activation and bleomycin induced pulmonary fibrosis; a macrophage autonomous phenotype[J]. PLoS One,2017,12(8):e0182851-e0182856. doi: 10.1371/journal.pone.0182851 [2] REN L M, LI R, CHEN L N, et al. Efficacy and safety of weekly leflunomide for the treatment of early rheumatoid arthritis: a randomized, multi-center study[J]. Int J Rheum Dis,2016,19(7):651-657. doi: 10.1111/1756-185X.12677 [3] BOCKHORN J, DALTON R, NWACHUKWU C, et al. MicroRNA-30c inhibits human breast tumour chemotherapy resistance by regulating TWF1 and IL-11[J]. Nat Commun,2013,4: 4(1):1393-1398. [4] LI J, LU M J, JIN J, et al. MiR-449a suppresses tamoxifen resistance in human breast cancer cells by targeting ADAM22[J]. Cell Physiol Biochem,2018,50(1):136-149. doi: 10.1159/000493964 [5] HAN R H, JI X M, RONG R, et al. MiR-449a regulates autophagy to inhibit silica-induced pulmonary fibrosis through targeting Bcl2[J]. J Mol Med,2016,94(11):1267-1279. doi: 10.1007/s00109-016-1441-0 [6] TANG Y N, GENG Q, CHEN D, et al. Germline proliferation is regulated by somatic endocytic genes via JNK and BMP signaling in Drosophila[J]. Genetics,2017,206(1):189-197. doi: 10.1534/genetics.116.196535 [7] HUANG Y, MA S F, ESPINDOLA M S, et al. Microbes are associated with host innate immune response in idiopathic pulmonary fibrosis[J]. Am J Respir Crit Care Med,2017,196(2):208-219. doi: 10.1164/rccm.201607-1525OC [8] DENG F, ZHANG P, FENG J, et al. Effect of leflunomideon inflammatory factors and immune function in rats with chronic glomerulonephritis[J]. J Sichuan Univ Med Sci Ed,2016,47(2):217-221. [9] PATEL A, ZHANG S J, PARAMAHAMSA M, et al. Leflunomide induces pulmonary and hepatic CYP1A enzymes via aryl hydrocarbon receptor[J]. Drug Metab Dispos,2015,43(12):1966-1970. doi: 10.1124/dmd.115.066084 [10] SCOTT D L. Interstitial lung disease and disease modifying anti-rheumatic drugs[J]. Lancet,2004,363(9416):1239-1240. [11] SAKAI F, NOMA S, KURIHARA Y, et al. Leflunomide-related lung injury in patients with rheumatoid arthritis: imaging features[J]. Mod Rheumatol,2005,15(3):173-179. doi: 10.3109/s10165-005-0387-9 [12] RYU C, SUN H X, GULATI M, et al. Extracellular mitochondrial DNA is generated by fibroblasts and predicts death in idiopathic pulmonary fibrosis[J]. Am J Respir Crit Care Med,2017,196(12):1571-1581. doi: 10.1164/rccm.201612-2480OC [13] ISHIDA Y, KIMURA A, NOSAKA M, et al. Essential involvement of the CX3CL1-CX3CR1 axis in bleomycin-induced pulmonary fibrosis via regulation of fibrocyte and M2 macrophage migration[J]. Sci Rep,2017,7(1):16833-16837. doi: 10.1038/s41598-017-17007-8 [14] LIANG L, HUIJUAN L, LIANJIANG D, et al. MiR-449a suppresses LDHA-mediated glycolysis to enhance the sensitivity of non-small cell lung cancer cells to ionizing radiation[J]. Oncol Res Feat Preclin Clin Cancer Therap,2017,26(4):547-556. [15] WU D D, LIU J, CHEN J L, et al. MiR-449a suppresses tumor growth, migration, and invasion in non-small cell lung cancer by targeting a HMGB1-mediated NF-κB signaling pathway[J]. Oncol Res,2019,27(2):227-235. doi: 10.3727/096504018X15213089759999 [16] ZHANG J, GAO F D, NI T J, et al. Linc-POU3F3 is overexpressed in in-stent restenosis patients and induces VSMC phenotypic transformation via POU3F3/miR-449a/KLF4 signaling pathway[J]. Am J Transl Res,2019,11(7):4481-4490. [17] SATO-MATSUBARA M, MATSUBARA T, DAIKOKU A, et al. Fibroblast growth factor 2(FGF2) regulates cytoglobin expression and activation of human hepatic stellate cells via JNK signaling[J]. J Biol Chem,2017,292(46):18961-18972. doi: 10.1074/jbc.M117.793794 [18] YANG Y L, YE Y J, QIU Q, et al. Triptolide inhibits the migration and invasion of rheumatoid fibroblast-like synoviocytes by blocking the activation of the JNK MAPK pathway[J]. Int Immunopharmacol,2016,41:8-16. doi: 10.1016/j.intimp.2016.10.005 [19] SHINGYOCHI Y, KANAZAWA S, TAJIMA S, et al. A low-level carbon dioxide laser promotes fibroblast proliferation and migration through activation of akt, ERK, and JNK[J]. PLoS One,2017,12(1):e0168937-e0168937. doi: 10.1371/journal.pone.0168937 -





 下载:
下载: